Выявление факторов риска регионарного метастазирования дифференцированного рака щитовидной железы
Автор: Козловска А., Топузов Э.Э., Рачинский С.В.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования. Вопросы онкохирургии
Статья в выпуске: 3 т.10, 2020 года.
Бесплатный доступ
Трудность диагностики регионарных метастазов, особенно при поражении центрального уровня шеи, представляет основную проблему выбора объема хирургического вмешательства у пациентов с диагнозом дифференцированного рака щитовидной железы (РЩЖ). Частота регионарного метастазирования дифференцированного РЩЖ в лимфатические узлы шеи составляет в среднем 60%. В статье описан процесс поиска факторов риска регионарного метастазирования дифференцированного рака щитовидной железы, а также дан обзор литературы по данной проблеме. Были проанализированы результаты хирургического лечения пациентов с морфологическим диагнозом папиллярного РЩЖ I-III стадии T1-4aN0-1bM0, которым было проведено хирургическое лечение в СПБ ГБУЗ «Городской клинический онкологический диспансер» Минздрава России в период с 2018 по 2019 гг. Согласно полученным в результате исследования данным выявлена связь регионального метастазирования с интратиреоидной сосудистой инвазией первичной опухоли (p 0,05). После выполненного хирургического лечения у пациентов с дифференцированным РЩЖ при оценке послеоперационного гистологического материала следует акцентировать внимание на наличии интратиреоидной сосудистой инвазии первичной опухоли и при её обнаружении расширять объём лечения и выполнять завершающую тиреоидэктомию с лимфодиссекцией и последующей радиойодтерапией.
Высокодифференцированный рак щитовидной железы, региональное метастазирование, лифодиссекция, мутация гена braf, мультифокальность, эктратиреоидное распространение, эндоваскулярная инвазия
Короткий адрес: https://sciup.org/140257631
IDR: 140257631 | DOI: 10.18027/2224-5057-2020-10-3-15-19
Текст научной статьи Выявление факторов риска регионарного метастазирования дифференцированного рака щитовидной железы
Как и другие первичные злокачественные новообразования головы и шеи, рак щитовидной железы (РЩЖ) имеет постоянный характер распространения в шейные лимфатические узлы (ЛУ). Центральный уровень шеи (уровни VI и VII) поражается первым, за которым следует распространение в боковые отделы шеи (II-V) уровни и уже за ними — контралатеральная сторона. Очень редко происходит вовлечение ЛУ подподбородочной или подчелюстной областей (уровень I) [1]. «Прыгающие» метастазы в латеральные ЛУ при отсутствии поражения центрального уровня шеи выявляются до 20% случаев [2].
Трудность диагностики регионарных метастазов, особенно поражения центрального уровня шеи [3], представляет основную проблему выбора объема хирургического вмешательства у пациентов с дифференцированным РЩЖ. Частота регионарного метастазирования дифференцированного РЩЖ в лимфатические узлы шеи составляет в среднем 60% [4,5] в зависимости от размера опухоли, возраста, пола и местного распространения.
Существующие методы дооперационной диагностики метастатических лимфатических узлов центральной и боковой групп шеи обладают низкой чувствительностью. Ультразвуковое исследование играет важную роль в обсле- довании пациентов с диагнозом РЩЖ, как неизвазивное, быстрое и легко воспроизводимое исследование, благодаря широкой доступности высокочастотных линейных датчиков. Но лимфатические узлы центрального уровня шеи более трудно визуализировать при ультразвуковом исследовании в сравнении с лимфатическими узлами бокового отдела шеи из-за их близости к щитовидной железе и заполненной воздухом трахее. Чувствительность УЗИ для выявления лимфатических узлов бокового отдела шеи составляет 79% по сравнению с 26% центрального уровня [6].
Положительная роль терапевтической центральной лимфодиссекции (ЦЛД) при cN1 хорошо известна, в то время как выполнение профилактической лимфодиссекции у больных дифференцированным РЩЖ при отсутствии клинических проявлений метастазирования является противоречивым [7]. Многие пациенты имеют cN0, когда центральные лимфатические узлы не изменены при предоперационной визуализации или во время интраоперационного осмотра. Несмотря на то, что опытный хирург может выполнить ЦЛД без осложнений, польза для отдельного пациента зависит от значимости полученной в результате такого лечения информации.
Собственные исследования. Вопросы онкохирургии
-
J. Nixon и соавторы включили в свое исследование 1798 пациентов, которые получили первичное лечение папиллярного РЩЖ с 1986 по 2010 год в объеме тиреоидэктомии в Memorial Sloan Kettering Cancer Center, и выявили, что 5-летние показатели онко-специфической и безреци-дивной выживаемости в этой группе были 100% и 96,6%, соответственно. Только у 12 пациентов возник рецидив в ЛУ центрального уровня шеи (менее 1%). Следует отметить, что профилактическая ЦЛД хирургами данного центра не практикуется, а выполняется терапевтическая ЦЛД в случае верификации метастазов центрального уровня шеи в результате срочного исследования замороженных срезов подозрительных ЛУ [8].
Nabhan и Ringel также не рекомендуют рутинную профилактическую шейную лимфодиссекцию, за исключением случаев медуллярного рака щитовидной железы и/или более крупных опухолей с подозрением на локальную инвазию или опухолей с плохой дифференцировкой [9].
Существуют и сторонники профилактической ЦЛД. Кропотов и соавторы в своем исследовании пришли к выводу, что клиническое течение папиллярного РЩЖ характеризуется высоким процентом регионарного метастазирования в лимфатические узлы центральной клетчатки шеи (41.5%), что приводит к необходимости выполнения тиреоидэктомии вместе с центральной ипсилатеральной лимфодиссекцией, не увеличивая частоту послеоперационных осложнений и развитием гипопаратиреоза только в 7.7 % случаев [10].
В последние годы расширяются знания о геномных характеристиках рака щитовидной железы. Однако в настоящее время эти характеристики пока не влияют на рутинное ведение пациентов [11]. Возможно, молекулярная оценка мутации BRAF V600E поможет более селективно подойти к выполнению ЦЛД, более агрессивному хирургическому лечению, для улучшения результатов лечения больных дифференцированным РЩЖ. Исследование Полякова и соавторов показало, что мутация BRAF у пациентов с диагнозом папиллярный РЩЖ связана с инвазией опухоли в капсулу щитовидной железы, в результате чего авторы пришли к выводу, что наличие мутации BRAF V600E при папиллярном РЩЖ является необходимым фактором при планировании объема хирургического лечения в сторону его расширения. [12].
В исследование Bao-Ding Chen и соавт. было включено 182 пациента с диагнозом папиллярный РЩЖ, у которых размер первичной опухоли согласно данным доопераци-онного УЗИ был <10 мм, была проведена тиреоидэктомия с плановой профилактической ЦЛД. В результате было выявлено несколько независимых прогностических факторов регионарного метастазирования у пациентов с cN0 папиллярным РЩЖ, таких как размер опухоли >7 мм, выраженную гипоэхогенность, мультифокальность и наличие мутации BRAFV600E. Данные факторы были предложены Bao-Ding Chen и соавторами хирургам для более точной оценки метастатического поражения ЛУ шеи у пациентов с папиллярной микрокарциномой щитовидной железы и проведения индивидуализированной профилактической ЦЛД [13].
Другие авторы пришли к выводу, что мутация BRAF не является плохим прогностическим факторам и не связана с неблагоприятным исходом, поэтому роль предоперационного молекулярного анализа ограничена улучшением диагностики при неопределенном цитологическом результате и все еще является спорной в отношении определения объема хирургического вмешательства и послеоперационного адъювантного лечения РЩЖ [14].
Именно поэтому целью нашего исследования стало выявление прогностических факторов регионарного метастазирования для определения необходимости проведения центральной и боковой лимфодиссекции у пациентов с дифференцированным РЩЖ и улучшения результатов лечения пациентов данной группы.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование было включено 23 пациента с морфологическим диагнозом папиллярный РЩЖ I–III стадии T1–4aN0–1bM0, которым было проведено хирургическое лечение в СПБ ГБУЗ «Городской клинический онкологический диспансер» Минздрава России в период с 2018 по 2019 гг. Возраст пациентов варьировал от 23 до 71 лет, 19 из них (83%) были женщины, 4 (17%) пациента — мужчины. Пациентам выполнялось хирургическое вмешательство в объеме: гемитиреоидэктомия, тиреоидэктомия с центральной или/и боковой лимфодиссекцией в соответствии с Российскими клиническими рекомендациями по диагностике и лечению высокодифференцированного РЩЖ у взрослых от 2017 года, в последующем выполнялось патоморфологическое исследование операционного материала и молекулярно-генетическое исследование на предмет наличия мутации V600E в 600 кодоне гена BRAF. По результатам гистологического исследования пациенты были разделены на 2 группы: 1 группу составили пациенты с N0, 2 — пациенты с верифицированными региональными метастазами. У 12 (52%) пациентов выполнена шейная лимфодиссекция по показаниям.
РЕЗУЛЬТАТЫ.
В первую группу пациентов вошли только женщины, во второй группе женщины составили 43% от общего числа, мужчины — 57%. Распределение пациентов по возрасту (>55 и <55 лет) в обеих группах было примерно одинаковым. При патоморфологическом исследовании выявлен мультифокальный характер роста РЩЖ (рис. 1) у 25% больных из 1 группы и у 43% — из 2 группы. Экстратиреоидное распространение (рис. 2) выявлено у 19% пациентов из 1 группы и 43% из 2 группы, следует отметить что только у одного пациента из 2 группы имелось массивное экстратиреоидное распространение
Собственные исследования. Вопросы онкохирургии первичной опухоли с инвазией в грушевидный синус, во всех остальных случаях эктратиреоидное распространение было малым. Интратиреоидная сосудистая инвазия обнаружена у 25 (86%) больных. В результате выполненного молекулярно-генетического исследования операционного материала на предмет наличия мутации V600E в 600 кодоне гена BRAF у 50% пациентов в 1 группе и 57% во 2 группе выявлена BRAF мутация (табл. 1).
Таблица 1. Результаты проведенного исследования
Таблица 2. Результаты проведенного исследования (продолжение)
|
Прогностический фактор |
1 группа (N0) |
2 группа (N+) |
p |
|
Мультифокальность |
25% |
43% |
> 0,05 |
|
Экстратиреоидное распространение |
19% |
43% |
> 0,05 |
|
Интратиреоидная сосудистая инвазия |
25% |
86% |
< 0,05 |
|
Наличие BRAF-мутации |
50% |
57% |
> 0,05 |
|
Характеристика |
1 группа |
2 группа |
|
Количество пациентов |
16 |
7 |
|
Возраст, лет: |
||
|
> 55 |
56% |
43% |
|
< 55 |
44% |
57% |
|
Пол: |
||
|
мужской |
– |
43% |
|
женский |
100% |
57% |
|
Многофокусность |
25% |
43% |
|
Экстратиреоидное распространение |
19% |
43% |
|
Интратиреоидная сосудистая инвазия |
25% |
86% |
|
Наличие BRAF-мутации |
50% |
57% |
Выявлена связь регионарного метастазирования с ин-тратиреоидной сосудистой инвазией первичной опухоли (p <0,05), тогда как мультифокальность, экcтратиреоид-ное распространение и наличие BRAF-мутации данной корреляции не продемонстрировали (p >0,05) (табл. 2).
ЗАКЛЮЧЕНИЕ
В результате нашего исследования совершен поиск прогностических факторов регионарного метастазирования дифференцированного РЩЖ, выявлена взаимосвязь интратиреоидной сосудистой инвазии первичной опухоли с метастазированием в шейные ЛУ (р <0,05). После выполненного хирургического лечения у пациентов с дифференцированным РЩЖ при оценке послеоперационного гистологического материала, следует акцентировать внимание на наличии интратиреоидной сосудистой инвазии и при её обнаружении выполнять завершающую тиреоидэктомию с ЦЛД и последующей радиойодтерапией.
Необходимы дальнейшие исследования для поиска прогностических факторов регионарного метастазирования дифференцированного РЩЖ и разработка более персонализированной стратегии ведения данной группы пациентов, адаптированной к риску вторичного поражения лимфатических узлов шеи.
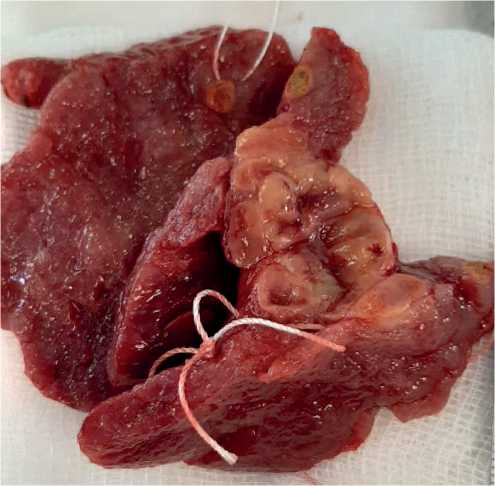
Рисунок 1. Многофокусный характер роста опухоли щитовидной железы (фокусы промаркированы лигатурами).
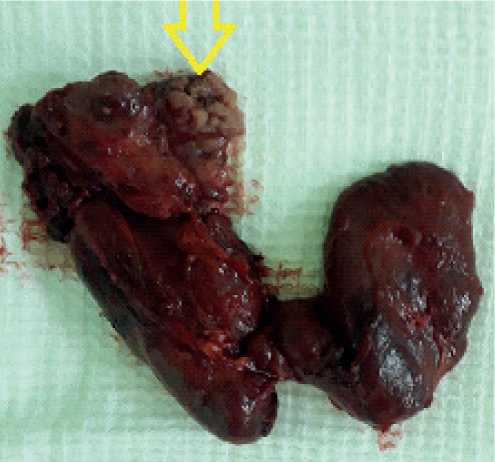
Рисунок 2. Большое экстратиреоидное распространение опухоли.
Собственные исследования. Вопросы онкохирургии
Список литературы Выявление факторов риска регионарного метастазирования дифференцированного рака щитовидной железы
- Selective Modified Radical Neck Dissection for Papillary Thyroid Cancer — Is Level I, II and V Dissection Always Necessary? / Caron, N. R., Tan, Y. Y., Ogilvie, J. B. [и др.] // World Journal of Surgery.— 2006.— Vol. 30 (5) — P. 833–840. doi:10.1007 / s00 268–005–0358–5
- Machens A. Skip metastases in thyroid cancer leaping the central lymph node compartment / Machens A, Holzhausen H-J, Dralle H. // Arch. Surg.— 2004.— Vol. 139 (1) — P. 43–45. doi: 10.1001 / archsurg. 139.1.43.
- Shirley, Lawrence A. The role of central neck lymph node dissection in the management of papillary thyroid cancer / Lawrence A. Shirley, Natalie B. Jones, John E. Phay// Frontiers in Oncology.— 2017.— Vol. 7 — P. 122. doi: 10.3389 / fonc. 2017.00 122
- Han L. 2108 Cases of Thyroid Cancer: Cervical Lymph Node Dissection or Not / Han L, Wu Z, Li W. // Research Square.— 2019. DOI: 10.21 203 / rs. 3. rs- 133 510 / v1. URL: https://assets.researchsquare.com / files / rs- 133 510 / v1 / d7e44c0df76c- 4d43‑b20c- 6662b6d166d9. pdf
- Константинова Н. Н. Сравнительная частота регионарного метастазирования высокодифференцированного рака щитовидной железы / Константинова Н. Н., Евменова Т. Д., Дроздова Д. Э. // Вестник хирургии имени И. И. Грекова. 2014. № 173 (5). С. 44–47. https://doi.org / 10.24 884 / 0042–4625–2014–173–5–44–47
- Papillary thyroid carcinoma nodal surgery directed by a preoperative radiographic map utilizing CT scan and ultrasound in all primary and reoperative patients / Lesnik D, Cunnane M, Zurakowski D et al. // Head Neck.— 2014.— Vol. 36 (2) — P. 191–202. doi: 10.1002 / hed. 23 277. Epub 2013 Apr 2.
- Wang1, Laura Y. Nodal metastases in thyroid cancer: prognostic implications and management / Laura Y Wang1, Ian Ganly// Future Oncology.— 2016.— Vol. 12, № 7 — Р. 981–994.
- Outcomes for patients with papillary thyroid cancer who do not undergo prophylactic central neck dissection / I. J. Nixon1, L. Y. Wang1, I. Ganly1 [и др] // Br J Surg.— 2016.— Vol. 103 (3).— P. 218–225. doi:10.1002 / bjs. 10 036.
- Nabhan, Fadi. Thyroid Nodules and Cancer Management Guidelines: Comparisons and Controversies / Fadi Nabhan, Matthew D. Ringel// Endocr Relat Cancer.— 2017.— Vol. 24 (2) — P. 13 — R26. doi:10.1530 / ERC- 16–0432.
- Центральная шейная лимфодиссекция при хирургическом лечeнии папиллярного рака щитовидной железы / Кропотов М. А., Гривачев Е. А., Яковлева Л. П. [и др.] // Злокачественные опухоли.— 2019 — № 2 — Т. 9 — С. 27–34. DOI: 10.18 027 / 222 450 572 019 922 734
- Nodal metastases in thyroid cancer: prognostic implications and management / Laura Y Wang1, Ian Ganly / Future Oncol.— 2016–12 (7) — p. 981–994. doi: 10.2217 / fon. 16.10.
- Влияние статуса гена BRAF на выбор тактики хирургического лечения высокодифференцированного рака щитовидной железы / А. П. Поляков, Н. Н. Волченко, Е. Н. Славнова [и др.] // Опухоли головы и шеи.— 2016.— № 4 — Т. 6 — С. 45–48. doi.org / 10.17 650 / 2222–1468–2016–6–4–45–48
- A multivariable model of BRAFV600E and ultrasonographic features for predicting the risk of central lymph node metastasis in cN0 papillary thyroid microcarcinoma / Bao-Ding Chen, Zheng Zhang, Ke-Ke Wang et al. // Cancer Management and Research.— 2019.— Vol. 11 — P. 7211–7217. doi: 10.2147 / CMAR. S199 921.
- Prognostic utility of BRAF mutation in papillary thyroid cancer / Xing M. // Mol Cell Endocrinol.— 2010.— Vol. 321 — P. 86–93. doi: 10.1016 / j. mce. 2009.10.012.
- Pre-operative role of BRAF in the guidance of the surgical approach and prognosis of differentiated thyroid carcinoma / Debora L S Danilovic, Erika U Lima1, Regina B Domingues [и др.] // European Journal of Endocrinology.— 2014.— Vol. 170, № 4.— Р. 619–625. https://doi. org / 10.1530 / EJE-13-0944


