Выявление и анализ различного усеченного фрагмента аллергического белка TBb в гречихе татарской
Автор: Ли П., Лин Р., Ванг З.
Журнал: Вестник аграрной науки @vestnikogau
Рубрика: Актуальные вопросы селекции гречихи
Статья в выпуске: 4 (25), 2010 года.
Бесплатный доступ
Аллергенные белки TBb (35kD) с сильной связывающей активностью иммуноглобулина Е (IgE) были выявлены в гречихе татарской. Цель этого исследования состояла в том, чтобы определить самую важную область TBb. Согласно предыдущему исследованию прогнозирования антигенной детерминанты, аллергический белок TBb был разделен на четыре фрагмента и назван F1, F2, F3, F4, соответственно. Ген фрагментов был амплифицирован методом ПЦР (полимеразная цепная реакция) с использованием праймеров, разработанных согласно TBb кДНК. Четыре экспрессионныx вектора, содержащие ген фрагментов, были построены и затем преобразованы в Escherichia coli BL21 (DE3) в клетке хозяина. Экспрессионные продукты были очищены Ni2 +-NTA при помощи колонки для аффинной хроматографии с использованием агарозы и проанализированы косвенным энзимсвязанным иммуносорбентным анализом (ELISA) с использованием сывороток от аллергенных пациентов. Очищенные белки были получены, и иммунологические результаты показали, что F1 и F2 демонстрируют более сильное соединение иммуноглобулина Е с сывороткой пациента, чем другие фрагменты. Результат означает, что F1 и F2, вероятно, содержат важные антигенные детерминанты в гречихе татарской.
Аллерген гречихи татарской, экспрессия, энзимсвязанный иммуносорбентный анализ (elisa), иммунологическая деятельность
Короткий адрес: https://sciup.org/147123543
IDR: 147123543 | УДК: 633.12:631.12
Текст научной статьи Выявление и анализ различного усеченного фрагмента аллергического белка TBb в гречихе татарской
Гиперчувствительность к гречихе (Fagopyrum esculentum) является частой причиной аллергии в Японии, Корее и других азиатских странах, вызывая реакции анафилактического типа у чувствительных людей, особенно у детей (Takahashi Y, и др., 1998). Сегодня во многих европейских странах и СШ А аллергия на гречиху становится фактором, вызывающим беспокойство здравоохранения из-за развивающейся тенденции употребления гречихи в качестве здоровой пищи и увеличивающегося использования гречневой муки в печеньях или вместо пшеничной муки людьми, имеющими аллергию на клейковину и страдающими целиакией (Schumacher F., Ш мидт П., Wuthrich B., 1993). В дополнение, сообщается о случаях астмы на ингаляции к гречихе или ночной астмы от сна на подушках, наполненных гречишной мякиной (обычно используемых в Корее), особенно у детей (Fritz SB., и др., 2001).
Гречиха принадлежит семейству Polygonaceae и включает две культурных разновидности: гречиха обыкновенная посевная (CB, Fagopyrum esculentum) и гречиха татарская (TB, Fagopyrum tataricum) (Yoshioka, H.; Yasueda, N.; Adachi, T., 2004). Об аллергенных реакциях на CB сообщается во многих различных областях, а число исследований, 64
Allergenic proteins TBb (35kD) with a strong IgE-binding activity have been identified in tartary buckwheat. The objective of this research was to determine the most important region of TBb. According to previous study on epitope prediction, allergic protein TBb was divided into four fragments and named F1, F2, F3, F4 respectively. The gene of fragments was amplified by PCR using the primers designed according to TBb cDNA. Four expression vectors containing the gene of fragments were constructed, and then transformed into the Escherichia coli BL21(DE3) host cell. The expression products were purified by Ni2+-NTA agarose affinity chromatography column, and analysed by indirect ELISA using sera from allergenic patients. The purified proteins were obtained and the immunological results showed that F1 and F2 exhibit stronger IgE binding to patient’s serum than the other fragments. The fact suggests that F1 and F2 probably contain the important epitopes in tartary buckwheat.
касающихся TB, увеличилось за последние годы (Zhang X., и др., 2008).
В данном исследовании аллергический белок TBb был разделен на четыре фрагмента при использовании сегментального экспрессионного метода и назван F1, F2, F3, F4, соответственно. Четыре экспрессионных вектора, содержащие ген фрагментов антигенных детерминант, были построены , и затем преобразованы в Escherichia coli BL21 (DE3) в клетке хозяина. Экспрессионные продукты были очищены и затем проанализированы косвенным энзимсвязанным иммуносорбентным анализом (ELISA) с использованием сывороток от аллергенных пациентов.
Материалы и методы
М атериалы
ДНК-полимераза Taq для цепной реакции полимеразы (PCR) была получена из TaKaRa (Далянь, Китай). Эндонуклеазы ограничения и другие ферменты для молекулярного клона были доставлены из Sangon (Ш анхай, Китай). Экспрессионный вектор pET-32m и штамм хозяина BL21 (DE3) были сохранены нашей лабораторией. Конъюгированные с пероксидазой хрена (HRP) антитела антиммуноглобулина Е мыши были доставлены из Southern Biotech.
Сыворотки от пациентов и контроль здоровья
Из Центра Крови Тайюаня, Китая были получены сыворотки трех пациентов с историей дыхательных, дерматологических, или желудочнокишечных симптомов, происходящих в течение 1 часа после приема внутрь гречихи. Здоровые сыворотки от добровольцев, не аллергических на гречневую крупу, использовались как отрицательный контроль .
Клонирование различных усеченных фрагментов в TBb
Согласно предыдущему исследованию предположения антигенной детерминанты, аллергический белок TBb был разделен на четыре фрагмента и назван F1, F2, F3, F4, соответственно. Ген различных усеченных фрагментов был усилен цепной реакцией полимеразы PCR от плазмиды pET-32m-TBb с использованием праймеров, перечисленных в таблице 1, и все программы цепной реакции полимеразы были представлены 30 циклами 94 ºС 1 минута, 60 ºС 1 минута, 72 ºС продукта PCR на 1 мин . Продукты цепной реакции полимеразы (PCR) были клонированы в pGEM-T короткого праймера для построения последовательности. После того, как они, оказались правильными, вектор был скомбинирован с Bam HI and Hind . Полученные фрагменты были взяты от экспрессионного вектора pET-32m, чтобы произвести четыре рекомбинантных плазмиды (pET-32m-F1, pET-32m-F2, pET-32m-F3 и pET-32m-F4).
Таблица 1 - Праймеры, разработанные для клонирования различных обрезанных фрагментов в TBb
|
фрагменты |
праймеры |
последовательности(5’-3’) |
|
F1 |
P1 |
5’-AT GGATCC GCGCAGCTATGGCCATGG -3’ |
|
P2 |
5’-AT AAGCTT TTACAAGAGGCCTCCTGGCTG-3’ |
|
|
F2 |
P3 |
5’-AT GGATCC CTTCCTTCCTACTCCAACG-3’ |
|
P4 |
5’-AT AAGCTT TTAGGCGGGAGATGGGATGAC-3’ |
|
|
F3 |
P5 |
5’-AT GGATCC GGTGTCGTGCAGTGGACT-3’ |
|
P6 |
5’-AT AAGCTT TTATGCGCCGATAAGTGCTTC-3’ |
|
|
F4 |
P7 |
5’-AT GGATCC AACATCTTGAGTGGATTCCA-3’ |
|
P8 |
5’-AT AAGCTT TTAATTGCTCCTTCCGCTTCCTC-3’ |
Прямые и обратные праймеры , содержащие Bam H I и Hin d III участки подчеркнуты
Экспрессия и очистка белков слияния
Построенные векторы, содержащие ген различных обрезанных фрагментов в TBb, были преобразованы в E. coli штамм BL21 (DE3), и экспрессия белка слияния была вызвана добавлением изопропил-бета-тиогалактопиранозида (IPTG) при заключительной концентрации 1 мм в жидкой среде Лурия-Бертани. После 3-х часов непрерывного встряхивания при 37°C белки слияния были очищены в условиях денатурации, с использованием комплекта HisTrap (Amersham Pharmacia Biotech, Упсала Ш веция) для идентификации. Рекомбинантный обрезанный фрагмент был проанализирован электрофорезом геля сульфатного многоакриламида додецила натрия (SDS-PAGE), с использованием 12.5 % геля многоакриламида.
Энзимсвязанный иммуносорбентный анализ (ELISA)
ELISA был выполнен, чтобы обнаружить IgE-связанную активность к различным обрезанным фрагментам F1, F2, F3 и F4. После наполнения 96-луночных плашек каждым белком (1,0 mg/50 ml 50миллиметрового буфера карбоната натрия, 9,6) и быстрого инкубирования при 4°C они были извлечены солевым раствором, буферизованным фосфатом (PBS, pH 7.5), содержащим 0,05 % полисорбата 20 (PBST), после чего последовала блокировка 1%-ым бычьим сывороточным альбумином на 1 час при 37°C. Далее плашки были обработаны фосфатно-буферным солевым раствором, быстро инкубированы при 4°C с сывороточными образцами, разбавленными из 5% (1:20 разбавлений). После дальнейшей отмывки с PBST конъюгированные с пероксидазой хрена (HRP) антитела антиммуноглобулина Е мыши (Southern Biotech, Бирмингем, Алабама), разбавленные PBST, были добавлены в плашки и инкубированы в течение
-
1 часа при 37°C, после чего они вступили в реакцию с хромогеном и ортофенуленом диамином. OD-характеристик смеси были измерены в 490 нм планшет-ридером (Био радиус, Геркулес, Калифорния).
Результаты
Клонирование , экспрессия и очистка различных обрезанных фрагментов в TBb
Используя сегментальный экспрессионный метод, векторы , содержащие ген различных обрезанных фрагментов в TBb, были успешно построены (рис. 1, рис. 2). Аллергические белковые фрагменты (F1, F2, F3, F4) TBb были выражены как 6× Гистеговые белки в соответствии с инструкциями изготовителя (Qiagen, Inc., Валенсия, Калифорния). После того, как рекомбинантные белки были очищены хроматографией с целью идентификации, результат анализа методом электрофореза в полиакриламидном геле с додецилсульфатом натрия показал, что молекулярная масса хорошо совпала с теоретическим прогнозом, и чистота была> 95 % (рис. 3).
Соотношение иммуноглобулина Е (IgE) фрагментов антигенного детерминанта ( эпитопа ) в TBb
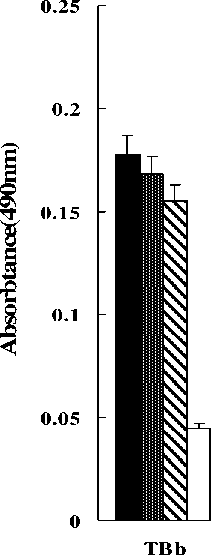
Чтобы определить реактивность IgE фрагментов и идентифицировать самую значительную область в TBb, энзимсвязанный иммуносорбентный анализ ( ELISA) был выполнен с каждым рекомбинантным белком, с использованием трех IgE-положительных сывороток и отрицательного контроля. Как показано на рисунке 4, сывороточные образцы от трех пациентов, имеющих аллергию на гречиху, были реактивными с этими рекомбинантными фрагментами, в то время как нормальный сывороточный образец был отрицателен. F1 и F2 показали самую сильную реактивность IgE среди всех тестированных фрагментов.
Mr 1 2 3 4
Mr 1 2 3 4 5 6 7 8
Рисунок 2 – Анализ электрофореза геля агарозы рекомбинантной идентификации плазмиды .
Рекомбинантная плазмида была идентифицирована двойными средами ( Bam H I and Hin d III) и цепной реакцией полимеразы (PCR). Mr, DL Маркер 2000; дорожка 1, 2, pET-32m-F1 идентификаци ; дорожка 3, 4, pET-32m-F2 идентификация ; переулок 5, 6, pET-32m-F3 идентификация ; переулок 7, 8, pET-32m-F4 идентификация
Рисунок 1 – Анализ электрофореза геля агарозы продуктов цепной реакции полимеразы
Ген различных обрезанных фрагментов был PCR усиленным от плазмиды pET-32m-TBb.
Г ., Маркер 2000 DL; дорожка 1, F1; дорожка 2, F2; дорожка 3, F3; дорожка 4, F4
kDa Mr 1 2 3 4
94.0
67.0
43.0
30.0
20.1
14.4
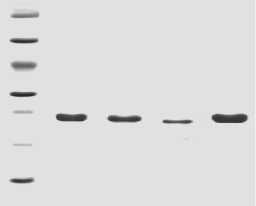
Рисунок 3 – Анализ методом электрофореза в полиакриламидном геле с додецилсульфатом натрия фрагментов в TBb.
Экспрессионные продукты были очищены Ni2 +-NTA при помощи колонки для аффинной хроматографии с использованием агарозы и они были изучены на 12.5 % геле , окрашенным кумасси бриллиантовым голубым . Mr., стандартный маркер белков (Pharmacia Bitotech, Упсала Ш веция ); дорожка 1, F1; дорожка 2, F2; дорожка 3, F3; дорожка 4, F4


Patient1
Patient2
Patient3
Normal serum
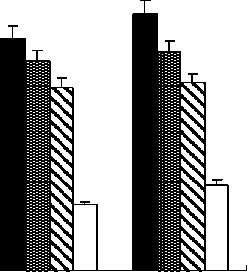
F1 F2 F3 F4
Fragments in TBb
Рисунок 4 – Соотношение белков к IgE в сыворотке от пациентов , имеющих аллергию на гречиху , и здоровый контроль , измеренный энзимсвязанным иммуносорбентным анализом ( ELISA). Были обнаружены статистически значительные различия между пациентами и здоровым контролем и между четырьмя фрагментами в их реактивности иммуноглобулина Е (IgE)
Дискуссия
Анализ антигенной детерминанты (эпитопа) аллергена является основополагающим методом, отражающим причину, почему различные аллергены вызывают сверхчувствительные реакции. Как правило, антигенная детерминанта (эпитоп) состоит из нескольких аминокислот или областей, которые могут быть расположены на различных подгруппах, формируя линейную или конформационную структуру.
Наше предыдущее исследование идентифицировало белок под названием аллерген TB в гречихе татарской и также выяснилось, что у него есть две области, у которых была та же самая структура распада, как и у других белков хранения семени. Выведенные N- и C-концевые области были названы TBb (34 kDa) и TBa (24 kDa), соответственно (Zhang X., и др., 2008). В данном исследовании, чтобы определить самую важную область TBb, мы расщепили его на четыре фрагмента и назвали F1, F2, F3, F4, соответственно, применяя сегментальный экспрессионный метод. Однако наши результаты энзимсвязанного иммуносорбентного анализа (ELISA) показали, что у фрагментов F1 и F2 присутствует более сильная связывающая реактивность иммуноглобулина Е (IgE), чем у других фрагментов. Полученные данные предполагают, что F1 и F2 вероятно содержали важные антигенные детерминанты (эпитопы) в TBb.
Тем не менее, необходимо большее количество признаков, чтобы доказать это заключение определенно. Будут применяться различные методы , такие как торможение энзимсвязанного иммуносорбентного анализа (ELISA), дот-блот анализ, вестерн-блоттинг и т.д. Этот анализ фрагментов аллергенного белка TBb гречихи татарской должен помочь терапевтическим усилиям и содействию в развитии гипоаллергенной гречихи.
Ф инансирование и поддерж ка
Работа была выполнена при поддержке Фонда Естественных наук Китая (30671084 и 30970611) и Фонда Естественных наук Области Ш аньси (2007011077).
Список литературы Выявление и анализ различного усеченного фрагмента аллергического белка TBb в гречихе татарской
- Takahashi Y, Ichikawa S, Aihara Y, Yokota S, 1998. Buckwheat allergy in 90,000 school children in Yokohama. Aerugi.47:16-33
- Schumacher F, Schmidt P, Wuthrich B,1993. Sarrazin allergy: a contribution to buckwheat allergy. Schweiz Med Wochenschr.123:1559-62
- Fritz SB, Gold BL, 2003. Buckwheat pillow-induced asthma and allergic rhinitis. Ann Allergy Asthma Immunol.90:355-8
- Lee SY, Lee KS, Hong CH, Lee KY, 2001. Three cases of childhood nocturnal asthma due to buckwheat allergy. Allergy.56:763-6
- Yoshioka, H., Yasueda, N., Adachi, T., 2004. Molecular cloning and expression of a major allergenic protein Fag e 2 from buckwheat. Fagopyrum.21: 35-38
- Xin Zhang, Jing Ming Yuan, Xiao Dong Cui, and Zhuan Hua Wang, 2008. Molecular Cloning, Recombinant Expression, and Immunological Characterization of a Novel Allergen from Tartary Buckwheat. J. Agric. Food Chem. 56:10947-10953
- Wang, Z. H., Zhang, Z., Zhao, Z. H., Wieslander, G., Norba ¨ck, D., Kreft, I,2004. Purification and characterization of a 24 kDa protein from tartary buckwheat seeds. Biosci.Biotechnol. Biochem.68: 1409-1413
- Wang, Z. H.,Wang, L.,Chang, W. J.,Li, Y. Y., Zhang, Z.;Wieslander, G., Norba ¨ck, D,2006. Cloning, expression, and identification of immunological activity of an allergenic protein in tartary buckwheat. Biosci. Biotechnol. Biochem. 70: 1195-1199


