Выявление микрометастазов в костном мозге и лимфатических узлах онкологических больных с использованием метода иммуномагнитной сепарации
Автор: Стилиди И.с, Лебединская О.В., Шубина И.Ж., Пирогов А.В., Полоцкий Б., Доненко Ф.В., Киселевский М.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Экспериментальные исследования
Статья в выпуске: 1 (21), 2007 года.
Бесплатный доступ
Исследована возможность выявления микрометастазов в костном мозге и лимфатических узлах больных раком лёгкого и пищевода методом магнитной сепарации с магнитными шариками, покрытыми антителами к цитокератинам. Выявлено, что данный метод позволяет получить обогащенную фракцию цитокератин-положительных клеток и может бьпь использован для целей интраоперационной диагностики микрометастазов. Однако при цитологическомисследованиине все выделенные клетки с фиксированными на их мембране магнитными шариками могут однозначно квалифицироваться как опухолевые. Для более точной верификации микрометастазов в костном мозге и лимфатических узлах онкологических больных необходимо дополнительное стандартное окрашивание и цитологический анализ клеток, выделенных методом положительной магнитной селекции.
Рак легкого, рак пищевода, микрометастазы, магнитная селекция
Короткий адрес: https://sciup.org/14054543
IDR: 14054543 | УДК: 616-006-033.2:
Текст научной статьи Выявление микрометастазов в костном мозге и лимфатических узлах онкологических больных с использованием метода иммуномагнитной сепарации
Современные хирургические методы позволяют существенно повысить эффективность лечения рака пищевода и немелкоклеточного рака лёгкого. Вместе с тем у значительного количества пациентов, несмотря на оптимальное хирургическое вмешательство, неоадъювантную и адъювантную химиотерапию, в течение двух лет наблюдаются рецидивы заболевания [1, 2, 3]. Неблагоприятным прогностическим признаком на этапе предварительной диагностики является выявление метастазов в лимфатических узлах. Однако даже в случае отрицательного гистологического анализа на наличие метастазов в лимфатических узлах почти у 50 % больных с I стадией немелкоклеточ- ного рака легкого и рака пищевода развивается рецидив заболевания Эти факты указывают на то, что у больных могут быть скрытые микрометастазы, которые не определяются традиционными методами дои интраоперационной диагностики. Таким образом, системное распространение процесса может происходить уже на ранних стадиях рака легкого и пищевода [17–19].
За последние 15 лет проблема выявления микрометастазов в лимфатических узлах и костном мозге стала широким полем для исследования [4–23]. Ряд сообщений свидетельствует об эффективности различных способов обнаружения микрометастазов.
Например, показано, что иммуногистохимический и иммуноцитохимический анализы эпителиальных ци-токератиновых протеинов (ЦК) являются эффективными методами выявления микрометастазов в лимфатических узлах и костном мозге [7, 10, 16, 24]. Однако методы иммуногистохимического и иммуноцитохимического анализов требуют большого количества времени и трудоёмки. Кроме того, они могут давать ложно-положительные результаты [4, 5].
В последние годы разработан метод иммуномаг-нитной сепарации для быстрого выделения опухолевых клеток из периферической крови и костного мозга. Результаты исследования показывают его эффективность у пациентов с остеосаркомой, злокачественной меланомой, раком молочной железы, колоректальным раком и др. [12, 22]. Данный метод приобретает большое практическое значение для интраоперационной диагностики микрометастазов с целью уточнения стадии заболевания и объёма хирургического вмешательства.
Целью нашего исследования является оценка возможности применения метода иммуномагнитной сепарации для интраоперационной диагностики микрометастазов в лимфатических узлах и костном мозге у больных немелкоклеточным раком легких и раком пищевода.
Материал и методы
Пробы для исследования были взяты у 25 пациентов в возрасте от 40 до 65 лет. Больным проводили хирургическое лечение по поводу немелкоклеточного рака легких и рака пищевода II–III стадии. По гистологическому типу опухоли относились к плоскоклеточному раку и аденокарциноме. Резецированный на этапе торакотомии сегмент ребра и удалённые в процессе операции регионарные лимфатические узлы использовали для анализа на микрометастазы.
Подготовка костного мозга и лимфатического узла
Удаленный сегмент ребра и лимфатический узел забирали непосредственно из операционной в лабораторию. Клетки костного мозга с помощью многократного промывания элюировали в среду RPMI 1640 (ICN, США). Из лимфатических узлов получали клеточную взвесь посредством механического измельчения. Из взвеси клеток костного мозга и лимфати- ческого узла выделяли мононуклеарные клетки (МНК) центрифугированием в Ficoll-Hypaque (Histopaque, Sigma, США) стандартной плотности.
Иммуномагнитная сепарация
Выделение цитокератин-положительных (ЦК+) клеток из МНК костного мозга и лимфатических узлов проводили посредством положительной селекции клеток с использованием набора для магнитной сепарации опухолевых клеток (MACS Cytokeratin Microbeads Carcinoma Cell Enrichment Kit, Miltenvi Biotec, Германия). МНК инкубировали с магнитными шариками, покрытыми моноклональными антителами к цитокератину 7/8. Процедуру иммуномаг-нитного разделения проводили в соответствии с протоколом, предусмотренным производителем.
Обогащённую взвесь ЦК-положительных клеток помещали на покрытые полилизином стёкла и высушивали. Образцы, включавшие две и более клеток с шариками, прикрепленными в форме розетки, считались положительными. Для морфологической идентификации мазки окрашивали гематоксилином-эози-ном. Микроскопическую оценку и фотографирование производили с помощью микроскопа Zeiss Axioplan (Carl Zeiss, Jenna, Германия).
Флуоресцентная цитометрия
Обогащенную суспензию отобранных ЦК+ клеток окрашивали FITC-мечеными моноклональными антителами CD45 c соответствующим изотипическим контролем IgG1 (Caltag Laboratories, США). Цитологические пробы анализировали с помощью флуоресцентного микроскопа Zeiss Axioplan 2 (Zeiss, Германия).
Цитологическое исследование
Клетки обогащенной суспензии наносили на стёкла, покрытые полилизином, и окрашивали гематок-силином-эозином (Gimsa-Solution Standard, Fluka Chemie, Швейцария). Микроскопическое исследование проводили с помощью микроскопа Zeiss Axioplan 2 (Zeiss, Германия).
Результаты исследования
В результате проведения магнитной сепарации образцов костного мозга, взятых у 25 онкологических больных раком пищевода и лёгких, в 15 из них обнаружены от 2 до 15 клеток, окруженных меченными антителами к цитокератинам магнитными шариками

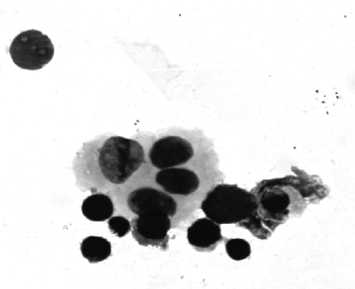
а
б
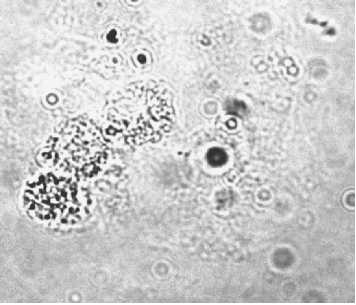
Рис. 1. Цитокератин-позитивные клетки, изолированные методом положительной магнитной селекции из костного мозга онкологических больных:
а (ок. 10, об. 40), в (ок. 10, об. 90) – клетки, образующие розетки с магнитными шариками, меченными антителами к цитокератинам, на неокрашенном препарате; б – клетки цитокератин-положи-тельной пробы, окрашенные азуром II-эозином (ок. 10, об. 90); г – CD45+ клетки цитокератин-положительной пробы, окрашенные фикоэритрин-мечеными антителами (ок. 10, об. 90)
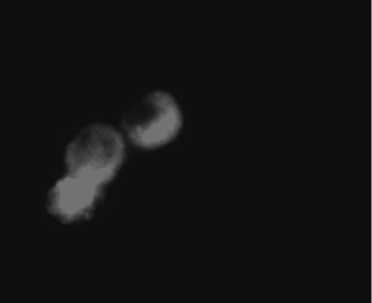
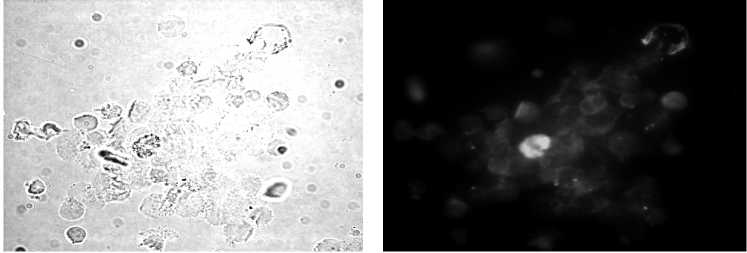
Рис. 2. Цитокератин-отрицательные клетки, изолированные методом отрицательной магнитной селекции из костного мозга онкологических больных:
а – клетки, свободные от магнитных шариков, меченных антителами к цитокератинам, на неокрашенном препарате (ок. 10, об. 40); б – CD45+ клетки цитокератин-отрицательной пробы, окрашенные фикоэрит-рин-мечеными антителами (ок. 10, об. 40)
в виде розеток (рис. 1а). Во всех образцах костного мозга с выявленными при иммуноцитохимическом окрашивании ЦК+ клетками также были идентифицированы клеточные комплексы с магнитными шариками. В позитивных образцах при окрашивании гемотоксилином-эозином выявлялись крупные клетки с ядрами округлой или овальной формы, которые, однако, при цитологическом анализе не могли быть квалифицированы как опухолевые (рис. 1б). Имму-нофлуоресцентное исследование клеток с фиксированными на мембране магнитными шариками пока- зало, что они экспрессируют маркёр гемопоэтических клеток – CD45 (рис. 1в, г) так же, как и ЦК-негатив-ные мононуклеарные лейкоциты костного мозга (рис. 2а, б).
В образцах пораженных метастазами лимфатических узлов обнаружено большое количество окруженных магнитными шариками клеток, которые при последующем стандартном цитологическом исследовании квалифицированы как опухолевые (рис. 3а, б). У 4 пациентов в морфологически интактных лимфатических узлах обнаружены единичные ЦК-позитив-
б
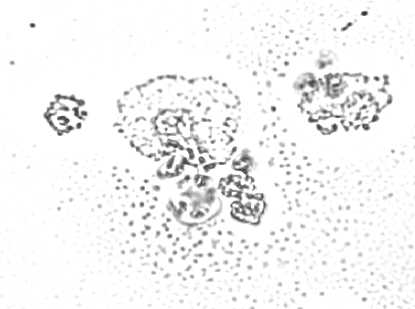
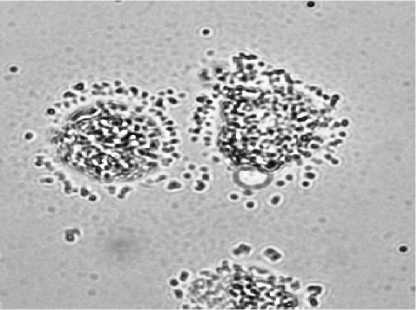
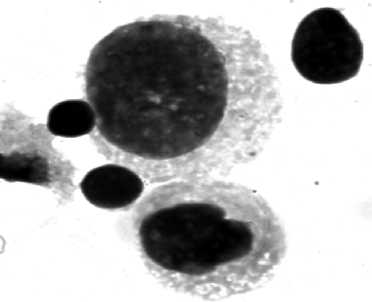
Рис. 3. Цитокератин-позитивные клетки, изолированные методом положительной магнитной сепарации из метастатических и интактных лимфатических узлов онкологических больных:
а – клетки метастатического узла, образующие розетки с магнитными шариками, меченными антителами к цитокератинам, на неокрашенном препарате (ок. 10, об. 90); б – клетки цитокератин-положительной пробы метастатического узла, окрашенные азуром II-эозином (ок. 10, об. 90); в – клетки интактного узла, образующие розетки с магнитными шариками, меченными антителами к цитокератинам, на неокрашенном препарате (ок. 10, об. 90); г – клетки цитокератин-положительной пробы интактного узла, окрашенные азуром II-эозином (ок. 10, об. 90)
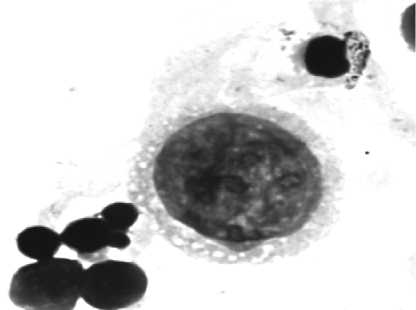
г
ные клетки, которые при окрашивании гематоксили-ном-эозином также были расценены как опухолевые (рис. 3в, г).
Таким образом, метод магнитной сепарации позволяет получить обогащенную фракцию цитокера-тин-положительных клеток и может быть использован для целей интраоперационной диагностики микрометастазов. Однако наличие в препаратах клеток с фиксированными на их мембране магнитными шариками, покрытыми антителами к цитокератинам, не дает оснований однозначно квалифицировать выделенные клетки как опухолевые. Для более точной верификации микрометастазов в костном мозге и лимфатических узлах онкологических больных необходимо дополнительное стандартное окрашивание клеток с последующим цитологическим исследованием.


