Выявление микромицетов Aspergillus flavus и их токсических метаболитов
Автор: Потатуркина-нестерова Н.И., Немова И.С., Нестеров А.С., Пантелеев С.В., Шроль О.Ю., Артамонова М.Н., Алексеева А.С.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Фундаментальная биология и медицина
Статья в выпуске: 2, 2015 года.
Бесплатный доступ
В работе произведена детекция микрофлоры репродуктивного тракта пациенток с ИППП и здоровых женщин методом газовой хроматографии - масс-спектрометрии. У штаммов микромицетов Аspergillus flavus, выделенных у больных женщин, в отличие от здоровых, обнаружены афлатоксины В1, В2, М1, G1.
Афлатоксины в1, в2, м1, микромицеты аspergillus flavus, микрофлора, репродуктивный тракт, иппп, miсromycetes aspergillus flavus
Короткий адрес: https://sciup.org/14113066
IDR: 14113066 | УДК: 579.61
Текст научной статьи Выявление микромицетов Aspergillus flavus и их токсических метаболитов
Введение. Большую опасность для здоровья человека и животных представляют плесневые микроскопические грибы, продуцирующие токсичные метаболиты – микотоксины. Установлено, что токсины плесневых грибов оказывают патогенное действие практически на все органы и системы организма человека и животных [1, 4, 8]. Основным источником плесневых грибов является почва. Установлено длительное пребывание спор грибов на растениях, в воде, в воздухе и пыли производственных помещений [2].
Ведущая роль среди грибов, продуцирующих микотоксины, принадлежит микро-мицетам рода Aspergillus , в частности A. fla-vus , часто являющимся причиной алиментарных микотоксикозов животных и человека [4, 5]. Эти микотоксины относятся к группе токсичных веществ небелковой природы – вторичных метаболитов грибов. Токсичные метаболиты гриба A. flavus могут обсеменять самые различные пищевые продукты: зерно, мясо, молоко, овощи, фрукты и др. Установлено мутагенное действие микотоксинов гриба A. flavus , выражающееся в нарастании числа хромосомных аберраций, а также их гепатотропное и канцерогенное действие. Показана связь первичного рака печени у человека с загрязнением пищи афлатоксином В1 [6].
Особенно высок риск возникновения злокачественных опухолей у лиц, занятых переработкой сельскохозяйственной продукции.
В настоящее время обсуждается роль микотоксинов как промоторов канцерогенеза [3].
Обнаружено тератогенное действие афлатоксинов, способность ингибировать биосинтез ДНК, РНК эукариотических клеток, глобулинов и иммуноглобулинов, вызывать развитие гиперергических реакций. Следовательно, токсины плесневых грибов оказывают патологическое действие практически на все органы и системы организма человека и животных [2, 11].
Установлено, что токсичное действие афлатоксинов обусловлено их взаимодействием с нуклеофильными участками ДНК, РНК и белков эукариотических клеток. Кроме того, они способны изменять свойства микробов, усугубляя тяжесть течения инфекционного процесса [10]. Однако выявление способности продуцировать микотоксины у микромицетов, обнаруженных в микробном консорциуме человека, представляет большие сложности. Высокая токсичность, небольшой размер молекул и незначительные структурные отличия между молекулами разных типов афлатоксинов затрудняют их детекцию.
Цель исследования. Детекция микроми-цетов Аspergillus flavus в составе микробного биоценоза репродуктивного тракта и токсических продуктов их метаболизма у женщин с ИППП.
Материалы и методы. Обследовано 89 женщин, больных ИППП (первая группа), и 59 практически здоровых женщин (вторая группа). Группы репрезентативны по возрасту. У всех обследованных определяли микробный профиль репродуктивного тракта в соответствии с Приказом министерства здравоохранения СССР от 22.04.1985 № 535 («Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений»). В качестве исследуемого материала использовали вагинальное и цервикальное отделяемое обследованных женщин.
У выделенных штаммов микромицетов Аspergillus flavus определяли наличие афлатоксинов В1, В2, М1, G1 методом газовой хроматографии – масс-спектрометрии (ГХ-МС) [5, 9]. Для этого использовали хроматограф Microbial Identification System (фирма MIDI Inc., Делавер, США).
Отобранный на стерильные зонды биологический материал из культуральной жидкости после серии химических реакций анализировали на содержание метиловых эфиров жирных кислот, спиртов и альдегидов. Для этого пробу на зонде высушивали c добавлением 80 мкл метанола и подвергали кислому метанолизу в 1,2 н HCl в метаноле в течение 45 мин. На этой стадии происходит освобождение жирных кислот и альдегидов из сложных липидов микроорганизмов и других клеток жидкости в виде метиловых эфиров и диметилацеталей. Для получения триметилсилильных эфиров оксикислот и стеролов су- хой остаток обрабатывали N,О-бис(триметил-силил)-трифторацетамидом в течение 9 мин при 80 ºС. В качестве внутреннего стандарта использовали дейтерометиловый эфир тридекановой кислоты.
Хроматографическое разделение производили при начальной температуре 130 ºС в течение 0,5 мин, затем осуществляли нагрев до температуры 320 ºС со скоростью 70 ºС/мин, выдержка при конечной температуре – 6 мин. В качестве газа-носителя использовали гелий, поток 1,2 мл/мин в режиме «без деления потока». Анализируемую пробу (1–10 мкл) вводили в поток газа при повышенной температуре дозатором через резиновую термостойкую мембрану. Жидкая проба быстро испарялась и потоком газа переносилась в хроматографическую колонку, находящуюся в термостате. Хроматограммы записывали в режиме регистрации выделенных ионов (SIM) при периодическом сканировании до 30 ионов в 5 интервалах времени. Интервалы и ионы выбирали таким образом, чтобы селективно детектировать маркеры определяемых токсинов.
В качестве контроля при выявлении афлатоксинов методом ГХ-МС использовали штамм A. flavus F-1118, полученный из лаборатории живых культур грибов Российского центра по глубоким микозам (г. Санкт-Петербург). Из данного штамма получали смесь афлатоксинов, которые использовали в качестве стандарта (рис. 1).
1250 mV
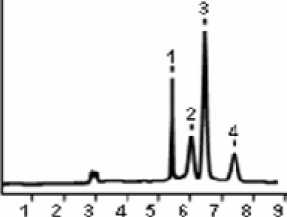
Рис. 1. Стандартная смесь афлатоксинов B1, B2, G1, G2
I г i- Г I— I— r I II
11 12 13 14 15 16 17 18 мин
Расчет концентрации афлатоксина В1 проводили по формуле
„ V 1 • V 3 • V 5 • т =т + h С =------------------,
V2 • V4 • V6 • M • hem где
-
V 1=125 мл – объем водно-ацетоновой смеси;
-
V 2=50 мл – объем водно-ацетонового фильтрата, взятого для анализа;
-
V 3=100 мл – объем водно-ацетонового фильтрата и раствора ацетата свинца;
-
V 4=80 мл – объем фильтрата после очистки ацетатом свинца;
-
V 5=400 мкл – объем очищенного раствора экстракта в хлороформе перед ГХ;
-
V 6=20 мкл – объем раствора экстракта, вводимого в инжектор хроматографа;
m ст =0,5 нг – количество афлатоксина во введенном объеме стандарта;
h ст =58,3 мм – высота пика стандарта афлатоксина;
h =24,8 мм – высота пика афлатоксина в введенном объеме экстракта;
М – объем исследуемого фильтрата, мл.
Результаты и обсуждение. В результате проведенных исследований на основании выявления химических соединений – продуктов метаболизма аэробных и анаэробных бакте- рий-ассоциантов репродуктивного тракта женщин с ИППП – в культуральных жидкостях идентифицировано 16 видов микроорганизмов. Качественный и количественный состав химических маркеров, позволяющих производить детекцию микроорганизмов, представлен в табл. 1, где приведены время удерживания и характерный ион, по которому вели регистрацию определяемых веществ.
Установлено, что содержание в культуральной жидкости метаболитов микроорганизмов, позволяющих производить детекцию, было различным при ИППП и у здоровых женщин. Это касалось и аэробных ( E. сo-li , Aspergillus flavus ), и анаэробных ( Bifidobacterium spp .) микроорганизмов, а также микробов, обладающих способностью осуществлять энергетический обмен как в аэробных, так и в анаэробных условиях ( Streptococcus spp., Staphylococcus spp., Klebsiellа spp., Cory-nebacterium хerosis и др.). Наибольшее увеличение количества метаболитов, обнаруженных в культуральной жидкости и являющихся детекторами микрофлоры репродуктивного тракта у пациенток с ИППП, по сравнению со здоровыми, отмечалось у таких микроорганизмов, как Aspergillus flavus .
Таблица 1
|
Химический маркер (микроорганизм) |
Время удерживания, мин |
Ион |
С, мкг/мл |
|
Декановая кислота ( Streptococcus spp .) |
4,36 |
87 |
0,92 |
|
Цис-вакценовая кислота ( Lactobacillus spp .) |
15,26 |
87 |
2,13 |
|
Октадеценовый альдегид ( Bifidobacterium spp .) |
15,80 |
75, 281 |
1,17 |
|
Антеизотридекановая кислота ( S. haemolythicus, S. аureus, S. hominis, S. saprophyticus ) |
16,49 |
87 |
0,07 |
|
Изогептадекановая кислота ( Staphylococcus еpidermidis ) |
13,60 |
87 |
1,41 |
|
Кампестерол (микромицеты) |
27,87 |
343 |
1,15 |
|
Антеизогептадекановая кислота ( Corynebacterium хerosis ) |
14,54 |
86 |
0,06 |
|
Ситостерол-β (микр. грибы) |
29,45 |
96 |
16,9 |
|
Циклогептадекановая кислота ( E. сoli ) |
14,34 |
85 |
0,06 |
|
2-оксимиристиновая кислота ( Klebsiellа spp .) |
14,12 |
86 |
0,07 |
|
Циклононадекановая кислота ( Enterococcus faecalis ) |
14,87 |
87 |
0,63 |
|
Химический маркер (микроорганизм) |
Время удерживания, мин |
Ион |
С, мкг/мл |
|
Гептадеценовая кислота ( Candida albicans ) |
13,81 |
87,25 |
1,45 |
|
Линолевая кислота ( Aspergillus flavus ) |
15,45 |
92,1 |
16,7 |
|
Оксиизоэйкозановая кислота ( Chlamydia rachomatis ) |
14,1 |
67 |
0,05 |
Качественный и количественный состав химических метаболитов – маркеров микроорганизмов
Содержание их маркера – линолевой кислоты – при ИППП составляло 67·105 кл./г, тогда как у здоровых женщин данный метаболит не обнаруживался. Количественные показатели декановой кислоты – маркера Streptococcus spp. – у женщин с ИППП превышали таковые у здоровых в 6,1 раза (табл. 2).
Таблица 2
|
Химический маркер (микроорганизм) |
При ИППП, ×105 кл./г |
Здоровые, ×105 кл./г |
|
Декановая кислота ( Streptococcus spp. ) |
212 |
35 |
|
Цис-вакценовая кислота ( Lactobacillus spp. ) |
871 |
967 |
|
Октадеценовый альдегид ( Bifidobacterium spp. ) |
371 |
478 |
|
Антеизотридекановая кислота ( S. haemolythicus, S. аureus, S. hominis, S. saprophyticus ) |
35 |
12 |
|
Изогептадекановая кислота ( Staphylococcus еpidermidis ) |
56 |
19 |
|
Кампестерол (микромицеты) |
136 |
0 |
|
Антеизогептадекановая кислота ( Corynebacterium хerosis ) |
158 |
79 |
|
Оксиизоэйкозановая кислота ( Chlamydia trachomatis ) |
24 |
3 |
|
Циклогептадекановая кислота ( E. сoli ) |
49 |
22 |
|
2-оксимиристиновая кислота ( Klebsiellа spp. ) |
32 |
11 |
|
Циклононадекановая кислота ( Enterococcus faecalis ) |
87 |
23 |
|
Гептадеценовая кислота ( Candida albicans ) |
225 |
54 |
|
Линолевая кислота ( Aspergillus flavus ) |
67 |
0 |
|
Афлатоксин В1 ( Aspergillus flavus ) |
500 |
0 |
|
Афлатоксин В2 ( Aspergillus flavus ) |
490 |
0 |
|
Афлатоксин М1 ( Aspergillus flavus ) |
475 |
0 |
|
Афлатоксин G1 ( Aspergillus flavus ) |
327 |
0 |
Уровень метаболитов, являющихся детекторами микроорганизмов, у пациенток с ИППП и у здоровых женщин
Выявленные изменения содержания в исследуемом материале метаболитов, являющихся детекторами микроорганизмов, свидетельствуют о снижении уровня обсемененно-сти репродуктивного тракта у пациенток с
ИППП нормальной микрофлорой ( Lactobacillus spp., Bifidobacterium spp .) и значительном увеличении уровня транзиторной биоты ( Streptococcus spp., Staphylococcus spp., Candida spp. и др.).
Таким образом, проведен ускоренный (менее двух часов) анализ компонентов микробных клеток и токсических метаболитов микромицетов Аspergillus flavus методом газовой хроматографии по спектру специфических компонентов их мембран или специфическим продуктам пиролиза и гидролиза клеточных препаратов для выявления микотоксинов.
В результате проведенных исследований на основании выявления химических соединений – продуктов метаболизма микромице-тов Aspergillus flavus , выделенных из репродуктивного тракта больных ИППП, в культуральных жидкостях идентифицировано четыре потенциально значимых соединения, продуцируемых микромицетами Aspergillus fla-vus : афлатоксин В1, афлатоксин В2, афлатоксин М1 и афлатоксин G1.
Традиционные пути идентификации микроорганизмов – возбудителей инфекционных заболеваний или гнойно-воспалительных процессов – включают в себя несколько этапов: посев биологического материала на питательные среды, получение чистых (т.е. состоящих из одинаковых микробов) культур, выращивание их на средах обогащения и лишь затем их идентификацию по характеру разрушения тех или иных субстратов. Даже для микроорганизмов, обладающих способностью к быстрому росту, эти этапы исследования занимают не менее 2 сут.
Известно, что в процессе метаболизма микробные клетки производят низшие карбоновые кислоты, причем набор кислот является как бы «визитной карточкой» того или иного микроорганизма. Это способствовало появлению экспресс-метода на основе метода хрома-то-масс-спектрометрии (ХМС). В основе метода лежит высокоточное определение специфических маркерных молекул, входящих в состав клеточных липидов микроорганизмов.
Применяемые на сегодняшний день методы идентификации микроэкологического статуса организма человека, а также диагностики инфекций имеют определенные ограничения и недостатки. Например, существенным недостатком классического бактериологического исследования, помимо дороговизны и длительности, является невозможность оценить роль некультивируемых микроорганизмов в инфекционно-воспалительном процессе. Иммуно-серологический метод является непрямым, поскольку выявляет не возбудителя, а иммунный ответ на него, который может иметь индивидуальные вариации. Известные молекулярно-биологические методы при несомненных преимуществах (прямое определение возбудителя, высокие специфичность и чувствительность, универсальность, скорость, возможность диагностики хронических и латентных инфекций) имеют такие серьезные недостатки, как частые ложноположительные результаты и невозможность адекватной количественной оценки.
Из всего вышесказанного вытекает очевидная необходимость надежного количественного экспресс-метода диагностики дисбактериозов и определения возбудителей инфекции. Такими свойствами обладает метод масс-спектрометрии микробных маркеров (МСММ) по селективным ионам, в основе которого лежит высокоточное определение специфических маркерных молекул, входящих в состав клеточных липидов микроорганизмов, а именно жирных кислот. Высокочувствительный и селективный метод газовой хроматографии – масс-спектрометрии позволяет одновременно измерять концентрации более сотни микробных маркеров непосредственно в анализируемом материале: крови, моче, био-птатах и других биологических жидкостях и тканях, а также в небиологических пробах, минуя стадии предварительного посева на питательные среды или использование тестовых биохимических материалов.
В связи с этим детекция потенциально значимых метаболитов аэробных и анаэробных бактерий-ассоциантов биоценоза репродуктивного тракта в культуральной жидкости методом газовой хроматографии представляет интерес для формулирования перспективных задач поиска новых алгоритмов коррекции нарушений репродуктивного здоровья.
Выводы:
-
1. Исследованы хромато-масс-спектрометрические характеристики (время удерживания и масс-спектры электронного удара) для специфических метаболитов, являющихся детекторами микрофлоры репродуктивно-
- го тракта у пациенток с нарушениями метаболизма различной степени тяжести.
-
2. С помощью исследованных характеристик маркеров в культуральной жидкости установлен видовой состав микробиоты репродуктивного тракта обследованных женщин, включающий 16 таксонов микроорганизмов.
-
3. Показана эффективность хромато-масс-спектрометрии, позволяющей в течение 2 ч по содержанию в пробе потенциально значимых метаболитов аэробных и анаэробных бактерий-ассоциантов выявить отличия в микроэкологическом статусе репродуктивного тракта женщин.
-
4. Наибольшее увеличение количества потенциально значимых метаболитов при ИППП, обнаруженных в культуральной жидкости, выявлено у микроскопических грибов Aspergillus flavus .
-
5. Среди выявленных химических веществ микробного происхождения обнаружены четыре потенциально значимых соединения, продуцируемых микромицетами Aspergillus flavus : афлатоксин В1, афлатоксин В2, афлатоксин М1, афлатоксин G1.
-
1. Выявление афлатоксина В 1 у клинических изолятов микромицетов Aspergillus flavus / Н. И. Потатуркина-Нестерова [и др.] // Современные проблемы науки и образования. – 2012. – № 4. – С. 10.
-
2. Елинов Н. П. Аспергиллезная инфекция; подходы к ее диагностике и лечению / Н. П. Ели-нов, В. С. Митрофанов, Р. М. Чернопятова // Проблемы медицинской микологии. – 2002. – Т. 4, № 1. – С. 24–27.
-
3. Немова И. С. Изменение микрофлоры кожи рабочих в условиях комбикормового завода
/ И. С. Немова, Н. И. Потатуркина-Нестерова, Н. А. Ильина // Аграрный научный журн. – 2006. – № 1. – С. 29–30.
-
4. Осипов Г. А. Сравнительное хроматомасс-спектрометрическое исследование состава химических маркеров микроорганизмов в крови и биоптатах слизистой оболочки кишечника / Г. А. Осипов, А. И. Парфенов, П. О. Богомолов // Российский гастроэнтерологический журн. – 2001. – № 1. – С. 54–69.
-
5. Осипов Г. А. Хромато-масс-спектрометрическое обнаружение микроорганизмов в анаэробных инфекционных процессах / Г. А. Осипов, А. М. Демина // Вестн. РАМН. – 1996. – Т. 13, № 2. – С. 52–59.
-
6. Определение микроэкологического статуса организма человека с использованием метода масс-спектрометрии микробных маркеров / Е. Г. Струкова [и др.] // Съезд аналитиков России и школа молодых ученых «Аналитическая химия – новые методы и возможности». – М., 2010. – С. 285–286.
-
7. Результаты выявления афлатоксина В1 у клинических изолятов Aspergillus flavus / А. В. Рыбин [и др.] // Современные наукоемкие технологии. – 2011. – № 1. – С. 47–48.
-
8. Этиологическая структура онихомикозов у больных псориазом / А. В. Рыбин [и др.] // Успехи современного естествознания. – 2011. – № 1. – С. 107–108.
-
9. An experimental model of enteric klebsiellosis / V. M. Bondarenko // Журн. микробиологии, эпидемиологии и иммунобиологии. – 1998. – № 1. – С. 3–6.
-
10. Hopkins M. J. Age and disease related changes in intestinal bacterial populations assessed by cell culture, 16S rRNA abundance, and community cellular fatty acid profiles / M. J. Hopkins, R. Sharp, G. T. Macfarlane // Gut Feb. – 2001. – № 48 (2). – Р. 198–205.
-
11. Potaturkina-Nesterova N. I. The effect of toxins from fungi in the genus aspergillus on the human body / N. I. Potaturkina-Nesterova // Журн. микробиологии, эпидемиологии и иммунобиологии. – 1997. – № 6. – С. 106–108.
THE IDENTIFICATION OF MICROMYCETES ASPERGILLUS FLAVUS AND ITS TOXIC METABOLITES
N.I. Potaturkina-Nesterova, I.S. Nemova, A.S. Nesterov, S.V. Panteleev, O.Y. Shrol, M.N. Artamonova, A.S. Alekseeva
Ulyanovsk State University
Список литературы Выявление микромицетов Aspergillus flavus и их токсических метаболитов
- Выявление афлатоксина В1 у клинических изолятов микромицетов Aspergillus flavus/Н. И. Потатуркина-Нестерова //Современные проблемы науки и образования. -2012. -№ 4. -С. 10.
- Елинов Н. П. Аспергиллезная инфекция; подходы к ее диагностике и лечению/Н. П. Елинов, В. С. Митрофанов, Р. М. Чернопятова//Проблемы медицинской микологии. -2002. -Т. 4, № 1. -С. 24-27.
- Немова И. С. Изменение микрофлоры кожи рабочих в условиях комбикормового завода/И. С. Немова, Н. И. Потатуркина-Нестерова, Н. А. Ильина//Аграрный научный журн. -2006. -№ 1. -С. 29-30.
- Осипов Г. А. Сравнительное хромато-масс-спектрометрическое исследование состава химических маркеров микроорганизмов в крови и биоптатах слизистой оболочки кишечника/Г. А. Осипов, А. И. Парфенов, П. О. Богомолов//Российский гастроэнтерологический журн. -2001. -№ 1. -С. 54-69.
- Осипов Г. А. Хромато-масс-спектрометрическое обнаружение микроорганизмов в анаэробных инфекционных процессах/Г. А. Осипов, А. М. Демина//Вестн. РАМН. -1996. -Т. 13, № 2. -С. 52-59.
- Определение микроэкологического статуса организма человека с использованием метода масс-спектрометрии микробных маркеров/Е. Г. Струкова //Съезд аналитиков России и школа молодых ученых «Аналитическая химия -новые методы и возможности». -М., 2010. -С. 285-286.
- Результаты выявления афлатоксина В1 у клинических изолятов Aspergillus flavus/А. В. Рыбин //Современные наукоемкие технологии. -2011. -№ 1. -С. 47-48.
- Этиологическая структура онихомикозов у больных псориазом/А. В. Рыбин //Успехи современного естествознания. -2011. -№ 1. -С. 107-108.
- An experimental model of enteric klebsiellosis/V. M. Bondarenko//Журн. микробиологии, эпидемиологии и иммунобиологии. -1998. -№ 1. -С. 3-6.
- Hopkins M. J. Age and disease related changes in intestinal bacterial populations assessed by cell culture, 16S rRNA abundance, and community cellular fatty acid profiles/M. J. Hopkins, R. Sharp, G. T. Macfarlane//Gut Feb. -2001. -№ 48 (2). -Р. 198-205.
- Potaturkina-Nesterova N. I. The effect of toxins from fungi in the genus aspergillus on the human body/N. I. Potaturkina-Nesterova//Журн. микробиологии, эпидемиологии и иммунобиологии. -1997. -№ 6. -С. 106-108.


