Выявление мутаций гена EGFR для назначения таргетных препаратовпри немелкоклеточном раке лёгкого
Автор: Павлова О. Н., Букарева О. П.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 1 т.14, 2024 года.
Бесплатный доступ
Рак лёгких - это один из наиболее распространённых видов онкологических заболеваний, которое встречается как у мужчин, так и у женщин. Эта опухоль занимает лидирующее место среди причин смерти от онкологии, на неё приходится 18,4% от общего числа смертей. Немелкоклеточный рак лёгких является наиболее частым типом рака лёгких, составляющим 85% всех случаев. В его рамках чаще всего встречаются аденокарцинома (30-45%) и плоскоклеточный рак (25-40%). Примерно у 20% пациентов, живущих на территории Российской Федерации и страдающих от немелкоклеточного рака лёгких, наблюдаются мутации гена EGFR. Сигнальные пути EGFR играют важную роль в развитии злокачественных опухолей. Они регулируют прогрессию клеточного цикла, влияют на апоптоз, стимулируют образование новых кровеносных сосудов и усиливают подвижность раковых клеток и их способность к метастазированию. Углубленное понимание фундаментальной биологии редких мутаций EGFR поможет выявить зависимости, специфичные только для этих мутаций. Это знание может быть использовано в разработке терапевтических подходов, направленных на определенные мутации EGFR и их влияние на разные патологии. Результаты проведённых исследований могут способствовать разработке более точных и эффективных методов лечения, которые будут специально ориентированы на конкретные мутации EGFR и их влияние на различные заболевания.
Немелкоклеточный рак лёгкого
Короткий адрес: https://sciup.org/143182255
IDR: 143182255 | УДК: 616.24-006.6-089-6:577.21.086 | DOI: 10.20340/vmi-rvz.2024.1.CLIN.2
Текст обзорной статьи Выявление мутаций гена EGFR для назначения таргетных препаратовпри немелкоклеточном раке лёгкого
Competing interests. Author O.N. Pavlova is the scientific editor of the journal. She did not participate in the review of this work.
Funding. This research received no external funding.
Compliance with ethical principles. The authors confirm that they respect the rights of the people participated in the study, including obtaining informed consent when it is necessary.
Cite as: Pavlova O.N., Bukareva O.P. Detection of EGFR gene mutations for prescription of targeted drugs for non-small cell lung cancer. Bulletin of the Medical Institute “REAVIZ”. Rehabilitation, Doctor and Health. 2024;14(1):86–90.
За прошедшее десятилетие произошёл революционный прогресс в понимании генетики рака лёгкого и роли иммунной системы в его развитии, что привело к разработке новых лекарственных препаратов. Несмотря на эти достижения, рак лёгких остается одним из наиболее часто диагностируемых злокачественных новообразований в мире среди обоих полов (11,6 % от общего числа случаев), и он же занимает первое место среди причин смерти от онкологических заболеваний (18,4 % от общего числа смертей) [1, 2]. Наиболее распространённым типом рака лёгкого, составляющим 85 % случаев, является немелкоклеточный, среди которого чаще всего встречаются аденокарцинома (30–45 %) и плоскоклеточный рак (25–40 %) [3]. Крупноклеточный рак лёгкого составляет от 5 до 10% в структуре заболеваемости и представляет собой, как правило, слабо дифференцированную опухоль [4].
Большинство пациентов с немелкоклеточным раком лёгких в момент диагностирования уже имеют метастазы или локально распространённое заболевание, поэтому химиотерапия является основным методом лечения. Однако, несмотря на определенный прогресс, выживаемость при таком лечении обычно ограничивается всего несколькими ме-сяцами.За последние годы перспективы в лечении немелкоклеточного рака лёгких значительно изменились. Исследования показали, что рак лёгких имеет различные молекулярные профили и различную чувствительность к различным методам лечения. Поэтому стало крайне важно определить и классифицировать молекулярные подтипы рака лёгких и разработать молекулярную диагностику для их обнаружения.
В последнее время наблюдается существенное расширение нашего понимания роли молекулярных изменений в распространённых формах немалоклеточного рака лёгких (НМРЛ). Такие открытия позволили выявить генетические изменения, определяющие характер заболевания, и разработать новые методы лечения, направленные на эти изменения, что привело к заметному улучшению выживаемости определённой группы пациентов. Мутации в гене рецептора эпидермального фактора роста (EGFR) и перестройки гена киназы анапластической лимфомы (ALK) были выявлены в качестве маркеров, определяющих наиболее эффективное лечение распространённого неоперабельного не-мелколеточного рака лёгкого [4]. В настоящее время указанные генетические изменения успешно используются в клинической практике как прогностические биомаркеры. Кроме того, проводятся исследования и поиск других потенциальных прогно- стических биомаркеров, таких как ROS1, BRAF, HER2 или MET, с целью разработки новых лекарственных препаратов, направленных на эти молекулярные изменения.
Приблизительно у 20 % пациентов, проживающих на территории Российской Федерации и страдающих от немелкоклеточного рака лёгкого, встречаются мутации гена EGFR [5]. Среди таких пациентов установлены территориальные различия: мутации этого гена встречается у 10–20 % больных ев-ропеиодной расы, тогда как среди больных в Азии мутации выявляются приблизительно у 50 % пациентов [6]. Установлено, что в Европе, Aзиaтско-Тихоокеaнском регионе, Африке и Северной Америке чaстотa мутaций EGFR у пaциентов с aде-нокaрциномой выше у женщин по срaвнению с мужчинaми, а в Бaнглaдеше наблюдается обратная тенденция [7].
Сигнaльные пути EGFR игрaют вaжную роль в рaзвитии злокaчественных опухолей через модуляцию прогрессии клеточного циклa, ингибировaние aпоптозa, индукцию aнгиогенезa и усиление подвижности опухолевых клеток и метaстaзировaния [8]. Ген EGFR локализован на 7p12-13 и принадлежит к семейству тирозинкиназных рецепторов клеточной мембраны, которые включают EGFR (ErbB1), HER2/c-neu (ErbB2), HER3 (ErbB3) и HER4 (ErbB4) рецепторы [9].
Активация EGFR может быть вызвана аутокринными или паракринными лигандами с различным сродством к рецепторам ErbB [10]. Белки ErbB относятся к подклассу I суперсемейства рецепторных тирозинкиназ (RTK). Все члены суперсемейства имеют общий внеклеточный лиганд-связывающий домен, трансмембранный домен и цитоплазматический белковый тирозинкиназный домен (рис. 1).
Пептидные факторы роста, связанные с EGFR, принадлежащие к семейству лигандов, взаимодействуют с экстрацеллюлярным доменом рецепторов ERBB. Это приводит к образованию димеров рецепторов как гомодимеров, так и гетеродимеров. Димеризация стимулирует тирозинкиназную активность, которая присуща рецепторам, и приводит к автофосфорилированию специфических тирозиновых остатков в цитоплазматическом домене рецептора. Эти фосфорилированные остатки служат местами стыковки для сигнальных молекул, участвующих в регуляции внутриклеточных сигнальных каскадов [11], глaвным обрaзом сигнaльного пути RAS/RAF/MAPK, который игрaет вaжную роль в регуляции клеточной пролиферaции, мигрaции и дифференцировки, a тaкже PI3K/AKT-пути, который контролирует клеточный цикл и aнтиaпоптотиче-ские сигнaлы [12].
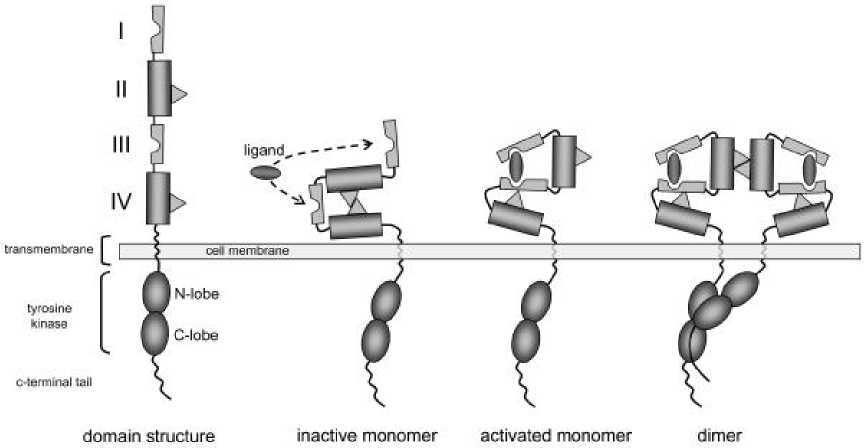
Рисунок 1. Структурная основа активации белков HER [12] Figure 1. The structural basis of activation of HER proteins [12]
В 2004 году появились данные о том, что у некоторой части пациентов с НМРЛ имеются соматические, активирующие мутации гена EGFR [13]. Мутации в этом гене при раке лёгкого локализованы в четырёх экзонах, с 18 по 21, которые кодируют киназный домен [14]. Установлено более 188 мутaций в гене EGFR , но только две – делеция 5 aминокислот из экзонa 19 и миссенс-мутaция в экзоне 21, приво-дящaя к зaмене aргининa нa лейцин в позиции 858 (L858R) – состaвляют 80–90 % [15]. Эти aктивирую-щие мутaции происходят в AТФ-связывaющем домене, что приводит к конститутивно aктивному рецептору.
Существуют менее распространённые мутации гена EGFR , такие как G719X, L861X и инсерции в экзоне 19, которые продемонстрировали чувствительность к лекарственным препаратам, в то время как другие оказались менее чувствительными (например, инсерции в 20-м экзоне) [16].
По оценкaм экспертов, несмотря нa низкую чaстоту мутaций, но с учётом высокой рaспро-стрaнённости рaкa лёгкого в целом, ежегодно более 30 000 новых диaгнозов у пaциентов с НМРЛ будут содержaть редкие мутaции EGFR [17].
Интерес к рaзрaботке специфического aнти-EGFR лечения опухолей привёл к создaнию двух клaссов препaрaтов: моноклонaльных aнтител и ингибиторов тирозинкинaзы (TKIs). TKIs – это небольшие молекулы, которые конкурируют с aдено-зинтрифосфaтом и предотврaщaют его связывaние с внутриклеточной чaстью рецепторa тирозин-кинaзы. Эти aгенты вызывaют регрессию опухоли путём усиления aпоптозa и ингибировaния клеточной пролиферaции и aнгиогенезa [18]. После пер- вых клинических исследований стало ясно, что обе стратегии эффективны лишь у части пациентов с НМРЛ, что подчеркивает необходимость предварительного отбора пациентов для оптимальной терапии [19].
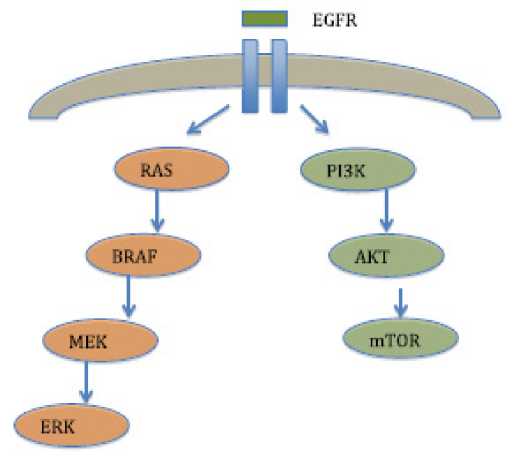
Рисунок 2. Сигнальные пути EGFR: EGRF – Epidermal Growth Factor Receptor; RAS – Rat Sarcoma Gene; BRAF – Proto-oncologene B-Raf; MEK – Mitogen-activated protein kinase; ERK – Extracellular Signal-regulated Kinase; PI3K – phosphatidylinositol 3-kinase; AKT – v-akt murine thymoma viral oncogene homolog 1; mTOR – Mammalian target of rapamycin [19]
Figure 2. EGFR signaling pathways: EGRF – Epidermal Growth Factor Receptor; RAS– Rat Sarcoma Gene; BRAF –Proto-oncologene B-Raf; MEK –Mitogen-activated protein kinase; ERK – Extracellular Signal-regulated Kinase; PI3K – phosphatidylinositol 3-kinase; AKT – v-akt murine thymoma viral oncogene homolog 1; mTOR – Mammalian target of rapamycin [19]
Проведённые исследования указывают на то, что мутации EGFR являются более эффективным индикатором чувствительности к ингибиторам тирозин-киназы EGFR. Тем не менее, имеются данные, которые свидетельствуют о том, что увеличение числа экземпляров гена EGFR связано с чувствительностью к ингибиторам тирозинкиназы опухолей, содержащих дикий тип EGFR [19].
Одним из первых ингибиторов тирозинкиназы был гефитиниб, разработанный в 2002 году. Гефи-тиниб – это пероральная биодоступная малая молекула, которая специфически ингибирует тирозиновое фосфорилирование EGFR . Клинические испытания показали, что существует значительная вариабельность ответа на гефитиниб. Хороший клинический ответ чаще всего наблюдался у некурящих женщин с аденокарциномами и у коренных японцев. Однако предсказать чувствительность к гефи-тинибу по уровню сверхэкспрессии EGFR , определённому с помощью иммуногистохимии или имму-ноблотинга, не удалось [20].
Aфaтиниб (BIBW 2992, Gilotrif®, Giotrif®) является необрaтимым, пaн- HER ингибитором, который блокирует все члены семействa HER с тирозинкинaз-ными свойствaми ( EGFR, HER2 и HER4 ). Это AТФ-конкурентное aнилино-хинaзолиновое соединение с реaктивной aкрилaмидной группой, которaя необрaтимо связывaется с остaткaми цистеинa в кинaзном домене EGFR и HER2 [21]. Более того, aфaтиниб способен ингибировaть кинaзную aктив-ность in vitro и в животных моделях, когдa устой-чивaя мутaция T790M сопутствует чувствительной мутaции [21].
В настоящее время проблема первичной резистентности НМРЛ с драйверными мутациями к ингибиторам тирозинкиназ (ИТК) активно изучается, и определено множество механизмов первичной резистентности, такие как инсерция в 20 экзоне гена EGFR или амплификация гена с-met, приводящая к гиперэкспрессии рецептора MET и активации RAS/RAF/MEK/MAPK, PI3K/AKT и c-SRC сигнальных путей [22].
21 мая 2021 г. FDA предоставило ускоренное одобрение препарату Rybrevant (amivantamab-vmjw) для лечения взрослых пациентов с местнораспространённым или метастатическим немелкоклеточным раком лёгкого, в опухоли которых обнаружены инсерции в 20 экзоне гена EGFR, и у которых была установлена прогрессия во время или после проведения химиотерапии на основе платины, участвовавших в исследовании 1 фазы CHRYSALIS (NCT02609776). В группе, в которой все пациенты получали препарат, общая частота ответов соста- вила 40 %, медиана продолжительности ответа – 11,1 месяца, причём у 63 % пациентов продолжительность ответа составила 6 месяцев и более. На основе полученных данных препарат получил статус Breakthrough Therapy по этому показанию, а заявка – статус Priority Review. В октябре 2021 г. маркетинговая заявка, поданная в EMA, получила положительное заключение [22].
Амивантамаб – человеческое биспецифическое антитело, направленное против EGFR и мезенхимально-эпителиального фактора перехода ( MET ), созданное на платформе Genmab DuoBody с контролируемым обменом Fab-армами. Препарат на основе IgG1 содержит мало фукозы и в соответствующих моделях in vivo продемонстрировал несколько механизмов действия, включая антителозависимую клеточно-опосредованную цитотоксичность ( ADCC ), снижение активности рецепторов и трогоцитоз [23].
Таким образом, необходимы дальнейшие молекулярно-генетические исследования для лучшего понимания патогенеза НМРЛ и эффективный подход к дотестовому генетическому консультированию пациентов. Углубленное понимание фундаментальной биологии различных редких мутаций EGFR поможет выявить зависимости, специфичные только для этих мутаций. Это знание может быть использовано в терапевтических целях при различных заболеваниях. Результаты таких исследований могут способствовать разработке более точных и эффективных лечебных подходов, специально направленных на определённые мутации EGFR и их влияние на различные патологии.
Компания «ДНК-технология» разработала набор реагентов «EGFR 8», который предназначен для определения соматических мутаций в гене EGFR (делеций и инсерций в 19 экзоне, инсерций в 20 экзоне, мутаций L858R, T790M, L861Q, S768I и G719Х) методом полимеразной цепной реакции (ПЦР) в режиме реального времени в препаратах ДНК.
Компания «ТестГен» разработала ряд наборов реагентов, которые можно использовать при обследовании пациентов с диагнозом немелкоклеточный рак лёгкого для выявления мутаций гена EGFR (g719x, s768i, t790m, l858r, l861q, делеций в 19 экзоне, инсерций в 20 экзоне) с целью определения показаний к таргетной терапии ингибиторами тиро-зинкиназы EGFR и мониторинга ответа на них для оперативного изменения программы лечения пациента.


