Выявление широкого спектра мутаций гена BRAF для назначения таргетных препаратов для лечения меланомы
Автор: Тороповский А. Н., Никитин А. Г., Соловьев А. В., Хузина Р. М., Павлова О. Н.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 1 т.13, 2023 года.
Бесплатный доступ
Меланома - агрессивное злокачественное образование кожи и слизистых нейроэпителиальной природы, гетерогенное как по фенотипу, так и по молекулярно-генетическим характеристикам, с высоким риском прогрессирования и неуклонно растущей заболеваемостью примерно на 5 % в год. Развитие меланомы обусловлено как внешними (ультрафиолетовым облучением), так и внутренними факторами, основными среди которых являются мутации в онкогенах и генах-супрессорах опухолей. В 75 % случаев меланомы кожи наблюдается гиперактивация сигнального пути RAS/RAF/MEK/ERK, и одним из его ключевых факторов является серинтреониновая киназа, кодируемая геном BRAF. Онкогенные мутации BRAF имитируют фосфорилирование активационной петли белка, что приводит к нахождению BRAF в постоянно активированном состоянии. Последующая работа MAPK сигнального пути в безостановочном режиме и потеря отрицательной обратной связи BRAF приводят к неконтролируемому росту и пролиферации клеток. Наиболее часто встречающимися мутациями в гене BRAF являются p.V600E (замена валина на глутаминовую кислоту), на чью долю приходится до 95 % случаев всех BRAF-мутантных меланом, и p.V600K (замена валина на лизин), которая может составлять до 20 % случаев и более. Разработка неселективных и селективных ингибиторов мутантного белка BRAF делают мутацию в данном гене предиктивным маркером ответа и эффективности применяемой таргетной терапии.
Меланома, braf, таргетные препараты
Короткий адрес: https://sciup.org/143179932
IDR: 143179932 | УДК: 616-006.81:085.277.3 | DOI: 10.20340/vmi-rvz.2023.1.CLIN.4
Текст научной статьи Выявление широкого спектра мутаций гена BRAF для назначения таргетных препаратов для лечения меланомы
Cite as: Toropovskii A.N., Nikitin A.G., Solovyev A.V., Khuzina R.M., Pavlova O.N. Identifying a wide range of mutations in the BRAF gene for prescribing targeted drugs for melanoma treatment. Bulletin of the Medical Institute “REAVIZ”. Rehabilitation, Doctor and Health. 2023;13(1):71–76. CLIN.4

Меланома – агрессивное злокачественное образование кожи и слизистых нейроэпителиальной природы, гетерогенное как по фенотипу, так и по молекулярно-генетическим характеристикам, с высоким риском прогрессирования и неуклонно растущей заболеваемостью примерно на 5 % в год [1, 2]. Однако, одновременно с этим наблюдается существенное увеличение общей пятилетней выживаемости пациентов с меланомой, что обусловлено развитием способов диагностики и, соответственно, выявлением заболевания на ранних стадиях [3].
На территории Российской Федерации, по данным за 2018 год, ведущей локализацией меланомы у обоих полов является кожа [4]. По данным Всемирной Организации Здравоохранения в структуре злокачественных новообразований кожи меланома занимает не более 10 %, будучи ответственной за 80 % летальных исходов среди пациентов этой группы [2], причем смертность от меланомы растёт гораздо быстрее, чем от других злокачественных образований [5].
Большому успеху в области лечения метастатической меланомы мы обязаны разработанным за последние десятилетия таргетным препаратам, первый из которых – ипилимумаб – был разработан более 10 лет назад [6]. За прошедшие десять лет список препаратов, применяемых для лечения меланомы, как запущенных стадий, так и применяемых у пациентов с высоким риском прогрессирования после хирургического лечения, был существенно расширен, что обуславливает необходимость практикующего онколога ориентироваться в принципах их назначения.
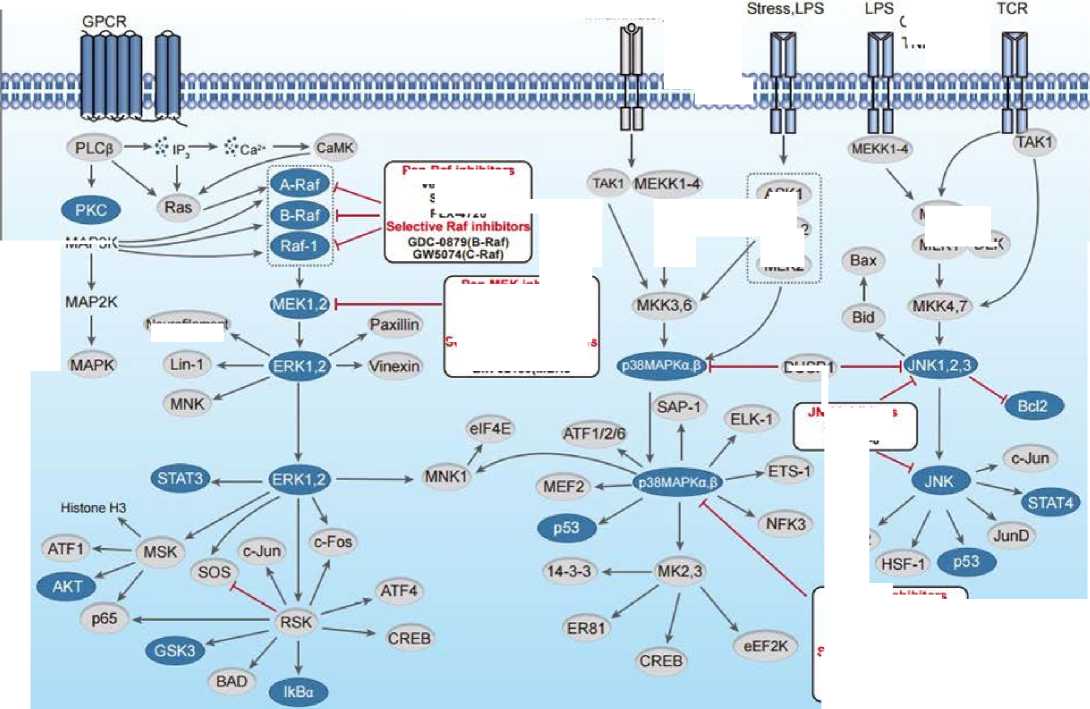
Развитие меланомы обусловлено как внешними (ультрафиолетовым облучением), так и внутренними факторами, основными среди которых являются мутации в онкогенах и генах-супрессорах опухолей. В 75 % случаев меланомы кожи наблюдается гиперактивация сигнального пути RAS/RAF/MEK/ERK (рис. 1). Одним из его ключевых факторов является серин-треониновая киназа, кодируемая геном BRAF. Мутации в гене BRAF становятся основополагающими в 40–80 % случаев меланомы кожи. На сегодняшний день известно около 40 соматических мутаций в гене BRAF [7]. В 80 % случаев выявляется нуклеотидная замена T1799A в 15-м экзоне BRAF, приводя- щая к замене валина на глутаминовую кислоту в 600-м кодоне (V600E) [8]. В 20 % случаев мутации кодона-600 представлены заменой V600K, редко встречаются замены V600R/D/M. Частота мутации V600К может достигать 5–10 %, а мутации V600D и V600R встречаются значительно реже [9].
Учитывая важность этого гиперактивированного пути в развитии меланомы, было разработано несколько ингибиторов MAPK для целенаправленного лечения опухолей с мутацией V600 BRAF , включая ингибиторы BRAF ( BRAFi ; вемурафениб, дабрафениб и энкорафениб) и ингибиторы MEK ( MEKi ; кобиметиниб, траметиниб и биниметиниб). Было показано, что применение BRAFi и MEKi в качестве отдельных агентов или в комбинации улучшает выживаемость при меланоме и немелкоклеточном раке легкого (НМРЛК).
Данные крупномасштабного секвенирования выявили множество дополнительных «горячих точек» мутаций BRAF , существующих за пределами кодона V600 . Онкогенные мутации BRAF имитируют фосфорилирование активационной петли белка, что приводит к нахождению BRAF в постоянно активированном состоянии. Последующая работа MAPK сигнального пути в безостановочном режиме и потеря отрицательной обратной связи BRAF приводят к неконтролируемому росту и пролиферации клеток. Также для мутаций BRAF было установлено влияние на способность к тканевой инвазии. В связи с этим появление мутации BRAF рассматривается не только как событие, инициирующее неопластическую трансформацию, но и как способствующий дальнейшему прогрессированию механизм биологической адаптации опухолевой клетки.
Недавно была предложена новая система классификации мутаций BRAF . Мутации V600 относятся к классу I мутаций BRAF и представляют собой RAS -независимые мономеры. Мутации класса II также являются BRAF -активирующими, но RAS -независимыми димерами. Существует различие между мутациями класса II BRAF на основе их местоположения; мутации класса IIa происходят в активационном сегменте (т.е. L597, K601), а мутации класса IIb – в p-петле, богатой глицином (т.е. G464, G469). Класс III состоит из мутаций BRAF с «низкой активностью» или подавляющих киназную активность [10].
Cytokines UV Inflammatory
CDC40
TNFaRll
MAP3K
DUSP1
ATF2
Pan-p38 inhibitors SB 203580 SB 202190
VX-745 Selective p38 inhibitors BIRB 796{p38a) LY2 228820(p38a)
VX-702(p38o) .
Рисунок 1. Путь МАРК. Источник:
Figure 1. МАРК pathway. Source:
Pan-Raf inhibitors Vomurafenib Sorafenib PLX-4720
NeuroMament
Рап-MEK inhibitors PD0325901 GSK1120212 U0126-EtOH Selective MEK inhibitors
AZD6244(MEK1) BIX 02189(MEK5
TOOTWOTti
ww
ASK1
TAO1.2
MLK3
MLK1 DLK
MLK2
IK inhibitors SP600125 JNK-IN-8
BRAF -мутантная меланома ассоциируется с более молодым возрастом пациентов, отсутствием связи с ультрафиолетовым облучением, локализацией на туловище и высоким числом невусов на теле [11].
Высокая частота мутаций при меланоме может быть связана с особенностями биологии меланоцитов. Наличие данных драйверных мутаций в этих клетках определяет потенциальную чувствительность опухолей к таргетной терапии. А-мелано-цитстимулирующий гормон и другие родственные проопиомеланокортин-производные пептиды являются важнейшими регуляторами биологии меланоцитов, которые связываются с рецептором мелано-кортина I, повышая уровень циклического АМФ, что приводит к увеличению пролиферации и меланогенеза в ответ на УФ-излучение. Этот цАМФ-зависимый сигнальный каскад активирует BRAF и впоследствии ERK9. Это основной специфический для меланоцитов сигнальный путь, контролирующий пролиферацию и дифференцировку [12].
Наиболее часто встречающимися мутациями в гене BRAF являются p.V600E (замена валина на глутаминовую кислоту), на чью долю приходится до 95 % случаев всех BRAF-мутантных меланом, и p.V600K (замена валина на лизин), которая может составлять до 20 % случаев и более. Согласно исследованию, проведенному в Институте меланомы (Австралия) A. Menzies, M. S. Carlino и соавт. в 2012 г., мутантные V600E меланомы имели более высокую долю локализации на конечностях, а мутантные меланомы V600K более часто встречались на коже головы и шеи. Также было установлено, что распространённость мутации BRAF обратно пропорциональна возрасту: так, молодые пациенты с метастатической меланомой имели более высокую распространённость мутации BRAF с преобладанием V600E генотипа, тогда как у пациентов пожилого возраста отмечалась меньшая распространенность мутации BRAF с большей долей генотипов, отличных от V600E (преимущественно V600K). Кроме того, ряд исследований показывает наличие связи между V600K генотипом и наличием хронического солнечного повреждения: возможно, что этиология меланомы V600K отличается от меланомы V600E, и, в отличие от последней, хроническое солнечное повреждение может играть важную роль в её патогенезе [13].
Разработка неселективных и селективных ингибиторов мутантного белка BRAF делают мутацию в данном гене предиктивным маркером ответа и эффективности применяемой таргетной терапии.
Однако практически у всех пациентов, получающих лечение ингибиторами B-RAF , развивается лекарственная устойчивость, приводящая к клиническим рецидивам. Выявленные до сих пор гетерогенные механизмы приобретенной устойчивости к BRAFi относятся к общим MAPK- редуцирующим, AKT -зависимым (Serine/threonine protein kinase) или MAPK -реактивирующим путям. Вопреки ожиданиям, вторичные мутации V600E B-RAF не были обнаружены для объяснения приобретенной устойчивости к B-RAFi , что позволяет предположить, что механизмы обхода V600E BRAF являются основным способом реактивации пути ERK (extracellular signal-regulated kinase) [14].
Однако комбинация кобиметиниба с вемура-фенибом улучшает выживаемость без прогрессирования по сравнению с плацебо и вемурафени-бом у ранее не леченных пациентов с BRAF ( V600 )-мутантной распространённой меланомой. Исследование, проведенное Hoffmann-La Roche, показало, что у взрослых пациентов с гистологически подтверждённой BRAF ( V600 ) мутацией неоперабельной меланомой IIIC или IV стадии одновременное применение ингибиторов BRAF и инигиби-торов МЕК увеличивает безрецидивную выживаемость до 12–3 месяцев для комбинации кобиме-тиниб и вемурафениб по сравнению с 7–2 месяцами для плацебо и вемурафениба. Это же исследование показывает увеличение до 22–3 месяцев для группы пациентов, получавшей кобиметиниб и вемурафениб, против 17–4 месяцев для плацебо и вемурафениба [15].
У 5–10 % пациентов с BRAF -мутацией обнаруживаются варианты, отличные от p. V600E/K . Несмотря на то, что большинство из них сопровождаются активацией MAPK , их прогностическая и предиктивная роли в настоящее время до конца не выяснены (табл. 1) [14–16]. Редкие мутации, затрагивающие кодоны 600 или 601 гена BRAF , а также мутация p. L597R потенциально чувствительны к комбинации BRAFi + MEKi или к монотерапии MEK -ингибиторами [16].
Таблица 1. Список мутаций 600 кодона гена BRAF , определяемый с помощью набора BRAF Ryro Kit (Qiagen, Германия)
Table 1. List of 600 codon BRAF mutations determined using the BRAF Ryro Kit (Qiagen, Germany)
|
Мутация |
Замена нуклеотидов |
Замена валина |
COSMIC ID |
|
V600E |
1799T > A |
Глутаминовая кислота |
476 |
|
V600K |
1798_1799 GT > AA |
Лизин |
473 |
|
V600M |
1798G > A |
Метионин |
1130 |
|
V600D |
1799_1800 TG > AT |
Аспарагиновая кислота |
477 |
|
V600R |
1798_1799 GT > AG |
Аргинин |
474 |
|
V600E complex |
1799_1800 TG > AA |
Глутаминовая кислота |
475 |
|
V600А |
1799T > С |
Аланин |
18443 |
|
V600G |
1799T > G |
Глицин |
6137 |
Обращает на себя внимание тот факт, что примерно 5 % пациентов имеют редкие мутации в 600 кодоне, и это важно учитывать при выборе тест-системы, с помощью которой тестируются образцы, поскольку во многих коммерческих наборах возможна детекция лишь двух наиболее частых мутаций. Тем не менее эти мутации патогенетические и также отвечают на терапию ингибиторами киназ. Таким образом, очевидна потребность клинического внедрения и расширения возможностей технологии молекулярно-генетического тестирования для эф- фективного принятия решений о назначении молекулярно-направленной терапии онкологических больных. При этом необходима оптимизация подходов на основе учёта популяционной специфики, объективных условий, связанных с наличием внут-риопухолевой гетерогенности, а также организационно-технических возможностей. Всё это внесет значимый вклад в совершенствование молекулярногенетической диагностики в онкологии.
Список литературы Выявление широкого спектра мутаций гена BRAF для назначения таргетных препаратов для лечения меланомы
- Erdmann F, Lortet-Tieulent J, Schuz J, et al. International trends in the incidence of malignant melanoma 1953-2008-are recent generations at higher or lower risk? Int J Cancer. 2013;132:385-400. https://doi.org/10.1002/ijc.2761
- Bertolotto C. Melanoma: from melanocyte to genetic alterations and clinical options. Scientifica. 2013:635203.
- Thomas L., Tranchand P., Berard F. et al. Semiological value of ABCDEcriteria in the diagnosis of cutaneous pigmented tumors. Dermatology (Basel). 1998; 197: 11-17. https://doi.org/10.1159/000017969
- Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2019 г. (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена филиал ФГБУ «НМИЦ радиологии» Минздрава России. 2020:252. [Kaprin A.D., Starinsky V.V., Petrova G.V. Malignant neoplasms in Russia in 2019 (morbidity and mortality). Moscow: Herzen Scientific Research Institute of Radiology, branch of NMRC of Radiology, Ministry of Health of Russia. 2020:252. (In Russ)]
- Lens M.B., Dawes M. Global perspectives of contemporary epidemiological trends of cutaneous malignant melanoma. Br J Dermatol. 2004;150:179-185
- Hodi F.S., O'Day S.J., McDermott D.F., Weber R.W., Sosman J.A., Haanen J.B. et al. Improved Survival with Ipilimumab in Patients with Metastatic Melanoma. N Engl J Med. 2010;363(8):711-723. https://doi.org/10.1056/ NEJMoa1003466
- Davies MA, Samuels Y. Analysis of the genome to personalize therapy for melanoma. Oncogene. 2010;29(41):5545-5555.
- Davies H., Bignell G. R., Cox C. et al. Mutations of the BRAF gene in human cancer. Nature. 2002;417(6892):949-954.
- Кит О.И., Водолажский Д.И., Златник Е.Ю., Ефимова И.Ю., Кочуев С.С., Пржедецкий Ю.В. Ассоциация мутационного статуса гена BRAF и клинико-морфологических особенностей меланомы кожи. Кубанский научный медицинский вестник. 2016;3. [Kit O.I., Vodolazhsky D.I., Zlatnik E.Yu., Efimova I.Yu., Kochuev S.S., Przhedetsky Y.V. Association of mutation status of BRAF gene and clinical and morphological features of skin melanoma. Kuban Scientific Medical Bulletin. 2016;3. (In Russ)]. URL: https://cyberleninka.ru/article/n/assotsiatsiya-mutatsionnogo-statusa-gena-braf-i-kliniko-morfologicheskih-osobennostey-melanomy-kozhi
- Dankner M., Lajoie M., Moldoveanu D., Nguyen T.T., Savage P., Rajkumar S. et al. Dual MAPK Inhibition Is an Effective Therapeutic Strategy for a Subset of Class II BRAF Mutant Melanomas. Clin Cancer Res. 2018;24(24):6483-6494. https://doi.org/10.1158/1078-0432.CCR-17-3384
- Menzies A.M., Haydu L.E., Visintin L., Carlino M.S., Howle J.R., Thompson J.F. et al. Distinguishing Clinicopathologic Features of Patients with V600E and V600K BRAF-Mutant Metastatic Melanoma. Clin Cancer Res. 2012;18(12):3242-3249. https://doi.org/10.1158/1078-0432.CCR-12-0052
- Davies H., Bignell G.R., Cox C., Stephens P., Edkins S., Clegg S. et al. Mutations of the BRAF Gene in Human Cancer. Nature. 2002;417(6892):949-954. https://doi.org/10.1038/nature00766
- Menzies A.M., Haydu L.E., Visintin L., Carlino M.S., Howle J.R., Thompson J.F. et al. Distinguishing Clinicopathologic Features of Patients with V600E and V600K BRAF-Mutant Metastatic Melanoma. Clin Cancer Res. 2012;18(12):3242-3249. https://doi.org/10.1158/1078-0432.CCR-12-0052
- Shi, H., Moriceau, G., Kong, X., Lee, M., Lee, H., Koya, R., Ng, C., Chodon, T., Scolyer, R.A., Dahlman, K.B., Sosman, J.A., Kef-ford, R.F., Long, G.V., Nelson, S.F., Ribas, A., & Lo, R.S. Melanoma whole exome sequencing identifies V600EB-RAF amplification-mediated acquired B-RAF inhibitor resistance. Nature communications. 2012;3:724-724.
- Ascierto P.A., McArthur G.A., Dreno B., Atkinson V., Liszkay G., Di Giacomo A.M. et al. Cobimetinib Combined with Vemurafenib in Advanced BRAF(V600)-Mutant Melanoma (coBRIM): Updated Efficacy Results from a Randomised, Double-Blind, Phase 3 Trial. Lancet Oncol. 2016;17(9):1248-1260. https://doi.org/10.1016/S1470-2045 (16)30122-X
- Зарецкий А.Р., Демидов Л.В., Самойленко И.В. Биомаркеры при метастатической меланоме кожи: можем ли мы точнее выбирать тактику лечения наших пациентов? Медицинский совет. 2021;9:48-63. https://doi.org/10.21518/2079-701X-2021-9-48-63 [Zaretsky A.R., Demidov L.V., Samoilenko I.V. Biomarkers in metastatic skin melanoma: can we choose treatment tactics more accurately for our patients? Medical Advice. 2021;9:48-63. https://doi.org/10.21518/2079-701X-2021-9-48-63 (In Russ)]


