Выявление значимых для экспорта зерна возбудителей бактериозов и комплекса сопутствующих микроорганизмов в посевах зерновых культур (на примере Тимирязевской полевой опытной станции)
Автор: Словарева О.Ю., Мувинги М., Яремко А.Б., Игонин В.Н., Рубец В.С.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Микробиология растений
Статья в выпуске: 1 т.58, 2023 года.
Бесплатный доступ
Согласно данным официальной статистики, в России ежегодно производится около 130 млн т продукции зерновых колосовых культур. В Едином Перечне карантинных объектов Евразийского экономического союза находится возбудитель желтого слизистого бактериоза пшеницы Rathayibacter tritici . Указанный вид подлежит выявлению при импорте и, при наличии требований импортера, при экспорте пшеницы. В связи с необходимостью регулирования в карантинных фитосанитарных лабораториях для Rathayibacter tritici имеется диагностическая методика. Для других возбудителей бактериозов зерновых культур, таких как Rathayibacter rathayi , Pseudomonas fuscovaginae , Pseudomonas cichorii, Pseudomonas fluorescens , Pseudomonas syringae, Acidovorax avenae, Erwinia rhapontici , Xanthomonas translucens , Clavibacter tessellarius и других, диагностические методики отсутствуют, поэтому обнаружения в практике работы диагностических фитосанитарных лабораторий не зафиксированы. Перечисленные виды регулируются странами-импортерами, закупающими в России более половины всей предназначенной для экспорта зерновой продукции. Бактериозы представляют серьезную угрозу производству зерна, а причиняемый ими возможный ущерб урожаю оценивается в 10-40 %. Бактерии могут вызывать вспышки заболеваний или находиться в растениях в скрытой форме в зависимости от условий окружающей среды и почти никогда не вызывают симптомов на зерне. В связи с этим обнаружить возбудителей бактериозов можно только в лаборатории, используя метод посева на питательные среды, проведение которого зачастую занимает неделю и более. Достоверная идентификация каждого вида бактерий, колонии которых получены в результате посева, возможна только с использованием молекулярных методов. Требуется разработка ПЦР-тестов, позволяющих проводить идентификацию целевых бактерий напрямую в образцах, не применяя культуральный метод, что существенно упростит и ускорит процедуру подтверждения соответствия состояния партий российского зерна требованиям импортеров. Разработка молекулярных методов диагностики возбудителей бактериозов зерновых культур возможна только после изучения их видового состава в растениях и зерне, при этом в вегетирующих растениях разнообразие живых бактерий существенно выше, чем в зерне. Информация о видовом составе бактерий на зерновых культурах позволит с применением геномного анализа обнаружить видоспецифичные ПЦР-мишени и разработать диагностические ПЦР-тесты для быстрой идентификации особо опасных и значимых для экспорта зерна видов бактерий. Ранее масштабного изучения бактериального состава в зерновых культурах не проводили, в связи с чем список бактерий, которые могут находиться вместе в одном образце, отсутствует. Отсутствует и полный перечень всех бактерий, которые можно встретить в зерновых культурах. В то же время для биоинформатического предсказания видоспецифичной ПЦР-мишени необходимо знать все виды, которые можно встретить в анализируемом образце, от которых следует отличать целевой вид. Состав бактериальной микробиоты может различаться в зависимости от культуры и сорта, поэтому максимальное разнообразие различных культур и сортов позволит получить более полную информацию. Влажные и умеренно теплые условия летнего периода в Центральном регионе России идеально подходят для развития бактериозов, поэтому сбор образцов мы проводили на территории Тимирязевской полевой опытной станции (г. Москва), где ежегодно ведутся работы по гибридизации, селекции и сортоиспытанию нескольких сотен сортов зерновых культур. Работа посвящена выявлению и идентификации бактерий в образцах зерновых культур Тимирязевской полевой опытной станции (г. Москва). Объектами исследования были бактериальные изоляты, выделенные из образцов зерновых культур в 2020 году. Идентификацию бактерий проводили посредством секвенирования ампликонов, полученных в результате ПЦР с парами праймеров PSF/PSR, SyD1/SyD2 и 8UA/519B и сравнения полученных последовательностей с помощью сервиса BLAST с последовательностями, размещенными в GenBank (https://blast.ncbi.nlm.nih.gov). В результате собраны 55 образцов зерновых культур, выделен и идентифицирован 171 бактериальный изолят, в том числе до вида идентифицированы 34 изолята. Бактериальное разнообразие представлено 14 видами. Среди них - фитопатогены Pantoea ananatis , Clavibacter michiganensis , Rhodococcus fascians , Pseudomonas trivialis , Pseudomonas viridiflava и Pseudomonas syringae . Наибольшая частота встречаемости - 70,9 % отмечена у видов, относящихся к роду Pseudomonas . Также высокой частотой встречаемости характеризуются представители родов Frigoribacterium (36,4 %), Clavibacter (16,4 %), Arthrobacter (12,7 %) и Rhodococcus (10,9 %). Результаты проведенного исследования могут быть использованы при разработке быстрых и достоверных способов диагностики особо опасных и значимых для экспорта зерна видов бактерий.
Диагностика фитопатогенов, бактериозы зерновых культур, пцр, секвенирование
Короткий адрес: https://sciup.org/142238098
IDR: 142238098 | УДК: 633.1:632.3.01/.08:632.913.1:579.64 | DOI: 10.15389/agrobiology.2023.1.184rus
Текст научной статьи Выявление значимых для экспорта зерна возбудителей бактериозов и комплекса сопутствующих микроорганизмов в посевах зерновых культур (на примере Тимирязевской полевой опытной станции)
Согласно данным официальной статистики, в России ежегодно производится около 130 млн т продукции зерновых колосовых культур. В Едином Перечне карантинных объектов Евразийского экономического союза находится возбудитель желтого слизистого бактериоза пшеницы Rathayibacter tritici. Указанный вид подлежит выявлению при импорте и, при наличии требований импортера, при экспорте пшеницы. В связи с необходимостью регулирования в карантинных фитосанитарных лабораториях для Rathayibacter tritici имеется диагностическая методика. Для других возбудителей бактериозов зерновых культур, таких как Rathayibacter rathayi, Pseudomonas fus-covaginae, Pseudomonas cichorii, Pseudomonas fluorescens, Pseudomonas syringae, Acidovorax avenae, Erwinia rhapontici, Xanthomonas translucens, Clavibacter tessellarius и других, диагностические методики отсутствуют, поэтому обнаружения в практике работы диагностических фитосанитарных лабораторий не зафиксированы. Перечисленные виды регулируются странами-импортерами, закупающими в России более половины всей предназначенной для экспорта зерновой продукции. Бактериозы представляют серьезную угрозу производству зерна, а причиняемый ими возможный ущерб урожаю оценивается в 10-40 %. Бактерии могут вызывать вспышки заболеваний или находиться в растениях в скрытой форме в зависимости от условий окружающей среды и почти никогда не вызывают симптомов на зерне. В связи с этим обнаружить возбудителей бактериозов можно только в лаборатории, используя метод посева на питательные среды, проведение которого зачастую занимает неделю и более. Достоверная идентификация каждого вида бактерий, колонии которых получены в результате посева, возможна только с использованием молекулярных методов. Требуется разработка ПЦР-тестов, позволяющих проводить идентификацию целевых бактерий напрямую в образцах, не применяя культуральный метод, что существенно упростит и ускорит процедуру подтверждения соответствия состояния партий российского зерна требованиям импортеров. Разработка молекулярных методов диагностики возбудителей бактериозов зерновых культур возможна только после изучения их видового состава в растениях и зерне, при этом в вегетирующих растениях разнообразие живых бактерий существенно выше, чем в зерне. Информация о видовом составе бактерий на зерновых культурах позволит с применением геномного анализа обнаружить видоспецифичные ПЦР-мишени и разработать диагностические ПЦР-тесты для быстрой идентификации особо опасных и значимых для экспорта зерна видов бактерий. Ранее масштабного изучения бактериального состава в зерновых культурах не проводили, в связи с чем список бактерий, которые могут находиться вместе в одном образце, отсутствует. Отсутствует и полный перечень всех бактерий, которые можно встретить в зерновых культурах. В то же время для биоинформатического предсказания видоспецифичной ПЦР-мишени необходимо знать все виды, которые можно встретить в анализируемом образце, от которых следует отличать целевой вид. Состав бактериальной микробиоты может различаться в зависимости от культуры и сорта, поэтому максимальное разнообразие различных культур и сортов позволит получить более полную информацию. Влажные и умеренно теплые условия летнего периода в Центральном регионе России идеально подходят для развития бактериозов, поэтому сбор образцов мы проводили на территории Тимирязевской полевой опытной станции (г. Москва), где ежегодно ведутся работы по гибридизации, селекции и сортоиспытанию нескольких сотен сортов зерновых культур. Работа посвящена выявлению и идентификации бактерий в образцах зерновых культур Тимирязевской полевой опытной станции (г. Москва). Объектами исследования были бактериальные изоляты, выделенные из образцов зерновых культур в 2020 году. Идентификацию бактерий проводили посредством секвенирования ампликонов, полученных в результате ПЦР с парами праймеров PSF/PSR, SyD1/SyD2 и 8UA/519B и сравнения полученных последовательностей с помощью сервиса BLAST с последовательностями, размещенными в GenBank . В результате собраны 55 образцов зерновых культур, выделен и идентифицирован 171 бактериальный изолят, в том числе до вида идентифицированы 34 изолята. Бактериальное разнообразие представлено 14 видами. Среди них — фитопатогены Pantoea ananatis, Clavibacter michiganensis, Rhodococcus fascians, Pseudomonas trivialis, Pseudomonas viridiflava и Pseudomonas syringae. Наибольшая частота встречаемости — 70,9 % отмечена у видов, относящихся к роду Pseudomonas. Также высокой частотой встречаемости характеризуются представители родов Frigoribacterium (36,4 %), Clavibacter (16,4 %), Arthrobacter (12,7 %) и Rhodococcus (10,9 %). Результаты проведенного исследования могут быть использованы при разработке быстрых и достоверных способов диагностики особо опасных и значимых для экспорта зерна видов бактерий. Кроме того, в процессе исследования выделены бактерии, принадлежащие определенным родам, но не относящиеся ни к одному из известных видов, что делает их перспективными для дальнейшего изучения и возможности описания новых видов — представителей микробиоты зерновых культур.
По информации, представленной Федеральной службой государственной статистики , озимые и яровые зерновые культуры — пшеница, рожь, ячмень, тритикале, а также овес ежегодно выращиваются в России на площади более чем 41 млн га, а валовый сбор продукции составляет около 130 млн т. При этом, по данным Таможенной статистики внешней торговли РФ , Российская Федерация по кодам ТН ВЭД 1001-1004 и 1008600000 ежегодно экспортирует более 39,5 млн т зерна (анализ за период с 2019 по 2021 год).
Болезни растений, вызываемые бактериальными патогенами, существенно ограничивают производство сельскохозяйственных культур и приводят к значительным ежегодным потерям в глобальном масштабе (1-3). Бактериозы зерновых представляют серьезную экономическую угрозу, так как, по разным оценкам, могут снижать урожайность на 10-40 % в зависимости от условий окружающей среды и того, в какую фазу онтогенеза растений произошло заражение (4, 5). Проблема требует системного контроля за распространением бактериальных инфекций (1, 6). В соответствии с Решением Совета Евразийской экономической комиссии от 30 ноября 2016 года ¹ 157 (в ред. решений Совета Евразийской экономической комиссии от 29.03.2019 ¹ 31, от 08.08.2019 ¹ 74, от 18.05.2021 ¹ 54, от 05.10.2021 ¹ 98, от 15.07.2022 ¹ 109), только один бактериальный фитопатоген — возбудитель желтого слизистого бактериоза пшеницы Rathayibacter tritici, регулируется на зерновых культурах, а именно на подкарантинной продукции под кодами ТН ВЭД 1001 и 1008600000 . Указанный вид подлежит выявлению при импорте и, при наличии требований импортера, при экспорте пшеницы. В связи с необходимостью регулирования, в Российской Федерации в карантинных фитосанитарных лабораториях разработана и применяется диагностическая методика для Rathayibac-ter tritici. Для выявления других опасных фитопатогенных бактерий — возбудителей бактериозов зерновых культур Rathayibacter rathayi, Pseudomonas fuscovaginae, Pseudomonas cichorii, Pseudomonas fluorescens, Pseudomonas syrin-gae, Acidovorax avenae, Erwinia rhapontici, Xanthomonas translucens и Clavibacter tessellarius такие методики в карантинных фитосанитарных лабораториях отсутствуют. При этом, по данным Федеральной службы по ветеринарному и фитосанитарному надзору и Европейской и Средиземноморской организации по защите растений , перечисленные виды регулируется в зерновой продукции фитосанитарными требованиями ряда стран, в том числе стран — импортеров российского зерна. Один или несколько из этих видов бактерий регулируются в Египте, Иордании, Турции, Марокко, Тунисе, Нигерии, Пакистане, Камеруне, Тайвани, Сербии, Южной Африке, Бразилии, Израиле, Колумбии и Мексике — в странах, которые, по данным Таможенной статистики внешней торговли РФ, закупают в России более половины всей предназначенной для экспорта зерновой продукции.
Колонизируя сосудистую ткань растений (7), бактерии не поддаются контролю в полевых условиях. Зачастую зараженные растения формируют зерно, которое представляет собой источник инфекции (3, 4, 8). Фитопато-генные бактерии способны длительное время сохраняться в растениях и семенах без проявления симптомов (9, 10). Среди возбудителей бактериозов зерновых культур характерные симптомы на семенах в виде розового пигмента может вызывать Erwinia rhapontici (11, 12). Для большинства бактериозов зерновых культур характерными симптомами являются различные полосы, штриховатости и перетяжки на листьях, ожоги, пожелтения, водянистые пятна или некрозы в зависимости от стадии заболевания. При этом отмечается, что колосья, включая семена и колосковые чешуи, обычно бессимптомны, но при этом могут сохранять инфекцию и быть ее источником (13). Наиболее эффективным способом предотвращения распространения заболеваний, передаваемых семенами, является ранняя лабораторная диагностика (14). При этом как для исследовательских целей (например, изучения механизмов взаимодействия в системе растение—фитопатоген, формирования устойчивости, экологии системы) (15, 16), так и для сельскохозяйственной практики (селекция сортов на устойчивость к болезням, создание свободных от инфекции культур клеток и тканей методами биотехнологии, фитосанитарный мониторинг, контроль карантинных объектов при экспорте и импорте сельскохозяйственной продукции) (16-18) необходимы надежные, унифицированные и высокочувствительные методы видовой идентификации возбудителей, позволяющие дифференцировать эти виды на фоне разнообразия микробиоты растения.
Наиболее быстрый и надежный подход при диагностике патогенов растений — использование видоспецифичных ПЦР-тестов (19). Для прогнозирования ПЦР-мишени с помощью биоинформатических методов и валидации полученных праймеров необходимы сведения о видовом составе микробиоты объекта. При этом важно располагать максимально полными коллекциями как целевых бактериальных изолятов, так и возможной сопутствующей микробиоты, от которой предлагаемый тест должен дифференцировать целевой регулируемый вид. Однако системный и широкомасштабный скрининг посевов зерновых культур на наличие значимых для экспорта бактериальных фитопатогенов в Российской Федерации до настоящего времени не проводился.
Климатические условия г. Москвы характеризуются высокой влажностью (20) и могут способствовать размножению бактерий внутри и на поверхности растения, что повышает вероятность их обнаружения. В настоящей работе из образцов зерновых культур с участков сортоиспытания и гибридизационных делянок на московской полевой опытной станции Российского государственного аграрного университета — МСХА им. К.А Тимирязева, наряду с бактериями, проявляющими хозяйственно полезные и нейтральные свойства, впервые идентифицированы фитопатогены Pantoea ananatis , Clavibacter michiganensis , Rhodococcus fascians , Pseudomonas trivialis , Pseudomonas viridiflava и Pseudomonas syringae .
Целью нашей работы был сбор и идентификация бактериальных изо-лятов в образцах, собранных на Тимирязевской полевой опытной станции, для формирования коллекции патогенной и непатогенной микробиоты зерновых культур.
Методика . Для исследования (2020-2021 годы) отбирали образцы растений пшеницы, тритикале и ржи 13 мая 2020 года с участков сортоиспытания и гибридизационных делянок полевой опытной станции Российского государственного аграрного университета — МСХА им. К.А Тимирязева. Образец озимых культур представлял собой 5-15 стеблей растений, срезанных у первого междоузлия, образец яровых культур состоял из 15 проростков. От одного сорта отбирали один образец. При наличии симптомов отбирали как растения с симптомами, так и здоровый вегетативный материал.
Из каждого образца готовили аналитическую пробу в соответствии с ранее описанной методикой (21) следующим способом. К 5-10 г измельченных с помощью простерилизованных ножниц растительных тканей образца добавляли 20 мл фосфатно-солевого буфера (на 1 л дистиллированной воды 2,9 г Na 2 HPO 4 •12Н 2 О, 0,2 г KH 2 PO 4 •2H 2 O, 8 г NaCl и 0,2 г KCl; pH 7,0-7,2), оставляли на шейкере на 1 ч при режиме 200 rpm, затем жидкую часть пробы пропускали через фильтры с размером пор 3-5 мкм и центрифугировали 10 мин при режиме 4 ° С, 10000 g. Надосадочную жидкость удаляли, а осадок суспендировали в 1 мл фосфатно-солевого буфера. Подготовку проб проводили в течение 1 нед после сбора образцов. До подготовки проб образцы хранили при 4 ° С в темноте.
Бактериальные изоляты выделяли на среде CRL (21), высевая на три чашки Петри методом Дригальского по 20 мкл аналитических проб. Через 5-7 сут с помощью стерильной бактериологической петли проводили пересев отдельных колоний на среду CRL. Отбирали все разнообразие морфоти-пов колоний, выросших на чашках. Небольшие фрагменты отдельных колоний полученных таким образом чистых культур отбирали с помощью стерильной бактериологической петли и суспендировали в 200 мкл дистиллированной воды. Суспензии использовали для выделения ДНК.
ДНК бактериальных культур получали с помощью коммерческого набора Проба-ГС (ЗАО «АгроДиагностика», Россия) в соответствии с инструкцией производителя.
Все образцы ДНК тестировали в двух повторах методом классической ПЦР. Амплификацию проводили на термоциклере T100 («Bio-Rad», США) с использованием олигонуклеотидов, синтезированных в ЗАО «Евроген» (Россия), и готовых смесей для ПЦР 5½ MasDDTaqMIX-2025 (ЗАО «Диалат», Россия). Первое тестирование проводили с праймерами PSF/PSR (PSF: 5´-AGCCGTAGGGGAACCTGCGG-3´, PSR: 5´-TGACTGCCAAGG-CATCCACC-3´) (22). Несколько копий последовательности длиной 610 п.н., амплифицируемой с указанными праймерами, расположены в тРНК у бактерий рода Pseudomonas. ПЦР-смесь на одну реакцию содержала 16 мкл воды, 5 мкл 5½ MasDDTaqMIX-2025, по 1 мкл каждого праймера в концентрации 10 мкмоль и 2 мкл ДНК. Программа амплификации: 95 °С — 10 мин; затем 25 циклов: 95 °С — 20 с, 64 °С — 15 с, 72 °С — 15 с; затем 72 °С — 2 мин. Наличие продукта ПЦР проверяли с использованием гельдокумен-тирующей системы («Bio-Rad», США) после электрофоретичекого разделения продуктов ПЦР в 1,5 % агарозном геле. Таким образом среди всех изо-лятов обнаруживали представителей рода Pseudomonas. Образцы ДНК культур, с которыми был получен продукт ПЦР длиной 610 п.н., тестировали с праймерами SyD1/SyD2 (SyD1: 5´-CAGCGGCGTTGCGTCCATTGC-3'´, SyD2: 5´-TGCCGCCGACGATGTAGACCAGC-3´) (22). Праймеры позволяют идентифицировать Pseudomonas syringae и амплифицируют продукт длиной 1040 п.н. ПЦР-смесь на одну реакцию содержала 17,4 мкл воды, 5 мкл 5½ MasDDTaqMIX-2025, по 0,3 мкл каждого праймера в концентрации 10 пмоль и 2 мкл ДНК. Программа амплификации: 95 °С — 10 мин; затем 25 циклов: 95 °С — 20 с, 64 °С — 15 с, 72 °С — 45 с; затем 72 °С — 7 мин. Наличие продукта ПЦР проверяли с использованием горизонтального электрофореза в 1,5 % агарозном геле. При наличии продукта длиной 1040 п.н., оставшийся в пробирке ампликон очищали с помощью набора GeneJET PCR Purification Kit («Thermo Fisher Scientific», США) и использовали для секвенирования по Сэнгеру с помощью набора Big Dye Kit, BigDye®XTerminator™ Purification Kit («Thermo Fisher Scientific», США) на генетическом анализаторе AB-3500 («Applied Biosystems», США) по адаптированной методике (23). При отсутствии продукта ПЦР длиной 1040 п.н. секвенирование проводили с продуктом ПЦР с праймерами PSF/PSR. С образцами ДНК, для которых не были получены продукты ПЦР с праймерами SyD1/SyD2 или PSF/PSR, проводили ПЦР с праймерами 8UA/519B (8UA: 5´-AGAGTTTGATCMTGGCTCAG-3´, 519B: 5´-GTATTACCGCGGC-KGCTG-3´) для участка 16–23S рРНК (24). ПЦР-смесь на одну реакцию содержала 14 мкл воды, 5 мкл 5½ MasDDTaqMIX-2025, по 2 мкл каждого праймера в концентрации 10 мкмоль и 2 мкл ДНК. Амплификация: 96 °С — 10 мин; затем 35 циклов: 95 °С — 15 с, 55 °С — 30 с, 72 °С — 30 с; 72 °С — 10 мин. Наличие продукта ПЦР проверяли с использованием горизонтального электрофореза в 1,5 % агарозном геле. Неиспользованные для электрофореза остатки ампликонов подвергали очистке и секвенированию, как описано выше.
Результаты секвенирования обрабатывали с помощью программы BioEdit . Расшифрованные нуклеотидные последовательности сравнивали с помощью сервиса BLAST с последовательностями, размещенными в GenBank . Результатом идентификации считали организм с максимальным сходством (Max score), автоматически вычисленным сервисом BLAST на основании расчета показателей Query coverage и Percent identity. Если в таксоне находили несколько таких организмов, результатом идентификации считали старший таксон.
Для каждого идентифицированного вида и рода рассчитывали частоту встречаемости (А) по формуле (25): А = В/С ½ 100 %, где В — число образцов, на которых обнаружена бактерия с определенной видовой принадлежностью, С — общее число проанализированных образцов. При расчете частоты встречаемости родов бактерий учитывали как идентифицированные до вида изоляты, так и изоляты, идентифицированные только до рода.
Результаты . Период отбора образцов растения озимых зерновых культур приходился на фазу выхода в трубку, яровых — на фазу проростков. Симптомы бактериальных болезней в период отбора образцов озимых зерновых культур на растениях отсутствовали. На проростках яровой ржи отмечали хлорозы. Всего отобрали 55 образцов зерновых культур (табл. 1).
1. Результаты сбора образцов зерновых культур (Тимирязевская полевая опытная станция, Российский государственный аграрный университет — МСХА им. К.А Тимирязева, г. Москва, 2020 год)
|
Культура |
Сорта |
|
Secale cereale L. ½ Triticosecale Wittm. & A.Camus |
Снежана, Верасень, Без названия Александр, Виктор, Немчиновский 56, Валентин 90, Тимирязевская 150 |
|
Triticum turgidum L. Triticum durum Desf. Triticum dicoccum Schrank Triticum sphaerococcum Percival ½ Triticosecale (Wittm. & A. Camus) sphaerococcum Triticum aestivum L. |
Донской янтарь, Терра Победа 70 Без названия Еремеевна Тит Жива, Алексеевич, Уруп, Морозко, Тимирязевская Юбилейная, Московская 56, Бирюза, Тимирязевка 150, Граф, Васса, Московская 39, Дуплет, Кавалерка, Алая заря, Немчиновская 24, Легенда, Авеста, Инна, Стан, Аскет, Велена, Ваня, Артель, Немчиновская 85, Видея, Донская лира, Синева, Московская 40, Дон 107, Степь, Губернатор Дона, Ростовчанка, Веха, Немчиновская 57, Августа, Со-бербаш, Анка, Гурт, Антонина, Немчиновская 17, Безостая 100 |
Пр им еч ан и е. Образец озимых культур представлял собой 5-15 стеблей растений, срезанных у первого междоузлия, образец яровых культур состоял из 15 проростков. От одного сорта отбирали один образец.
Среди собранных образцов 14 — рожь ( Secale cereale L.), тритикале (½ Triticosecale Wittm. & A.Camus, ½ Triticosecale (Wittm. & A. Camus) sphaero-coccum ), тургидная ( Triticum turgidum L.), твердая ( Triticum durum Desf.) и шаровидная ( Triticum sphaerococcum Percival) пшеницы, 41 образец — мягкая пшеница ( Triticum aestivum L.) (см. табл. 1).
Всего из собранных образцов был выделен 171 бактериальный изо-лят. В результате ПЦР с праймерами PSF/PSR ампликон длиной 610 п.н. был получен для 60 протестированных образцов ДНК бактериальных культур (рис. 1).
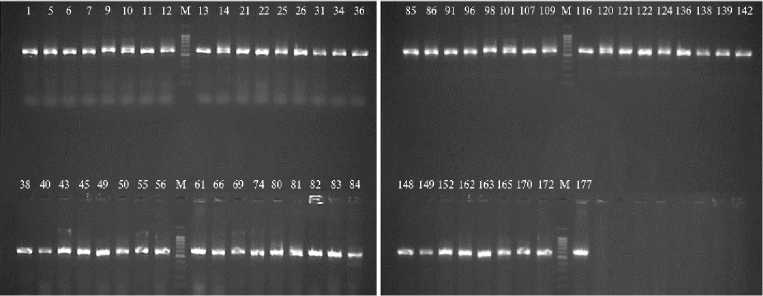
Рис. 1. Продукты ПЦР с праймерами PSF/PSR (610 п.н.), полученные для образцов ДНК бактериальных изолятов из сортов зерновых культур: 1 — Снежана; 5 — Жива; 6, 7 — Алексеевич; 9-12 — Морозко; 13, 14 — Тимирязевская Юбилейная; 21 — Московская 56; 22 —Бирюза; 25, 26 — Тимирязевка 150; 31 — Александр; 34, 36, 38 — Донской янтарь; 40 — Виктор; 43 — Triticum dicoccum Schrank (без названия); 45 — Немчиновский 56; 49 — Еремеевна; 50 — Тит; 55, 56 — Московская 39; 61 — Дуплет; 66-69 — Кавалерка; 74 — Алая заря; 80 — Немчиновская 24; 81, 82 — Победа 70; 83, 84 — Легенда; 85, 86 — Авеста; 91, 96, 98 — Верасень; 101 — Инна; 107 — Терра; 109 — Тимирязевская 150; 116 — Стан; 120-122 — Аскет; 124 — Велена; 136 — Видеа; 138, 139 — Донская лира; 142 — Синева; 148 — Дон 107; 149 — Степь; 152 — Ростовчанка; 162 — Собербаш; 163, 165 — Анка; 170 — Антонина; 172 — Немчиновская 17; 177 — Secale cereale L. (без названия); М — маркер длин ДНК 100+ bp DNA ladder (100-1000 п.н. («Евроген», Россия) (Тимирязевская полевая опытная станция, Российский государственный аграрный университет — МСХА им. К.А Тимирязева, г. Москва, 2020 год).
В результате ПЦР с праймерами SyD1/SyD2 ампликон длиной 1040 п.н. был получен для восьми протестированных образцов ДНК бактериальных культур (рис. 2).
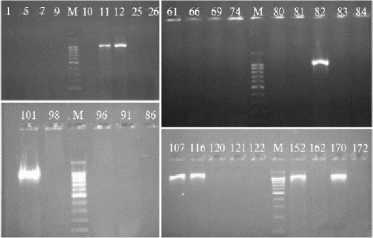
ция, Российский государственный аграрный г. Москва, 2020 год).
Рис. 2. Продукты ПЦР с праймерами SyD1/SyD2 (1040 п.н.), полученные для образцов ДНК бактериальных изолятов из сортов зерновых культур: 1 — Снежана; 5 — Жива; 7 — Алексеевич; 9-12 — Морозко; 25, 26 — Тимирязевка 150; 61 — Дуплет; 66, 69 — Кавалерка; 74 — Алая заря; 80 — Немчиновская 24; 81, 82 — Победа 70; 83, 84 — Легенда; 86 — Авеста; 91, 96, 98 — Верасень; 101 — Инна; 107 — Терра; 116 — Стан; 120-122 — Аскет; 152 — Ростовчанка; 162 — Собербаш; 170 — Антонина; 172 —
Немчиновская 17; М — маркер длин ДНК 100+ bp DNA ladder (100-1000 п.н. («Евроген», Россия) (Тимирязевская полевая опытная стан-университет — МСХА им. К.А Тимирязева,
Для оставшихся 103 образцов ДНК бактериальных культур были получены ампликоны длиной 500 п.н. в результате ПЦР с праймерами 8UA/519B (рис. 3).
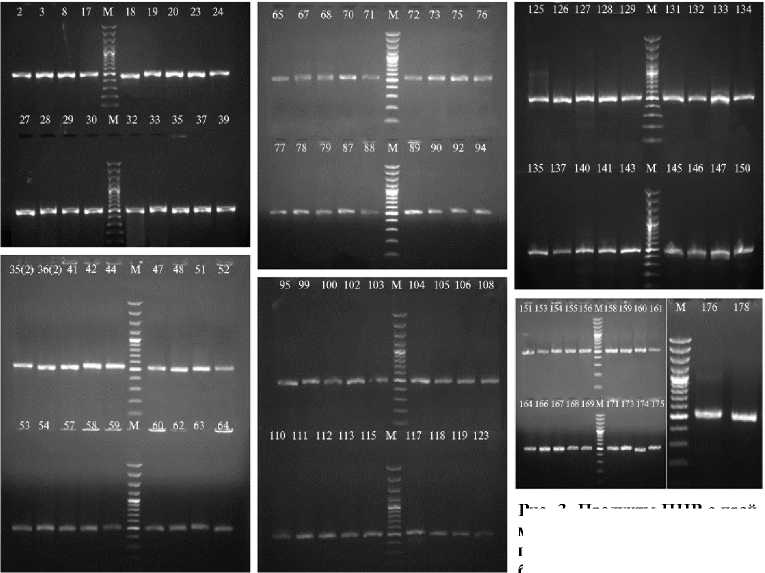
Рис. 3. Продукты ПЦР с праймерами 8UA/519B (500 п.н.), полученные для образцов ДНК бактериальных изолятов из сортов зерновых культур: 2, 3 —
Снежана; 8 — Уруп; 17-20 — Тимирязевская Юбилейная; 23-24 — Бирюза; 27 — Тимирязевка 150; 28-30 — Граф; 32, 33, 35, 37 — Донской янтарь; 39 — Виктор; 35(2), 36(2) — Донской янтарь; 41-42 — Васса; 44 — Немчиновский 56; 47-48 — Еремеевна; 51-52 — Тит; 53-54, 57-58 — Московская 39; 59-60 — Валентин; 62-65 — Дуплет; 67-68 — Кавалерка; 70-73, 75-76 — Алая заря; 77-79 — Немчиновская 24; 87-90 — Авеста; 92, 94 — Верасень; 95, 97, 99 — Верасень; 100, 102-103 — Инна; 104-106, 108 — Терра; 110-111 — Тимирязевская 150; 112-114, 117 — Стан; 118-119 — Аскет; 123 — Велена; 125 — Ваня; 126-129, 131-132 — Артель; 133-134 — Немчиновская 85; 135 — Видеа; 137 — Донская лира; 140-141 — Синева; 143, 145-146 — Московская 40; 147 — Дон 107; 150 — Губернатор Дона; 151 — Ростовчанка; 153 — Веха; 154-155 — Немчиновская 57; 156, 158-159 — Августа; 160-161 — Собербаш; 164 — Анка; 166-169 — Гурт; 171 — Немчиновская 17; 173-175 — Безостая 100; 176, 178 — яровая рожь Secale cereale L. (без названия); М — маркер молекулярных масс GeneRuler 100 bp Plus (100-1000 п.н.), («Thermo Fisher Scientific», США) (Тимирязевская полевая опытная станция, Российский государственный аграрный университет — МСХА им. К.А Тимирязева, г. Москва, 2020 год).
-
2. Результаты выравнивания нуклеотидных последовательностей бактериальных изолятов, полученных секвенированием по Сэнгеру (сервис BLAST, https://blast.ncbi.nlm.nih.gov ; Тимирязевская полевая опытная станция, Российский государственный аграрный университет — МСХА им. К.А Тимирязева, г. Москва, 2020 год)
-
3. Результаты идентификации бактерий в образцах зерновых культур (кроме Triticum aestivum L.) (Тимирязевская полевая опытная станция, Российский государственный аграрный университет — МСХА им. К.А Тимирязева, г. Москва, 2020 год)
Культура
Сорт 1 Результат идентификации
Secale cereale L.
Снежана Pseudomonas sp., Rhodococcus sp.
Верасень Pseudomonas trivialis , Micrococcus sp.,
Staphylococcus sp., Pseudomonas sp., Ar-throbacter sp.
Без названия Actinomycetales bacterium, Pseudomonas
sp., Pseudoclavibacter helvolus
½ Triticosecale Wittm. & A.Camus
Александр Pseudomonas sp.
Виктор Frigoribacterium sp., Pseudomonas sp.
Немчиновский 56 Dyadobacter sp., Pseudomonas sp.
Валентин 90 Clavibacter michiganensis , Frigoribacterium
faeni
Тимирязевская Pseudomonas sp., Frigoribacterium sp.,
150 Rathayibacter festucae
Triticum turgidum L.
Донской янтарь Uncultured bacterium, Frigoribacterium
faeni , Paucimonas lemoignei , Uncultured Enterobacteriaceae bacterium, Uncultured soil bacterium, Pantoea ananatis , Frigoribacterium sp., Salinibacterium sp., Pseudomonas sp.
Терра Arthrobacter sp., Rhodococcus sp., Clavi-
bacter michiganensis , Pseudomonas syrin-gae , Frigoribacterium sp.
Triticum durum Desf.
Победа 70 Pseudomonas viridiflava , Pseudomonas sy-
ringae
Triticum dicoccum Schrank
Без названия Pseudomonas sp.
Triticum sphaerococcum Percival
Еремеевна Frigoribacterium sp., Sanguibacter sp.,
Pseudomonas sp.
½ Triticosecale (Wittm. & A. Camus) sphaerococcum
Тит Pseudomonas sp., Bacterium, Uncultured
bacterium
Пр и меч ани е. Образец озимых культур представлял собой 5-15 стеблей растений, срезанных у первого
междоузлия, образец яровых культур состоял из
15 проростков. От одного сорта отбирали один образец.
|
Морозко |
9 |
PSF/PSR |
Pseudomonas viridiflava |
712 |
99 % |
88,17 % |
|
Морозко |
10 |
PSF/PSR |
Pseudomonas syringae , Pseudomonas syringae pv. aptata |
575 |
100 % |
99,68 % |
|
Морозко |
11 |
PSF/PSR |
Pseudomonas syringae pv. atrofaciens , Pseudomonas syringae |
1596 |
100 % |
97,18 % |
|
Морозко |
12 |
PSF/PSR |
Pseudomonas syringae pv. atrofaciens , |
1596 |
100 % |
97,18 % |
Pseudomonas syringae
Пр им еч ан и е. 1 — сорт, из образцов которого выделен изолят, 2 — ¹ изолята, 3 — пара праймеров (подробнее см. в разделе «Методика»), 4 — микроорганизм с максимальным сходством 5 — максимальный балл (max score), 6 — охват запроса (query coverage), 7 — идентичность (percent identity). Полностью таблица представлена на сайте http://www,
Очистка, секвенирование и обработка с помощью программы BioEdit позволили получить нуклеотидные последовательности для каждого из выделенных изолятов и провести выравнивание этих последовательностей в сервисе BLAST . Примеры полученных результатов представлены в таблице 2 (полностью см. на сайте .
Некоторые виды идентифицированных бактерий присутствовали только в каком-либо одном образце зерновых культур (табл. 3). Грамположи-тельная бактерия Rathayibacter festucae, выделенная из образца тритикале сорта Тимирязевская 150, первоначально была выявлена в 2002 году из листового галла, вызванного нематодой Anguina graminis на овсянице красной (26). Род Rathayibacter включает 6 видов, среди которых Rathayibacter tritici и Rathayi-bacter rathayi патогенны для зерновых культур и регулируются фитосанитар-ными требованиями ряда стран , .
Идентифицированный в образце озимой ржи вид Pseudoclavibacter helvolus (см. табл. 3) — грамположительная бактерия, у которой не отмечают фитопатогенных свойств (27). Грамотрицательная бактерия Paucimonas lem-oignei, выделенная из тургидной пшеницы сорта Донской янтарь (см. табл. 3), не характеризуется как фитопатоген (28).
Идентифицированный в образце тургидной пшеницы сорта Донской янтарь вид Pantoea ananatis (см. табл. 3) — грамотрицательная бактерия, которая служит возбудителем различных бактериозов растений (29) и, согласно сведениям Федеральной службы по ветеринарному и фитосанитарному надзору , регулируется карантинным перечнем Колумбии. В то же время сообщалось, что Pantoea ananatis способствует активному обмену веществ у растений (30).
В единичных образцах озимой мягкой пшеницы (общая выборка — 41 образец) (табл. 4) мы обнаружили как фитопатогенные, так и хозяйственно полезные бактерии.
Грамположительная бактерия Arthrobacter chlorophenolicus , выделенная из образца пшеницы сорта Синева (см. табл. 4), обладает хозяйственно полезными свойствами — повышает засухоустойчивость растений (31) .
-
4. Результаты идентификации бактерий в образцах озимой мягкой пшеницы Trit-icum aestivum L. (Тимирязевская полевая опытная станция, Российский государственный аграрный университет — МСХА им. К.А Тимирязева, г. Москва, 2020 год)
Сорт
1 Результат идентификации
Жива
Pseudomonas trivialis
Алексеевич
Pseudomonas sp., Pseudomonas poae
Уруп
Erwinia sp.
Морозко
Pseudomonas viridiflava , Pseudomonas syringae
Тимирязевская Юбилейная
Pseudomonas sp., Frigoribacterium sp., Uncultured bacterium, Clavibacter sp., Kineococcus sp.
Московская 56
Pseudomonas sp.
Бирюза
Pseudomonas sp., Pantoea sp., Uncultured bacterium
Тимирязевка 150
Pseudomonas sp., Pseudomonas poae , Uncultured bacterium
Граф
Curtobacterium sp., Arthrobacter sp., Streptomyces sp.
Васса
Frigoribacterium sp.
Московская 39
Frigoribacterium sp., Clavibacter sp., Pseudomonas trivialis , Pseudomonas sp.
Дуплет
Frigoribacterium sp., Bacterium, Curtobacterium sp.
Кавалерка
Pseudomonas sp., Uncultured bacterium, Bacterium, Pseudomonas graminis
Алая заря
Oerskovia sp., Cellulomonas sp., Frigoribacterium sp., Microbacterium sp., Pseudomonas sp., Bacterium
Немчиновская 24
Microbacteriaceae bacterium, Frondihabitans sp., Curtobacterium sp., Pseudomonas sp.
Легенда
Pseudomonas graminis , Pseudomonas poae
Авеста
Pseudomonas poae , Clavibacter sp . , Frigoribacterium sp. , Sphingomonas sp.
Инна
Clavibacter michiganensis , Pseudomonas syringae, Uncultured bacterium, Microbacterium sp.
Стан
Rhodococcus fascians , Arthrobacter sp., Phycicoccus sp., Pseudomonas syringae pv. syringae , Frigoribacterium sp.
Аскет
Frigoribacterium sp., Bacillus sp., Pseudomonas viridiflava , Pseudomonas chlo-roraphis , Pseudomonas sp.
Велена
Rhodococcus sp., Pseudomonas viridiflava
Ваня
Plantibacter sp.
Артель
Uncultured bacterium, Unidentified microorganism, Frigoribacterium sp., Curto-bacterium sp., Rhizosphere soil bacterium, Sphingomonas sp.
Немчиновская 85
Clavibacter sp., Frigoribacterium sp.
Видея
Bacterium, Pseudomonas sp.
Донская лира
Plantibacter sp., Pseudomonas sp., Pseudomonas syringae pv. syringae
Синева
Frigoribacterium sp., Arthrobacter chlorophenolicus , Pseudomonas sp.
Московская 40
Clavibacter sp., Arthrobacter sp.
Дон 107
Frigoribacterium sp., Pseudomonas sp.
Степь
Pseudomonas sp.
Губернатор Дона
Frigoribacterium sp.
Ростовчанка
Bacterium, Pseudomonas sp.
Веха
Erwinia sp.
Немчиновская 57
Rhodococcus fascians , Uncultured bacterium
Августа
Bacillus sp., Uncultured bacterium
Собербаш
Clavibacter sp., Pseudomonas sp., Bacterium
Анка
Гурт
Антонина
Немчиновская 17
Безостая 100
Pseudomonas trivialis , Bacterium, Pseudomonas sp.
Pseudomonas sp., Agreria sp., Frondihabitans sp., Sphingomonas sp.
Pseudomonas syringae
Rhodococcus sp.
Athrobacter sp., Micrococcus sp., Frigoribacterium sp.
Пр им еч ан и е. Образец представлял собой 5-15 стеблей растений, срезанных у первого междоузлия. От одного сорта отбирали один образец.
Грамотрицательная почвенная бактерия Pseudomonas chlororaphis из образца пшеницы сорта Аскет (см. табл. 4) используются в качестве биоагента против болезней растений (32).
Также выделены бактерии, присутствие которых отмечено в нескольких образцах злаковых культур (см. табл. 3, 4). Идентифицированы виды грамположительных бактерий Clavibacter michiganensis и Rhodococcus fascians и грамотрицательных Pseudomonas trivialis , Pseudomonas viridiflava и Pseudomonas syringae (включая патовар Pseudomonas syringae pv. syringae ), для которых описаны фитопатогенные свойства (4, 33-37). Кроме того, выделены и идентифицированы грамположительные бактерии Frigoribacterium faeni , обычно выделяемые из почвы, филлосферы растений и других источников, для которых хозяйственно ценные или патогенные свойства не отмечены (38). Также выделены грамотрицательные бактерии Pseudomonas graminis и Pseudomonas poae (см. табл.3, 4), которые обычно выделяются из почвы или растений и используются для контроля болезней растений (39, 40).
-
5. Частота встречаемости видов и родов бактерий в образцах зерновых культур (Тимирязевская полевая опытная станция, Российский государственный аграрный университет — МСХА им. К.А Тимирязева, г. Москва, 2020 год)
|
Род |
Частота встречаемости, |
% 1 Вид |
Частота встречаемости, % |
|
Agreria sp. |
1,8 |
– |
|
|
Arthrobacter sp. |
12,7 |
Arthrobacter chlorophenolicus |
1,8 |
|
Bacillus sp. |
5,5 |
– |
|
|
Cellulomonas sp. |
1,8 |
– |
|
|
Clavibacter sp . |
16,4 |
Clavibacter michiganensis |
5,5 |
|
Curtobacterium sp. |
7,3 |
– |
|
|
Dyadobacter sp. |
1,8 |
– |
|
|
Erwinia sp. |
3,6 |
– |
|
|
Frigoribacterium sp. |
36,4 |
Frigoribacterium faeni |
3,6 |
|
Frondihabitans sp. |
3,6 |
– |
|
|
Kineococcus sp. |
1,8 |
– |
|
|
Microbacterium sp. |
3,6 |
– |
|
|
Micrococcus sp. |
3,6 |
– |
|
|
Oerskovia sp. |
1,8 |
– |
|
|
Pantoea sp. |
3,6 |
Pantoea ananatis |
1,8 |
|
Paucimonas sp. |
1,8 |
Paucimonas lemoignei |
1,8 |
|
Phycicoccus sp. |
1,8 |
– |
|
|
Plantibacter sp. |
3,6 |
– |
|
|
Pseudoclavibacter sp. |
1,8 |
Pseudoclavibacter helvolus |
1,8 |
|
Pseudomonas sp. |
70,9 |
Pseudomonas chlororaphis Pseudomonas graminis Pseudomonas poae Pseudomonas syringae Pseudomonas trivialis Pseudomonas viridiflava |
1,8 3,6 7,3 12,7 7,3 7,3 |
|
Rathayibacter sp. |
1,8 |
Rathayibacter festucae |
1,8 |
|
Rhodococcus sp. |
10,9 |
Rhodococcus fascians |
3,6 |
|
Salinibacterium sp. |
1,8 |
– |
|
|
Sanguibacter sp. |
1,8 |
– |
|
|
Sphingomonas sp. |
5,5 |
– |
|
|
Staphylococcus sp. |
1,8 |
– |
|
|
Streptomyces sp. |
1,8 |
– |
Пр и меч ани е. Прочерки означают, что виды внутри рода не идентифицированы
Использованные методы позволили установить, что частота встречаемости бактерий, принадлежащих родам Pseudomonas, Frigoribacterium, Clavi- bacter, Arthrobacter и Rhodococcus на зерновых культурах Тимирязевской полевой опытной станции составляла более 10 % (табл. 5). Разнообразие самых распространенных в исследуемых образцах бактерий — псевдомонад (частота встречаемости в исследованных образцах составила 70,9 %) представлено шестью видами (см. табл. 5), из которых три вида — Pseudomonas chlororaphis, Pseudomonas graminis и Pseudomonas poae, по данным литературы, обладают полезными для растений свойствами, а три вида — Pseudomonas syringae, Pseudomonas trivialis и Pseudomonas viridiflava являются фитопатогенами.
Бактерии рода Frigoribacterium , вторые по частоте встречаемости (см. табл. 5), — обычные представители микробиоты растений, способствующие их росту и адаптации (41). К обычным представителям почвенной и растительной микробиоты также относятся бактерии Arthrobacter sp., которые мы обнаружили в образцах зерновых культур с частотой встречаемости 12,7 %.
Мы обнаружили распространение патогенного вида Clavibacter mich-iganensis с частотой 5,5 %. Наиболее вероятно, что обнаруженные бактерии принадлежат подвиду Clavibacter michiganensis subsp. tessellarius ( Clavibacter tessellarius sp. nov.), который является возбудителем бактериальной мозаики пшеницы, так как подвиды Clavibacter michiganensis высокоспецифичны в отношении растения-хозяина, и именно подвид tessellarius поражает пшеницу (42).
Среди бактерий Rhodococcus sp., частота встречаемости которых составила 10,9 %, только Rhodococcus fascians , по данным литературы, может вызывать болезни растений (34).
Частота встречаемости прочих идентифицированных родов и видов бактерий составляла менее 10 %.
Таким образом, в своем исследовании мы изучили микробиоту локальных посевов зерновых культур (Тимирязевская полевая опытная станция, 2020 год) и выделили полевые изоляты, которые могут быть использованы при формировании единой коллекции бактерий зерновых с целью создания видоспецифичных праймеров, которые будут являться ключевой частью разрабатываемых нормативных документов по выявлению и идентификации карантинных и значимых для экспорта возбудителей бактериозов зерновых культур. Указанные нормативные документы, потребность в которых очень велика, будут использоваться фитосанитарными лабораториями, осуществляющими свою деятельность в области фитосанитарного контроля. Учитывая региональные особенности почвенно-климатических и агротехнических условий и биоразнообразие изолятов (43-45), мы полагаем, что типовые штаммы из зарубежных коллекций микроорганизмов (при их доступности) подходят для этих целей в меньшей степени. Отметим, что ранее масштабного изучения бактериального состава в зерновых культурах в России не проводили, в связи с чем отсутствует информация о видовом составе бактерий, которые могут находиться вместе в одном образце. Отсутствует и полный перечень бактерий, которые можно встретить в зерновых культурах в России.
Исследование состава микробиоты мы провели на посевах экономически значимых культур с применением методов классической микробиологии для изоляции бактерий из образцов и молекулярно-генетических методов для идентификации выделенных изолятов. Полученные данные могут пополнить знания о бактериях, обитающих в растениях, и будут полезны для формирования общих представлений о микробиоме целевых культур в полевых условиях.
Бактерии выделили из проростков яровых культур (рожь) и из зеленых растений озимых культур в фазу выходя в трубку, что могло повлиять на число клеток некоторых видов бактерий в растениях по соотношению с другими и косвенно — на состав полученных штаммов (4, 5, 13). Штаммы выделяли на чашках Петри с учетом разнообразия морфотипов, что достаточно субъективно и в любом случае не позволяет учитывать некультивиру-емые микроорганизмы (45). Однако это не противоречит задачам, которые мы поставили перед собой при выполнении работы — выделить изоляты для формирования коллекции значимых для экспорта бактериальных фитопатогенов и сопутствующей им микробиоты. Полученные данные о составе и частоте встречаемости бактерий мы не распространяем на другие посевы зерновых даже в этой же агроклиматической зоне.
Важно отметить, что в микробиоте зерновых растений мы выявили патогенные, нейтральные и полезные виды. Учет патогенов может способствовать совершенствованию методов оценки фитосанитарного состояния посевов зерновых, а среди полезных видов могут быть обнаружены бактерии-кандидаты для разработки новых препаратов для биологического контроля фитопатогенов. Кроме того, мы выявили бактерии, принадлежащие к определенным родам, но не относящиеся ни к одному из известных видов, что делает их перспективными для дальнейшего изучения и возможности описания новых видов — представителей микробиоты зерновых культур.
Итак, с участков сортоиспытания и гибридизационных делянок Тимирязевской полевой опытной станции мы собрали 55 образцов зерновых культур, из которых выделили 171 бактериальный изолят, из которых 37 изо-лятов идентифицировали до вида с использованием молекулярно-генетических методов диагностики. Выявленное бактериальное разнообразие представлено 14 видами. Среди них к фитопатогенам относятся Pantoea ananatis, Clavibacter michiganensis, Rhodococcus fascians, Pseudomonas trivialis, Pseudomonas viridiflava и Pseudomonas syringae. При этом Pantoea ananatis включена в сигнальный перечень Североамериканской организации по защите растений, Rhodococcus fascians регулируется в качестве карантинного объекта в Аргентине, Бразилии, Чили, Мексике и др., Pseudomonas viridiflava является карантинным организмом для Мексики и регулируется в качестве некарантинного организма в Швейцарии и Великобритании, а Pseudomonas syringae (и, в частности, патовар Pseudomonas syringae pv. syringae, обнаруженный нами на зерновых культурах), является карантинным организмом для таких импортеров российского зерна, как Тайвань, Мексика, Колумбия и Иордания, а также регулируется фитосанитарными требованиями Египта, Зимбабве и Великобритании в зерновой продукции как некарантинный вид , . Также выделены и идентифицированы бактерии, обладающие хозяйственно полезными свойствами: Arthro-bacter chlorophenolicus, Pseudomonas chlororaphis, Pseudomonas graminis и Pseudomonas poae. Прочие идентифицированные виды — Rathayibacter festucae, Pseudoclavibacter helvolus, Paucimonas lemoignei и Frigoribacterium faeni, по данным литературы, не обладают выраженными вредными или полезными свойствами. Наибольшая частота встречаемости — 70,9 % отмечена у видов, относящихся к роду Pseudomonas. Также высокой частотой встречаемости характеризуются представители родов Frigoribacterium (36,4 %), Clavibacter (16,4 %), Arthrobacter (12,7 %) и Rhodococcus (10,9 %). Полученные экспериментальные данные о видовом составе бактерий на зерновых культурах могут быть использована при анализе распространения бактериозов на территории Российской Федерации и их диагностике, а также для биоинформа-тического анализа бактериальных геномов при поиске видоспецифичных генетических маркеров карантинных объектов.
Список литературы Выявление значимых для экспорта зерна возбудителей бактериозов и комплекса сопутствующих микроорганизмов в посевах зерновых культур (на примере Тимирязевской полевой опытной станции)
- Singh J., Chhabra B., Raza A., Yang S.H., Sandhu K.S. Important wheat diseases in the US and their management in the 21st century. Frontiers in Plant Science, 2023, 13: 1010191 (doi: 10.3389/fpls.2022.1010191).
- Krawczyk K., Wielkopolan B., Obrępalska-Stęplowska A. Pantoea ananatis, a new bacterial path-ogen affecting wheat plants (Triticum L.) in Poland. Pathogens, 2020, 9(12): 1079 (doi: 10.3390/pathogens9121079).
- Sapkota S., Mergoum M., Liu Z. The translucens group of Xanthomonas translucens: complicated and important pathogens causing bacterial leaf streak on cereals. Molecular Plant Pathology, 2020, 21(3): 291-302 (doi: 10.1111/mpp.12909).
- Tambong J. Bacterial pathogens of wheat: symptoms, distribution, identification, and taxonomy. In: Wheat. IntechOpen, 2022 (doi: 10.5772/intechopen.102855).
- Butsenko L., Pasichnyk L., Kolomiiets Y., Kalinichenko A., Suszanowicz D., Sporek M., Pat-yka V. Characteristic of Pseudomonas syringae pv. atrofaciens isolated from weeds of wheat field. Applied Sciences, 2021, 11(1): 286 (doi: 10.3390/app11010286).
- Sundin G.W., Castiblanco L.F., Yuan X., Zeng Q., Yang C.H. Bacterial disease management: challenges, experience, innovation and future prospects: challenges in bacterial molecular plant pathology. Molecular Plant Pathology, 2016, 17(9): 1506-1518 (doi: 10.1111/mpp.12436).
- Wichmann F., Vorhölter F., Hersemann L., Widmer F., Blom J., Niehaus K., Reinhard S., Conradin C., Kölliker R. The noncanonical type III secretion system of Xanthomonas translucens pv. graminis is essential for forage grass infection. Molecular Plant Pathology, 2013, 14(6): 576-588 (doi: 10.1111/mpp.12030).
- Xie G.L., Zhang G.Q., Liu H., Lou M.M., Tian W.X., Li B., Zhou X.P., Zhu B., Jin G.L. Genome sequence of the rice-pathogenic bacterium Acidovorax avenae subsp. avenae RS-1. Jour-nal of Bacteriology, 2011, 193(18): 5013-5014. (doi: 10.1128/JB.05594-11).
- Nandi M., Macdonald J., Liu P., Weselowski B., Yuan Z.C. Clavibacter michiganensis ssp. mich-iganensis: bacterial canker of tomato, molecular interactions and disease management. Molecular Plant Pathology, 2018, 19(8): 2036-2050 (doi: 10.1111/mpp.12678).
- Coutinho T.A., Wingfield M.J. Ralstonia solanacearum and R. pseudosolanacearum on Eucalyptus: opportunists or primary pathogens? Frontiers in Plant Science, 2017, 8: 761 (doi: 10.3389/fpls.2017.00761).
- McMullen M.P., Stack R.W., Miller J.D., Bromel M.C., Youngs V.L. Erwinia rhapontici, a bac-terium causing pink wheat kernels. In: Proceedings of the North Dakota Academy of Sciences. Grand Forks, ND, 1984, 38: 78.
- Wise K.A., Zhao Y.F., Bradley C.A. First report of pink seed of pea caused by Erwinia rhapontici in North Dakota. Plant Disease, 2008, 92(2): 315 (doi: 10.1094/PDIS-92-2-0315A).
- Asaad S., Sands D.C., Mohan S.K. Chapter 4: Detection of Pseudomonas syringae pv. syringae in wheat seeds. In: Detection of plant-pathogenic bacteria in seed and other planting material, Second Edition. AIP Publications, 2017: 21-26 (doi: 10.1094/9780890545416.004).
- Boykin L.M., Sseruwagi P., Alicai T., Ateka E., Mohammed I.U., Stanton J.L., Kayuki C., Mark D., Fute T., Erasto J., Bachwenkizi H., Muga B., Mumo N., Mwangi J., Abidrabo P., Okao-Okuja G., Omuut G., Akol J., Apio H.B., Osingada F., Kehoe M.A., Eccles D., Savill A., Lamb S., Kinene T., Rawle C.B., Muralidhar A., Mayall K., Tairo F., Ndunguru J. Tree lab: portable genomics for early detection of plant viruses and pests in Sub-Saharan Africa. Genes (Basel), 2019, 10(9): 632 (doi: 10.3390/genes10090632).
- Горшков В.Ю. Бактериозы растений: молекулярные основы формирования растительно-мик-робных патосистем. Казань, 2017.
- Nair S., Manimekalai R. Phytoplasma diseases of plants: molecular diagnostics and way forward. World Journal of Microbiology and Biotechnology, 2021, 37(6): 102 (doi: 10.1007/s11274-021-03061-y).
- Игнатьева И.М., Словарева О.Ю. Совершенствование ПЦР-теста для диагностики расти-тельного материала зернобобовых культур на наличие возбудителя бактериального ожога гороха. Тез. докл. 22-й Всероссийской конференции молодых ученых «Биотехнология в расте-ниеводстве, животноводстве и сельскохозяйственной микробиологии» (Москва, 07-09 ноября 2022 г.). М., 2022: 140.
- Ignatyeva I.M., Karimova E.V., Prikhodko S.I. Diagnostics of the bacterial blight pathogen of bean Xanthomonas axonopodis pv. phaseoli in plant and seed material of grain legumes using molecular genetics methods. AIP Conference Proceedings, 2021, 2388: 030014 (doi: 10.1063/5.0068504).
- Islam M.R., Hossain M.R., Kim H.T., Jesse D.M.I., Abuyusuf M., Jong H.J., Park J.I., Nou I.S. Development of molecular markers for detection of Acidovorax citrulli strains causing bacterial fruit blotch disease in melon. International Journal of Molecular Sciences, 2019, 20(11): 2715 (doi: 10.3390/ijms20112715).
- Корнейкова М.В., Сошина А.С., Гавричкова О.В. Условно-патогенная микробиота пыли в городах разных климатических зон на примере Мурманска и Москвы. Микология и фи-топатология, 2021, 55(4): 256-270 (doi: 10.31857/S0026364821040085).
- Slovareva O.Y. Detection and identification of pathogens of bacterial diseases of wheat and barley in the Russian Federation. Microbiology Independent Research Journal (MIR Journal), 2020, 7(1): 13-23 (doi: 10.18527/2500-2236-2020-7-1-13-23).
- Kazempour M.N, Kheyrgoo M., Pedramfar H., Rahimian H. Isolation and identification of bac-terial glum blotch and leaf blight on wheat (Triticum aestivum L.) in Iran. African Journal of Biotechnology, 2010, 9(20): 2860-2865.
- Белкин Д.Л., Бондаренко Г.Н., Яремко А.Б., Уварова Д.А. Метод секвенирования в видо-вой идентификации карантинных вредных организмов. Карантин растений. Наука и прак-тика, 2019, 28(2): 31-34.
- Honda-Takinami R., Hata J., Matsuoka K., Hoshi S., Koguchi T., Sato Y., Akaihata H., Kataoka M., Ogawa S., Nishiyama K., Suzutani T., Kojima Y. Association between the presence of bacteria in prostate tissue and histopathology in biopsies from men not complaining of lower urinary tract symptoms. Fukushima Journal of Medical Science, 2022, 68(3): 161-167 (doi: 10.5387/fms.2022-34).
- Минаева Л.П., Самохвалова Л.В., Завриев С.К., Стахеев А.А. Первое выявление гриба Fusarium coffeatum на территории Российской Федерации. Сельскохозяйственная биология, 2022, 57(1): 131-140 (doi: 10.15389/agrobiology.2022.1.131rus).
- Dorofeeva L.V., Evtushenko L.I., Krausova V.I., Karpov A.V., Subbotin S.A., Tiedje J.M. Rathayibacter caricis sp. nov. and Rathayibacter festucae sp. nov., isolated from the phyllosphere of Carex sp. and the leaf gall induced by the nematode Anguina graminis on Festuca rubra L., respectively. International Journal of Systematic and Evolutionary Microbiology, 2002, 52(6): 1917-1923 (doi: 10.1099/00207713-52-6-1917).
- Raghupathi P.K., Herschend J., Røder H.L., Sørensen S.J., Burmølle M. Draft genome assembly of two Pseudoclavibacter helvolus strains, G8 and W3, isolated from slaughterhouse environments. Genome Announcements, 2016, 4(2): e00077-16 (doi: 10.1128/genomeA.00077-16).
- Jendrossek D. Transfer of [Pseudomonas] lemoignei, a gram-negative rod with restricted catabolic capacity, to Paucimonas gen. nov. with one species, Paucimonas lemoignei comb. nov. International Journal of Systematic and Evolutionary Microbiology, 2001, 51(3): 905-908 (doi: 10.1099/00207713-51-3-905).
- Weller-Stuart T., De Maayer P., Coutinho T. Pantoea ananatis: genomic insights into a versatile pathogen. Molecular Plant Pathology, 2017, 18(9): 1191-1198 (doi: 10.1111/mpp.12517).
- Lu L., Chang M., Han X., Wang Q., Wang J., Yang H., Guan Q., Dai S. Beneficial effects of endophytic Pantoea ananatis with ability to promote rice growth under saline stress. Journal of Applied Microbiology, 2021, 131(4): 1919-1931 (doi: 10.1111/jam.15082).
- Miranda-Ríos J.A., Ramírez-Trujillo J.A., Nova-Franco B., Lozano-Aguirre Beltrán L.F., Itur-riaga G., Suárez-Rodríguez R. Draft genome sequence of Arthrobacter chlorophenolicus strain Mor30.16, isolated from the bean rhizosphere. Genome Announcements, 2015, 3(3): e00360-15 (doi: 10.1128/genomeA.00360-15).
- Liu F., Yang S., Xu F., Zhang Z., Lu Y., Zhang J., Wang G. Characteristics of biological control and mechanisms of Pseudomonas chlororaphis zm-1 against peanut stem rot. BMC Microbiology, 2022, 22(1): 9 (doi: 10.1186/s12866-021-02420-x).
- Hwang I.S., Oh E.J., Song E., Park I.W., Lee Y., Sohn K.H., Choi D., Oh C.S. An apoplastic effector Pat-1Cm of the gram-positive bacterium Clavibacter michiganensis acts as both a patho-genicity factor and an immunity elicitor in plants. Frontiers in Plant Science, 2022, 13: 888290 (doi: 10.3389/fpls.2022.888290).
- Park J.M., Koo J., Kang S.W., Jo S.H., Park J.M. Detection of Rhodococcus fascians, the caus-ative agent of lily fasciation in South Korea. Pathogens, 2021, 10(2): 241 (doi: 10.3390/patho-gens10020241).
- Sawada H., Fujikawa T., Tsuji M., Satou M. Pseudomonas allii sp. nov., a pathogen causing soft rot of onion in Japan. International Journal of Systematic and Evolutionary Microbiology, 2021, 71(1). (doi: 10.1099/ijsem.0.004582).
- Lipps S.M., Samac D.A. Pseudomonas viridiflava: An internal outsider of the Pseudomonas syrin-gae species complex. Molecular Plant Pathology, 2022, 23(1): 3-15 (doi: 10.1111/mpp.13133).
- Xin X.F., Kvitko B., He S.Y. Pseudomonas syringae: what it takes to be a pathogen. Nature Reviews Microbiology, 2018, 16(5): 316-328. (10.1038/nrmicro.2018.17).
- Zhuo Y., Jin C.Z., Jin F.J., Li T., Kang D.H., Oh H.M., Lee H.G., Jin L. Lacisediminihabitans profunda gen. nov., sp. nov., a member of the family Microbacteriaceae isolated from freshwater sediment. Antonie Van Leeuwenhoek, 2020, 113(3): 365-375 (doi: 10.1007/s10482-019-01347-8).
- Crovadore J., Calmin G., Chablais R., Cochard B., Schulz T., Lefort F. Whole-genome sequence of Pseudomonas graminis strain UASWS1507, a potential biological control agent and biofertilizer isolated in Switzerland. Genome Announcement, 2016, 4(5): e01096-16 (doi: 10.1128/ge-nomeA.01096-16).
- Sun H., Kong L., Du H., Chai Z., Gao J., Cao Q. Benefits of Pseudomonas poae s61 on Astragalus mongholicus growth and bioactive compound accumulation under drought stress. Journal of Plant Interactions, 2019, 14(1): 205-212 (doi: 10.1080/17429145.2019.1611958).
- Shen S.Y., Fulthorpe R. Seasonal variation of bacterial endophytes in urban trees. Frontiers in Microbiology, 2015, 6: 427 (doi: 10.3389/fmicb.2015.00427).
- Li X., Tambong J., Yuan K.X., Chen W., Xu H., Lévesque C.A., De Boer S.H. Re-classification of Clavibacter michiganensis subspecies on the basis of whole-genome and multi-locus sequence analyses. International Journal of Systematic and Evolutionary Microbiology, 2018, 68(1): 234-240 (doi: 10.1099/ijsem.0.002492).
- Сенников В.А., Ларин Л.Г., Россинская Т.М., Белолюбцев А.И., Коровина Л.Н. Колеба-ния и изменение климата Петровско-Разумовского за 125-летний период наблюдений. Известия Тимирязевской сельскохозяйственной академии, 2005, 1: 141-146.
- Белолюбцев А.И., Асауляк И.Ф. Агроклиматическое обеспечение продукционных процес-сов сельскохозяйственных культур в условиях центрального района Нечерноземной зоны. Известия Тимирязевской сельскохозяйственной академии, 2013, 4: 66-84.
- Думова В.А., Першина Е.В., Мерзлякова Я.В., Круглов Ю.В., Андронов Е.Е. Основные тен-денции в формировании почвенного микробного сообщества в условиях стационарного по-левого опыта по данным высокопроизводительного секвенирования библиотек гена 16S-рРНК. Сельскохозяйственная биология, 2013, 5: 85-92 (10.15389/agrobiology.2013.5.85rus).


