Выращивание Ipomoea batatas (L.) Lam. в условиях светокультуры in vitro и ex vitro
Автор: Калашникова Елена Анатольевна, Киракосян Рима Нориковна, Абубакаров Халид Геланьевич, Гущин Артем Владиславович, Слепцов Николай Николаевич, Темирбекова Сулухан Кудабердиевна, Глинушкин Алексей Павлович, Мелешина Ольга Викторовна, Ребух Назих Ясер, Тареева Марина Михайловна
Журнал: Овощи России @vegetables
Рубрика: Селекция и семеноводство сельскохозяйственных растений
Статья в выпуске: 6 (62), 2021 года.
Бесплатный доступ
Актуальность. В настоящее время особой популярностью пользуются продукты питания, в состав которых входят пребиотики, в частности, инулин. Интерес к данному веществу оправдан его ценными свойствами - он является хорошим иммуномодулятором, очищает организм от токсинов, радионуклидов, «плохого» холестерина, способствует усвоению полезных микроэлементов, необходимых для жизнедеятельности человека. Инулин содержится в таких растениях, как топинамбур, цикорий, а также в батате, популярность которого с каждым годом возрастает. Однако растения батата боятся холода и неморозоустойчивы. Поэтому создание новых сортов и гибридов, обладающих устойчивостью к пониженным температурам является актуальной проблемой. Клеточная биотехнология направлена на решение данной проблемы с применением методов клонального микроразмножения, клеточной селекции, соматической гибридизации и др. Для быстрого размножения и получения высококачественного посадочного материала применяют методы биотехнологии, в частности, клональное микроразмножение. Однако в этой технологии существуют трудности, связанные с плохой адаптацией микроклонов к условиям ex vitro. Этот факт вносит дополнительное требование к подбору оптимальных режимов укоренения in vitro и адаптации ex vitro микроклонов. Материал и методика. Целью работы было изучение влияния условий культивирования на укоренение in vitro и адаптации ex vitro микроклонов I. batatas (L.). Объектом исследования были микрочеренки батата, размноженные in vitro. Микрочеренки I. batatas культивировали in vitro на питательной среде, содержащей минеральные соли по прописи Мурасига и Скуга, а также различные ауксины. Изучали влияние красного (R) и дальнего красного (FR) света на укоренение микропобегов in vitro и адаптацию микроклонов ex vitro. Результаты. Экспериментально установлено, что выращивание микрочеренков на питательной среде, содержащей ИМК в концентрации 0,5-1 мг/л и в условиях освещения светодиодными лампами красного и дальнего красного света в равном соотношении, приводит к получению микроклонов с хорошо развитой корневой системой и надземной биомассой. Применение аэропонной установки на последнем этапе клонального микроразмножения позволяет получать высококачественный посадочный материал, способный хорошо переносить адаптацию к условиям открытого грунта.
Батат, регуляторы роста, спектральный состав света, светодиоды, микроклоны, аэропоника, in vitro, ex vitro
Короткий адрес: https://sciup.org/140290365
IDR: 140290365 | УДК: 635.22:581.1.043:573.6 | DOI: 10.18619/2072-9146-2021-6-22-29
Текст научной статьи Выращивание Ipomoea batatas (L.) Lam. в условиях светокультуры in vitro и ex vitro
Оригинальные статьи /Originalarticles
В настоящее время большой популярностью пользуются продукты питания диетического и функционального назначения,в состав которых входят различные пребиотики, антиоксиданты, клетчатка и др. Это связано, прежде всего, с изменением экологической ситуации в мире и необходимостью защиты человека и животных от внешних стрессовых факторов. Особый интерес привлекают продукты, содержащие инулин – природный полисахарид,син-тезируемый в растениях и не имеющий аналогов синтетического производства.Интерес к данному веществу оправдан его ценными свойствами. Благодаря инулину, который является естественным пребиоти-ком, улучшается перистальтика кишечника, пищева-рение,обеспечивается питание и рост ценных бифидобактерий, растущие колонии которых вытесняют патогенную флору и оздоравливают кишечник,стиму-лируя биохимические реакции пищеварения [1,2,3]. Кроме того, инулин является хорошим иммуномодулятором, очищает организм от токсинов, радионуклидов, «плохого» холестерина, способствует усвоению полезных микроэлементов,необходимых для жизнедеятельности человека (кальций, магний, железо, медь, фосфор и др.). Экспериментально доказано, что инулин не оказывает негативное влияние на организм человека.Поэтому его включают в состав гипоаллергенного детского питания для детей грудного возраста. Однако следует отметить, что в пищевой промышленности используют импортный инулин,так как его производство в России практически отсутствует.
В настоящее время глобализация и информационная революция обострили существенные проблемы мировой экономики.Данное обстоятельство необходимо учитывать в Российской Федерации,т.к.совре-менное развитие экономики страны связано с импор-тозамещением. Особую актуальность этот вопрос приобрел еще в 2015 году, когда США и страны Европейского союза и другие западные партнеры продлили экономические санкции против России. Поэтому необходимо пересмотреть системы управления производством и получать свою конкурентоспособную продукцию высокого качества. Данное направление приобретает особую актуальность и для производства продуктов питания функционального и диетического назначения.
В последнее время все чаще говорят о ценной сельскохозяйственной культуре – батат или сладкий картофель ( Ipomoea batatas (L.) Lam.). Интерес к данной культуре связан, прежде всего, с тем, что он является источником инулина. Батат внешне очень похож на картофель, но в реальности представляет собой нечто среднее между картофелем,морковью и тыквой.
Вопреки распространенному заблуждению батат с картофелем отнюдь не родственники. Картофель относится к семейству пасленовых,а батат – к семейству вьюнковых (ямсовых). Это многолетнее травянистое лиановидное растение любит мягкий теплый климат и выращивается обычно в тропических и субтропических странах, где достаточно влажный воздух способствует его активному росту. Батат боится холода и неморозоустойчив,лучше всего он себя чувствует при средней температуре от 20 до 30°С и обилии солнечного света.В этих условиях клубни батата вызревают в зависимости от сорта от 2 до 9 месяцев. Несмотря на то,что растение является многолетним, обычно батат возделывается как однолетняя культура.
Корнеплоды батата в зависимости от сорта значительно отличаются по форме,размеру и цвету.Масса одного «клубня» может варьировать от 200 г до 10 кг. Форма бывает шаровидной или веретеновидной, а цвет – от желто-коричневого до красного снаружи и белого, желтого, розовато-фиолетового, красноватого или оранжевого внутри. Существует довольно много сортов батата,но все их делят на две основные группы: овощные (обычно с желтоватой мякотью) и десертные (с цветом мякоти от розового до красного). Первые – менее сладкие – по вкусу похожи на подмороженный картофель, вторые напоминают тыкву, дыню, каштан и банан.
Основными производителями батата всегда считались Израиль и США, хотя сегодня свыше 80% его мирового урожая приходится на Китай. Батат прекрасно прижился в Японии,Южной Корее,а также на своей исторической родине – в Центральной и Южной Америке [4].
Ареал возделывания батата широкий.Его выращивают в странах Африки, Средней Азии, Перу, Колумбии, Китае и др. [5]. Что касается Российской Федерации,то батат выращивают в южных регионах с жарким климатом.
Однако при вегетативном размножении I. batatas L. часто происходит передача вирусов от растения-донора к новому посадочному материалу. Решить данную проблему можно с использованием биотехно-логии,в частности,метода клонального микроразмножения [6]. Кроме того, в культуре каллусных клеток in vitro возможно получать самоклоны и использовать их в классической селекции в качестве нового исходного материала [7,8]. Для I. batatas L. данное направление исследований приобретает особое значение, так как необходимо создавать новые сорта,обладаю-щие устойчивостью к низким положительным температурам для расширения ареала возделывания данной культуры в Российской Федерации.Поэтому разработка новых и эффективных методов размножения in vitro, регенерации растений из каллусной культуры, является актуальной задачей.
Для того, чтобы повысить эффективность производства, снизить материальные затраты, а также улучшить качество микроклонов,необходимо проводить оптимизацию технологии на каждом этапе клонального микроразмножения. Известно, что морфогенетический потенциал растений in vitro зависит от ряда взаимосвязанных факторов минеральной, гормональной и физической природы. Экспериментально доказано, что важное значение в регуляции морфогенеза оказывает система освещения. Спектральный состав света должны обеспечить наиболее благоприятные режимы для морфофизиологических ответных реакций исследуемых объектов на стресс [6]. В климатических камерах или световых комнатах для культивирования растений используют искусственные источ- ники света, например, люминесцентные лампы, натриевые лампы, металлогалогенные лампы и др. Самыми популярными и самыми распространенными являются люминесцентные облучатели. Однако, по мнению многих исследователей, эти источники, с одной стороны,имеют излишне широкий спектр длин волн, который находится в интервале 350-750 нм, с другой стороны,излучение имеет линейчатую структуру с неравномерно распределёнными пиками мощности излучения. Светодиодные источники света, получившие распространение, позволяют создавать линейчатые спектры с точно заданными соотношениями участков спектра. Кроме того, традиционные источники света потребляют больше электрической энергии,и при этом излучают больше тепла.Особый интерес представляют исследования по изучению влияния спектрального состава света на укоренение микроклонов и их адаптацию ex vitro.
Вопросы укоренения микроклонов in vitro и приживаемости их in vivo тесно связаны между собой, поскольку большие потери растительного материала могут происходить при переводе микрорастений в асептические условия.Это связано с тем,что микрорастения имеют слабо развитую листовую пластинку, недостаточную саморегуляцию транспирации и низкую фотосинтетическую активность, обусловленные преимущественно гетеротрофным способом питания in vitro [9,10]. Кроме того, гибель микроклонов при переносе их в условия ex vitro может происходить в результате того, что корни, сформировавшиеся в условиях in vitro , отличаются ломкостью и чувствительны к различным механическим повреждениям [9]. Недостаточное содержание питательных веществ,медленный начальный рост после пересадки растений из пробирок в контейнеры с субстратом, слабо развитая надземная и подземная части – не дает возможности вырастить высококачественный посадочный материал к началу периода вегетации. Использование технологий, основанных на выращивании растений без почвы в воздушной среде – гидропоники и аэропоники – позволяет не только решить данные проблемы, но и оптимизировать параметры роста,морфологические и физиологические процессы.
Исходя из вышеизложенного, цель работы – усовершенствовать технологию укоренения in vitro и адаптации ex vitro микроклонов I. batatas (L.)
Материалы и методы
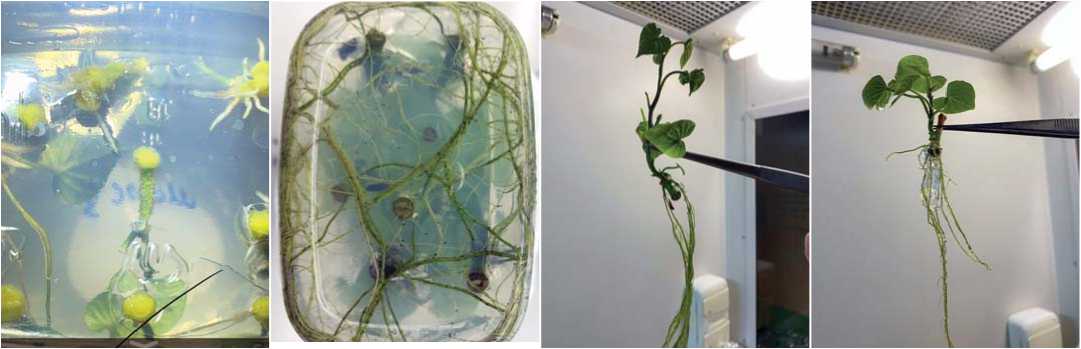
Объектом исследования служили неукорененные микропобеги I. batatas (L.) срт Jewel, размноженные in vitro (рис. 1).
Укоренение микрочеренков in vitro
Микропобеги культивировали на питательной среде,содержащей ½ нормы минеральных солей по прописи Мурасига и Скуга (МС) [11], 2% сахарозы, а также различные ауксины. В качестве ауксинов исследовали индолил-3-уксусную кислоту (ИУК) и индолилмасляную кислоту (ИМК) в концентрациях 0,5 и 1 мг/л. Выращивание микропобегов проводили в биологических пробирках в условиях световой комнаты, при температуре +21...23°C, 16-часовом

Рис.1.Исходный материал в экспериментах Fig.1.Source materialin experiments фотопериоде,при освещении белыми флуоресцентными лампами (марка «O SRA M A G», производство – Германия) с интенсивностью 3-3,5 тыс. люкс. Исследования проводили в соответствии с методиками, разработанными на кафедре биотехнологии РГАУ-МСХА имени К.А.Тимиязева [12].
Выращивание микрочеренков
в условиях светокультуры
Микрочеренки культивировали на двух вариантах питательных сред: 1)½ нормы минеральных солей по прописи МС, 2% сахарозы, ИМК 0,5 мг/л, 0,7% агара; 2) дистиллированная вода, ИМК 0,5 мг/л и 0,7% агара.
Исследуемые микрочеренки батата помещали в светонепроницаемые гроутенты (Urban G rower 60x60x200 см (G orshkoff, Россия)) с излучением, выровненным по плотности потока фотосинтетических фотонов, и различным соотношением уровней излучения в области 660 нм (R – красный) и 730 нм (FR – дальний красный). Контрольный вариант размещали в световой комнате,где было создано освещение белыми линейно-люминесцентными лампами (марка «O SRA M A G », производство – Германия) с интенсивностью 150 мкмоль/м2с.
Варианты соотношения R/FR:
R/FR = 1, PPFD = 142 (±10) мкмоль/м2с (рис. 2а)
R/FR = 1/2, PPFD = 142 (±10) мкмоль/м2с (рис. 2d)
R/FR = 2, PPFD = 142 (±10) мкмоль/м2с (рис. 2c)
Контроль: линейно-люминесцентные лампы, 4000К, PPFD 150 мкмоль/м2с (рис. 2d)
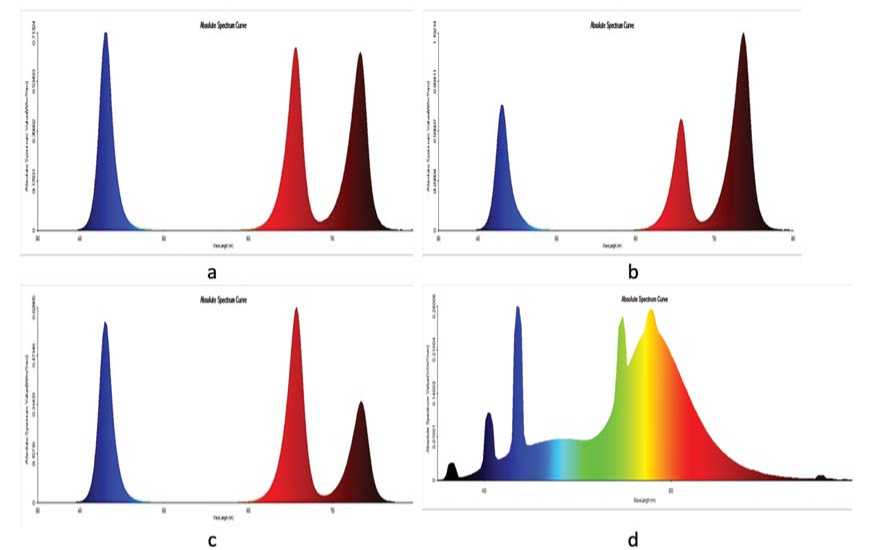
Рис.2.Варианты соотношения R/FR: а - R=FR,b - R
Fig.2.Variants ofthe R/FR ratio: a - R=FR,b - R
Измерения спектров излучения выполнены прибором PLA-20 (Everfine, Китай).
В конце цикла выращиванияучитывалиследующие показатели: число корней(шт),длина корней(см), количестволисть-ев (шт), площадь листьев (S) (cм2), высота побега (см).
Адаптация растений-регенерантов к условиям ex vitro
Адаптацию растений-регенерантов проводили двумя способами: на аэропонной установке и в почве.
Аэропоника основана на выращивании растений в воздушной или туманной среде без использования почвы или агрегатных сред. В качестве оборудования для адаптации микроклонов использовали GrowPlant X-Stream 120 (Нидерланды) – аэропонный клонер на 120 посадочных мест с системой орошения корневой зоны черенков или растений (Рис. 3). В комплектацию пропагатор «X-Stream 120» входит клонарий, рама для горшков, система распыления, и пробки из неопрена.
В аэропонной установке применяли гранулированное минеральное удобрение «Растворин» (Россия), в состав которого включены: калий(от18до28%),азот(8-18%),фосфор(5-18%), марганец 0,1%, бор 0,01%, медь 0,01%, цинк 0,01%, молибден 0,001%. Кроме удобрения «Растворин» в систему добавляли 3 жидких комплексных минеральных удобрения марки General Hydroponics серии FloraSeries - FloraGrow, FloraBloom, FloraMicro.
При выращивании микроклонов в условиях аэропоники использовали светодиодную подсветку, которая располагалась равномерно от ряда к ряду с регулируемым спектром освещения и интенсивностью до 300 µmol m-2 s-1.
В работе использовали подсветку светодиодными лампами красного (АХ 0]5 =646^674 nm, X max = 660 nm) и синего (АХ0] 5 =452^477 nm, X max =465 nm) спектра и 16-часовой фотопериод.
Оборудованием для адаптации микрорастений в почвенных условиях служила установка гидравлическая стеллажная УГС-4. Источником освещения служили натриевые лампы ДНаТ, мощностью400 Вт, цоколь Е40,установленные втепли-це.
В качестве субстрата при адаптации в почвенных условиях использовали готовый грунт «Универсальный» (Россия) торговой марки «Родная Земля»– высококачественный натуральный грунт многоцелевого назначения на основе торфа, полностью готовый к применению для выращивания ягодных, цветочных и декоративных культур. Содержание питательных

a b c
Рис.3.Пропагатор «X-Stream 120»: a – держатель для микроклонов, b – микроклоны перед адаптацией,c – внешний вид пропагатора «X-Stream 120» Fig.3.GrowPlant X-Stream 120: a – washers-holders,b – regenerating plants inholders, c – appearance ofthe propagator" X-Stream 120»
веществ, мг/л: суммарный азот (NH 4 +NO 3 ) – не менее 240, фосфор (P 2 О 5 ) – не менее 290, калий (К 2 О) – не менее 330.
Растения-регенеранты первоначально промывали раствором марганцовки (KMgO4) и пересаживали в пластиковые сосуды с заранее плотно набитым грунтом и сверху накрывали полиэтиленовым пакетом. В ходе процесса акклиматизации проводили опрыскивание растений и полив по мере необходимости.
Доращивание растений в условиях теплицы
После одного месяца адаптации микроклонов батата в условиях аэропоники и почвы, их переносили для доращивания в условия теплицы. Для этого использовали цветочные горшки объемом 5 л. В качестве субстрата использовали смесь, состоящую из биоперегноя универсального (фирма «Поля русские») и вермикулита (марка «Morris Green») в соотношении 1:3. Полив и опрыскивание осуществляли один раз в неделю. Ежедневно проводилиосмотр растений на наличие бактериальных и грибных болезней. В условиях теплицы поддерживали температуру +22oС и относительную влажностью воздуха 70-60%.
Выращивание микроклонов в открытом грунте
Полученные микроклоны батата высаживали в грунт после установления погоды без заморозков. Работа выполнена на территории опытного поля ФГБНУ ВНИИ Фитопатологии (ОПИ, Раменки, Одинцовского района, МО). Оптимальной для нормального развития считаетсятемпература в пределах +25…30oС.Дляуспешного выращивания растениютребуется плодородная почва, по составу достаточно легкая и дренированная. Кислотность должна быть в пределах 5,5-6,5 рН.
Статистическая обработка данных
Статистическая обработка результатов проведена по стандартным методикам [13]. Данные в таблицах приведены в виде среднеи ̆ арифметическои ̆ со стандартнои ̆ ошибкои ̆ (M±mM). Оценка различии ̆ выборочных средних проведена при значении доверительнои ̆ вероятности 0,95.
Результаты и обсуждение
Влияние ауксинов на укоренение микрочеренков батата invitro
Известно, что для формирования и оптимального роста корневой системы требуется применение ауксина. Однако экспериментально установлено, что от типа и концентрации исследуемого ауксина качество корневой системы укорененных побегов или черенков будет различным. Можно наблюдать формирование утолщенных корней, ломких, слабо развитых и др. Как правило, для укоренения in vivo и in vitro применяют ИУК или ИМК. Поэтому мы в своей работе изучали действие именно этих ауксинов (0,5 и 1 мг/л) на укоренение микропобегов батата in vitro.
Исследования показали, что независимо от применяемого ауксина и его концентрации на 10 сутки с начала культивирования наблюдали образование в базальной части микропобегов каллусной ткани светло-желтого цвета и плотной консистенции (рис. 4 a). В процессе культивирования каллусная ткань зеленела, и в ней закладывались меристемы корня, которые развивались в мощную корневую систему к концу цикла выращивания (рис. 4 b). Средняя длина корней соста-вила15-18 см насредес ИМК и на средес ИУК– 10-12см(рис. 4 c, d). Полученные данные согласуются с исследованиями Dugassa G., Feyissa T. [14] и Doliñski R., Olek O. [15]. Авторами показано, что для укоренения микрочеренков батата целесообразно применять ИМК в концентрации 0,5 мг/л. Однако в этих условиях культивирования длина корневой системы для исследуемых сортов батата не превышала 9-11 см.
Полученные в результате исследований растения-регенеранты, в дальнейшем использовали в работе по подбору оптимальных условий для их адаптации ex vitro .
Выращивание микрочеренков в условиях светокультуры
Исследования по влиянию света на микрочеренки растений in vitro с использованием светодиодов позволяют разработать режимы освещения на принципиально новом уровне, обеспечивая не только морфогенетическую активность эксплантов in vitro, но эффективную адаптацию микроклонов ex vitro .
Фитохромы – широко распространенное группа красных/дальне-красных чувствительных фоторецепторов, которые впервые были обнаружены у растений, где они составляют один изтрехосновных классов регуляторовфото-морфогенеза. Все фитохромы используют ковалентно присо-единенныехромофоры билина, которые обеспечивают фотоконверсию между краснопоглощающими (Pr) и дальнепогло-щающими (Pfr) формами. Таким образом, фитохромы являются фотопереключаемыми фотосенсорами; канонические фитохромы имеют консервативноеN-концевоефотосен-
abcd
Рис.4.Формирование каллусной ткани в базальной части микропобегов батата (а), формирование корневой системы (b)на среде,содержащей ИМК (с)и ИУК (d) Fig.4.Formation ofcallus tissue in the basalpartofsweet potato micro-shoots (a), formation ofthe root system (b),on a nutrientmedium containing BCI(c),BER(d)
сорное ядро и С-концевую регуляторную область, которая обычно включает в себя гистидинкиназный домен. Открытие новых бактериальных и цианобактериальных членов семейства фитохромов в течение последнего десятилетия значительно способствовало биохимической и структурной характеристике этой группы, причем первая кристаллическая структура фотосенсорного ядра бактериофитохрома появилась в2005 году.Этаструктура идругие недавние биохимические исследования позволили по-новому взглянуть на структуру фитохрома, процесс фотоконверсии, который является центральным для восприятия света, и механизм передачи сигнала этим важным семейством фоторецепторов [16]. Фитохром измеряет отношение красного света (R) к дальнему красному свету (FR), тем самым позволяя растению оценить количество фотосинтетическиактивного света и вызвать реакцию избегания тени [17].
Излучение в области FR очень плохо поглощается, и, следовательно, свет, который проходит через растительные объекты или отражается от них, обеднен R и значительно обога-щендлинами волн FR.Таким образом, полезным параметром для описания естественного освещения является отношение фотонной освещенности в R к таковой в FR (соотношение R: FR). Этот параметр часто напрямую определяется следующим соотношением [18]:
photon irradiance between 655 and 665 nm
R. : FR ratio = ------------------------------------------------------------------------------------------------- photon irradiance between 725 and 735 nm
Исследования по изучению влияния соотношенияR к FR на морфофизиологические показатели растений были проведены в условиях ex vitro на различных зеленых культурах (салат, крест-салат), пряных травах (базилик, руккола), овощных (томат, огурец), а также на плодово-ягодных культурах (малина, ежевика) [19]. Авторами показано, что соотношение крас- ного и дальнего красного света оказывает не однозначное влияние на ростовые и биохимические процессы, и исследования в этом направлении необходимодополнять результатами, полученными в контролируемых условиях in vitro. Наиболее изучено влияние СД-облучателей разного спектра действия – красного, синего, зеленого, оранжевого и др [20]. Авторы отмечают, что различные световые режимы оказывают стимулирующее действие на физиологические процессы в микрорастениях. Причем, основное действие режимов освещения направлено на формирование эффективно функционирующего фотосинтетического аппарата, с помощью которого клонированные растения будут более успешно преодолевать стресс, в том числе в ходе их акклиматизации к условиям ex vitro [21]. Что касается растений батата,то исследования такого рода ранее никем как в России, так и за рубежом не проводились.
Микрочеренки батата выращивали на двух вариантах питательной среды: содержащие минеральные соли по МС и не содержащие никаких солей (вода и агар). Контейнеры с эксплантами помещали в гроутенты, в которых соотношение красного(R) идальнекрасного(FR) находились в разныхсоот-ношениях. Основные биометрические показатели микрорастений по вариантам приведены в таблицах 1 и 2.
Из полученных результатов следует, что изученные режимы выращивания оказывают не однозначное влияние на морфометрические показатели микрорастений батата. Установлено, что при культивировании растений в более стрессовых условиях, например, на питательной среде, содержащей только воду и агар, действие спектрального состава проявляется более выраженно, по сравнению с питательной средой, содержащей минеральные соли по прописи МС. Так, в условиях отсутствия питания и при освещении R=FR все учитываемые показатели были в 1,5-2 раза выше,
Таблица 1. Влияние режимов выращивания на биометрические показатели микрорастений батата, культивируемых на среде МС [Table 1. Influence of growing modes on biometric indicators of sweet potato microplants cultivated on MS medium]
|
Показатели |
R |
R=FR |
R>FR |
Люминесцентные лампы (контроль) |
|
R/FR |
0,5 |
1 |
3 |
10 |
|
Ср. число корней, шт |
5,25 ± 0,25 |
3,75 ± 0,15 |
3,25 ± 0,16 |
3,75 ± 0,15 |
|
Средняя длина корней, см |
11,87 ± 0,63 |
14,37 ± 0,75 |
11,75 ± 0,60 |
12,25 ± 0,69 |
|
Среднее число листьев, шт |
4,25 ± 0,22 |
5,25 ± 0,20 |
4,00 ± 0,24 |
4,75 ± 0,21 |
|
S листа, cм2 |
3,23 ± 0,15 |
3,88 ± 0,15 |
2,89 ± 0,13 |
3,18 ± 0,14 |
|
Средняя длина побега, см |
1,87 ± 0,10 |
2,37 ± 0,12 |
1,80 ± 0,10 |
1,82 ± 0,12 |
Таблица 2. Влияние режимов выращивания на биометрические показатели микрорастений батата, культивируемых на воде [Table 2. Influence of growing modes on biometric indicators of sweet potato microplants cultivated on water
|
Показатели |
R |
R=FR |
R>FR |
Люминесцентные лампы (контроль) |
|
R/FR |
0,5 |
1 |
2 |
10 |
|
Среднее число корней, шт |
5,67 ± 0,38 |
4,33 ± 0,25 |
2,33 ± 0,15 |
2,25 ± 0,11 |
|
Средняя длина корней, см |
6,83 ± 0,30 |
11,75 ± 0,63 |
7,33 ± 0,33 |
7,62 ± 0,38 |
|
Среднее число листьев, шт |
2,00 ± 0,10 |
2,00 ± 0,10 |
1,33 ± 0,10 |
2,25 ± 0,11 |
|
S листа, cм2 |
4,51 ± 0,22 |
3,96 ± 0,15 |
6,11 ± 0,39 |
2,35 ± 0,12 |
|
Средняя длина побега, см |
0,95 ± 0,10 |
0,90 ± 0,10 |
1,33 ± 0,10 |
0,72 ± 0,10 |
чем в контрольном варианте (освещение люминесцентными лампами). В вариантах R
Что касается выращивания микрорастений на питательной средес минеральнойосновой МС,то существенный стимулирующий эффект был получен только в варианте освещения R=FR. Средняядлина корней выше контроля на 17%, среднее числолистьев– на 10%, площадьлистовой пластики– на22%, средняядлина побега– на 30%. Востальных вариантахучиты-ваемые показатели были ниже или на уровне контроля.
Таким образом, проведенные исследования позволили заключить, что для размножения и укоренения батата in vitro целесообразно применять освещение светодиодными лампами красного света (R) и дальнего красного света (FR) в равном соотношении.
Адаптация микроклонов батата
Успех клонального микроразмножения зависит, прежде всего, от правильного подбораусловий адаптации полученных микроклонов. На этом этапе необходимо создавать условия, обеспечивающие быстрый рост как корней, так и надземной части растений, а также восстановлению функции устьичного аппарата – регулирование транспирации [6]. Решение задачи взаимодействия клонального микроразмножения вусловиях in vitro и условий адаптации микрорастений в условиях позволит достигнуть синергетического эффекта, выраженного в получении посадочного материала высокого качества с наименьшими экономическими и временными затратами.
Наши исследования показали, что применение аэропон-ной установки привело к 100%-ой акклиматизации микроклонов батата к условиям ex vitro. В этих условиях наблюдали активный рост как надземной, так и корневой системы. Следует отметить, что на 7 сутки с начала адаптации микроклонов, длина корневой системы составил 25-28 см и была хорошо разветвленной, а средняя высота побегов составила 10-12 см. Работы по адаптации микроклонов батата на аэро-понных установках ранее никем не проводились. Что касается адаптации микроклонов батата в почвенных условиях, то числоадаптированных растений не превышало85%. Причем, рост надземной части был замедлен и формирование побегов высотой5-7 см было отмеченотолько на 14 сутки с начала адаптации. Полученные наши данные согласуются с результатами других авторов [1,2,5,8,14].
Таким образом, применение аэропонной установки на последнем этапе клонального микроразмножения позволяет снизить процент гибели растений,активизировать рост и развитие зеленной биомассы, а также корневой системы, что является необходимым условиемдля последующегохороше-го роста растений в условиях открытого грунта.
В дальнейшем адаптированные растения были перенесены в условия поля, где корневая система не заглублялась. Ее боковые ответвления, утолщаясь, превращаются в клубни. Для гарантии рекомендуем до устойчивого тепла укрывать пленкой или нетканым материалом.
Поливали умеренно, рыхлили грунт. При недостаточно жарких погодных условиях – температуре воздуха ниже25оС – корнеплоды этого теплолюбивого растения будут некрупными.
В процессе роста микроклоны батата прошли фазу вегетации и перешли в фазу цветения (рис.5).
Осенью, за 2 недели до сбора урожая полив прекращали. Сбор батата происходил вручную. Клубни подкапывали, отряхивали от грунта. Одновременно срезали плети. Урожай помещали в ящики. Собранный сухой батат лучше хранится. Очищенные и высушенные клубни могут храниться до весны. Форма плодов может быть округлой, конусообразной, веретенообразной. В среднем корнеплоды вырастают массой от 0,5 кг до 1,0 кг. Крупные экземпляры массой более 10 кг в основном используют для производства муки, крахмала, сахара, спирта, а также идут на корм скоту. Кожица у плодов тонкая. Поверхность, в отличие от картофеля, без глазков, может быть гладкой, шероховатой, слегка бугристой. Цвет кожицы корнеплода имеет различные оттенки красного и коричневого, но бывает и других цветов (рис. 6). Мякоть, как правило, мягкая и сочная, но может быть твердой и сухой. Мякоть десертных сортов имеет розовый, красный, фиолетовый окрас, но изредка может быть и белый. Цвет мякоти кормовых сортов как правило белая.


Таким образом, в результате проведенных исследований были определены наилучшие условия, обеспечивающие высокое укоренение микропобегов in vitro и адаптацию микроклонов I. batatas ex vitro .
Применение светокультуры и аэропонной технологии позволило получить высококачественный посадочный материал, способный расти в условиях Московской области.
Об авторах:
Elena A. Kalashnikova – Dr. Sci. (Biology),
Head of the Department of Biotechnology, Corresponding Author, ,
Rima N. Kirakosyan – Cand. Sci. (Biology), Associate Professor of the Department of Biotechnology, ,
Artem V. Gushchin – Assistant at the Department of Biotechnology, ,
Khalid G. Abubakarov – postgraduate student of the Department of
Sulukhan K. Temirbekova – Dr. Sci. (Biology), ,
Alexey P. Glinushkin – Dr. Sci. (Biology), Corresponding Member RAS,
Olga V. Meleshina – Cand. Sci. (Agriculture),
Список литературы Выращивание Ipomoea batatas (L.) Lam. в условиях светокультуры in vitro и ex vitro
- Adikini S., Settumba B.M., Mwanga R.O.M., Gibson R.W. Sweet potato cultivar degeneration rate under high and low potato virus disease pressure zones in Uganda. Canadian Journal of Plant Pathology. 2015;37(1):136-147.
- Onwubiko N.C., Ihezie C.I., Mozie M.U. In vitro Regeneration of Sweet Potato (Ipomoea batatas (L.) Lam.) from Node Explants. American Journal of Experimental Agriculture. 2015;8(2):87-92.
- Sihachakr D. Haïcour R., Cavalcante Aves J.M., Umboh I., Nzoghé D., Servaes A., Ducreux G.Plant regeneration in sweet potato (Ipomoea batatas L., Convolvulaceae). Euphytica. 1997;96(1):143-152.
- Abubakar A.S. Yahaya S.U., Shaibu A.S. In vitro propagation of sweet potato (Ipomoea batatas (L.) Lam.) cultivars. Agric. Sci. Digest. 2018;38(1):17-21. https://doi.org/10.18805/ag.D-128
- El-Afifi S.T., Zaghloul M.M., El Saady W.A., Mosaad F.S. Using tissue culture technique in micropropagation of sweet potato (Ipomoea batatas). Journal of Plant Production, Mansoura Univ. 2012;3(7):2201-2209.
- Калашникова Е.А. Клеточная инженерия растений. М.: Юрайт. 2020. 347 с.
- Gaba V.P. Plant growth regulators in plant tissue culture and development. Plant development and biotechnology, CRC Press. Boca Ratom. 2005. Р.87-99.
- Gubba A., Sivparsad B.J. Development of an efficient plant regeneration protocol for sweet potato (Ipomoea batatas L.) cv. Blesbok. African Journal of Biotechnology. 2002;11(84):14982-14987.
- Гущин А.В., Швец Д.А., Навроцкая Э.В. Применение аэропонной установки для адаптации клонированных растений. 2019. 116 с.
- Калашникова Е.А., Киракосян Р.Н., Чуксин И.С., Навроцкая Э.В., Аладина О.Н. Технология адаптации микроклонов Vitis vinifera к условиям ex vitro. Проблемы развития АПК региона. 2019;3(39):69-74.
- Murashige S., Skoog F. A revised medium for rapid growth and bioassays with tobac-co tissue cultures. PhysiolPlant. 1962;(15):473-497. https://doi.org/10.1111/j.1399-3054.1962.tb08052.x
- Калашникова Е.А., Чередниченко М.Ю., Киракосян Р.Н., Зайцева С.М. Лабораторный практикум по культуре клеток и тканей растений. М.: РГАУ-МСХА. 2017. 163 с.
- Лакин Г.Ф. Биометрия. М.: Высшая школа, 1990. 352 с.
- Dugassa G., Feyissa T. In vitro production of virus-free sweet potato [Ipomoea batatas (L.) Lam] by meristem culture and thermotherapy. Ethiop. J. Sci. 2011;34(1):17-28.
- Doliñski R., Olek O. Micropropagation of sweet potato (Ipomoea batatas (L.) Lam.) from node explants. Acta Sci Pol., Hortorum Cultus. 2013;12(4):117-127.
- Rockwell N.C., Yi-Shin Su, Lagarias J.C. Phytochrome structure and signaling mechanisms. Annual Review of Plant Biology. 2006;(57):837-858.
- Sage L.C. Pigment of the Imagination: A History of Phytochrome Research. San Diego: Academic Press, Inc. 1992. 562 pp.
- Bot A. Phytochromes and Shade-avoidance Responses in Plants. Annals of Botany. 2005;96(2):169-175.
- Тараканов И.Г., Яковлева О.С. Влияние качества света на физиологические особенности и продукционный процесс базилика эвгенольного (Ocimum gratissimum L.). Естественные науки. 2012;(3):95-97.
- Калашникова Е.А., Гудь Л.А., Анисимов А.А., Киракосян Р.Н., Васильев А., Тараканов И.Г. Влияние спектрального состава света на морфофизиологические показатели микроклонов малины и ежевики in vitro. Известия ТСХА. 2020;(2):54-63. https://doi.org/10.26897/0021-342X-2020-2-54-63
- Kim H.H., Goins G.D., Wheeler R.M., Sager J.C. Green-light supplementation for enhanced lettuce growth under red- and blue-light-emitting diodes. Hort. Sci. 2004;(39):1617-1622.


