Выраженность процессов перекисного окисления липидов и антиоксидантный потенциал у больных с распространенным раком яичников в динамике полихимиотерапии
Автор: Лебедева В.А., Пушкарев сВ., Сафронов И.Д., Трунов А.Н.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Экспериментальные исследования
Статья в выпуске: 2 (22), 2007 года.
Бесплатный доступ
Рассматриваются вопросы по изучению перекисного окисления липидов и антиоксидантной активности у больных с распространенным раком яичников при проведении полихимиотерапии. При этом выявлена активация процессов ПОЛ и достоверное снижение антиоксидантной активности. Полученные результаты позволяют высказаться о необходимости назначения антиоксидантной и сорбционной терапии.
Рак яичников, полихимиотерапия, перекисное окисление липидов
Короткий адрес: https://sciup.org/14054559
IDR: 14054559 | УДК: 618.11-006.6:
Текст научной статьи Выраженность процессов перекисного окисления липидов и антиоксидантный потенциал у больных с распространенным раком яичников в динамике полихимиотерапии
Актуальной проблемой современной онкогинекологии является увеличение частоты встречаемости злокачественных опухолей яичников, основную массу которых составляют процессы III–IV стадии [1, 9]. Несмотря на значительное количество исследований, посвященных данной проблеме, многие механизмы развития патологического процесса остаются до конца не изученными, а разработка патогенетических обоснованных методов ранней диагностики и лечения заболевания остаётся важной и приоритетной [3, 5]. Не вызывает сомнения тот факт, что в основе патогенеза злокачественных заболеваний, в том числе и рака яичников, лежат процессы, приводящие к нарушению целостности клеточных мембран. Одним из основных механизмов их разрушения является активация процессов перекисного окисления липидов (ПОЛ) и свободнорадикального окисления, которые еще более усугубляются при нарастании опухолевой массы [2, 6, 8].
Несмотря на то, что опухоли яичников чувствительны к проведению лекарственной полихимиотерапии, возможности ее ограничены у контингента с III–IV стадией в связи с токсическими осложнениями и выраженными нарушениями метаболических функций на уровне целостного организма [3, 4]. В сложившейся ситуации получается, что нарастание опухолевой массы в организме, с одной стороны, и токсическое воздействие самих лекарственных средств могут привести к утяжелению течения основного опухолевого заболевания [2, 6, 8]. Поэтому возникает необходимость разработки новых научно обоснованных подходов проведения полихимиотерапии рака яичников, основанных на использовании в схеме комплексного лечения препаратов, обладающих антиоксидантными и энтеросорбционными свойствами.
Цель исследования – изучить выраженность процессов перекисного окисления липидов и состояние антиоксидантной системы у больных раком яичников III–IV стадии в процессе лекарственного лечения.
Материал и методы
Для выполнения поставленной цели исследования было обследовано 118 женщин, из
Таблица 1
Содержание антиоксидантов в сыворотке крови у практически здоровых женщин и больных раком яичников III - IV стадии (M ±m)
|
Показатели |
β-каротин, мкг% |
Ретинол, мкг% |
α-токоферол, мг% |
Церулопламин, мг/л |
Лактоферрин, нг/мл |
|
Практически здоровые |
395 ± 3,07 |
57,4 ± 2,05 |
1,23 ± 0,045 |
382,2 ± 30,2 |
1100 ± 400 |
|
Больные раком яичников |
30,1 ± 3,34* |
41,7 ± 2,34* |
0,9 ± 0,074* |
293,4 ± 11,65* |
2138 ± 127* |
Примечание: * – различия статистически значимые по сравнению с группой практически здоровых женщин (p<0,05).
них 82 женщины были с диагнозом рак яичников III–IV стадии, средний возраст – 58,5 ± 1,15 года. Группу сравнения составили 36 практически здоровых жительниц города и области аналогичного возраста.
Клинический диагноз у обследуемых пациенток верифицировался при комплексном клиническом обследовании, с использованием дополнительных методов обследования (ультразвуковое исследование органов малого таза и брюшной полости, компьютерная томография, рентгенография органов грудной клетки, ректовагинальное исследование). Всем больным выполнены общие анализы крови и мочи, биохимические исследования крови (общий белок, альбумины, холестерин, триглицериды, мочевина, АСТ, АЛТ, электролиты Na и K), определение опухолевого маркера Са-125.
Заключительный диагноз выставлялся после гистологического подтверждения злокачественного процесса. В исследуемой группе больных в 8 % случаев наблюдения гистологически подтверждена гранулёзоклеточная опухоль, а у остальных пациенток диагностирована аденокарцинома.
Курсы полихимиотерапии (ПХТ) проводились по следующим схемам:
СР (циклофосфан – 800 mg в/в, в 1-й день; платидиам – 100 mg в/в, в 3-й день, длительность проведения 7 дней); CAP (циклофосфан – 800 mg, в/в, в 1-й день; платидиам – 100 mg, в/в, в 3-й день; доксорубицин – 50 mg, в/в, в 6-й день, длительность проведения 10 дней).
Состояние реакций ПОЛ в крови оценивали по содержанию малонового диальдегида (МДА) в сыворотке крови. Исследование показателей антиоксидантной защиты в крови включало:
-
– определение содержания жирорастворимых антиоксидантов (β-каротина, ретинола и α-токо-
- феpола) с помощью высокоэффективной жидкостной хроматографии в сыворотке крови.
-
- определение концентраций хелаторов ионов переменной валентности лактоферрина и церулоплазмина проводилось на тест-системах «Лактоферрин - стрип D-4156» производства Вектор-Бест и по методу H.A. Ravin в модификации С.В. Бестужевой, В.Г. Колб (1982) в сыворотке крови.
В работе использовались методы непараметрической статистики. Значимость различий вариационных рядов в связанных попарно выборках оценивалась с помощью U-критерия Вил-коксона–Манна–Уитни, корреляция показателей вычислялась по методу Спирмена. Анализ данных проводился с помощью пакета прикладных программ Statgrafics. Достоверным считали различие между сравниваемыми рядами с уровнем достоверной вероятности 95 % (р<0,05).
Результаты и обсуждение
В результате проведенных исследований была выявлена активация процессов ПОЛ у больных раком яичников. Содержание малонового диальдегида в сыворотке крови обследованных женщин составило 4,39 ± 0,185 нмоль/мл (р<0,05), а в группе практически здоровых женщин – 3,22 ± 0,093 нмоль/мл. Высокий уровень МДА в сыворотке крови отмечается у 73,2 % больных раком яичников III–IV стадии.
При оценке состояния антиоксидантной системы (табл. 1) было установлено, что у больных раком яичников III–IV стадии отмечается снижение в крови содержания β-каротина на 23,8 %, ретинола – на 27,4 % и α-токоферола – на 25,5 % по сравнению показателями в группе практически здоровых женщин.
При проведении сравнительного анализа, с учетом принципов Международной класси-
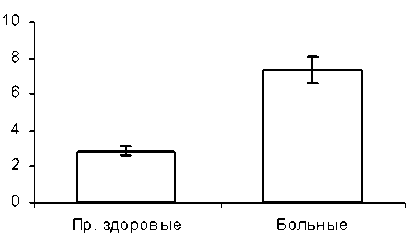
Рис.1. Величина соотношения лактоферрин/церулоплазмин у больных раком яичников III–IV стадии и практически здоровых женщин фикации питания, выделяющей пять статусов витаминной обеспеченности (дефицитный, маргинальный, нормальный, избыточный и токсический), было обнаружено, что суммарная величина гиповитаминозных (содержание ретинола < 40 мкг% и токоферола < 0,7 мг%) состояний в обследуемых группах варьирует от 27–41 % у больных раком яичников III–IV стадии, до 9–16 % у здоровых лиц.
В процессе изучения состояния следующего звена антиоксидантной системы (хеллаторов ионов металлов переменной валентности) было выявлено, что уровень активности церулоплазмина в сыворотке крови у больных раком яичников на 23,3 % ниже, а лактоферрина на 94,4 % выше, чем в контрольной группе (табл. 1). При этом следует отметить, что в крови церулоплазмин совместно с трансферрином (лактоферрином) образуют молекулярную систему, регулирующую концентрацию восстановленных ионов железа (Fe2+) и определяющую суммарную антиоксидантную активность (АОА) сыворотки в отношении Fe2+-индуцированного ПОЛ. В присутствии восстановителей из трансферрина (лактоферрина) высвобождается Fe2+, который окисляется церулоплазмином в Fe3+, при этом концентрация Fe2+ определяется соотношением трансферрин/церулоплазмин [2, 6, 8].
При расчете соотношения лактоферрин/церу-лоплазмин (рис. 1) было обнаружено, что данная величина у больных в 2,5 раза больше (p<0,05), чем в группе практически здоровых женщин. Это, в свою очередь, может косвенно свидетельствовать о высоком уровне ионов Fe2 + , обладающих выраженным прооксидантным потенциалом. Корреляционная связь между содержанием лактоферрина и церулоплазмина в крови у больных раком яичников III–IV стадии имеет достоверный отрицательный характер (r = - 0,52, p<0,05).
Таким образом, представленные результаты свидетельствуют о том, что одним из ведущих механизмов патогенеза рака яичников распространенных форм является окислительный стресс, характеризующийся резким увеличением в крови продуктов ПОЛ и истощением антиоксидантной защиты и, в первую очередь, компонентов жирорастворимого звена (β-каротин, ретинол, α-токоферол).
Следующим этапом исследования явилось изучение особенностей реакций ПОЛ и механизмов регуляции их активности в организме больных распространенным раком яичников при проведении курсов ПХТ. Было установлено, что содержание МДА в сыворотке крови (4,31 ± 0,16 нмоль/мл) после 3-го курса ПХТ достоверно (р<0,05) превышает аналогичную величину в группе больных, не получавших цитостатики (3,89 ± 0,15 нмоль/мл). Высокий уровень МДА
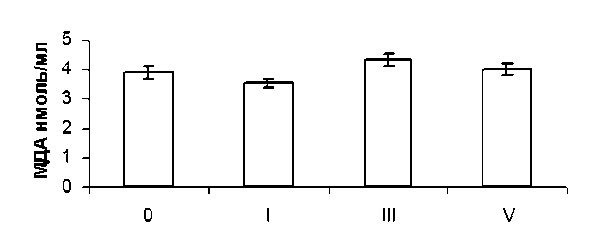
Рис. 2. Содержание МДА в сыворотке крови у больных раком яичников III–IV стадии в зависимости от количества курсов полихимиотерапии:
0 – уровень МДА до лечения; I, III, V – после соответствующих курсов ПХТ
Таблица 2
Содержание антиоксидантов в сыворотке крови у больных раком яичников III–IV стадии (n=50) в процессе ПХТ (M + m)
|
Показатели |
β-каротин, мкг% |
Ретинол, мкг% |
α-токоферол, мг% |
Церулоплазмин, мг/л |
Лактоферрин, нг/мл |
|
До ПХТ |
34,4 ± 4,11 |
40,4 ± 2,91 |
0,99 ± 0,09 |
292 ± 17,9 |
2287,5 ± 206 |
|
1-й курс ПХТ |
31,7 ± 2,52 |
42,3 ± 2,87 |
0,81 ± 0,07 |
286,1,± 23,1 |
1958,9 ± 297 |
|
3-й курс ПХТ |
25,2 ± 2,57* |
39,8 ± 3,84 |
0,89 ± 0,08 |
274,1 ± 21,1 |
1497,7 ± 189* |
|
5-й курс ПХТ |
23,9 ± 1,67* |
34,4 ± 2,53* |
0,79 ± 0,09* |
312,3 ± 20,2 |
1616,7 ± 196* |
Примечание: * – различия статистически значимые по сравнению с исходными показателями до начала ПХТ (p<0,05).
в сыворотке крови у больных женщин сохраняется и после проведения 5-го курса ПХТ (4,0 ± 0,17 нмоль/мл), что, по всей вероятности, отражает прооксидантный эффект действия цитостатических препаратов (рис. 2).
При оценке состояния антиоксидантной системы было установлено, что у больных раком яичников отмечается снижение в крови содержания β-каротина после проведения 3-го и 5-го курсов ПХТ на 27 % и 31 %, а ретинола и α-токоферола после 5 курса соответственно на 15 % и 20 %, по сравнению с аналогичными показателями в группе больных, не получавших цитостатическую терапию. Прогрессировавшее в динамике ПХТ снижение «средних» значений концентрации жирорастворимых антиоксидантов у больных наблюдалось и при анализе уровня хеллаторов ионов металлов переменной валентности (табл. 2).
В процессе специального лечения уровень лактоферрина в сыворотке крови у больных раком яичников снижается после 3-го курса ПХТ на 34,5 %, а после 5-го курса ПХТ на 29,3 %, что может привести не только к неконтролируемой интенсификации ПОЛ, но и к изменению целого ряда лактоферрин зависимых реакций: неспецифического иммунитета, гемостаза и миелопоэза и др. Следовательно, при проведении лечебных курсов ПХТ у больных раком яичников III–IV стадии происходит рост активности реакций ПОЛ и снижение содержания антиоксидантов в крови.
Таким образом, основываясь на литератур- ных данных и собственных результатах, можно утверждать, что одним из неспецифических патогенетических механизмов канцерогенеза является окислительный стресс [6, 7]. Его проявление в организме больных сопровождается развитием дисбаланса в системе «ПОЛ – антиоксиданты» и утяжелении течения основного заболевания. Уровень баланса в соотношении «ПОЛ – антиоксиданты» является важным прогностическим критерием, который может использоваться как в диагностике, так и на этапах лечения злокачественных опухолей яичников.


