Высокая суммарная доза облучения улучшает выживаемость больных локализованной формой мелкоклеточного рака легкого: результаты одноцентрового ретроспективного анализа
Автор: Скрипчак Ю.В., Кононова Г.В., Асахин С.М., Левит М.Л., Гагарина Т.Ю., Пушкарева И.К., Вальков М.Ю.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 (55), 2013 года.
Бесплатный доступ
Проведено ретроспективное изучение общей выживаемости больных Л-МРЛ, получавших не менее 2 курсов химиотерапии и дистанционную ЛТ в СОД не менее 50 Гр на первичный очаг. Больные группы СОДст (n=71) получили облучение грудной клетки в стандартно рекомендованной дозе, в группе СОДэск (n=69) суммарная доза составляла 60–74 Гр по биологическому эквиваленту. Лучевую терапию в режиме ускоренного фракционирования с эскалацией дозы (УГФЭД) чаще применяли в группе СОДэск. Более 1, 3 и 5 лет жили пациенты из группы СОДэск и СОДст соответственно в 54 % (95 % ДИ 42–65 %) и 32 % (95 % ДИ 23–44 %), р=0,11; в 25 % (95 % ДИ 16–36 %) и 1 % (95% ДИ 0–8 %), р=0,0003; в 17 % (95 % ДИ 10–28 %) и 0 % (95 % ДИ 0–5 %) случаях (р=0,0007). Медиана выживаемости в группах составила 14 (95 % ДИ 10–17 мес) и 9 (95 % ДИ 8–11 мес) мес, χ 2=16,8, р
Локализованный мелкоклеточный рак легкого, лучевая терапия
Короткий адрес: https://sciup.org/14056303
IDR: 14056303 | УДК: 616.24–006.6–036.8:615.849.1
Текст научной статьи Высокая суммарная доза облучения улучшает выживаемость больных локализованной формой мелкоклеточного рака легкого: результаты одноцентрового ретроспективного анализа
Раком легкого ежегодно заболевают более чем 50 тыс. человек в РФ, а в мире – более 1,2 миллиона. В общей структуре мировой и российской онкологической заболеваемости эта опухоль занимает первое место [1, 2, 13]. Мелкоклеточный рак легкого (МРЛ) составляет 18–25 % всех случаев рака легкого, его доля в последние десятилетия снижается. Только треть из обратившихся за помощью имеют локализованное поражение (Л-МРЛ).
При Л-МРЛ ведущим методом лечения, как и при диссеминированной форме, является химиотерапия, включающая дуплеты либо три препарата. Стандартным и наиболее популярным режимом химиотерапии в настоящее время является сочетание платины и этопозида [3, 18–20]. Согласно данным рандомизированных исследований и метаанализов, доказанной является польза облучения (ЛТ) грудной клетки. Это приводит к увеличению 2-летней выживаемости на 5,4 % [16]. Стандартными схемами ЛТ на сегодня являются 50–54 Гр в режиме традиционного фракционирования (ТФ) и 45 Гр в режиме ускоренного гиперфракционирования [12, 22].
Большинство больных Л-МРЛ погибают от прогрессирования опухоли, причем в 50 % случаев, в том числе и локального, в пределах поля облучения. В связи с этим в ряде нерандомизированных исследований были предприняты попытки увеличения суммарной дозы на первичный очаг в грудной клетке как в режиме ТФ [17, 21], так и с использованием нетрадиционного фракционирования [7]. В настоящее время ведутся два рандомизированных исследования, изучающих такую возможность [10].
В клинике Архангельского клинического онкологического диспансера (АКОД) с 1996 г. применяется схема ускоренного гиперфракционирования с эскалацией дозы, характеризующаяся более высокой биологически эквивалентной суммарной дозой (БЭД), чем рекомендованные [2]. Она была введена в локальные стандарты лечения в 2002 г.
Цель исследования – ретроспективный анализ выживаемости больных Л-МРЛ в зависимости от БЭД облучения в составе схем химиолучевого лечения.
Материал и методы
В исследование включали больных Л-МРЛ, получавших химиолучевое лечение в условиях АКОД с марта 1991 г. по декабрь 2006 г. Основными критериями отбора были локализованная форма МРЛ (М0) и получение химиолучевой терапии. Специальными дополнительными критериями отбора для ЛТ была доза облучения не ниже 50 Гр по биологическому эквиваленту для традиционного фракционирования, для ХТ – не менее 2 курсов химиотерапии не менее чем двумя препаратами в стандартных дозах. Профилактическое облучение головного мозга после достижения полной или практически полной регрессии опухоли было вве- дено в стандарты лечения Л- МРЛ в АКОД после 2005 г. и допускалось в исследовании.
Лучевую терапию проводили на гамма-терапевтических установках РОКУС-АМ (Равенство, СПб.) и линейном ускорителе электронов Clinac 2100 C (Varian, USA). Согласно стандарту лечения, принятому в ГБУ АО АКОД , в объем облучения входят область первичного очага и зоны регионарного лимфатического метастазирования. Элективное облучение средостения при отсутствии признаков медиастинальных метастазов проводят всем больным. Отступы для компенсации субклинического микроскопического распространения, неточностей в воспроизведении укладок и смещения опухоли вследствие дыхательных движений составляют 2–3 см в верхне-нижнем и 1,5–2 см в передне-заднем и медиально-латеральном направлении. Лимфатические узлы надключичной области со стороны поражения облучают только в случае их метастатического поражения. Облучение осуществляли по 2D методике с двух встречных полей. Сокращение полей до размеров, соответствующих размерам исходной первичной опухоли и регионарных метастазов, предпринимается по достижении дозы 40–44 Гр либо ее биологического эквивалента.
В исследование включались больные, получившие суммарную дозу облучения не ниже стандартной, подведенную в режимах традиционного фракционирования (ТФ) и ускоренного гиперфракционирования с эскалацией дозы (УГФЭД). Облучение в режиме ТФ проводили по 2 Гр ежедневно 5 раз в нед. Схема УГФЭД состоит в двукратном в день облучении с промежутком между дневными фракциями 5–7 ч. Первоначально разовая доза составляет 1,4 Гр, затем, по достижении СОД 42 Гр и сокращения полей, ее увеличивают до 1,6 Гр. Суммарно в режиме УГФЭД подводили дозу 64,4–67,2 Гр, что эквивалентно 71–74 Гр, подведенным в режиме ТФ [11].
Химиотерапию осуществляли отдельно от ЛТ. В соответствии с установленной в ГБУ АО АКОД программой радикального лечения при Л-МРЛ проводят 2 индукционных и 2–4 консолидирующих курса не менее чем двумя препаратами. До 2000 г. это были, как правило, циклофосфан 1000 мг/м2, доксорубицин 40 мг/м2 и винкристин 1 мг/м2 (CAV), либо метотрексат 30 мг/м2 (САМ) каждые 28 дней. После 2000 г. применяется главным образом схема PE – цисплатин 100 мг/м2 в 1-й день и этопозид по 100 мг в 1, 2, 3-й дни каждые 21–28 дней. Кроме того, про- водилась химиотерапия по схемам ТС (паклитаксел 135 мг/м2 в 1-й день и карбоплатин AUC 5 мг/м2в 1-й день каждые 3–4 нед), GP (гемцитабин 1000 мг/м2 в 1-й и 8-й дни и цисплатин 70 мг/м2 в 1-й день каждые 3–4 нед), IP (иринотекан 60 мг/м2 в 1, 8 и 15-й дни и цисплатин 60 мг/м2 в 1-й день каждые 3–4 нед).
В соответствии с целью исследования отобранных для анализа больных Л-МРЛ разделили на 2 группы. Группа 1 – облучение с эскалацией дозы до СОД, превышающей 58 Гр на первичный очаг (СОДэск). Группа 2 (контрольная) – химиолучевая терапия с облучением до стандартной дозы 50–58 Гр в пересчете на традиционное фракционирование (СОДст).
Распределения больных в группах по качественным и порядковым признакам оценивали с помощью критерия χ2, по непрерывным – с помощью критерия Стьюдента либо его непараметрического аналога – U-теста Манна–Уитни. Все сравнения были двусторонними. Статистически значимым уровнем различий установлено значение р<0,05.
Основным критерием эффективности лечения была принята общая выживаемость больных, рассчитанная как временной промежуток между датой установления диагноза и датой смерти от любой причины. Выживаемость больных оценивали путем построения таблиц дожития (life tables), графически представляли в виде кривых Каплана–Майера, сравнивали между группами с помощью лог-рангового критерия. Цензурирование проводили по дате последней проверки базы канцер-регистра либо по дате последней явки на контрольный осмотр. Выживаемость представляли в виде Ме (95 % доверительный интервал (95 % ДИ)), кумулятивную выживаемость – в виде % (95 % ДИ). Оценку влияния на общую выживаемость исходных факторов (демографических, характеризующих опухоль и лечение) осуществляли с помощью регрессии Кокса. Введение переменных в модель осуществляли форсированным методом.
Результаты и обсуждение
Всего для анализа отобрано 140 больных Л-МРЛ (табл. 1). Из них 71 – получил суммарную дозу ЛТ на область опухолевого поражения в диапазоне
Таблица 1
|
Признак |
Доза облучения на опухоль, иГр |
р |
|
|
60–74 (СОДэск) |
50-59 (СОДст) |
||
|
Возраст, лет |
|||
|
До 40 |
1 (5,8 %) |
1 (1,4 %) |
0,053 |
|
40–49 |
13 (18,8 %) |
17 (23,9 %) |
|
|
50–59 |
18 (26,1 %) |
32 (45,1 %) |
|
|
60–69 |
30 (43,5 %) |
19 (26,8 %) |
|
|
70 и старше |
4 (5,8 %) |
2 (2,8 %) |
|
|
Пол |
|||
|
Женский |
4 (5,8 %) |
3 (4,2 %) |
0,717 |
|
Мужской |
65 (94,2 %) |
68 (95,8 %) |
|
|
Стадия |
|||
|
I |
9 (13,0 %) |
9 (12,7 %) |
0,993 |
|
II |
14 (20,3 %) |
14 (19,7 %) |
|
|
III |
46 (66,7 %) |
48 (67,6 %) |
|
|
Клинико-анатомическая форма |
|||
|
Периферический рак |
6 (8,7 %) |
8 (11,3 %) |
0,780 |
|
Центральный рак |
63 (91,3 %) |
63 (88,7 %) |
|
|
Фракционирование |
|||
|
ТФ |
28 (40,6 %) |
65 (91,5 %) |
<0,0001 |
|
УГФЭД |
41 (59,4 %) |
6 (8,5 %) |
|
|
Всего |
69 (100 %) |
71 (100 %) |
|
Таблица 2
|
Выживаемость, лет |
Доза облучения на опухоль, иГр |
р |
|||||
|
60–74 (СОДэск) |
50–59 (СОДст) |
||||||
|
% |
ДИ- |
ДИ+ |
% |
ДИ- |
ДИ+ |
||
|
1 |
53,6 |
42,0 |
64,9 |
32,4 |
22,7 |
43,9 |
0,1083 |
|
2 |
29,0 |
19,6 |
40,6 |
7,0 |
3,0 |
15,5 |
0,0048 |
|
3 |
24,6 |
16,0 |
36,0 |
1,4 |
0,3 |
7,6 |
0,0003 |
|
4 |
21,7 |
13,6 |
32,8 |
0,0 |
0,0 |
5,1 |
0,0002 |
|
5 |
17,4 |
10,2 |
28,0 |
0,0 |
0,0 |
5,1 |
0,0007 |
Распределение больных Л-МРЛ по исходным характеристикам
Показатели кумулятивной выживаемости больных Л- МРЛ в зависимости от изоэффективной суммарной дозы на опухоль
50–58 Гр по биологическому эквиваленту (1-я группа), 69 больных – 60–74 Гр по изоэффекту. Больные в анализируемых группах были равномерно распределены по основным критериям, определяющим прогноз, – стадии, полу, клиникоанатомической форме Л-МРЛ. Более пожилые пациенты получали облучение в повышенной суммарной дозе. При этом повышенная по сравнению со стандартно рекомендуемой суммарная доза значимо чаще была подведена в режиме ускоренного гиперфракционирования.
Медиана времени последующего наблюдения к моменту анализа составила 140 мес, при этом 134 пациента погибли, из них 71 (100 %) – в группе
СОДст, 63 (91 %) – в группе СОДэск (табл. 2). Показатели кумулятивной выживаемости в группе СОДэск были статистически значимо более благоприятными по сравнению с таковыми в группе СОДст, начиная со второго года наблюдения. Более 5 лет были живы 12 (17,4 %) больных, получивших повышенные дозы ЛТ, и ни одного – в стандартной группе. Медиана выживаемости в группах составила соответственно 13,5 (95 % ДИ, 9,5–17,4) мес в группе СОДэск и 9,0 (95 % ДИ, 8,8–11,2) мес в группе СОДст, χ2=16,8, р<0,0001 (рис. 1).
Учитывая ретроспективный характер исследования и неравномерность в распределении больных в группах по возрасту и режиму фракционирова-
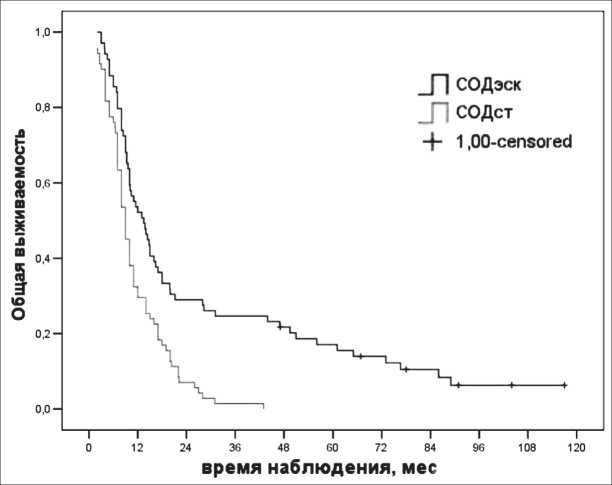
Рис. 1. Показатели общей выживаемости у больных локализованным МРЛ в зависимости от способа лучевой терапии СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2013. № 1 (55)
Результаты регрессионного анализа
Таблица 3
|
Фактор |
Нескорректированные |
Скорректированные |
|||||||
|
ОР |
ДИ- |
ДИ+ |
р |
ОР |
ДИ- |
ДИ+ |
р |
||
|
1 |
СОД 60 Гр и более |
0,48 |
0,33 |
0,69 |
0,000 |
0,57 |
0,37 |
0,88 |
0,012 |
|
2 |
УГФЭД |
0,53 |
0,37 |
0,77 |
0,001 |
0,75 |
0,47 |
1,21 |
0,239 |
|
3 |
Женский пол |
0,53 |
0,23 |
1,21 |
0,132 |
0,72 |
0,30 |
1,69 |
0,445 |
|
4 |
Возраст >65 лет |
1,25 |
0,82 |
1,92 |
0,299 |
1,01 |
0,63 |
1,60 |
0,975 |
|
5 |
III стадия |
1,26 |
0,88 |
1,79 |
0,203 |
1,04 |
0,72 |
1,50 |
0,834 |
|
6 |
Центральный рак |
0,55 |
0,31 |
0,99 |
0,045 |
0,57 |
0,31 |
1,05 |
0,072 |
Примечание: референтные группы: 1. Стандартная (50–59 Гр) СОД. 2. Традиционное фракционирование. 3. Мужской пол. 4. Возраст моложе 65 лет. 5. I–II стадия. 6. Периферический РЛ.
ния, проведен регрессионный анализ (табл. 3). При первичном анализе значимое положительное влияние на прогноз имели повышенная, по сравнению со стандартной, суммарная доза облучения, режим фракционирования УГФЭД и центральная локализация Л-МРЛ. После коррекции по другим факторам статистически значимое влияние на прогноз оказала только суммарная доза ЛТ: при СОД 60 иГр и выше ОР составило 0,57 (95 ДИ, 0,37–0,88), что соответствует снижению риска смерти от любой причины на 43 .
В настоящем ретроспективном исследовании показано, что суммарная доза облучения на опухоль может быть значимым фактором прогноза при локализованной форме мелкоклеточного рака легкого: при дозе на опухолевый очаг, по биологическому эффекту составлявшей 60 Гр и более, больные Л-МРЛ имели более низкий риск смерти от любой причины по сравнению со стандартной дозой. Химиотерапия является основным методом лечения МРЛ, однако при локализованной его форме облучение первичного очага и зон регионарного лимфооттока приводит к увеличению 2-летней выживаемости на 5,4 % [16]. Применение ЛТ на грудную клетку в настоящее время входит в рекомендованный стандарт лечения при Л-МРЛ.
При этом, однако, существуют вопросы, требующие решения в научных исследованиях, к ним относят и величину суммарной дозы облучения. Современный стандарт дозы основан на результатах наиболее успешных опубликованных рандомизированных клинических исследований. Это ставший классическим режим [22] ежедневного двукратного в день облучения по 1,5 Гр за 30 фракций, на фоне химиотерапевтического дуплета, начиная со второго цикла химиотерапии, и ранее установленный во многих исследованиях стандарт дозы при использовании однократного в день облучения до эквивалента 50 Гр в режиме ТФ [4, 14]. Будет ли эффективным дальнейшее повышение дозы – покажут результаты двух рандомизированных исследований, которые в настоящее время проводятся в Европе и США [10].
В нескольких исследованиях было изучено влияние дозы на противоопухолевый эффект лечения. Например, в рандомизированном исследовании [8] сравнивали противоопухолевую эффективность суммарных доз 25 и 37,5 Гр на грудную клетку разовыми фракциями 2,5 Гр, что выше традиционного размера фракции 1,8–2,0 Гр. Актуарная частота внутригрудного прогрессирования была значимо выше у больных, получивших СОД 25 Гр – 80 %, против 69 % при СОД 37,5 Гр. В другом ретроспективном исследовании увеличение частоты внутригрудного локального контроля при Л-МРЛ наблюдали после повышения СОД с 30 до 50 Гр [6]. Через 2,5 года после лечения локальный контроль в группе пациентов, получивших СОД 30 Гр, составлял 16 % по сравнению с 63 % у пациентов, получавших облучение в дозе 50 Гр. В третьем исследовании локальный контроль достигал 96 % после СОД, эквивалентной 60 Гр [15].
Максимально переносимая доза при ТФ одновременно с химиотерапией платиной и этопозидом, согласно данным исследования 1-й фазы, проведенного Группой В по изучению рака и лейкемии (CALGB), может быть выше 70 Гр, для режима ускоренного гиперфракционирования с разовой дозой 1,5 Гр, подводимой дважды в день, она равна 45 Гр [7].
Целью настоящего исследования было изучение общей выживаемости больных Л-МРЛ. Этот крите- рий эффективности включает в себя и локальный контроль, и риск смерти от токсичности, и от отдаленных метастазов, что, учитывая высокий риск смерти больных, является наиболее адекватной оценкой эффекта лечения. Суммарная доза в диапазоне 60–74 Гр по изоэффекту привела к снижению риска смерти от любой причины на 43 % (ОР – 0,57) по сравнению со стандартной. Ретроспективный характер исследования не позволяет оценить вклад каждого из компонентов (локальный контроль, риск отдаленного прогрессирования, токсичность).
Еще одним важным фактором, определяющим эффективность современной ЛТ при химиолу-чевом лечении Л-МРЛ, является использование нетрадиционного фракционирования. Ускоренное гиперфракционирование (УГФ), согласно радиобиологическим предпосылкам [9], снижает риск ускоренной репопуляции клоногенов опухоли за счет сокращения общего времени лечения, однако, при этом наблюдается повышение острой токсичности. Два опубликованных рандомизированных исследования по сравнению схем УГФ с традиционными показали конфликтующие результаты.
В исследовании A.T. Turrisi et al. [22] продемонстрировано преимущество в выживаемости у больных, получавших УГФ по 1,5 Гр дважды в день ежедневно до 45 Гр по сравнению с 45 Гр за 25 фракций в течение 5 нед. В обеих группах облучение начиналось одновременно с первым из 4 запланированных курсов ХТ по схеме PE. Более 5 лет живы 26 % и 16% больных соответственно. Эзофагит III степени и выше чаще встречался в группе УГФ – 27 % против 11 %.
В исследовании NCCTG 262 больных были рандомизированы на получение ЛТ в режиме однократного (50,4 Гр за 28 фракций) и двукратного в день (48 Гр за 32 фракции с двухнедельным перерывом после 24 Гр) дистанционного облучения, начинавшегося вместе с четвертым из 6 запланированных курсов PE. Двухлетняя выживаемость в группах была аналогичной – 45 % и 47 %, что, по мнению многих экспертов, может быть следствием расщепления схемы УГФ [5].
В нашем исследовании при многофакторном анализе не удалось продемонстрировать преимущества схемы УГФЭД перед ТФ (ОР – 0,75 (ДИ 0,47–1,21), р=0,239). Причиной этого может быть то, что по локальным стандартам АКОД ЛТ начиналась в последовательном режиме после 2–4
курсов химиотерапии, когда ускоренная репопуляция клоногенов была включена, и общее время облучения было не столь определяющим фактором. В целом показатели 5-летней выживаемости в основной группе (17,4 %) сопоставимы с лучшими результатами опубликованных исследований, что свидетельствует об эффективности высоких доз ЛТ при лечении Л-МРЛ.
Недостатком настоящего исследования является ретроспективный характер. Учитывая нерегулярный и отрывочный характер записей о токсичности лечения, трудно было учесть этот фактор. Кроме того, базы данных популяционного регистра не содержат важных сведений об исходном состоянии больных и дефиците массы тела. Эти показатели в большой степени определяют прогноз жизни больных. Однако достаточно жесткие критерии отбора в этот анализ (СОД ЛТ не менее 50 Гр и не менее 2 курсов ХТ в лечебной дозе), вероятно, позволили избежать попадания больных с оценкой по ECOG менее 2 и выраженным дефицитом массы тела в анализ.
Еще одним фактором, отрицательно влияющим на валидность анализа, служит длительное время набора больных в исследование. Пациенты на ранних стадиях набора с большей вероятностью могли иметь отдаленные метастазы по сравнению с обследованными с помощью МСКТ в последние годы. Использование релевантных методов статистического анализа, сравнительно большая для такой редкой патологии популяция больных позволяют частично нивелировать эти указанные недостатки.
Все вышесказанное обусловливает необходимость проведения проспективного рандомизированного исследования для проверки гипотезы о большей эффективности более высокой суммарной дозы при Л-МРЛ. Однако, учитывая то, что подходящие больные встречаются достаточно редко (в Архангельской области – в среднем 7 пациентов в год), требуется кооперация нескольких центров.
Таким образом, в настоящем ретроспективном исследовании показано, что увеличение суммарной дозы выше стандартно рекомендуемых 50–58 Гр может привести к улучшению выживаемости больных Л-МРЛ. Окончательное подтверждение этой гипотезы возможно только в рамках проспективного рандомизированного исследования.


