Высокие технологии в микробиосепарации (по материалам обзора ж. "Electrophoresis", 2004 г.)
Автор: Беленький Б.Г.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Материалы научного семинара "Микрочиповые технологии в аналитической химии"
Статья в выпуске: 3 т.15, 2005 года.
Бесплатный доступ
Настоящая статья является авторизованным переводом с англ. яз. обзора [1] Yan Li с соавторами "Капиллярная электрохроматография пептидов и белков" (Electrophoresis, 2004). В статье дается обзор последних достижений в биоанализе с использованием капиллярной электрохроматографии (КЭХ) в разделении белков и пептидов. Кратко рассмотрены основные принципы КЭХ. Большое внимание уделяется разработке новых стационарных фаз и новых конструкций колонок, указываются их достоинства и недостатки. Рассмотрены появившиеся в последнее время новые технологии изготовления колонок для КЭХ, прежде всего монолитных, которые должны обеспечить высокую скорость и эффективность разделения. Представлены различные аналитические платформы КЭХ: КЭХ c использованием давления, высокоэффективная микрожидкостная хроматография (микро-ВЭЖХ) с использованием электрического напряжения, на микрочипах и многомерная электрохроматография. Рассматриваются различные методы детектирования, в первую очередь масс-спектрометрия (гибридные приборы с встроенным микрофлюидным чипом).
Короткий адрес: https://sciup.org/14264393
IDR: 14264393 | УДК: 543.544:
Текст научной статьи Высокие технологии в микробиосепарации (по материалам обзора ж. "Electrophoresis", 2004 г.)
Высокие технологии в современной микробиосепарации представлены капиллярной электрохроматографией (КЭХ) пептидов и белков, монолитными стационарными фазами для хроматографии, в частности последним достижением в этой области — монолитными КЭХ-колонками, созданием новых аналитических платформ для разделения пептидов и белков методом КЭХ: на микро-чиповых платформах, многомерной КЭХ, новыми методами детектирования в КЭХ, прежде всего с использованием времяпролетного масс-спектрометра (МС) с устройством электроспрей-ионизации (ЭСИ). Развитием в КЭХ пептидов и белков сегодня является создание гибридного жидкостного хромато-масс-спектрометра для протеомики на основе гибридной конструкции: высокоинформативного МС-МС с инсталлированным микрофлюидным чипом, интегрирующим устройство ввода пробы, колонки для монолитной КЭХ с устройством ЭСИ.
Капиллярная электрохроматография появилась в последние годы как микроколоночный электро-кинетический метод разделения, сочетающий в себе две хорошо известные аналитические технологии — микровысокоэффективную жидкостную хроматографию (µ-ВЭЖХ) и капиллярный электрофорез (КЭ).
Программа исследования генома человека близка к завершению. Однако она представляет собой лишь первый шаг в изучении клеточных функций и функций более высоких порядков. Для достижения их полного понимания необходим системный анализ белков. Исследование полного комплемента клеточных белков — протеомика, зависит от разработки усовершенствованных методов биосепарации и других аналитических методов. Поскольку КЭХ сочетает в себе высокую эффективность, ультрачувствительность, минимальный расход реагентов и пробы и хорошую совместимость с высокоинформативной суперчувствительной масс-спектрометрией, она хорошо подходит для применения в протеомике.
Течение жидкости через колонку в КЭХ происходит под действием электрического поля. В появившихся к настоящему времени нескольких обзорах по КЭХ внимание концентрировалось на теории и механизмах КЭХ [2–4], аппаратуре [5] и ряде впечатляющих применений [6–8]. Однако в немногих работах рассматривалась КЭХ для анализа пептидов и белков. Колонки для КЭХ классифицируются в обзоре по режимам разделения и механизмам генерации электроосмотического потока (ЭОП), а не по материалам насадки. В обзоре представлены основные принципы КЭХ и развития КЭХ на базе высоких технологий, даются примеры применения современной КЭХ в анализе пептидов и белков.
ОСНОВНЫЕ ПРИНЦИПЫ КЭХ
Транспортные функции в КЭХ осуществляются за счет т. н. электроосмотического потока (ЭОП). Его особенности определяются свойствами электролита: вязкостью и диэлектрической постоянной, дзета-потенциалом Z на поверхности внутренних стенок капилляра или насадки. Линейная скорость ЭОП u описывается уравнением Смолу-ховского:
U = _ «.ME, (1) П где е0, ег — диэлектрическая проницаемость в вакууме, относительная проницаемость среды; η — ее вязкость и E — напряженность электрического поля. Это выражение относится к движению жидкости вблизи плоской поверхности с равномерно распределенным зарядом при приложении электрического поля, параллельного этой поверхности.
Для пористых сред, обычно используемых в КЭХ, возможны и другие модели ЭОП. Выражение для средней линейной скорости ЭОП u r в насадочных колонках записывается следующим образом [9]:
u r = u p
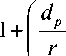
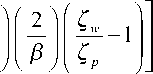
где u r — средняя скорость; u p — скорость электроосмотического потока, генерируемого на поверхности насадки колонки, определяемая выражением (3); d p — диаметр частиц наcадки; r — радиус капиллярной колонки; Z w — дзета-потенциал на стенке капилляра; Z p — дзета-потенциал материала насадки; в — безразмерный параметр, определяемый выражением (4).
а где аь дочной
и
р
еоеЛ pE а
п
I аь )
,
— отношение электропроводностей наса-
( ст *) и полой ( a b ) колонок.
в = з ,
где е с — общая пористость колонки; а — безразмерный параметр, зависящий от структуры насадки и формы частиц.
Электроосмотическая движущая сила дает плоский профиль потока с пониженным размыванием зон по сравнению с ВЭЖХ, в которой пуазейлев-ский поток имеет параболический профиль. Считается, что плоский профиль (так называемая "пробка") частично объясняет более высокую эффективность КЭХ по сравнению с ц -ВЭЖХ. Недавно получены оценки для размывания зон в КЭХ и ц -ВЭЖХ [10] по упрощенному уравнению Ван-Димтера:
H = A + — + Cu . (5) U
Член А в выражении (5) характеризует "вихревую диффузию" (размывание за счет профиля скорости). Найдено, что из-за плоского профиля ЭОП в КЭХ член С , описывающий дисперсию зон, связанную с сопротивлением межфазному массопе-реносу, меньше, чем в µ-ВЭЖХ. Уменьшение членов А и С в уравнении Ван-Димтера приводит к уменьшению высоты теоретической тарелки, т. е. в некоторой степени увеличению эффективности колонок в КЭХ. Кроме того, из-за отсутствия перепада давления в КЭХ-колонке ее длину можно увеличить, а размер частиц уменьшить до субмикронного уровня.
Обычно считается, что разделение пептидов и белков в КЭХ осуществляется в результате наложения хроматографического удерживания и электрофоретической миграции. В действительности
чаще всего разделение связано только с одним из указанных факторов. Описанные процессы могут проходить и последовательно, поэтому может осуществляться двухмерное разделение в одной колонке.
Недавно в работе [4] на основании модели случайных блужданий моделирован механизм разделения заряженных пептидов и белков в КЭХ. Предполагается, что в достаточно сильных электрических полях ионизированные компоненты пробы могут мигрировать не только в объемном растворе, но в адсорбированном состоянии на ионизированной поверхности стационарной фазы. Для описания этого явления были введены три безразмерных параметра, связанных следующей зависимостью:
в cec
в 1с
1 + « ( YP ic +( 1 - Y )) ,
где в сес — коэффициент удерживания в КЭХ (определяется выражением (7)); а — приведенная подвижность компонента пробы (скорость электрофоретической миграции, отнесенная к электроосмотической подвижности, U em / U p ); e lc — коэффициент удерживания в изократической µ-ВЭЖХ, который определяется выражением (8); y — отношение скорости поверхностной электродиффузии Uec к скорости электрофоретической миграции U em .
Коэффициенты удерживания определяются:
в сес = t cec/ = 1 + k сес , (7) t 0
в 1с = tk/t = 1 + k c • (8) t 0
Миграционное поведение заряженных компонентов пробы, например пептидов и белков, описывается с помощью вышеприведенных выражений в трех разных режимах разделения:
– "в одном направлении", когда электрофоретическая миграция компонентов пробы происходит в направлении ЭОП;
– "встречных направлениях", когда электрофоретическая миграция пробы проходит в направлении, противоположном направлению ЭОП;
– комбинированном одно- встречнонаправленном режиме, когда проба включает компоненты, мигрирующие как в направлении ЭОП, так и противоположном направлении.
Согласно этой модели, в колонке КЭХ создается [4] внутренний градиент, который способствует фокусировке пиков и повышению эффективности этого метода.
Таким образом, сочетание электрофоретической миграции в подвижной фазе с поверхностной электродиффузией в стационарной фазе делает
КЭХ уникальным высокоселективным инструментом разделения пептидов и белков.
КОЛОНОЧНЫЕ ТЕХНОЛОГИИ В КЭХ БЕЛКОВ И ПЕПТИДОВ
Если классифицировать КЭХ стационарной фазы, все равно в круглых или прямоугольных капиллярах (микрофлюидных чип-анализаторах), то можно выделить два типа колонок: полые (ОТ-СЕС) [11] и насадочные (РС-СУС) [12].
Обзор прежде всего касается цилиндрических колонок для КЭХ, которыми комплектуются приборы высокоэффективного капиллярного электрофореза (превращая их в капиллярные электрохроматографы). Это происходит прежде всего потому, что цилиндрические колонки изучены гораздо лучше (о них известно гораздо больше), чем новые прямоугольные колонки для микрофлюидных чип-анализаторов. С другой стороны, особенности цилиндрических колонок позволяют лучше понять технологические и аналитические возможности прямоугольных колонок микрофлюидных чипов.
Для разделения пептидов и белков рекомендуется использовать полые колонки с пористым слоем (PLОT). Насадочные колонки (HK) набиваются либо гранулированным (сферическим) сорбентом, заключенным между двумя фриттами (НК с гранулированным наполнителем), либо сплошным (монолитным) материалом, и тогда использование фритты уже не требуется (монолитная колонка).
Стационарная фаза в КЭХ выполняет две функции: во-первых, содержит центры удерживания компонентов пробы, а во-вторых, обеспечивает размещение фиксированных зарядов для генерации ЭОП. Хотя разрабатывались новые стационарные фазы для КЭХ-биоанализа [7], их использование для разделения пептидов и белков было ограниченным. Основные препятствия для применения КЭХ в протеомике заключались в необратимой адсорбции пептидов и белков на стенках капилляров из кварцевого стекла без покрытия и/или на поверхности материала насадки колонок и в электростатическом взаимодействии заряже-ных функциональных групп пептидов и белков с необходимыми для создания ЭОП заряженными материалами насадки. Эти особенности колонок приводят к появлению хвостов у пиков, снижающих эффективность колонок и воспроизводимость времени удерживания.
Полые колонки с пористым слоем
В полой колонке с пористым слоем (PLОT) для КЭХ тонкий пористый слой стационарной фазы связывается (ковалентными связями, либо нековалентными взаимодействиями) с внутренней стен- кой капилляра из кварцевого стекла. Поэтому для КЭХ получили признание PLOT-колонки [11], у которых на внутренней стенке кварцевого капилляра содержится большое количество силанольных групп, которые депротонируются в широком диапазоне рН фонового электролита. Последнее может привести к необратимой адсорбции пептидов и белков на стенках капилляров. Для исключения этого явления ведутся работы, направленные на снижение силанофильных эффектов и тем самым на улучшение характеристик колонок для КЭХ пептидов и белков [13–16]. Для этого на внутренних стенках капилляров ковалентно связываются или адсорбируются полимерные модификаторы с пространственно большими группами, такие как полиакриламид, полиэфир, поливиниловый спирт и т. п., чтобы воспрепятствовать контакту между отрицательно заряженными силанолами и положительно заряженными пептидами.
Недавно появился новый вид PLOT-колонок [14] для КЭХ пептидов и белков с увеличенной площадью хроматографической поверхности благодаря формированию на внутренних стенках кварцевого капилляра толстого шероховатого полимерного слоя путем полимеризации in situ ди-винилбензола и винилбензилхлорида в 2-октанольном растворителе. Поверхностные хлороме-тильные группы этого полимера обрабатываются алкиламинами для получения длинных алкильных цепочек в качестве центров гидрофобного удерживания и образования четвертичных аммониевых групп для создания стабильного ЭОП. Механизм разделения у этого вида PLOT-колонок основан на сочетании хроматографического и электрофоретического процессов.
На рис. 1 приведена полученная на растровом электронном микроскопе микрофотография цилиндрической полой колонки с пористым слоем. На подобных колонках с полиаспарагиновой кислотой (РАА) [15] ряд белков разделялись в изо-кратическом режиме с эффективностью в 10– 100 раз выше, чем в ВЭЖХ, и разрешением, сравнимым с разрешением градиентной ВЭЖХ. Для уменьшения влияния силанолов на стенках капилляров на разделение белков в качестве привитых полимерных пористых слоев использовалось множество синтетических полимерных покрытий, например полисахарид-декстран [16], полиакриламид [17], гидроксилированный полиэфир [18], по-ливинилметилсилоксандиолполиакриламид [19], полиакрилоиламиноэтоксиэтанол [20], поливиниловый спирт [21], полиаргинин [22], ацетат целлюлозы [23] и полиэтилен-пропиленгликоль [24]. После подобной обработки в капилляре все-таки еще остаются свободные силанольные группы. Таким образом, улучшение стабильности покрытий и снижения влияния силанольных групп — вот пути дальнейшего развития технологии PLOT-
Рис. 1. Электронная микрофотография полой колонки с пористым слоем, полученная на растровом электронном микроскопе. Воспроизводится по работе [14]
колонок для КЭХ. Хотя структура подобных PLOT-колонок характеризуется высокой проницаемостью, их низкое фазовое отношение приводит в этом виде КЭХ к низкой емкости и, таким образом, к снижению чувствительности детектирования.
Насадочные колонки с гранулированной насадкой
Большинство использовавшихся до настоящего времени колонок для КЭХ заполняются в качестве стационарной фазы гранулированными материалами и называются набивными колонками с гранулированной насадкой. В этих колонках используется удерживающая слой сорбента фритта, которую обычно формируют путем сплавления материала насадки. Насадочные колонки обеспечивают лучшее удерживание и более высокую эффективность, чем PLOT-колонки, причем гранулированные материалы насадки, используемые во многих колонках КЭХ, — это те же материалы, что и обычно применяемые в ВЭЖХ-колонках, например, для обращенно-фазной (О-Ф) и ионообменной хроматографии. Хотя при разделении синтетических полимеров, например полистиролов [25], в КЭХ используется вытеснительная электрохроматография, для разделения пептидов и белков она еще не применялась. В КЭХ использовались также сегментированные насадочные колонки с гранулированной насадкой и стационарные фазы смешанного типа, например сильный катионообменник (SCX) в комбинации с обращенно-фазным сорбентом.
Обращенно-фазная электрохроматография
Чаще всего колонки КЭХ заполняются обращенно-фазными материалами. В большинстве работ по О-Ф КЭХ используются частицы кремнезема диаметром 3–5 мкм, модифицированные С18 и гораздо реже С8. Наиболее широко используемые промышленно выпускаемые сорбенты перечислены в табл. 1. Характеристики удерживания линейных и циклических пептидов в КЭХ на колонках с применением С8 и С18 гранулированных сорбентов исследовались в работах [26–28]. Величины удерживания и избирательность КЭХ значительно отличаются от соответствующих величин как при капиллярном зонном электрофорезе (КЗЭ), так и О-Ф ВЭЖХ. Можно считать, что подобная КЭХ представляет собой метод разделения, ортогональный обоим указанным методам.
Ионообменная электрохроматография
Хроматографическая поверхность в ионообменной КЭХ покрыта фиксированными зарядами, которые создают ЭОП и связывают противоположно заряженные компоненты. Основной недостаток ионообменных материалов на основе кремнезема состоит в зависимости ЭОП от рН подвижной фазы. Чтобы избежать этого в ионообменной КЭХ для увеличения поверхностного заряда используются сильные и слабые анионо- и катионо-обменники: SCX, SAX, WCX, WAX [29–31], которые широко применялись при разделении электрически заряженных пептидов и белков в ионообменных насадочных колонках с гранулированной насадкой. При этом кремнийсодержащая основа сначала покрывается слоем "мягких" гидрофильных полимеров, уже на которые прививаются ионогенные группы. Поэтому белковые вещества взаимодействовуют с заряженными функциональ-
Табл. 1. Наиболее широко используемые выпускаемые промышленностью обращенно-фазные материалы насадок для КЭХ
Описано использование SCX [29] для разделения небольших пептидов типа (Gly) n , (Glu) n и (Ala) n на уровне базовой линии при эффективности КЭХ на уровне 460 000 тарелок/м, при этом высокая скорость ЭОП сохранялась в широком диапазоне рН. Подобная эффективность объясняется электрофоретическим концентрированием (стэкингом) и хроматографической фокусировкой во время инжекции и разделения пептидов с положительным зарядом, как это показано на рис. 2. Разделение десяти пептидов в этой колонке требовало менее 3.5 мин.
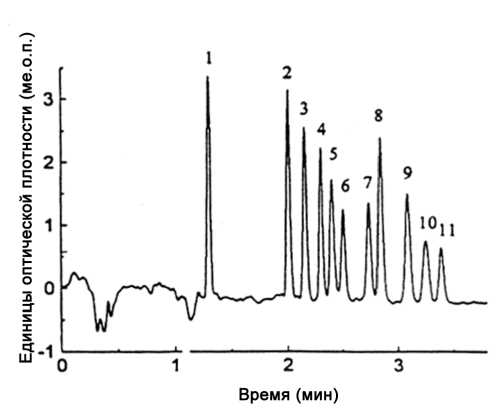
Рис. 2. Хроматограмма смеси, содержащей десять пептидов. Ионообменная колонка для капиллярной электрохроматографии с внутренним диаметром 75 мкм и внешним диаметром 375 мкм, заполненная Spherisorb(ом) — сильным катионообменни-ком; длина заполненной части и общая длина 10 см и 31 см соответственно. Условия эксперимента: подвижная фаза — 60 % ацетонитрила в 30 мМ буфере KH 2 PO 4 (рН 3.0); приложенное напряжение 25 кВ; электрокинетическая инжекция при напряжении 5 кВ в течение 10 с; УФ-детектирование на длине волны 200 нм. Пики: 1 — бензиловый спирт; 2 — Gly-Gly; 3 — Gly-Tyr; 4 — Ala-Ala-Ala; 5 — Gly-Gly-Gly; 6 — Ala-Ala-Ala-Ala; 7 — Gly-Gly-Gly-Gly; 8 — Gly-Gly-Asn-Ala; 9 — Gly-Gly-Gly-Gly-Gly-; 10 — Glu-Glu-Glu-; 11 — Gly-Gly-Gly-Gly-Gly-Gly. Воспроизводится по работе [29]
Для разделения кислых белков разработан новый сильный гранулированный анионообменник на основе кремнезема [30]. Для этого стационарная фаза и внутренние стенки капилляра вначале силанизировались, а затем дериватизировались с использованием 3-(метакрилойламино)-пропил-триметил-аммоний хлорида для присоединения групп с сильными анионообменными свойствами к гидрофильному слою на хроматографической поверхности (см. рис. 3). Для ионообменной КЭХ белков в изократическом режиме получено выражение, определяющее разрешение электрохроматографического процесса. Применение этой фазы в КЭХ на основе SAX расширено на разделение разновидностей гликоформ белков и триптических гидролизатов белков.
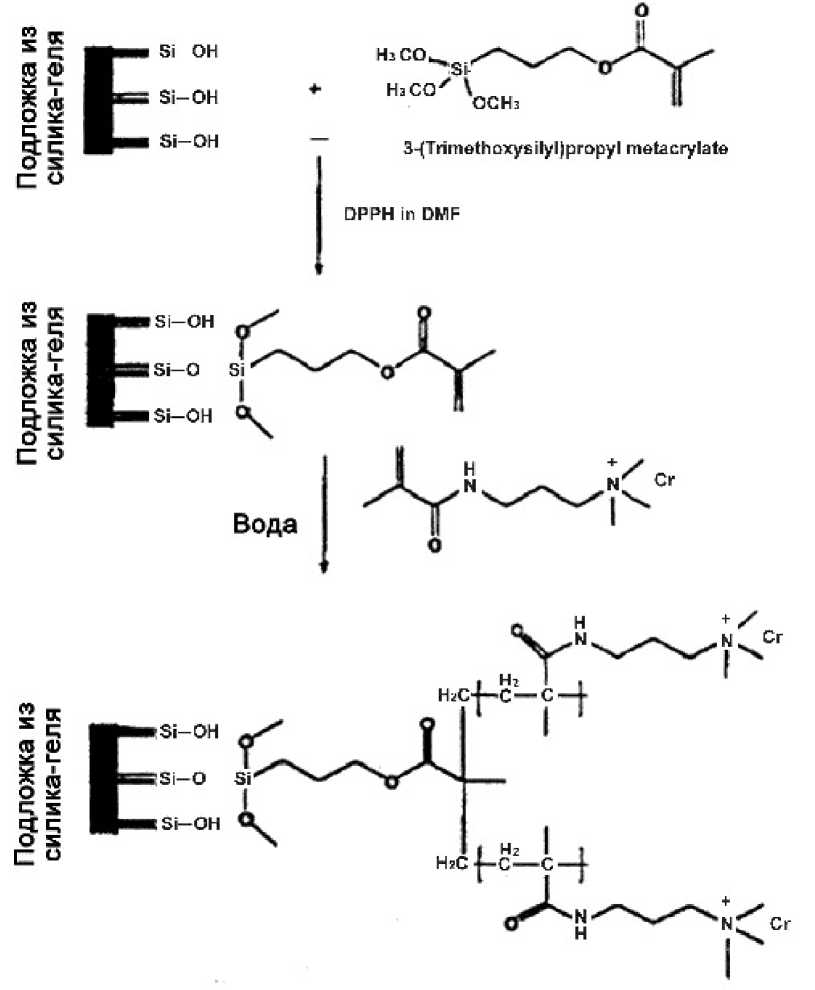
Рис. 3. Схема химических реакций для подготовки хроматографической колонки с гранулированной набивкой. Воспроизводится по работе [30]
Помимо ионообменных материалов на основе SCX и SAX использовались сорбенты на основе WCX и WAX, которые связывались с поверхностью кварца. Для уменьшения сильного электростатического взаимодействия основных пептидов и белков с анионными группами на поверхности кремнеземной стационарной фазы разработана на основе слабого катионообменника новая стационарная фаза для разделения основных пептидов и белков. Используя эту фазу экспериментально изучен механизм удерживания основных пептидов в КЭХ [31]. Эти ионообменные КЭХ-колонки обеспечивали постоянный сильный стабильный ЭОП в широком диапазоне рН.
При КЭХ выделяется создаваемое в результате повышенной ионной силы буфера джоулево тепло. Этот возмущающий эффект накладывается на электростатические взаимодействия. Последнее может препятствовать применению ионообменной КЭХ для разделения пептидов и белков.
Сегментированные колонки и стационарные фазы смешанного типа
Недавно предложен подход, позволяющий увеличить скорость ЭОП [32]. Для этого капилляры для КЭХ составлялись из двух частей (сегментов), которые заполнялись разными стационарными фазами для управления и регулировки ЭОП. Колонки такого типа называются сегментированными капиллярами [32] или сегментированными колонками, в которых один сегмент заполняется одним видом стационарной фазы для разделения, а другой, вспомогательный сегмент, — другим видом стационарной фазы, например ионообменником для генерации ЭОП. Так как при изготовлении колонок с гранулированной насадкой предусматривается полая часть в качестве окна детектирования, она может служить и в качестве отдельного участка для ускорения ЭОП. Схематическое изображение сегментированных колонок показано на рис. 4. В сегментированных колонках может быть точно отрегулирована избирательность КЭХ для пептидов и белков путем изменения длины различных сегментов насадочных колонок КЭХ.
Предложены колонки и со стационарными фазами смешанного типа, сочетающими О-Ф и ионообменные сорбенты [26, 28]. Поскольку стационарные фазы смешанного типа всегда содержат обращенную фазу, например алкильные цепочки, взаимодействующие с гидрофобной частью пептидов и белков, и ионообменник, поддерживающий стабильный ЭОП в широком диапазоне рН, они позволяют разделять анализируемые вещества с помощью двух видов хроматографии и электрофоретической миграции. Недавно исследовались процессы удерживания линейных и циклических пептидов в КЭХ на фазах смешанного типа, содержащих сильный катионообменник (сульфокис- лоту) и n-алкильные группы [26, 28]. Подобные колонки Spherisorb смешанного типа (С18 О-Ф/SCX) использовались для разделения пептидов на основе гидрофобных и ионообменных взаимодействий и электрофоретической миграции.
Монолитные колонки
Надежность и воспроизводимость колонок сильно зависят от технологии их изготовления. Однако изготовление узкофракционированных микрочастиц и набивка ими капиллярных колонок требует высокой квалификации оператора и специализированного оборудования. Кроме того, фритта, используемая для удерживания насадки, способствует появлению центров зарождения пузырьков воздуха, приводящих к нестабильности базовой линии, прерыванию тока в системе и уменьшению ЭОП. Для преодоления этих проблем, часто встречающихся при использовании насадочных колонок с гранулированной насадкой, к счастью, разработано новое поколение колонок для КЭХ — на основе пористых полимерных монолитных стационарных фаз (монолитов).
Монолиты или сплошные слои для хроматографии стали наиболее многообещающим видом стационарных фаз в КЭХ для разделения пептидов и белков главным образом из-за их высокой сепарационной эффективности и простоты изготовления "in situ". Здесь удерживающая фритта больше не нужна, обеспечивается хорошая проницаемость колонок благодаря макропористой структуре монолита, а химический состав поверхности монолита хорошо контролируется. Монолитные стационарные фазы (МСФ) были разработаны как сорбенты для ВЭЖХ с пониженным в 3–5 раз рабочим давлением для фракционирования биополимеров (см. Приложение "Развитие монолитных
Фритта Окно детектирования фритта
Поток подвижной фазы
Заполненный сегмент
Сегмент для ускорения ЭОП
Колонка разделения Дополнительная колонка (полая/заполненная)
Поток подвижной фазы v у
—► б
А
Фритта Окно детектирования
Рис. 4. Схематическое изображение сегментированных колонок: а — колонка, заполненная двумя разными набивками; б — частично заполненная колонка стационарных фаз для быстрой ВЭЖХ биополимеров"). Разработаны три поколения МСФ: первое поколение — в дисковом формате; второе — в формате колонок и капилляров для ВЭЖХ; третье поколение — для КЭХ пептидов и белков. Недавно опубликовано несколько превосходных обзоров по МСФ третьего поколения, предназначенных для КЭХ [34-37]. В большинстве из них монолитные колонки для капиллярной электрохроматографии (КЭХ) классифицируются по типу применяемых монолитных материалов, например монолитные колонки на основе золь-гелей, акриламидов, полистиролов, полиметилакрилатов, кремнеземов. Подробнее о монолитных колонках, представленных в каждой из этих групп, можно прочитать в этих обзорах [34-37].
Как отмечалось выше, важным фактором колонок КЭХ является формирование электроосмотического потока (ЭОП). Ниже будут рассмотрены последние разработки в области монолитных стационарных фаз для КЭХ пептидов и белков в соответствии с классификацией монолитных колонок на основе механизма формирования ЭОП, а не типов мономеров и агентов поперечного сшивания.
Монолиты, формируемые путем включения заряженных мономеров
Интенсивный ЭОП получают в монолитных колонках с высоким содержанием заряженных частиц.
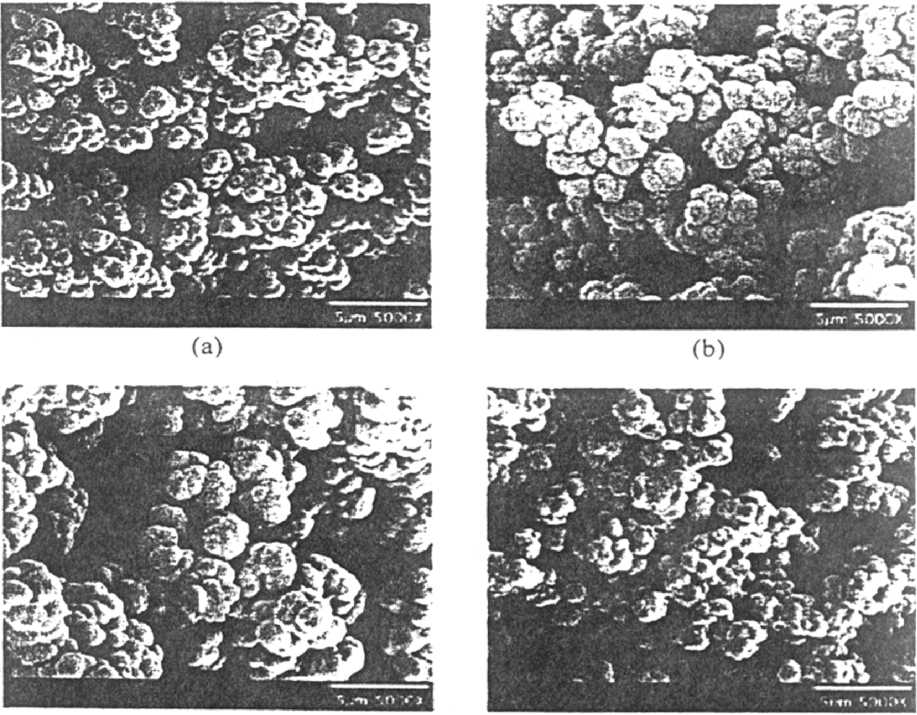
(с) (d)
Рис. 5. Микроизображения проб (полученные на растровом электронном микроскопе), экстрагированных с помощью метанола: отрицательно заряженного лаурилакрилатного монолита (а); положительно заряженного бутилакрилатного монолита (b); положительно заряженного бутилакрилатного монолита с удвоенным процентным содержанием (1%) заряженного мономера (с) и положительно заряженного бутилакрилатного монолита с 1% целлюлозы (d). Воспроизводится по работе [41]
Для этого заряженные мономеры добавляют в смесь мономеров, чтобы включить в монолит либо катионные, либо анионные группы. Недавно сообщалось об успешном изготовлении заряженного монолита путем полимеризации пористой матрицы из акриламида, метиленбисакриламида, акриловой кислоты, додецилакрилата и полиоксиэтилена, на котором разделялись четыре тирозинсодержащих пептида [38]. Разработаны МСФ для КЭХ с сульфокислотными группами, вводимыми путем добавления в качестве мономеров винилсульфокислоты (VSA) или 2-акриламидо-2-метил-1-пропансульфокислоты (AMPS) [39, 40]. Здесь алкильные цепи монолитных стационарных фаз действуют как хроматографические центры, а сульфокислотная часть обеспечивает заряд, необходимый для формирования и поддержания сильного ЭОП. В работе [41] описано разделение нейтральных, катионных и анионных аминокислот и пептидов с помощью КЭХ с использованием гидрофобной пористой МСФ на основе акрилата, получаемой с помощью УФ-инициируемых процессов. Здесь в зависимости от рН подвижной фазы и природы анализируемого вещества для усиления ЭОП в монолиты включались четвертичные аминные или сульфокислотные группы. Избирательность и ЭОП легко регулировались подбором степени гидрофобности и заряда монолита. Структуры этих заряженных монолитов иллюстрируются рис. 5.
Постфункционализация нейтральной поверхности монолитной стационарной фазы
Поскольку для формирования ЭОП необходимы поверхностные заряды, предложен метод, в котором на поверхность монолитов после полимеризации вводятся заряженные группы. Этот процесс называется "постфункционализацией" нейтрального пористого монолитного носителя. Применению органополимерных монолитных колонок с постфукнционализацией для КЭХ пептидов и белков посвящены работы [44–48]. Обычно анализ выполнялся в режиме движения компонентов пробы навстречу ЭОП. Монолитные колонки, изготовлявшиеся путем in situ сополимеризации глицидилметакрилата (GMA), метилметакрилата (ММА), этиленгликоль диметилметакрилата (EGDMA), функционализировались с помощью N-бутиламина, в результате чего получались функциональные группы фиксированных третичных аминов с этильными и бутильными цепями. Эти колонки использовались для разделения белковых смесей и ангиотензинов [44]. Монолитные колонки на основе полистирола, изготовлявшиеся путем сополимеризации винилбензолхлорида (VBC) и дивинилбензола (DVB) функционализировались с помощью реакции поверхностных бен-зилхлоридных групп с N,N-диметилоктиламином
[45]. На этом пористом стирольном монолите с четвертичноаммониевыми группами и октиловыми цепями на поверхности разделены четыре полипептида. Недавно монолит из поли(VBC-EGDMA), функционализированный с помощью N,N-диметилбутиламина, был успешно применен для разделения синтетических пептидов, белков и триптического гидролизата цитохрома С, как показано на рис. 6 [46]. В процедуре постфункционализации при изготовлении монолитных колонок применяются и другие реагенты, которые обычно служат для функционализации монолитных микросфер для насадочных колонок для КЭХ пептидов и белков [47, 48].
Чтобы исключить трудоемкий этап подбора порогенов для оптимизации монолитной среды разделения был разработан метод изготовления пористых полимерных монолитов для КЭХ с использованием технологий привитой сополимеризации [36, 49]. В этом подходе вначале получают пористые монолиты с хорошо контролируемым
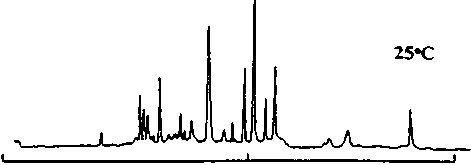
55-С
О 5 10 Minutes
Рис. 6. Электрохроматограммы, иллюстрирующие разделение триптического гидролизата цитохрома С, полученные при изократическом элюировании в монолитной колонке при температурах 25 и 55 ° С с постфункционализацией. Использовалась капиллярная колонка из кварцевого стекла с внутренним диаметром 75 мкм со стирольным монолитом, имеющим четвертичные аммонийные функциональные группы; полная и эффективная длина 30 см и 40 см соответственно. Условия эксперимента: подвижная фаза — 40 % ацетонитрила в 50 мМ фосфатном буфере, рН 2.5; приложенное напряжение — 30 кВ; УФ-детектирование на длине волны 214 нм. Воспроизведено по работе [46]
размером пор, а желаемая химия поверхности исходного монолита достигается с помощью фото-инициируемой привитой сополимеризации соответствующих полимерных цепей на поверхности пор. Успех применения привитой фотосополимеризации для изготовления монолитных колонок с использованием поли(2-акриламидо-2-метил-1-пропансульфокислоты) (AMPS) и 4,4-диметил-2-винилазелактона (VAL) тестируется путем измерения ЭОП и интенсивности флуоресценции соответственно [49]. В качестве иллюстрации описано быстрое и эффективное разделение четырех пептидов при помощи КЭХ с монолитными колонками, изготовленными путем привитой сополимери- зации с AMPS [49]. Реагенты, часто использовавшиеся для постфункционализации монолитных фаз в упомянутых выше работах, указаны в табл. 2.
Монолиты с кольцевым ЭОП
Адсорбцию пептидов и белков на стационарной фазе можно уменьшить, используя вместо насадок на основе кремнезема, полимеро-органические монолитные насадки. Поскольку в объеме МСФ всегда присутствуют для формирования ЭОП электрические заряды, при разделении пептидов и белков сохраняется проблема электростатического
Табл. 2. Реагенты, часто используемые для постфункционализации монолитных носителей
|
Реагент |
Структура реагента |
Поверхность монолита после функционализации |
Ссылка |
|
|
N-этилбутиламин |
[44] |
|||
|
N,N-диметилоктил-амин N,N-диметилбутил-амин N-метилоктадецил-амин-йодометан |
Yvx/Szs в R = -(CH2)17 CH3, CH 3 1 |
4/ Nl yV y-v yv у + N^ z+ xz x/ N^ < + \R |
[45] [46] [47] |
|
|
Сульфокислота 1,3-пропансульфон |
Q h2sos 0^0 |
к |
R = -(CH2)17 CH3 |
[48] |
|
Поли(2-акриламидо-2-метил-1-пропан-сульфокислота) Поли-4,4-диметил-2-винилазлактон |
CH, СЬЦ—С—CH;SO3H NH -C-CHCH- -II i * 0 L J n |
1 CH- CH3-C-CH,SO3H 4CH2CH-C-NH) n |
[49] [49] |
|
|
u d |
||||
взаимодействия заряженных функциональных групп пептидов и белков с заряженной насадкой. Постфункционализация вносит еще одну проблему, которая называется дилеммой двойного слоя в КЭХ, когда заряды на поверхности монолита того же знака, что и заряды анализируемого вещества; при этом происходит отталкивание зарядов, препятствующее взаимодействию заряженных анализируемых компонентов с центрами удерживания на хроматографической поверхности [46, 47]. Поэтому в большинстве разделений пептидов и белков с помощью КЭХ преобладают процессы электрофоретической миграции, а не комбинация действующих одновременно механизмов хроматографического удерживания и электрофоретической миграции. Для преодоления проблемы необратимой адсорбции и электростатического связывания при сохранении интенсивного ЭОП и, следовательно, высокой скорости разделения в КЭХ получена новая сепарационная среда разделения, содержащая положительно заряженный слой полимера, который наносится на внутренние стенки капилляров для получения кольцевого ЭОП, и нейтральную объемную стационарную фазу из поли(VBC-EG-DMA) [50]. Структура такой монолитной многослойной колонки показана на рис. 7. Разделение пептидов в такой колонке происходит за счет комбинации механизмов обращенно-фазовой хроматографии и электрофоретической миграции.
Другие виды монолитов
Как и гранулированные сорбенты насадочных
Положительно заряженный полимерный слой на внутренних стенках для формирования кольцевого электроосмотического потока
Нейтральный гидрофобный объемный монолит
Рис. 7. Многослойная структура монолитной колонки с кольцевым электроосмотическим потоком колонок, монолитные стационарные фазы можно разделить на обращенно-фазные, ионообменные и смешанного типа. Разделение пептидов с использованием КЭХ на сульфированной монолитной колонке со стационарной фазой смешанного типа, содержащей обращенно-фазный материал и сильный катионообменник, описано в работе [51]. Кроме того, монолитные колонки КЭХ также могут быть сегментированными. Однако контроль полимеризации с разными мономерами и кроссагентами в разных сегментах колонки остается проблемой. Хотя вытеснительная электрохроматография применялась для разделения полимеров, монолитные колонки для этих целей еще не разработаны. Можно ожидать, что в дальнейшем появятся работы по вытеснительной электрохроматографии для разделения пептидов и белков.
АНАЛИТИЧЕСКИЕ ПЛАТФОРМЫ ДЛЯ РАЗДЕЛЕНИЯ БЕЛКОВ И ПЕПТИДОВ МЕТОДОМ КЭХ
КЭХ с применением давления или микро-ВЭЖХ с применением электрического напряжения
Один из подходов к увеличению скорости разделения основывается на приложении давления в КЭХ или электрического напряжения в µ-ВЭЖХ. Хотя названия этих методов кажутся взаимозаменяемыми, между ними есть отличия. Понятие КЭХ с приложением давления (Р-КЭХ) охватывает методы, в которых элюент движется по капиллярной колонке, а дополнительное давление либо усиливает объемный поток под действием ЭОП, либо является фактором градиентного элюирования [52]. В то же время µ-ВЭЖХ с приложением электрического напряжения (V-µ-ВЭЖХ) включает методы, в которых объемный поток прокачивается через капиллярную колонку за счет градиента давления, а напряжение, приложенное к колонке, приводит к формированию небольшого ЭОП, зависящего от природы стационарной и подвижной фаз. Предполагается, что приложение давления в колонке (Р-КЭХ) может использоваться также для регулировки избирательности, т. к. это дает возможность изменять относительные подвижности в выражении (6) и тем самым создает разность кажущихся коэффициентов удерживания в КЭХ [4].
В работе [53] описано картирование триптического гидролизата цитохрома С методом градиентной КЭХ с использованием колонок с набивкой 5 мкм сферами октадецилкремнезема. Разрешение, полученное при использовании Р-КЭХ, оказалось выше, чем при градиентной µ-ВЭЖХ. Стационарная фаза смешанного типа (обращенно-фазная/анионообменная) использовалась для на- бивки колонок при разделении ангиотензинов, энкефалинов и триптических пептидов миоглобина сердца лошади с помощью Р-КЭХ [54]. Используемая стационарная фаза содержала октадецил-силан и диалкиламины. Заряженные аминные группы стационарной фазы создавали сильный постоянный ЭОП и позволяли регулировать как время удерживания, так и избирательность разделения путем подбора рН подвижной фазы в диапазоне от 2 до 5. На профиль элюирования пептидов сильно влияют величины и полярность напряжения разделения. Недавно продемонстрирован высокоэффективный анализ пептидов с помощью Р-КЭХ/Р-КЭ при использовании монолитных полимерных колонок, изготовленных по методике, описанной в работе [44]. Эффективность разделения составляла свыше 300 000 тарелок/м [55].
Детектирование в КЭХ
Одним из недостатков КЭХ, как и других капиллярных методов анализа, является недостаточная чувствительность детектирования. Поэтому для полной реализации возможностей КЭХ необходимо использовать высокочувствительное детектирование. Этот раздел, естественно, касается электрохроматографии как в капиллярных колонках, так и в микрофлюидных чипах. Чувствительность детектирования в КЭХ значительно повышена при ее использовании в комбинации
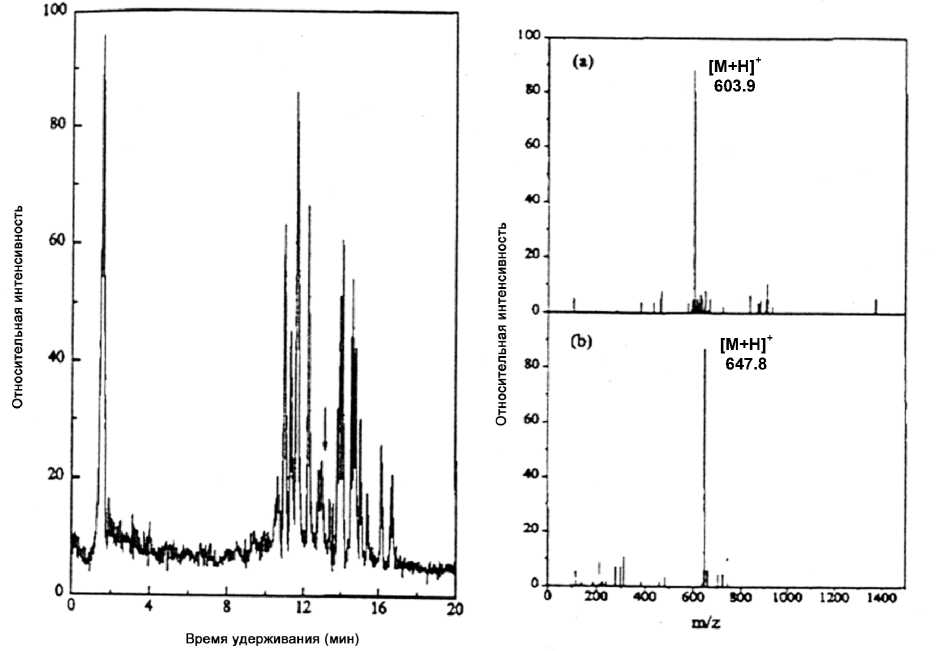
Рис. 8. Хроматограмма (левая часть) полного ионного тока при разделении триптического гидролизата куриного яичного белка при объеме введенной пробы 12 пмоль, соответствующем количеству исходного белка, и масс-спектры, соответствующие пику, отмеченному стрелкой на хроматограмме. Длина колонки 6 см. Условия эксперимента: градиент 0–40 % ацетонитрила за 20 мин; приложенное напряжение 1000 В; дополнительное давление 40 бар. Масс-спектрометрия: (а) — фрагмент TQINK, m/z = 603.9, время выхода 12.95 мин; (b) — фрагмент VYLPR, m/z = 647.8, время выхода 13.01 мин. Воспроизводится по работе [64]
с масс-спектрометрией (МС). Впервые сочетание электрохроматографического метода с МС продемонстрировано в 1991 г. в работе Verheij и др. [56], в которой описывалось использование Р-КЭХ и МС с непрерывным динамическим потоком и ионизацией путем бомбардировки быстрыми атомами (CG-FAB) для анализа алкалоидов морфина и нуклеотидов. Позднее указанные авторы использовали Р-КЭХ в сочетании с ESI-МС для анализа пептидов и других биомолекул [57]. Работы Verheij открыли дорогу широкомасштабной, высокопроизводительной и высокочувствительной идентификации пептидов, их высокочувствительному секвенированию и определению посттрансляционных модификаций белков. Именно сочетание КЭХ и ESI-МС [58] составляет в настоящее время основу идентификации пептидов в протеомике, особенно с применением электроспрей-ионизации [59] и ионизации с матричной лазерной десорбцией (МАLDI) [60]. Эти масс-спектрометрические методы обеспечили грандиозный прогресс в определении характеристик электрофорети-чески разделенных пептидов и белков как в режиме on-line, так и в автономном режиме (off-line).
В 1995 г. метод Р-КЭХ-ESI-МС был использован для анализа N-защищенных пептидов в колонке, заполненной О-Ф стационарной фазой, при скоростях элюции 1–2 мкл/мин [61]. Недавно комбинация V-µ-ВЭЖХ и ESI-МС была использована для исследования влияния приложенного напряжения на избирательность при разделении и картировании пептидов [62]. Описано несколько примеров использования КЭХ-ESI-МС для анализа белков и пептидов [63–65]. КЭХ с полыми С8 функционализированными капиллярными колонками использовалась для разделения и идентификации триптического гидролизата миоглобина сердца лошади [63]. При этом пятнадцать пептидов идентифицировались на хроматограмме полного ионного тока при детектировании время-пролетным масс-спектрометром, что охватывало 90 % пептидной последовательности. Р-КЭХ с колонкой, заполненной 3 мкм зернами Vydac C18, сочеталась с времяпролетной МС рефлектронного типа с ионной ловушкой для анализа шести стандартных проб пептидов и белковых гидролизатов [64]. На рис. 8 представлены хроматограммы полного ионного тока триптического гидролизата куриного овальбумина и масс-спектры, соответствующие току, отмеченному стрелкой на хроматограмме. В другом исследовании таким же образом анализировали бычий β-лактоглобулин А и гемоглобин человека [65]. Описано использование се-рийновыпускаемых колонок смешанного типа (с обращенно-фазным анионообменным материалом насадки для разделения пептидов и триптического гидролизата миоглобина сердца лошади методом Р-КЭХ с детектированием на основе время- пролетной МС рефлектронного типа с ионной ловушкой [54]. Эффективность разделения оказалась такой же, как у О-Ф колонки, однако с другим порядком элюирования. Поскольку подбор электрического поля и градиента давления обеспечивал высокопроизводительный анализ сложных смесей пептидов, была доказана применимость монолитных колонок для определения масс и анализа триптического гидролизата альбумина бычьей сыворотки методами Р-КЭХ/Р-КЭ в сочетании с электроспрей-МС [55]. Высокая эффективность колонок и крутой градиент позволяли осуществлять разделение пептидов за минуты с определением их масс, охватывающим 73 % всей последовательности альбумина бычьей сыворотки.
Последние разработки в КЭХ с детектированием лазерно-индуцированной флуоресценции (ЛИФ) также представляют высокочувствительную альтернативу УФ-детектированию при исследовании пептидов и белков. При КЭХ-разделении аминокислот, меченных нафталин-2,3-дикарбоксальдегидом (NDA), с ЛИФ-детекти-рованием в качестве стационарной фазы использовались заряженные лаурилакрилатные монолиты, функционализированные сульфокислотными группами [41]. При использовании ЛИФ для детектирования аминокислот, дериватизированных флуорогенными реагентами, достигалось значительное снижение пределов детектирования. КЭХ применялась и в сочетании со спектроскопией ядерного магнитного резонанса (ЯМР) [66]. Пять алкилбензоатов разделялись в КЭХ-колонке, заполненной на 90% 5 мкм сферами и на 10 % 3 мкм сферами Gromsil ODS-2 с использованием 2 мМ бората D 2 O/CD 3 CN(20/80) при давлении 8 бар и напряжении 20 кВ. Сравнение этого метода с комбинацией µ-ВЭЖХ-ЯМР показало, что в случае КЭХ-ЯМР время анализа значительно сокращается в результате дополнительного влияния давления и электроосмотических сил на скорость потока в КЭХ. Ожидается дальнейшее расширение применения КЭХ-ЯМР для разделения пептидов.
КЭХ на микрочиповых платформах
Переходим к результатам КЭХ, полученным непосредственно на приборах, изготовляемых методами микротехнологии (микрочипах), которые позволяют получить хорошо контролируемые микроканалы для разделения. Можно быть уверенным, что в будущем КЭХ на микрочипах станет мощным инструментом аналитической химии с широким применением в медикобиологических исследованиях, в особенности при изучении генома и в протеомике, где требуется быстрое, высокоэффективное и высокопроизводительное разделение и определение свойств биомолекул, таких как пептиды и белки [67].
В работах [64, 69] представлен анализ триптических пептидов с использованием микроколонок на основе матричных коллокационных структур, модифицированных С18 (CJVOSS). Показано, что эффективность разделения пептидов и белков с использованием КЭХ на микрочипах сравнима с эффективностью разделения при использовании µ-ВЭЖХ. Недавно продемонстрирована возможность применения чипов COMOSS из полидиме-тилсилоксана (PDMS) [70]. Поверхность PDMS модифицировалась с помощью AMPS, поли(4-стиролсульфокислоты), полиакриловой кислоты, поливинилсульфокислоты и полистеарилметакри-латного сополимера AMPS путем полимеризации с цериевым (IV) катализатором на COMOSS-микрочипах, что обеспечивало высокоэффективное разделение смесей пептидов [71]. Каналы в микрочипах, модифицированные С18-AMPS, обеспечивали избирательное разделение триптического гидролизата бычьего сывороточного альбумина, меченного флуоресцеин-изотио-цианатом (FITC-BSA), с высокой воспроизводимостью и эффективностью . Схема разделительной COMOSS-колонки и разделение пептидов из гидролизата FITC-BSA на микрочипе, модифицированном С18-AMPS, показаны на рис. 9 и 10 соответственно.
Недавно был изготовлен микрочип с гранулированной насадкой для выполнения КЭХ без использования фритты [72]. Канал разделения на микрочипе заполнялся микросферами диаметром 3 мкм из октадецилсиланизированного кремнезема. На рис. 11 приведены фотографии каналов в PDMS, заполненных частицами, дериватизиро-ванными с помощью октадецилсилана (ODS). В таком канале разделение двух нейтральных тестовых соединений: метанола и бензальдегида на уровне базовой линии достигалось менее чем за 15 с.
В работе [41] описано электрохроматографическое разделение на чипах пептидов, меченных NDA. Отрицательно заряженные монолиты из лаурилакрилата с сульфокислотными группами помещались в микроканалы стеклянных чипов. Для повышения чувствительности использовалось ЛИФ-детектирование. Разработаны другие микрочипы с целью совмещения электрофоретического разделения пептидов и белков с детектированием методом электроспрей-МС через специальный жидкостной интерфейс в системе микрочип-МС [73–77]. Эти успешные технологии создания комбинированных систем легко реализовать для КЭХ на микрочипе в комбинации с масс-спектрометрией.
Многомерное электрохроматографическое разделение
Сложность биологических образцов способст-
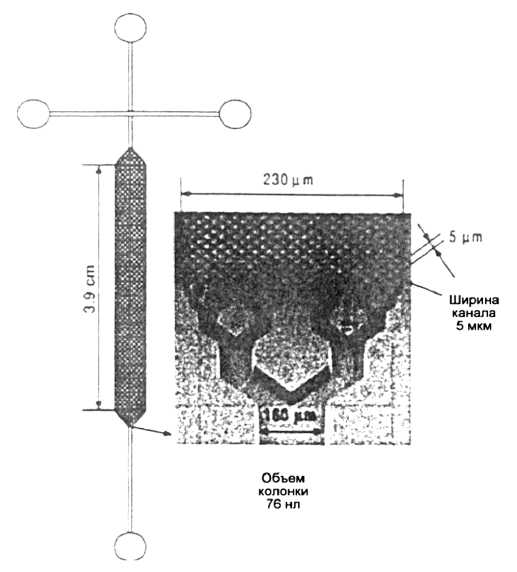
Рис. 9. Схема разделительной колонки COMOSS. Воспроизводится по работе [71]
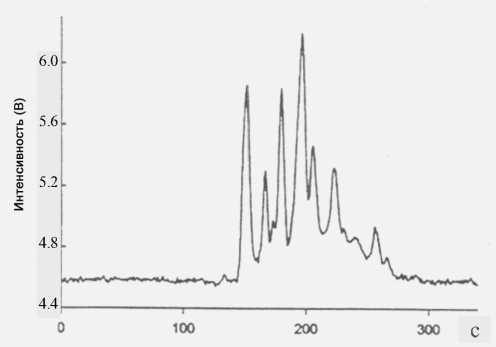
Рис. 10. Разделение пептидов гидролизата альбумина бычьей сыворотки с флуоресцеинизоцианатной меткой (FITC-BSA) на микрочипе, подверженном модификации с помощью С18-AMPS. Напряжение 1000 В; подвижная фаза: 1 мМ карбонатный буфер (рН 9.0). Диффузионная инжекция в течение 60 с. Воспроизводится по работе [71]
вовала развитию для их разделения многомерной электрохроматографии. Представляется, что разработка двухмерных систем КЭХ-КЭХ или ВЭЖХ-КЭХ, которые обеспечат идеальные профили потоков, позволит значительно повысить
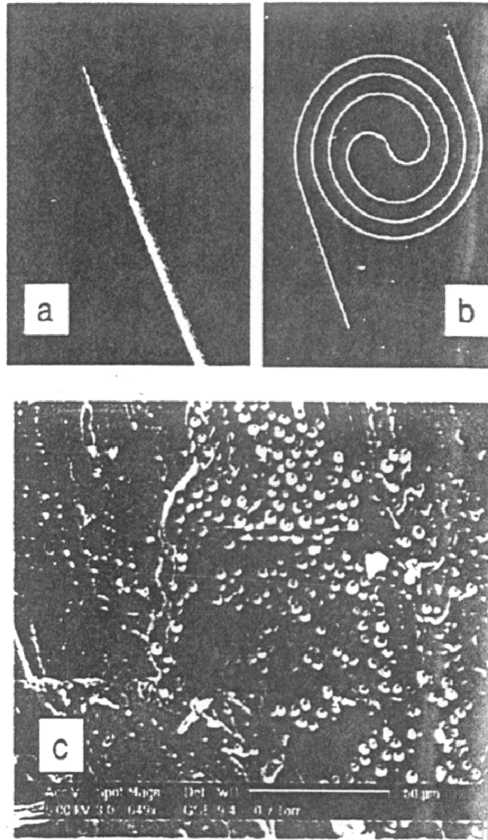
Рис. 11 . Фотографии конусных прямолинейного (а) и спирального (b) каналов, выполненных в по-лидиметилсилоксане и заполненных частицами материала, дериватизированного с помощью окта-децил-кремнезема, и электронные микрофотографии (с) поперечного сечения канала с заполнителем, выполненного в пластиковом материале, до тепловой обработки. Диаметр частиц 3 мкм. Воспроизводится по работе [71]
эффективность и селективность анализа пептидов и белков, значительно уменьшить время разделения, уменьшить объемы пробы. Поскольку МС-детектор может стыковаться в on-line комбинации с ВЭЖХ и КЭ, обеспечивается дополнительная размерность анализа. Недавно была разработана система ВЭЖХ-КЗЭ-МС [76] и предложено таким же образом реализовать комбинацию ВЭЖХ-КЭХ-МС. В работе [77] описана система трехмерной электрохроматографии в микрочиповом фор- мате для разделения гистидин-содержащих фрагментов пептидов. В этом исследовании использовались трипсиновое расщепление и аффинная хроматография на гранулированных насадочных колонках с фриттой, полученной методами микротехнологий, а обращенно-фазное разделение выполнялось на колонках COMOSS.
ЗАКЛЮЧЕНИЕ
Показанные в настоящем обзоре успехи в области КЭХ пептидов и белков достигнуты благодаря высокой эффективности и избирательности этого метода КЭХ. При этом внимание фокусировалось на технических разработках, главным образом на колоночных технологиях и различных конструкциях колонок для КЭХ. Поскольку каждый вид колонок имеет свои преимущества и недостатки, то следует направлять усилия на выполнение конкретных требований разделения пептидов и белков методом КЭХ. При разработке и изготовлении новых колонок важно, чтобы среда разделения содержала необходимые группы для требуемых хроматографических разделений и заряды для формирования надлежащего ЭОП, чтобы обеспечить высокую скорость и эффективность разделения. Последнее достигается при переходе к монолитным колонкам за счет увеличения отношения гидродинамического и диффузионного диаметров стационарных фаз. Использование различных аналитических платформ КЭХ обеспечили поразительные успехи в области анализа пептидов и белков, которые освещены в данном обзоре. Проведенные фундаментальные исследования ставили своей целью демонстрацию механизмов разделения и удерживания при КЭХ белковых веществ.
Хотя КЭХ сочетает в себе достоинства µ-ВЭЖХ и КЭ, она имеет и недостатки, которые необходимо преодолеть. В конечном счете успех КЭХ, как любого другого гибридного метода, основывается на усилении достоинств и исключении недостатков. Задача хроматографического и про-теомического сообществ заключается в превращении технических достижений в решения практических биологических проблем. КЭХ пептидов и белков в микрочиповом формате представляет перспективную область решения сложных аналитических задач протеомики.
Приложение. РАЗВИТИЕ МОНОЛИТНЫХ СТАЦИОНАРНЫХ ФАЗ ДЛЯ БЫСТРОЙ ВЭЖХ БИОПОЛИМЕРОВ
Первое поколение монолитных стационарных фаз (МСФ) — макропористые монолитные слои
Монолитная пористая стационарная фаза, впервые предложенная в 1989 г. в дисковом формате
(высокоэффекитивная мембранная хроматография) Б.Г. Беленьким, Ф. Швецом и Т.Б. Теннико-вой [78–81], разработана в Институте макромолекулярной химии (Прага, Чешская Республика). Созданные монолитные диски толщиной до 3 мм помещались в специально разработанные полиолефиновые картриджи, которые можно было последовательно соединять в серии. Благодаря реализованному в монолитных слоях конвективному межфазному массопереносу монолитные диски позволяли очень быстро и эффективно разделять белки и нуклеиновые кислоты [82, 83].
В середине 1980-х Б.Г. Беленький с сотрудниками изучали хроматографию белков на дисках МСФ незначительной толщины различной химической структуры и конфигурации [84], используя градиентное вытеснение. Было показано, что хорошего разрешения белковых зон в градиентных условиях можно достичь на дисках малой толщины. Это открытие привело к концепции коротких монолитных пористых слоев (дисков) [84].
Полная теория массообмена в монолитных пористых материалах разработана Liapis [85] и Tas-sarek [86].
Поскольку трудно создать тонкие слои из микрочастиц вследствие неоднородности упаковки и образования каналов, новая МСФ была разработана Ф. Швецом в Институте макромолекулярной химии ЧСАН (Прага, Чешская Республика) в мембранном формате. Впоследствии монолитные пористые диски в полиолефиновых кольцах под коммерческим названием CIM Диски начала выпускать фирма BIA Separation (Любляна, Словения). CIM Диски можно ставить друг на друга для многомерной хроматографии, названной "объединенной жидкостной хроматографией", в которой CIM Диски различной химической природы использовались одновременно.
МСФ второго поколения — твердые макропористые полимерные монолитные слои (колонки и капилляры)
В Корнельском университете (Итака, Нью-Йорк, США) в 1990-х годах Ф. Швец предложил новые макропористые монолитные слои, которые формировались путем полимеризации (литья) под давлением [87]. В отличие от полученных ранее монолитных дисков в мембранном формате эти монолиты полимеризуются in situ в трубках типа хроматографических колонок или капилляров, в которых они остаются после окончания отливки и промывания пористого монолита. Для этого трубки заполняются смесью мономеров (один из них должен быть кросс-агентом), свободно радикальным инициатором и порогенным растворителем. Полимеризация выполняется после герметизации колонки при тщательно контроли- руемом тепловом режиме. Эти колонки выпускаются компанией Isco (Линкольн, Небраска, США) под торговым названием SWIFT в различных форматах с большим ассортиментом функциональных групп. С появлением протеомики формат капиллярных колонок из пористого монолита, хорошо совместимый с масс-спектрометром, становится очень популярным, т. к. значительно проще полимеризовать жидкие предшественники полимеров и формировать стационарную фазу in situ в капиллярах, чем изготовлять узкофракциониро-ванные микрочастицы и эффективно упаковывать ими насадочные колонки. Фирмы Isco и LC Packings (Саннивэйл, Калифорния, США) называют монолитные пористые колонки и капиллярные слои в своих каталогах. Б. Karger [88] с сотрудниками недавно продемонстрировали потенциал этих монолитных капиллярных колонок, изготовленных с 20 мкм диаметром из плавленного кварца, для самых эффективных разделений белков и триптических гидролизатов.
МСФ третьего поколения — монолитные колонки для капиллярной электрохроматографии (КЭХ)
Предложены несколько методов изготовления монолитных пористых стационарных фаз с заданной химией поверхности. Так, непосредственно полимеризуемые монолиты из сополимера диви-нилбензола и стирола являются превосходными стационарными фазами для самого быстрого разделения пептидов и белков [89]. Другой вариант — это синтез монолита с реактивными функциональными группами и их последующей модификацией. Полиглицидилметакрилат [90] является основным монолитом для подобных приложений. Другой метод, который позволяет как приготовлять монолиты, так и модифицировать их поверхность, представляют УФ-инициируемые процессы. При использовании капилляров с УФ-прозрачным покрытием из ПТФЭ, может быть осуществлена более быстрая полимеризация, чем инициируемая термически [91, 92]. Химия этих слоев определяется выбором УФ-прозрачных мономеров.
Монолитные диски на основе кремнезема
Поскольку пористые неорганические материалы очень популярны, N. Tanaka разработал монолитные диски из кремнезема [93, 94]. В отличие от дисков из органических полимеров монолитные колонки из кремнезема не могут быть изготовлены in situ непосредственно аналитических размеров из-за значительной усадки при гидролитически инициированной поликонденсации тетраалкоксисилана в присутствии порогена — этиленгликоля. Модификация кремнеземного стержня с помощью C18 позволяет получить монолитную колонку для обращенно-фазных разделений. Указанные колонки продаются Merck KGaA (Дармштадт, Германия) под торговым названием Chromolith.
Хотя монолиты — новый формат стационарных фаз для ВЭЖХ, должно быть сделано еще много новаций, чтобы полностью раскрыть перспективы этого нового класса хроматографических слоев для ВЭЖХ. Подытоживая развитие МСФ в последние годы, выдающийся международный эксперт хроматографии G. Guiochon недавно [95] заявил: "Изобретение и разработка монолитных дисков (колонок) — это главная технологическая новация в изготовлении стационарных фаз, это — действительно первое новое крупное достижение в этой области, с тех пор как M. Tswett изобрел хроматографию столетие назад".


