Высокодозная иммуносупрессивная терапия с аутологичной трансплантацией стволовых кроветворных клеток при аутоиммунных заболеваниях
Автор: Россиев В.А., Александрова И.Я., Макаров С.В., Моисеева Т.В., Козлов В.А.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 1 (25), 2017 года.
Бесплатный доступ
В статье рассмотрены возможности применения высокодозной иммуносупрессивной терапии с аутологичной трансплантацией стволовых кроветворных клеток при аутоимунных заболеваниях.
Аутоиммунные заболевания, стволовые клетки, высокодозная иммуносупрессивная терапия
Короткий адрес: https://sciup.org/14344257
IDR: 14344257 | УДК: 616.419
Текст научной статьи Высокодозная иммуносупрессивная терапия с аутологичной трансплантацией стволовых кроветворных клеток при аутоиммунных заболеваниях
-
1ГБУЗ «Самарская областная клиническая больница им. В.Д. Середавина» 2Частное учреждение образовательная организация высшего образования «Медицинский университет «Реавиз»
-
3Федеральное государственное бюджетное научное учреждение «Научно-исследовательский институт фундаментальной и клинической иммунологии»
В статье рассмотрены возможности применения высокодозной иммуносупрессивной терапии с аутологичной трансплантацией стволовых кроветворных клеток при аутоимунных заболеваниях.
Ключенвые слова: аутоиммунные заболевания, стволовые клетки, высокодозная иммуносупрессивная терапия.
Актуальность поиска и внедрения новых препаратов и методов лечения аутоиммунных заболеваний (АИЗ) обусловлена их широкой распространенностью и ранней инвалидизацией больных. Среди объединяющих признаков этой гетерогенной нозологической группы необходимо отметить дефекты иммунорегуляции с выработкой аутоантител к различным компонентам тканей, развитие признаков хронического воспаления и деструктивных изменений в органах-мишенях. Традиционно используемые в терапии АИЗ глюкокортикостероиды, иммунодепрессанты, иммуномодулирующие препараты не всегда позволяют достичь устойчивой ремиссии, вызывают побочные эффекты и осложнения, порой нивелирующие результаты лечения; отмечено отсутствие или ограничение их влияния на прогрессирование заболевания [1–3]. Доказана эффективность иммуноаблативной терапии при АИЗ [4–6]. Однако опыт использования высокодозной иммуносупрессивной терапии (ВИСТ) с аутотрансплантацией стволовых кроветворных клеток (аутоТСКК) при системной красной волчанке (СКВ), ревматоидном артрите (РА), рассеянном склерозе (РС) ограничен. Это создает предпосылки для дальнейших исследований, анализа полученных данных с определением критериев допуска, оценки эффективности и времени проведения терапии, возможности прогнозирования ее результатов.
Цель работы – на основании собственных результатов исследован и я и анализа данных литературы определить возможные границы применения ВИСТ-аутоТ С КК при аутоиммунных заболеваниях (СКВ, РА, РС).
Материалы и методы. Клиническое исследование проводилось в ГБУЗ «Самарская областная клиническая больница» с 1999 по 2011 г. на основе добровольн о го инфор м ированного согласия пациентов с одобрения этического комитета. Критерии вкл ю чения больных в исследование: верифицированный диагноз АИЗ, отсутствие сопутствующих заболеваний в стадии декомпенсации, резистентность или низкая эф ф ективность стандартной терапии, а также признаки неблагоприятного течения СКВ, РА. В ряде случаев наблюдалась непереносимость иммуномодулирующих препаратов. Из исследова н ия исключали пациентов, отказавшихся выполнять рекомендации специалистов. Под набл ю дением находилась г руппа из 10 больных (7 с СКВ, 3 с РА) и 49 пациентов с РС (табл. 1).
Таблица 1
Анамнестические данные больных с АИЗ, наблюдавшихся в центре трансплантации костного мозга и клеточной терапии ГБУЗ СОКБ
|
Нозологическая форма |
Пол |
Возраст, годы |
Длительность заболевания до ВИСТ-аутоТСКК, годы |
Длительность наблюдения после ВИСТ-аутоТСКК. мес (медиана) |
|||
|
М |
Ж |
М+т |
min—max |
М+т |
min—max |
||
|
СКВ и РА |
3 |
7 |
TlAtiX |
16-50 |
5,9±1,3 |
3-9 |
39,3 |
|
PC |
22 |
27 |
34,9±1.33 |
18-54 |
8.4±0.69 |
2-25 |
42.0 |
Острое течение СКВ диагностировано у 2 бол ь ных, подострое – у 4, хроническое – у 1. При интерпретации данных об эффективности терапии у больных СКВ и РА использовали критерии оценки активности болезни (European Consensus Lupus Activity Measurement – ECLAM, Systemic Lupus Erythematosus Disease Activity Index – SLEDAI, шкала а ктивности болезни – Disease activity score, DAS). В группе больных РС у 15 диагностирован о ремитти-рующее течение заболевания, у 34 – прогрессир у ющие варианты. Эффективно с ть ВИСТ-аутоТСКК у больных РС определяли на основан и и динамики неврологического статуса с оценкой тяжести состояния больных по расширенной шкале инвалидизации (Expanded Disability Status Scale – EDSS) и шкале функциональных систем (FS). К линическ и м улучшением по критериям Европейской группы по пересадке клеток крови и костного мозга (European Group for Blood and Marrow Transplanta t ion – EBMT) считали уменьшение выраженности неврологического дефицита по EDSS ми н имум на 0,5 балла по сравнению с исходным уровнем при условии, что через 3 мес. улучшение подтверждалось. Увеличение значения показателя по шкале ассоциировалось с прогресс и рованием заболевания. Отсутствие изменений по EDSS после трансплантации по сравнению с исходным показателем рассматривали как стабилизацию состояния. Характер морфолог и ческих изменений в ЦНС инт е рпретировался по данным магнитно-резонансной томографии. Исследовали биохимические показатели крови, титр антител к ДНК, общий анализ крови, мочи.
Мобилизацию периферических стволовых кроветворных клеток – СКК (CD34+) проводили препаратом нейпоген в дозе 8,7–10,0 мкг/кг/сут. На 4–5-е сутки от начала мобилизации осуществляли цитаферез этих клеток с помощью аппарата «Haemonetics MCS». Содержание мононуклеаров с маркером CD34+ в трансплантате составляло от 4,5 до 25,0∙106. Предтранс- плантационное кондиционирование проводили по протоколам ВЕАМ в течение 6 дней и флу-дарабин + мелфалан в течение 6 дней. Кроме того, в обоих случаях в течение 3 дней вводили антилимфоцитарный глобулин (АЛГ). Дозы препаратов в режимах кондиционирования перед аутотрансплантацией СКК были следующие: а) ВЕАМ+АЛГ: кармустин 300 мг/м2 + этопозид 100 мг/м2 + цитарабин 100 мг/м2 ∙ 2 + мелфалан 140 мг/м2 + АЛГ 20 мг/кг; б) флударабин + мелфалан +АЛГ: 1–5-й дни флударабин 30 мг/м2 (–6–2-й дни); 6-й день – мелфалан 140 мг/м2 (–1-й день) 6, 8 и 9-й дни (–1, +1, +2) – АЛГ 20 мг/кг. Аутотрансплантацию СКК по протоколам осуществляли на 7-й день (0-й день). Случаев смерти, связанных с трансплантацией, не зарегистрировано.
Статистическую обработку полученных данных проводили с использованием пакета прикладных программ SPSS версии 21 и др. с заданным уровнем значимости p = 0,05. При сравнении результатов до и после ВИСТ-аутоТСКК использовали критерий W Вилкоксона. В работе применяли анализ выживаемости Каплана–Майера, а также системный многофакторный анализ (СМА) [7], позволяющий интегрировать многомерные, несопоставимые количественные характеристики процесса или состояния в единую систему для медицинских и биологических исследований. Для математического моделирования использовали СМА с вычислением взвешенных средних значений, интегральных показателей ( ХBi ± δ i ) клинического статуса пациента с его анамнестическими данными по полученным в процессе исследования единичным параметрам. Степень влияния единичного параметра на систему оценивали весовым коэффициентом (Рi).
Результаты. Признаки миело- и органотоксичности нивелировались в ранний посттрансплантационный период и в дальнейшем не влияли на течение АИЗ. Миелотоксиче-ский агранулоцитоз возникал в среднем на +7-й день. Фебрильная нейтропения отмечена лишь у 60 % больных, что, вероятно, обусловлено пребыванием их в асептических палатах, ранней профилактической деконтаминацией кишечника ко-тримоксазолом, флуконазолом или итраконазолом, отсутствием предшествующей агрессивной цитостатической и иммуносупрессивной предлеченности. Частота развития инфекционных осложнений не превышала 60 %. Пациентам назначали антибиотики цефалоспоринового ряда третьего-четвертого поколения, фамцикловир. При продолжающейся персистирующей лихорадке к лечению добавляли амфотерицин В. Частота развития инфекционных осложнений у больных РС с оценкой по EDSS 6,0 баллов и более по сравнению с группой пациентов с меньшими оценками статистически незначима. К +15-му дню количество гранулоцитов обычно достигало 500 в 1 мкл и более, температура тела нормализовалась. Критическая тромбоцитопения развивалась в сроки от +5 до +18-й дни и обусловливала необходимость трансфузии 6–8 лечебных доз донорского тромбоконцентрата. Ни в одном случае тяжелых геморрагических осложнений не отмечено.
Предтрансплантационное кондиционирование по протоколу флударабин + мелфалан + АЛГ использовали как альтернативу протоколу ВЕАМ+АЛГ на основе метода случайного выбора у 2 больных с РА и 15 больных с РС. Это позволило при высоком иммуносупрессивном эффекте достичь меньшей органо- и миелотоксичности. Частота ответа на аутотрансплантацию СКК одинаковая в этих протоколах. Различия между группами по указанным протоколам по данным 5-летней общей выживаемости (ОВ) и 5-летней выживаемости без прогрессирования (ВБП) статистически незначимы ( p > 0,1).
Нами отмечен клинический эффект у 2 больных с быстро прогрессирующим течением РА. После трансплантации оценка по DAS снизилась у одного с 2,8 до 0,9 и достигнута полная ремиссия; у другого с 4,97 до 3,28 со стойким регрессом суставного синдрома. У третьего больного с медленно прогрессирующим течением РА в возрасте 50 лет эффект от лечения отсутствовал, смерть наступила через 5 мес от осложнений основного заболевания. Применение ВИСТ-аутоТСКК у больных СКВ позволило улучшить прогноз для жизни и достичь полной ремиссии у 4 больных с различным течением заболевания. Это подтверждалось (рис. 1) снижением индекса по ЕСLAM более чем на 50 % – с 5,57 ± 0,43 до 2,0 ± 0,31 балла (p < 0,01), а также уменьшением индекса активности SLEDAI на 60 % – c 15,4 ± 2,27 до 6,0 ± 1,38 балла (p < 0,01). У 2 больных отмечалась частичная ремиссия со снижением оценок по ЕСLAM на 2–3 балла, у одного пациента достигнута стабилизация состояния длительностью более года. Регресс клинических признаков в подгруппе больных СКВ касался в большей мере общих, кожных проявлений; суставного, почечного синдромов (табл. 2). Нами отмечены позитивные изменения гематологических показателей, нервно-психической сферы, состояния мышц, серозных оболочек. У 5 пациентов через 3–5 мес титр антител к ДНК стал отрицательным. Изменения в гемограмме носили в основном компенсаторный характер. Наблюдение показало, что эффективность ВИСТ-аутоТСКК при СКВ не связана с течением заболевания, нивелированные признаки аутоиммунной агрессии позитивно отражались на функции органов-мишеней.
В контрольной группе 183 больных СКВ и РА (что отмечено в ранее проведенном исследовании) показана низкая эффективность стандартной терапии: по шкале DAS у 42,5 % больных РА отсутствовал результат лечения, по индексу активности ELCAM у 74,8 % больных СКВ достигнута лишь неполная ремиссия [8].
ОВ за 5 лет в группе больных РА и СКВ составила 80 %, 5-летняя ВБП 30 %.
Среди прогностических факторов, влияющих на отдаленные результаты (более 2 лет) ВИСТ-аутоТСКК, следует отметить возраст пациентов, длительность заболевания и индекс активности по шкале SLEDAI. Ранее нами установлено [8], что ВИСТ-аутоТСКК наиболее результативна у больных СКВ и РА моложе 29 лет, при длительности заболевания не более 7 лет и индексом активности СКВ по шкале SLEDAI >17 баллов, при недостаточной эффективности других методов лечения.
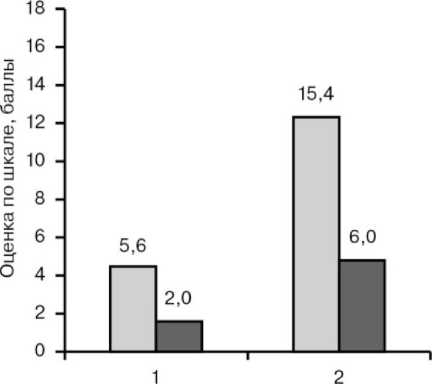
□ 1-ECLAM,2-SLEDAI-долечения
□ 1-ECLAM,2-SLEDAI - после лечения
Рис. 1. Индексы активности заболевания у больных СКВ до и после ВИСТ-аутоТСКК:
1 – ЕСLAM; 2 – SLEDAI
Таблица 2
Число клинических признаков, вошедших в шкалу ECLAM, в группе больных СКВ до и после ВИСТ-аутоТСКК
|
Клинические и лабораторные -проявления |
Число признаков |
|
|
до трансплантации |
после трансплантации |
|
|
Лихорадка |
4 |
0 |
|
Усталость |
7 |
1 |
|
Артрит |
6 |
3 |
|
Скуловая сыпь |
5 |
1 |
|
Кожный васкулит |
1 |
0 |
|
Миозит |
1 |
0 |
|
Плеврит |
1 |
0 |
|
Мигрень |
3 |
1 |
|
Судороги |
2 |
0 |
|
Протеинурия >0.5 г/сут |
2 |
0 |
|
Гематурия |
5 |
0 |
|
Негемолитическая анемия |
4 |
2 |
|
Повышение СОЭ >25 мм/ч |
5 |
2 |
В работе представлены данные 49 больных РС со значением п оказателя по EDSS 5,9 ± 0,15 балла до ВИСТ-аутоТСКК и клиническим ответом на лечение в следующих временных точках наблюдения: 6, 12, 24 и 60 мес. Вы р аженные признаки и нвалидизации (EDSS 6,0 балла) отмечались у 71 % больных, у которых использование имму н омодулирующей терапии существенно ограничено. После ВИСТ-аутоТСКК положительн а я клиническая динамика отмечена у всех больных: в большей мере подвергались регрессу нарушения координации, дисфункция тазовых органов, уменьшались признаки спастического пареза. Показатель EDSS снижался в среднем на 0,5–1,5 балла, в 2 случаях – на 2 и 2,5 бал л а, достигая в точках наблюдения 6 и 12 мес. статистически значимого различия 5,22 ± 0,17 б алла ( р < 0,001). У 2 больных с высокими показателями по EDSS > 6,5 балла и длительным течением заболевания отмечены признаки прогрессирования РС в ранние сроки после трансп л антации на 8-м и 9-м месяцах. В точке наблюдения 24 мес. улучшение по сравнению с исходной оценкой по EDSS сохранилось у 33 пациентов, стабилизация – у 3, прогрессирование отмечено у 5 пациентов (17 %). Показатель по EDSS в точке наблюдения 24 мес был ниже исходного 5 ,38 ± 0,19 ( p < 0,0031). При осмотре через 60 мес показатель по EDSS в группе РС приближался к значению до лечения 5,86 ± 0,24 балла ( p > 0,1). Необ х одимо отметить два наблюдения с низкими показателями по EDSS 3,5 балла и длительност ь ю заболевания менее 5 лет, в которых зарегистрировано снижение показателя по шкале почти на 50 % после т рансплантации СКК, которое сохранилось более 60 мес. Нейровизуализационная картина после ВИСТ-аутоТСКК в целом у обследованных пациентов характеризовалась уменьшением количества и/или сокращением площади очагов в ЦНС с признаками замещения их глиозом. По резу л ьтатам использования различных режимов кондиционирования статистически значимых различий по EDSS не выявлено. Необходимо отметить, что в к о нтрольной группе 32 больных РС, имеющих сходную клиническую характеристику с пациентами, получившими ВИСТ-аутоТСКК, применение стандартной терапии с включением глюкокортикостероидов, цитостатиков, метаболических, нейропротективных препаратов не приводило к статистически значимому длительному снижению показателя по EDSS.
Результаты анализа Каплана-Майера, проведенные к дате представления работы, отображены на рис. 2, а, на котором отмечена кривая 5-летней ОВ больных РС с двумя исходами в точках наблюдения: 29 и 45 мес. На рис. 2, б отображена кривая 5-летней ВБП в 47 незаконченных (цензурированных) и 2 законченных в связи со смертью (нецензурированных) наблюдениях с Р.С. По данным анализа 5-летняя ОВ составила в среднем 95 % (ДИ 91–99 %), 5-летняя – ВБП 45 % (ДИ 37–53 %). Необходимо отметить, что число эпизодов обострения (табл. 3) у больных РС после ВИСТ-аутоТСКК сокращалось, они носили более стертый и часто кратковременный характер, чем до трансплантации, что существенным образом отражалось на качестве жизни (КЖ) пациентов.
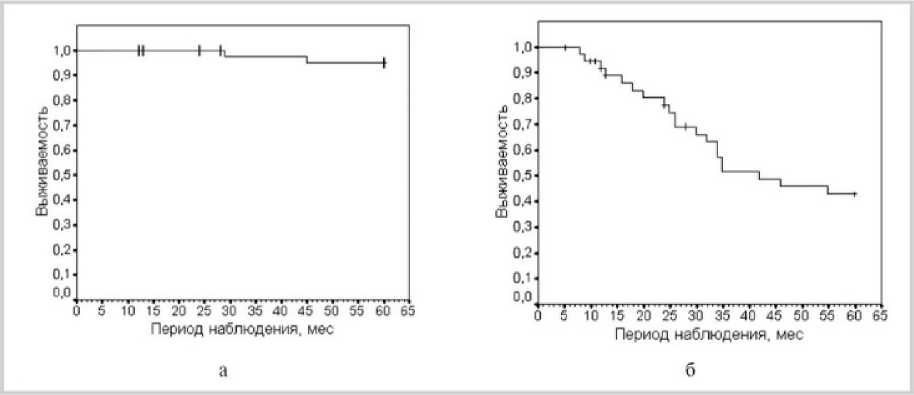
Рис. 2. Кривые 5-летней выживаемости у больных РС после ВИСТ-ау т оТСКК: а – ОВ; б – ВБП. ± (незаконченные) цензурированные наблюдения
Динамика частоты обострений и оценки по EDSS в группе больных РС
Таблица 3
|
Показатель |
В течение 12 мес до ВИСТ- ________________ После ВИСТ-аугоТСКК ________________ аутоТСКК через 12 мес через 24 мес через 60 мес |
|
Частота обострений Оценка по EDSS. баллы |
2.11 +1.03 0.055+0,23* 0.39±0.55* 0.83±0.8* 5,9+0.15 5.22+0,17* 5,38+0,19* 5,86+0,24 |
Примечание. * – различия показателей до и после ВИСТ-аутоТСКК по критерию Вилкоксона W ст а тистически значимы (p < 0,01).
Для решения вопроса о влиянии клинических и анамнестических факторов на результат ВИСТ-аутоТСКК и определении возможности прогнозирования эффективности трансплантации СКК у больных РС использовали СМА. Вычисляли коэффициент влияния (Рi) каждого клинического и анамнестического показателя на систему в целом, за которую принят клинический статус больных РС в 2 подгруппах с наибольшими сроками наблюдения. В первой подгруппе (n = 20) в отличие от второй (n = 6) отмечались лучшие клинические результаты после ВИСТ-аутоТСКК: снижение значения по EDSS не менее чем на 1,0 балла; длительный период стабилизации состояния; в течение 2 лет редкие (по сравнению с периодом до трансплантации) эпизоды обострения заболевания или их отсутствие. В группах высокие Рi (от 0,5 до 3,6) определены у больных с данными, которые в большей мере сопряжены с эффективностью ВИСТ-аутоТСКК. К ним относились оценки состояния пирамидной системы и мозжечка по шкале FS как наиболее часто вовлекаемые в процесс при РС; длительность первой ремиссии, а также расчетная величина – индекс прогрессирования болезни, определенный по длительности заболевания и оценке по EDSS. В дальнейшем на основе СМА при математическом моделировании прогностических критериев эффективности ВИСТ-аутоТСКК определены интегральные значения этих данных. Они оказались статистически значимо различимы и составили в первой подгруппе ХB ± δi = 57,9 ± 2,46, во второй подгруппе ХBi ± δi = 81,8 ± 5,35. Это подтверждало обоснованность учета именно этих показателей в прогнозировании возможных результатов ВИСТ-аутоТСКК. У больных с прогрессирующим течением РС устойчивое значение показателя 4 балла и более по шкале FS при длительном течении заболевания, достигших по EDSS 6,5 балла, отдаленные клинические результаты были хуже. Вероятно, это связано с преобладанием нейродегенеративных процессов в ЦНС. Отмечено, что длительная первая ремиссия является позитивным признаком, связанным с лучшим ответом на ВИСТ-аутоТСКК у пациентов с Р.С. Для больных с ремиттирующим течением заболевания целесообразно ориентироваться на индекс прогрессирования болезни вне обострения Р.С. При его значении от 1,1 и менее отмечены лучшие результаты в отдаленном периоде, если показатель по EDSS не превышал 6,0 баллов.
Обсуждение. Необходимо отметить, что оценка эффективности ВИСТ-аутоТСКК у больных с системными заболеваниями соединительной ткани совпадает с данными других авторов. В проведенном исследовании в центре трансплантации костного мозга НИИ клинической иммунологии СО РАМН [9] у 15 больных с СКВ при неэффективной стандартной иммуносупрессивной терапии достигнута ремиссия у 6 после ВИСТ-аутоТСКК и снижение активности заболевания также у 6 пациентов. Ранняя посттрансплантационная летальность составила 13 %, 5-летняя ОВ – 80 %, 5-летняя безрецидивная выживаемость – 20 %. Причина летальных исходов в отдаленные сроки связана с активностью СКВ. В контрольной группе ремиссий не было, летальность составила 20 %, 5-летняя ОВ – 70 %. Авторы делают вывод об эффективности ВИСТ-аутоТСКК в лечении резистентной к иммуносупрессивной терапии тяжелой СКВ; ВИСТ-аутоТСКК имеет преимущества перед стандартной терапией, длительное применении которой приводило к осложнениям: выраженному остеопорозу с переломами костей, стероидному сахарному диабету, рецидивирующей инфекции. В многоцентровом исследовании с участием 73 больных РА после ВИСТ-аутоТСКК [6] отмечено, что у 67 % достигнуты положительные клинические результаты и статистически значимое снижение уровня инвалидности. Авторы также придерживаются мнения о безопасности метода и необходимости применения трансплантации СКК при тяжелых и резистентных к стандартной терапии формах РА. В другом многоцентровом исследовании [5] дан анализ результатов применения ВИСТ-аутоТСКК у 89 больных РА и 85 пациентов с СКВ, находящихся в реестре EBMT и EULAR. Как отмечают авторы, 5-летняя ОВ у больных СКВ составила 76 %, у пациентов с РА – 94 %; 5-летняя ВБП в группе с РА зарегистрирована на уровне 18 %. Однако при СКВ этот показатель оказался выше, чем в других исследованиях, и составил 44 %. Авторы отмечали, что на данные о ВБП после трансплантации влияли возраст пациентов моложе 35 лет ( p = 0,01) и длительность болезни.
Полученные нами данные об эффективности и безопасности ВИСТ-аутоТСКК при РС аналогичны результатам многоцентрового исследования, проведенного Российской кооперативной группой клеточных технологий [10, 11]. Однако отмечалось различие по 5-летней ВБП при Р.С. Наши данные соответствуют результатам группы ЕВМТ в многоцентровом исследовании на основании 12-летнего наблюдения [5]. Значение этого показателя было выше – 66 % у больных РС в другом многоцентровом исследовании итальянской группы [4]. Важно отметить и опыт коллег [12], по данным которых 4-летняя ВБП в группе с EDSS от 3,5 до 8,5
балла составила 76 %. Вероятно, различие результатов обусловлено клинической неоднородностью групп наблюдения со значительным представительством (45 %) в последнем случае больных с низкими оценками по EDSS (3,0 баллов). Более устойчивые результаты терапии, влияющие на КЖ пациентов, отмечались у пациентов молодого возраста с длительностью заболевания менее 10 лет, что отмечалось нами в предыдущих исследованиях [13, 14, 15]. В обзоре данных из регистра ЕВМТ [16] также выявлена более высокая эффективность имму-ноаблативной терапии у больных моложе 40 лет, у которых РС диагностирован в последние 5 лет, что необходимо учитывать при назначении ВИСТ-аутоТСКК.
Имеются основания полагать, что ВИСТ-аутоТСКК замедляет прогрессирование РС, что подтверждено длительным периодом стабилизации состояния больных и отмечено также в других исследованиях [4, 17]. При отсутствии эффекта от иммуномодулирующих препаратов возможно использование ранней (EDSS от 1,5 до 3 баллов) и поздней (EDSS от 3,5 до 6,5 балла) трансплантации, предложенной Ю.Л. Шевченко и соавт. [12], так как данный метод лечения влияет на иммунопатологические воспалительные механизмы при аутоиммунном процессе, уменьшая активность и дальнейшее прогрессирование заболевания как при ремит-тирующем, так и прогрессирующем течении РС. Вопрос о проведении трансплантации спасения, когда показатель по EDSS составляет от 7 до 8,5 балла, дискутабелен, так как влияние терапии на дальнейшее течение болезни и наступление критической инвалидизации ограничено из-за выраженности нейродегенеративных изменений, если не диагностируется агрессивное течение РС. Применение ВИСТ-аутоТСКК при злокачественных и агрессивных формах РС [18, 19] позволяет достичь выраженного регресса неврологической симптоматики, что ведет к увеличению продолжительности жизни пациентов при безопасности метода.
На основании успехов иммуномодулирующей терапии при АИЗ формируется мнение о целесообразности применения трансплантации СКК у больных в качестве терапии второй линии при неэффективности стандартного лечения [20, 21]. Тем не менее вопросы о сроках и условиях применения ВИСТ-аутоТСКК, а также возможности сочетания ее с иммуномодулирующей терапией, определение иммунных механизмов рецидива и регенеративного потенциала СКК нуждаются в дальнейшем изучении.
Заключение. В рамках данного исследования можно отметить некоторые клинически очерченные границы применения ВИСТ-аутоТСКК при АИЗ. Метод безопасен, позволяет нивелировать признаки аутоиммунной агрессии, что позитивно отражается на функции органов-мишеней при СКВ, РА, РС. Он может использоваться в случаях рефрактерности, низкой эффективности и непереносимости стандартной терапии при АИЗ. Необходимо принять во внимание опыт других исследований аутоТСКК при СКВ и РА, отмечающих, что оптимальные клинические результаты достигаются у пациентов моложе 35 лет с небольшой длительностью заболевания и умеренными признаками активности болезни. Клинические наблюдения при РС показывают, что лучший ответ на аутоТСКК отмечен при длительности заболевания менее 10 лет при значении EDSS не более 6,5 балла. Кроме того, необходимо учитывать возраст пациентов моложе 40 лет при назначении этой терапии. В прогнозировании эффективности ВИСТ-аутоТСКК имеют значение низкие и умеренные оценки по шкале FS, индекс прогрессирования болезни, длительность первой ремиссии.
Немногочисленные данные отечественных и зарубежных исследований, полученные в результате применения ВИСТ-аутоТСКК у больных с системными заболеваниями соединительной ткани и РС, подчеркивают научно-практическую значимость применения клеточных технологий и перспективность их клинического использования при АИЗ, нашедших отражение в ряде документов [22, 23].
Список литературы Высокодозная иммуносупрессивная терапия с аутологичной трансплантацией стволовых кроветворных клеток при аутоиммунных заболеваниях
- Шмитд Т.Е. Лечение рассеянного склероза в стадии прогрессирования//Рассеянный склероз: руководство для врачей. М.: МЕДпресс-информ; 2012.
- Davis J.M., Maradit Kremers H., Crowson C.S., Nicola P.J., Ballman K.V., Therneau T.M., Roger V.L., Gabriel S.E. Glucocorticoids and cardiovascular events in rheumatoid arthritis: a population-based cohort study//Arthritis Rheum. 2007;56(3):820-830 DOI: 10.1002/art.22418
- Kang I., Park S.H. Infectious complications in SLE after immuno-suppressive therapies//Cur Opin Rheumatol. 2003;15(5):528-534 DOI: 10.1097/00002281-200309000-00002
- Mancardi G.L., Sormani M.P., Di Gioia M., Vuolo L., Gualandi F., Amato M.P., Capello E., Cunr D., Uccelli A., Bertolotto A., Gasperini C., Lugaresi A., Merelli E., Meucci G., Motti L., Tola M.R., Scarpini E., Repice A.M., Mas-sacesi L., Saccardi R. Autologous haematopoietic stem cell transp-lantation with an intermediate intensity conditioning regimen in multiple sclerosis: the Italian multi-centre experience//Multiple Sclerosis J. 2012;18(6):835-842 DOI: 10.1177/1352458511429320
- Farge D., Labopin M., Tyndall A., Fassas A., Mancardi G.L., Van Laar J., Ouyang J., Kozak T., Moore J., Kutter I., Chesnel V, Marmont A., Gratwohl A., Saccardi R. Autologous hematopoietic stem cell transplantation for autoimmune diseases: an observational study on 12 years' experience from the European Group for Blood and Marrow Transplantation Working Party on Autoimmune Diseases.//Haematologica. 2010; 95(2):284-292 DOI: 10.3324/haematol.2009.013458
- Snowden J.A., Passweg J., Moore J.J., Milliken S., Cannell P., Van Laar J., Verburg R., Szer J., Taylor K., Joske D., Rule S., Bingham S.J., Emery P., Burt R.K., Lowenthal R.M., Durez P., McKendiy R.J., Pavletic S.Z., Espigado I., Jan-tunen E., Kashyap A., Rabusin M., Brooks P., Bredeson C., Tyndall A. Autologous hemopoietic stem cell transplantation in severe rheumatoid arthritis: a report from the EBMT and ABMTR//J Rheumatol. 2004; 31(3):482-488.
- Углов Б.А., Котельников Г.П., Углова М.В. Основы статистического анализа и математического моделирования в медико-биологических исследованиях. Самара: СамГМУ 1994.
- Осина И.Г., Россиев В. А., Караулов А.В. Новые технологии в диагностике и лечении аутоиммунных заболеваний. Самара: НТЦ, 2007.
- Демин А.А., Козлов В.А., Лисуков И.А. и др. Отдаленные результаты ауто-трансплантации стволовых кроветворных клеток при резистентной системной красной волчанке//Сибирский медицинский журнал. -2011. -№ 1. -С. 86-89.
- Мельниченко В.Я., Россиев В.А., Афанасьев Б.В. и др. Российский опыт лечения больных рассеянным склерозом высокодозной иммуносупрессивной терапией с аутотрансплантацией стволовых кроветворных клеток. Гематология и трансфузиология. 2012; 3 (прил. «Материалы Конгресса гематологов России», :63.
- Novik A., Kuznetsov A., Afanasyev B., Rossiev V., Lisukov I. Long-term follow-up after autologous haematopoietic stem cell transplantation for multiple sclerosis//Bone Marrow Transplantation. 2011; 46(1):85.
- Шевченко Ю.Л., Кузнецов Ф.Н., Федотов Ю.Н. и др. Варианты стратегии высокодозной иммуносупрессив-ной терапии с трансплантацией кроветворных стволовых клеток при рассеянном склерозе: результаты длительного мониторинга//Вестник национального медико-хирургического центра им. Н.И. Пирогова. -2012. -№ 2. -С. 3-8.
- Макаров С.В., Россиев В.А., Ефремов А.Г. и др. Комплексная оценка результатов высокодозной иммуносупрес-сивной терапии и аутотрансплантации стволовых кроветворных клеток у больных рассеянным склерозом со вторично-прогрессирующим течением заболевания//Неврологический журнал. -2005. -№ 2. -С. 18-23.
- Супильников А.А., Юхимец С.Н. Прикладные аспекты применения математико-статистических методов моделирования в медицине//Вестник медицинского института «РЕАВИЗ»: реабилитация, врач и здоровье. -2012. -№ 2 (6). -С. 18-22.
- Makarov S.V., Rossiev V.A., Efremov AG. Clinical results of high-dose immunosupressive therapy with autologous stem cell transplantation in treatment of autoimmune diseases of the neurological system//Eur J Neurol. 2011;18(2):531.
- Saccardi R., Kozak T., Bocelli-Tyndall C., Fassas A., Kazis A., Havrdova E., Carreras E., Saiz A., Lцwenberg B., te Boekhorst P.A., Gualandio F., Openshaw H., Longo G., Pagliai F., Massacesi L., Deconink E., Ouyang J., Nagore F.J., Besalduch J., Lisukov I.A., Bonini A., Merelli E., Slavino S., Gratwohl A., Passweg J., Tyndall A., Steck A., Andolina M., Capobianco M., Martin J.L., Lugaresi A., Meucci G., Sбez R.A., Clark R.E., Fernandez M.N., Fouillard L., Herstenstein B., Koza V, Cocco E., Baurmann H., Mancardi G.L. Autologous stem cell transplantation for progressive Multiple Sclerosis: update of the European Group for Blood and Marrow Transplantation autoimmune diseases working party database // Multiple Sclerosis. 2006;12(6):814-823 DOI: 10.1177/1352458506071301
- Bowen J.D., Kraft G.H., Wundes A., Guan Q., Maravilla K.R., Gooley T.A., McSweeney P.A., Pavletic S.Z., Open-shaw H., Storb R., Wener M., McLaughlin B.A., Henstorf G.R., Nash R.A. Autologous hematopoietic cell transplantation following high-dose immunosuppressive therapy for advanced multiple sclerosis: long-term results//Bone Marrow Transplantation. 2012;47(7):946-951 DOI: 10.1038/bmt.2011.208
- Mancardi G.L., Murialdo A., Rossi P., Gualandi F., Martino G., Marmont A., Ciceri F., Schenone A., Parodi R.C., Capello E., Comi G., Uccelli A. Autologous stem cell transplantation as rescue therapy in malignant forms of Multiple Sclerosis//Multiple Sclerosis. 2005;11(3):367-371 DOI: 10.1191/1352458505ms1181cr
- Fagius J., Lundgren J., Oberg G. Early highly aggressive MS succes-sfully treated by hematopoietic stem cell transplantation//Multiple Sclerosis. 2009;15(2):229-237 DOI: 10.1177/1352458508096875
- Radaelli M., Merlini A., Greco R., Sangalli F., Comi G., Ciceri F., Martino G. Autologous bone marrow transplantation for the treatment of multiple sclerosis//Cur Neurol Neuroscie Reports. 2014;14(9):478 DOI: 10.1007/s11910-014-0478-0
- Rogojan C. Frederiksen J.L. Hematopoietic stem cell transplantation in multiple sclerosis//Acta Neurologica Scan-dinavica. 2009;120(6):371-382 DOI: 10.1111/j.1600-0404.2009.01168.x
- «ВП-П8-2322. Комплексная программа развития биотехнологий в Российской Федерации на период до 2020 года» (утв. Правительством РФ 24.04.2012 1853п-П8) Доступно по: http://government.ru/media/files/41d4e85f0b854eb1b02d.pdf. Ссылка активна на 08.10.2015.
- Распоряжение Правительства РФ 2580-р от 28.12.2012 «Об утверждении Стратегии развития медицинской науки в Российской Федерации на период до 2025 года». http://www.rosminzdrav.ru/documents/5413-rasporyazhenie-pravitelstva-rossiyskoy-federatsii-ot-28-dekabrya-2012-g-n-2580-r. Ссылка активна на 08.10.2015.


