Высокоэффективные штаммы клубеньковых бактерий люцерны (Medicago varia L.): молекулярно-генетическая характеристика и использование в сопряженной селекции
Автор: Румянцева М.Л., Владимирова М.Е., Мунтян В.С., Степанова Г.В., Саксаганская А.С., Кожемяков А.П., Орлова А.Г., Becker A., Симаров Б.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Кормовые ресурсы
Статья в выпуске: 6 т.54, 2019 года.
Бесплатный доступ
В травостоях многолетних кормовых бобовых трав предпочтение отдается люцерне для создания культурных пастбищ и восстановления деградированных почв. Люцерна изменчивая ( Medicago sativa L. nothosubsp. varia (Martyn) Arcang) высокоурожайная и устойчивая к неблагоприятным условиям возделывания культура, что важно для зон рискованного земледелия России. Урожайность люцерны в значительной степени зависит от успешности формирования растительно-микробной симбиотической системы с клубеньковыми бактериями (ризобиями), которая становится способной фиксировать азот атмосферы. Согласно современным исследованиям по симбиогенетике, эффективность симбиотических систем предопределяется комплементарностью взаимодействия геномов растения и его микросимбионта. Исходя из этого и биопрепараты, которые используют для обработки семян бобовых, также должны содержать селекционно подобранные штаммы ризобий с соответствующими генотипическими характеристиками. В представленной работе впервые проведен сравнительный анализ урожайности 73 сорто-микробных систем, сформированных на основе штаммов Sinorhizobium meliloti , выделенных из района, подверженного засолению, и производственных штаммов 425а и 415б, которые используют для приготовления биопрепарата Ризоторфин, с сортами люцерны, созданными методами традиционной и сопряженной селекции. Показана перспективность отбора высокоэффективных штаммов, комплементарных хозяйственно-ценным сортам растений-хозяев в модельных опытах. Установлено, что штаммы А1 и А2 активнее формировали симбиотические системы с испытанными сортами люцерны, чем производственные штаммы. Впервые показано, что сорто-микробные системы на основе новых сортов обладают повышенной адаптивностью, а потенциал повышения прибавок урожая для них существенно превышает 50 %. Впервые получены данные, показывающие, что урожайность сорто-микробных систем, сформированных производственным штаммом 425а, преимущественно зависит от неконтролируемых факторов согласно двухфакторному дисперсионному анализу. Вместе с тем, геномные характеристики этого штамма играют более существенную роль, чем сорто-штаммовые взаимодействия, в формировании урожая, что, по-видимому, обуславливает востребованность биопрепаратов на основе этого штамма для разных сортов в различных географических районах Российской Федерации. Высокая комплементарность штаммов А1 и А2 к сорту Агния и функциональная значимость генетических характеристик штамма 425а обусловили интерес к их геномным характеристикам. Сравнительный анализ геномов с использованием ДНК-биочипов выявил существенные различия между высокоэффективными штаммами. Установлено, что гены, обуславливающие симбиотическую активность и стрессоустойчивость ризобий, имели дивергентную структуру преимущественно у штаммов, адаптированных к условиям засоления. Данные первых этапов молекулярно-генетического анализа высокоэффективных штаммов указывают на необходимость продолжения исследований, которые позволят осуществлять направленный подбор штаммов-микросимбионтов для современных сортов люцерны. Впервые представленные результаты оценки урожайности сорто-микробных систем, выращиваемых в различных природно-климатических условиях России, наглядно доказывают необходимость широкого внедрения метода сопряженной симбиотической селекции для создания новых хозяйственно ценных сортов бобовых трав, необходимых для формирования устойчивой кормовой базы.
Сорта люцерны, метод сопряженной селекции, высокоэффективные штаммы, симбиотические гены и гены стрессоустойчивости ризобий, геномные острова, сорто-микробные системы, урожайность, двухфакторный дисперсионный анализ
Короткий адрес: https://sciup.org/142226289
IDR: 142226289 | УДК: 636.2:631.52:631.461.52 | DOI: 10.15389/agrobiology.2019.6.1306rus
Текст научной статьи Высокоэффективные штаммы клубеньковых бактерий люцерны (Medicago varia L.): молекулярно-генетическая характеристика и использование в сопряженной селекции
Формирование устойчивой кормовой базы для животноводства и птицеводства, в том числе повышение качества кормов, — необходимое условие для эффективного развития современных агропромышленных комплек-
∗ Работа выполнена при финансовой поддержке Министерства образования и науки Российской Федерации (Соглашение ¹ 14.607.21.0178, RFMEFI60717X0178).
сов. Выращивание многолетних кормовых трав как пастбищных культур и включение их в зерновые и пропашные севообороты позволяет значительно удовлетворять потребности луговодства в азоте и существенно снижать экологические риски, связанные с применением минеральных удобрений.
Люцерна — кормовая культура, которая дает высокобелковый корм для скота и птицы, который богат всеми необходимыми витаминами, углеводами, минеральными солями и микроэлементами, а его перевариваемость достигает 70-80 % (1, 2). Люцерну издавна выращивали практически во всех основных почвенно-климатических зонах России. В настоящее время к использованию допущено 125 сортов люцерны, относящихся к трем видам: Medicago sativa L. nothosubsp. varia (Martyn) Arcang (люцерна изменчивая), Medicago sativa L. subsp. sativa (люцерна синяя) и Medicago sativa L. subsp. falcata (L.) Arcang (люцерна желтая) (3). Практическое предпочтение получила люцерна изменчивая (гибрид люцерны посевной и желтой), в которой успешно сочетается высокая урожайность, характерная для люцерны посевной, с высоким качеством сухого вещества и устойчивостью к неблагоприятным условиям возделывания, присущим люцерне желтой (1). Современные зимостойкие сорта этого вида можно выращивать в условиях холодного гумидного климата Нечерноземной зоны России. Люцерна изменчивая широко используется как сидерат для восстановления плодородия почв, в том числе деградированных. Выращивание этой кормовой культуры позволяет получать до 200 кг/га экологически безопасного биологического азота, а содержание азота в корневых и пожнивных остатках может достигать 120-200 кг/га (4).
Накапливаемый люцерной азот, который находится в биологически доступной форме, — это результат симбиотического взаимодействия растений с почвенными микроорганизмами ризобиями. Известно, что сорта бобовых значительно различаются по отзывчивости на инокуляцию разными штаммами и даже одним и тем же штаммом (5-8). Штаммы ризо-бий, которые используют для обработки семян растений, неодинаковы по способности формировать симбиоз на одном/нескольких сортах/видах растений-хозяев (хозяйская специфичность) (7, 9). Во многих исследованиях, направленных на повышение урожайности бобовых, приоритет отдается штаммам-микросимбионтам (10, 11). При этом авторы отмечают, что штаммы должны успешно конкурировать с местными штаммами в ри-зоплане корня растения-хозяина как в типовых условиях выращивания люцерны, так и при воздействиях различных абиотических факторов (засушливость, засоленность, низкие или высокие значения рН почвы) (8, 12-17). В ряде исследований показано, что штаммы, устойчивые к абиотическим факторам, чаще формируют эффективные симбиозы с растениями-хозяевами (15, 18-20). Однако вплоть до настоящего времени работы по селекции растений и штаммов-микросимбионтов ведутся раздельно (11, 21), хотя публикации, в которых обсуждается необходимость совместных исследований, также имеются (7, 14, 21).
Согласно последним достижениям симбиогенетики, в процессе формирования растительно-микробной системы происходит интеграция генетических ресурсов растений и микроорганизмов в единую систему (23). Факт того, что растительный и микробный компоненты, а также их взаимодействие играют ключевую роль при формировании симбиотических систем, рассмотрен в ряде работ (23-25). Следовательно, при направленном получении симбиотических систем, обладающих высокой урожайностью, следует учитывать хозяйскую специфичность штаммов по отношению к сорту растения-хозяина, однако в настоящее время такие иссле- дования немногочисленны (7, 21, 26, 27). На практике, несмотря на то, что экономическая целесообразность применения биопрепаратов под бобовые доказана (28-32) и под определенные виды бобовых используют соответствующие биопрепараты, сорто-штаммовая специфичность при этом не учитывается. В результате обработки посевов разных сортов одного вида бобовых штаммом, входящим в состав биопрепарата, происходит формирование «случайных» сорто-микробных систем, в которых может иметь место значительное варьирование симбиотрофных показателей, таких как густота посевов, накопление растительной массы, содержание белка (протеиновая питательность корма), развитие корневой системы, размер и количество клубеньков на корнях. Это приводит к снижению показателей продуктивности, что согласуется с имеющимися данными (6, 15, 33-35).
Именно принцип комплементарности геномов бобово-ризобиальных компонентов составляет основу современного биотехнологического метода создания сортов бобовых культур, учитывающего их симбиотрофные показатели. Впервые положительные результаты получены при селекции новых сортов клевера (36). Работы по созданию современных сортов люцерны, таких как Агния и Таисия (37), были начаты относительно недавно. Однако указанные сорта уже включены в Государственный реестр селекционных достижений и допущены к использованию в РФ соответственно в 2012 и 2015 году (3). Это стало возможным только благодаря тому, что новый биотехнологический подход позволяет сократить продолжительность селекционного процесса на 5-7 лет и создавать сорта нового поколения с повышенными показателями продуктивности (повышение кормовой массы и урожайности семян) (37).
В представляемой работе по результатам деляночных опытов, проведенных в рамках Географической сети опытов Всероссийского НИИ сельскохозяйственной микробиологии (ГСО ВНИИСХМ), выявлены высокопродуктивные сорто-микробные системы, обладающие узкой и широкой адаптивностью. Приведены первые результаты сравнительного анализа полногеномных последовательностей двух высокоэффективных и одного производственного штамма (425а), которые показывают перспективность дальнейших исследований геномов штаммов, направленных на создание высокопродуктивных сорто-микробных систем.
Цель настоящего исследования заключалась в оценке вкладов растительного и микробного компонентов и их взаимодействия в повышение продуктивности сорто-микробных систем, сформированных на основе сортов люцерны, полученных методами традиционной и сопряженной селекции, в симбиозе с высокоэффективными штаммами Sinorhizobium meliloti из экосистемы Приаралья и штаммами 425а и 415б, используемыми при производстве биопрепарата Ризоторфин для люцерны.
Методика . Штаммы 425а и 415б Sinorhizobium meliloti , на основе которых готовят Ризоторфин (разработка ВНИИСХМ), рассматривали как производственные; 141 природный штамм (изолят) S. meliloti изначально был выделен из клубеньков дикорастущих растений люцерны, произраставших на почвах с сульфатно-хлоридным типом засоления (38). Соле-устойчивость штаммов S. meliloti определяли по увеличению концентрации клеток штамма относительно начальной (OD 6 00 = 0,005) при выращивании культуры в жидкой полной среде TY (39), содержащей 3,5 % NaCl (w/v), в течение 96 ч при 28 °С и 180 об/мин, согласно описанию (38, 40). Штамм Rm1021 S. meliloti использовали в качестве референсного.
Молекулярно-генетический анализ штаммов. Общую ДНК бактерий выделяли из штаммов с использованием набора NucleoSpin
Tissue Kit («Macherey-Nagel GmbH», Германия). Мечение ДНК проводили с использованием набора Bio Prime с фрагментом Кленова ДНК-полимеразы I, случайными октамерами и аминоаллил-dUTP и флуорофорами Cy3 и Cy5 («Thermo Fisher Scientific», США). ДНК-пробы очищали на колонках Microcon («Millipore, США), количественно включившуюся метку определяли с использованием спектрофотометра Nanodrop («Thermo Fisher Scientific», США).
Геномы штаммов А1, А2 и 425а секвенировали методом MiSeq («Illumina», США). Для каждого штамма было получено от 7 до 15 контигов. Поиск последовательностей геномных островов в контигах проводили с использованием Mauve . Наличие геномных островов (ГО) в геномах проверяли методом ПЦР с оригинальными парами праймеров для внешних пограничных участков (41). ДНК-биочипы для гибридизации на основе полной геномной нуклеотидной последовательности референс-штамма Rm1021 (NC_003037, NC_003047, NC_003078) были предоставлены Центром биотехнологии университета г. Билефельд (Center for Biotechnology, Bielefeld University, Германия). Каждый чип содержал 6205 геноспецифичных 70-мерных олигонуклеотидных зондов в трех повторностях. Чипы гибридизовали в соответствии со стандартными условиями (42), сканирование проводили с использованием Tecan HS 4800 Pro («Tecan», Швейцария), сканы анализировали с помощью программ Genepix («Molecular Devices», США) и EMMA (Bielefeld University, Германия). Вероятности присутствия/отсутствия генов и динамический порог отсечения для каждого из экспериментов вычисляли с применением программ GACK (43) и Statistica 6.0 («Dell Software Company», США).
Оценка симбиотической активности штаммов. В мик-ровегетационных опытах растения люцерны сорта Вега вида M. varia инокулировали испытуемыми штаммами и выращивали на вермикулите без добавления азота (типовые условия) в пробирках объемом 85 см3 или на 0,7 % агаризованной среде Красильникова-Кореняко с добавлением 0,6 % NaCl (условия засоления) в пробирках объемом 60 см3 в 8-кратных повторностях согласно описанию (13). Симбиотическую эффективность штаммов оценивали по прибавке сухой массы инокулированных растений (СМР), рассчитанной по воздушно-сухой массе (высушивание растений каждого образца при 37 °С в течение 7 сут до постоянной массы) по отношению к массе неинокулированных растений (контроль без инокуляции, КБИ).
Деляночные опыты проводили в ГСО ВНИИСХМ в четырех географических районах на делянках с учетной площадью от 1,8 до 24 м2 в период с 2003 по 2018 год. Всего выращивали 10 сортов люцерны изменчивой ( M. varia ), полученных методами традиционной и современной селекции, и сорт Мира люцерны хмелевидной ( M. lupulina ). К сортам люцерны изменчивой, полученным традиционным методом селекции, относились Вега 87, Лада, Луговая 67, Пастбищная 88, Селена, Марусинская 425, Сюлин-ская и Кузбасская, к полученным современным методом сопряженной селекции — Агния и Таисия, а также сортообразец Л10/2. Сорта люцерны Марусинская 425 (оригинатор ОНО «Моршанская селекционная станция») и Кузбасская (оригинатор ФГБУН Сибирский федеральный научный центр агробиотехнологий РАН) получены методом отбора дикорастущих экотипов люцерны, дальнейший отбор проводили по высокой урожайности на плодородной почве; внесены в Государственный реестр селекционных достижений соответственно в 1938 и 1957 году (3). Сорт Сюлинская адаптирован к условиям Центральной Якутии, обладает высокой зимостойкостью, в Государственный реестр не внесен. Сорта интенсивного типа Вега
87, Лада, Луговая 67 созданы для возделывания на агрофонах с внесением высоких доз минеральных удобрений (3, 44). Сорта Пастбищная 88 и Селена получены от скрещивания генотипов люцерны с высокой адаптивной способностью для возделывания на слабокислых и средне окультуренных почвах (3, 44). Эти сорта включены в Государственный реестр в 1998 и 2000 году. Сорта Агния и Таисия созданы с использованием биотехнологии сопряженной симбиотической селекции для возделывания на средне окультуренных и неокультуренных почвах; включены в Государственный реестр соответственно в 2012 и 2015 году (3, 44). Сорт Мира люцерны хмелевидной ( M. lupulina ) создан с применением химического мутагенеза на основе местной дикорастущей люцерны из Московской области (3, 44).
Предпосевную обработку семян проводили методом опудривания или рабочим раствором препарата; посев широкорядный, с шириной междурядий 0,3-0,7 м, на глубину 2-3 см; повторность делянок 3- или 4-кратная; норма высева 2,4 млн семян/га; удобрения не применяли (данные ГСО) (29). Обязательная отчетность по каждому опыту включала значения сухого вещества (СВ; высушивание растений при 105 °С до постоянной массы) и/или зеленой массы растений (ЗМР), полученных по отдельным укосам или суммарные величины укоса травостоя за вегетационный период. Опыты по выращиванию разных сортов люцерны могли существенно различаться по схемам, но, как правило, продолжались не менее 2-3 лет, а число независимых экспериментов могло варьировать от 2 до 6. Величину СВ и/или ЗМР для каждой повторности опыта и контроля без инокуляции, а также среднее и ошибки среднего значения СВ и/или ЗМР рассчитывали, исходя из значений СВ и/или ЗМР, полученных для каждой повторности опыта и для КБИ. Кроме того, по каждому деляночному опыту предоставляли значения НСР05, показывающие достоверность различий между опытом и КБИ (45). При проведении многолетних (5-6-летних) исследований на сортах Агния, Таисия, Селена, Луговая Л10/2, Марусинская 465, Вега 87, Лада и Пастбищная 88 массу растений, ее средние значения, ошибки средних и НСР05 получали отдельно для каждого года.
Статистическая обработка данных . Оценку урожайности сорто-микробных систем, сформированных на основе указанных выше сортов и штаммов клубеньковых бактерий, оценивали по прибавке урожая зеленой (ЗМР) или сухой массы растений (СМР) либо сухого вещества (СВ) в случае деляночных опытов, согласно следующей формуле:
ПМ i = [(МР i – М КБИ i )/М КБИ i ] ½ 100 %, где ПМ i — прибавка урожая в i -м эксперименте, МP i — масса растений в i -м эксперименте, МКБИ i — масса КБИ в i -м эксперименте согласно данным ГСО. Среднюю прибавку урожая (СП) вычисляли по ЗМР и СВ как
СП = (∑ПМ i / n ), где i — номер опыта, n — число опытов. При расчете СП не учитывали резко выделяющиеся значения прибавок, которые определяли на основании их относительных отклонений (45). Ошибку С П вычисляли по формуле:
x = S/V n, где х — ошибка СП, S — стандартное отклонение, рассчитанное для значений ПМ, n — число опытов. В том случае, когда имелось только одно значение ПМ (результат одного опыта), то определяли ошибку в 5 %.
Однофакторный дисперсионный анализ (ANOVA) использовали для оценки достоверности величин прибавок сухой массы растений, получаемых в результате их инокуляции штаммами клубеньковых бактерий, при а = 0,05 (46). Двухфакторный дисперсионный анализ (46) проводили для количественной оценки вкладов генотипов растений-хозяев и генотипов изучаемых штаммов в формирование прибавки урожая, оцениваемого по ЗМР или СВ.
Коэффициент корреляции определяли согласно описанию (47), критерий χ2 — в программном пакете PAST (48).
Результаты . Оценка симбиотических свойств штаммов в микровегетационных опытах . При изучении симбиоза 141 штамма S. meliloti с сортом Вега 87 вида M. varia в стандартизированных условиях стерильных микровегетационных опытов мы выявили 36 штаммов, которые формировали высокоэффективный симбиоз с растениями (средний разброс прибавок СМР у инокулированных растений находился в пределах от 77,0 до 157,9 % относительно референса). Наиболее перспективными были признаны шесть штаммов (А1-А6), различавшихся по солеустойчивости (табл. 1). Прибавки по СМР от инокуляции штаммами А2, А4 и А5, имевшими разный фенотип, составили в среднем 317 %, штаммами А3 и А6 (солечувствительный фенотип) — более 180 % по отношению к контролю без инокуляции. Наибольшее значение прибавки установили при использовании штамма А1 солеустойчивого фенотипа — соответственно > 500 и 360 % относительно КБИ и референса (см. табл. 1). Величины прибавок относительно штамма-референса были сходными в случае штамма А6, превышали на 70 % в случае штамма А3 и были более чем в 2 раза выше последней при инокуляции штаммами А2, А4 и А5 (см. табл. 1). В условиях модельного засоления инокуляция испытуемыми штаммами также способствовала увеличению сухой массы растений. Статистически значимые прибавки по отношению к референсу получили только в случае штаммов А2, А4 и А5 (в среднем более 180 %; p < 0,05). Исключение составил штамм А1, который формировал высокоэффективный симбиоз в незасоленных условиях, тогда как при засолении оцениваемая прибавка СМР была более чем на 20 % ниже величин, полученных для штаммов А3 и А6, но сходной с таковой для референса (см. табл. 1).
1. Оценка симбиотической активности штаммов Sinorhizobium meliloti с люцерной сорта Вега 87 ( Medicago varia L.) в микровегетационных опытах
Таким образом, анализ симбиотических свойств шести штаммов, из которых два имели солеустойчивый, а четыре — солечувствительный фенотип, не позволяет сделать вывод о взаимосвязи между собственной солеустойчивостью штаммов и возможностью формировать ими стрессоустойчивые симбиотические системы, что, однако, не противоречит результатам, о которых мы сообщали ранее (38). В то же время анализ величин прибавок СМР, полученных в незасоленных и засоленных условиях, выявил положительную корреляцию: штаммы, инокуляция которыми способствовала значительному повышению урожайности растений в незасо- ленных условиях, также формировали высокопродуктивные симбиотические системы при засолении (коэффициент корреляции r составил 0,89).
Оценка симбиотических свойств штаммов в деляноч-ных опытах. Симбиотическую эффективность и хозяйскую специфичность указанных штаммов проверяли в симбиозе с 10 сортами люцерны изменчивой ( M. varia ), полученными методами традиционной и современной селекции, а также с люцерной хмелевидной сорта Мира ( M. lupulina ) (табл. 2). В качестве группы сравнения использовали производственные штаммы 425а и 415б. Всего изучили 73 сорто-микробные системы, из которых 32 проверили в 2-6 независимых экспериментах в условиях модельных деляночных опытов в рамках ГСО (см. табл. 2).
-
2. Районы проведения деляночных опытов с разными сортами люцерны в рамках Географической сети опытов (ГСО ВНИИСХМ)
Опытные поля
Характеристика почв
Брянская область1, Брянская государственная сельскохозяйственная академия (Брянская ГСХА; с 2014 года — Брянский государственный аграрный университет), 2002-2009 годы
Московская область1, Федеральный научный центр кормопроизводства и агроэкологии имени В.Р. Вильямса (ФНЦ ВИК им. В.Р. Вильямса), 2002-2018 годы ФГБНУ Новгородский научно-исследовательский и проектно-технологический институт сельского хозяйства (Новгородский НИПТИСХ)2, 2005-2009, 2018 годы ООО «РосАгро» Волосовского района Ленинградской области2, 2015 год Томский государственный педагогический университет (ТГПУ)3, 2002-2006 годы Приморский НИИ сельского хозяйства (Приморский НИИСХ)4, 2014 года ФГБНУ Якутский НИИ сельского хозяйства им. М.Г. Сафонова (Якутский НИИСХ), ГМУ4, 2011 год
Серая лесная легкосуглинистая почва среднеокультуренная (рН 5,7)
Дерново-подзолистая, среднесуглинистая, слабо окультуренная почва (рН 4,49-5,08), неокульту-ренная почва
Сорта люцерны измен чивой ( Medicago varia L.) Марусинская, Селена, Вега 87, Лада, Луговая 67
Пастбищная, Агния, Таисия, Селена, Луговая 67 (Л10/2), Мира (люцерна хмелевидная M. lupulina L.)
Дерново-подзолистая, легкосугли- Пастбищная, Вега 87, Селенистая на глине, средне окульту- на, Лада, Луговая 67 ренная почва
Дерново-карбонатныея окульту- Агния, Таисия ренные почвы (pH 6,5)
Серая лесная почва Кузбасская
Лугово-бурая, тяжелый суглинок Вега 87
Таежно-палевые мерзлотные поч- Сюлинскаяй вы, темновато серые подзолистые среднесуглинистые, на светло-пале-
-
3. Симбиотрофные показатели сорто-микробных систем, сформированных штаммами Sinorhizobium meliloti с разными сортами люцерны изменчивой ( Medi-cago varia L.) в деляночных опытах (ГСО ВНИИСХМ)
вом суглинке
Прим еч ани е. 1 — Центральный, 2 — Северо-Западный, 3 — Западно-Сибирский, 4 — Дальневосточный районы постановки деляночных опытов по Географической сети опытов (ГСО ВНИИСХМ). Поч- венные характеристики, период и условия проведения опытов, сорта люцерны приведены согласно отчетным карточкам ГСО (см. раздел «Методика»).
Так как схемы поставленных опытов различались (контрольные штаммы, число укосов и экспериментов, годы исследований, учитываемые параметры), сравнительный анализ симбиотрофной эффективности сортомикробных систем, сформированных на основе указанных выше сортов и штаммов ризобий, проводили по показателям прибавок урожая зеленой массы растений (ЗМР) и/или сухого вещества (СВ), средние значения прибавок для которых приведены в таблице 3. Значения прибавок, полученные для однократных 2-3 летних экспериментов, приведены с указанием года учета результатов (см. табл. 3).
Оценка урожайности сорта Сюлинская в симбиозе со штаммом А1 или А2 или с производственным штаммом 425а не выявила достоверных различий (р > 0,05) между этими тремя сорто-микробными системами в условиях Дальневосточного географического района (см. табл. 3). В то же время сорт Сюлинская оказался отзывчивым на инокуляцию производственным штаммом 415б, поскольку величина прибавки ЗМР была почти в 2 раза выше, чем в случае вышеуказанных штаммов (см. табл. 3). Интересно, что статистически значимые прибавки ЗМР для симбиотических систем Сюлинская-А2 и Селена-А2, выращиваемых в географически удаленных регионах (соответственно Дальневосточный и Центральный), были сходными (среднее значение 47,7±9,4 %). Инокуляция люцерны сорта Селена штаммом А2 способствовала 4-кратному увеличению СВ растений по сравнению с использованием производственного штамма 425а в условиях Центрального региона, тогда как системы, образуемые сортом Селена со штаммами А2 или А3 либо с производственными штаммами 425а или с 415б, достоверно не различались по величинам прибавок ЗМР в условиях СевероЗападного географического района (р > 0,05). Урожайность по СВ для системы Селена-А2 была достоверно выше, чем для системы Пастбищная 88-А2 (более чем в 2 раза) в условиях Центрального региона (см. табл. 3).
Высокие значения прибавок (по ЗМР) на сорте Пастбищная 88 по- лучили при использовании штаммов А1 или А2 в условиях другого географического района — Северо-Западного (среднее значение 70,4±8,3 %), что более чем в 3 раза превышало средние значения прибавок при применении производственного штамма 425а (р < 0,05; см. табл. 3). При этом прибавки по ЗМР, полученные для систем Селена-А2 и Селена-А3, были сходными с величиной прибавки, установленной для системы Пастбищная 88-А2, но более чем в 3 раза выше, чем для системы Пастбищная 88-425а. Следует отметить хорошую отзывчивость сорта Пастбищная 88 на инокуляцию штаммом 415б (прибавки по ЗМР), тогда как прибавки от инокуляции штаммом 425а могли значительно разниться по годам исследований (2009 год, см. табл. 3) в условиях Северо-Западного региона. Согласно полученным данным, симбиотическая система Селена-А2 может быть рекомендована для выращивания в двух районах Центрального и Северо-Западного регионов как высокоэффективная и обладающая широким адаптивным потенциалом, а системы Селена-А3, Пастбищная 88-А1/А2 — для условий Северо-Западного региона. Также для последнего географического района может представлять интерес инокуляция сортов Селена и Пастбищная 88 производственным штаммом 415б или 425а, но ожидаемые прибавки урожая, вероятно, окажутся существенно ниже (см. табл. 3).
Сорт Марусинская 425 изучали в симбиозе с пятью испытуемыми штаммами, сорт Кузбасская — с А2, также оба сорта оценивали в симбиозе с производственным штаммом 425а. Прибавки для указанных симбиотических систем на основе сорта Кузбасская со штаммом А2 или с производственным штаммом 425а (усредненные значения прибавок соответственно 14,5 и 17,3 %, см. табл. 3), как и для сорта Марусинская 425 в симбиозе со штаммом А2 или А3 (среднее значение 17,9±2,7 %), достоверно не различались. Незначительно большие прибавки регистрировали в случае инокуляции того же сорта штаммом А4 или производственным штаммом 425а (см. табл. 3). Следует отметить крайне низкую отзывчивость сорта Марусинская 425 на инокуляцию штаммом А1, вместе с тем размер прибавки мог существенно варьировать по годам исследований (2008 год, см. табл. 3). Наиболее высокие значения прибавок получены для системы Марусинская 425-А5 (прибавки по ЗМР выше в 1,3 раза, чем для штамма 425а) (см. табл. 3).
Сорт Вега 87 преимущественно испытывали в Северо-Западном регионе со штаммами А1, А2, А3 и с обоими производственными штаммами, тогда как в Центральном — только в симбиозе с А2. Урожайность системы Вега 87-А2, оцениваемая по ЗМР, была в 2,5 раз выше в Северо-Западном регионе, чем в Центральном, при этом следует отметить нестабильность величины прибавок по годам исследований (2009 год, см. табл. 3). Более высокие показатели урожайности получены для системы Вега 87-А1 (прибавка ЗМР 120,1±6,0 %) и почти в 2 раза более низкие — для системы Вега 87-А3 в том же географическом районе (см. табл. 3). Вместе с тем инокуляция сорта Вега 87 производственным штаммом 425а не приводила к статистически значимым прибавкам (4,0±0,2 %; см. табл. 3), тогда как использование производственного штамма 415б позволяло получать среднюю прибавку 25,5 %, величина последней также могла возрастать в несколько раз в условиях Северо-Западного региона в зависимости от года исследований (2016 год, см. табл. 3). Системы Вега-87-А1 и Вега 87-А2 следует рассматривать как высокоурожайные для Северо-Западного региона.
Урожайность сорта Лада от инокуляции штаммом А2 в условиях Центрального, а также Северо-Западного регионов была сходной (среднее значение 42,5±2,2 %; см. табл. 3). Инокуляция растений сорта Луговая 67 сопровождалась формированием эффективной симбиотической системы только в случае использования производственного штамма 425а (прибавка по СВ составила 20,5 %) в условиях Северо-Западного региона (см. табл. 3). Следовательно, систему Лада-А2 можно рассматривать как эффективную и обладающую широкой адаптивностью, тогда как система Луговая 67-425а дает статистически значимые, но невысокие прибавки при выращивании в Северо-Западном регионе.
Таким образом, использование производственного штамма 425а позволяет получать прибавки урожая (по ЗМР), варьирующие от 4 до 27,3 % на сортах Вега 87, Кузбасская, Лада, Луговая 67, Марусинская 425 и Пастбищная 88. Значимые прибавки на сортах Вега 87 и Пастбищная 88 могут быть получены при инокуляции производственным штаммом 415б. Статистически значимые прибавки на сорте Селена (не менее 50 %) ожидаемы при инокуляции любым из двух упомянутых штаммов, тогда как отзывчивость сорта Сюлинская на инокуляцию штаммом 415б была в 2 раза выше (более 70 %). Испытуемые высокоэффективные штаммы позволяли получать прибавки по ЗМР от 40 до 80 % на 5 из 8 сортов, полученных традиционными методами селекции, при этом в случае сортов Пастбищная 88 и Селена создаваемые сорто-микробные системы обладали высоким адаптивным потенциалом.
Особенно следует отметить тот факт, что штамм А1, отобранный по данным микровегетационных опытов на сорте Вега 87 как суперэффективный, способствовал получению наиболее высоких показателей урожайности этого сорта и в полевых опытах. Штаммы А1 и А2 также испытывали в симбиозе с сортом Мира люцерны хмелевидной. Урожайность соответствующих сорто-микробных систем не уступала и даже превышала по величине прибавку, полученную при использовании производственного штамма 415б. Штаммы А1 и А2 можно рассматривать как перспективные для использования в качестве микробного препарата под посевы люцерны хмелевидной сорта Мира как сидерата на слабокислых почвах.
Таким образом, представленные результаты по симбиотической активности штаммов с сортами люцерны, полученными традиционными методами селекции, однозначно свидетельствуют о необходимости селекционного подбора высокоэффективных штаммов в модельных лабораторных условиях и важности оценки генетической комплементарности микро- и макросимбионтов в создаваемых сорто-микробных системах.
Агния и Таисия — сорта нового поколения, при создании которых учитывались симбиотрофные показатели. Урожайность сорта Агния оценивали со штаммом А1, который использовали в процессе создания сорта, а также со штаммами А2-А6 в деляночных опытах в Центральном и Северо-Западном регионах. Необходимо отметить высокую отзывчивость сорта Агния на инокуляцию штаммами А1-А4 (средняя прибавка по СВ 153,9 %; см. табл. 3) и сорта Таисия — штаммами А2-А5 в условиях Центрального региона, тогда как симбиотрофные показатели для этих же сортов при их инокуляции штаммом А6 были либо сопоставимы, либо ниже таковых при использовании штамма 415б (см. табл. 3). Сорт Агния районирован в Центральном регионе и при выращивании в другом районе показатели урожайности могут отличаться. В условиях Северо-Западного региона высокие прибавки по СВ были получены при инокуляции растений сорта Агния штаммами А5 или А6 (среднее значение 146,1 %), а также штаммом А4 (более 60 %; см. табл. 3), тогда как высокоэффективный симбиоз с сортом Таисия формировал штамм А6 (прибавки по ЗМР и СВ соответственно 176,6 и 98,0 %). Следует отметить, что урожайность (по СВ) сорта Агния и Таисия могла возрастать в 2,5-4 раза в некоторые годы исследо- ваний в Центральном (2008, 2014 годы) и в 1,5-2 раза в Северо-Западном регионе (2012, 2015 годы; см. табл. 3).
Сходно высокие прибавки получены в опытах с новым сортообраз-цом Л10/2 (Г.В. Степанова, персональные данные), который инокулировали штаммами А1-А5. Показатели урожайности по ЗМР для штаммов А1-А4 были сходными и составили в среднем 154,3±9,0 %, что 2-кратно превышало прибавки, полученные при использовании штамма 415б. В случае штамма А2 значение прибавки было в 7 и 23 раза выше (в зависимости от года исследования; см. табл. 3), чем величина прибавки, полученная при инокуляции исходного сорта Луговая 67.
Таким образом, инокуляция сорта Агния производственными штаммами 425а или 415б или сорта Таисия последним из указанных штаммов не позволяла получать значения прибавок по СВ соответственно более 10 % и 23 % в Северо-Западном и в среднем 35 % — в Центральном регионе, но в некоторые годы величины прибавок также могли возрастать соответственно в 4,0 и 2,6 раза (2014 год, см. табл. 3). В случае инокуляции сорта Агния или сортообразца Л10/2 штаммами А1-А4 величина прибавок варьировала от 130 до почти 200 % по годам исследований (по СВ и по ЗМР), на сорте Таисия прибавки составили от 79 до 102 % при инокуляции штаммами А2-А5 в Центральном регионе. Выявлено два штамма — А6 и А3, которые формировали высокоэффективные системы с сортом Агния или Таисия только в одном из двух географических районов исследования: штамм А3 — в Центральном, А6 — в Северо-Западном. Высокая урожайность системы Агния-А6 подтвердилась в производственном опыте на делянках площадью 0,1 га (ООО «РосАгро», Волосовский р-н, Ленинградская обл.) (54). Прибавка урожайности по ЗМР в этом опыте, как определено в указанной работе, составила 163,4±8,7 % (см. табл. 3). А4 и А5 (в отличие от указанных выше штаммов) формировали высокоэффективные системы с обоими сортами в обоих районах исследования. Полученные результаты показывают, что сорта, созданные на основе сопряженной селекции, имеют высокую отзывчивость на инокуляцию, что позволяет в 2-3 раза поднять урожайность, вместе с тем для них характерна высокая специфичность растительно-микробного взаимодействия.
Двухфакторный дисперсионный анализ данных де-ляночных опытов. Цель анализа заключалась в определении роли факторов варьирования (вкладов) со стороны растительно-микробных систем (макро- и микросимбионты, их сочетания) и неконтролируемых факторов в формирование урожая. Анализ величин прибавок для сортов, полученных методами традиционной селекции (сорта ТС — Пастбищная 88, Сюлинская, Вега 87, Марусинская 425) и методом сопряженной селекции (МСС — сорта Агния, Таисия, сортообразец Л10/2), которые формировали симбиозы с изучаемыми высокоэффективными штаммами, позволил показать, что в случае сортов МСС наибольшее влияние на формируемые с ними симбиотические системы оказывали штаммы бактерий-микросимбионтов (значение вклада составило 11,58 %), тогда как с сортами ТС, наоборот, больший вклад был обусловлен генетическими характеристиками растений этих сортов люцерны (6,99 %; рис., А). Неконтролируемые факторы в указанных случаях оказывали сходное влияние на сорто-микробные системы, сформированные на основе сортов МСС или ТС. Оценка вклада штаммов показала, что высокоэффективные природные штаммы А1-А4 активно формировали симбиоз на изученных сортах люцерны (вклад 56,6 %), а в случае производственных штаммов 425а и 415б определенную роль (6 %) в формировании симбиотических систем с рассматри- ваемыми сортами растений играли их геномные характеристики (см. рис., Б). Установлено, что симбиотические системы на основе высокоэффективных штаммов А1-А4 были менее подвержены воздействию со стороны неконтролируемых факторов, чем симбиотические системы, сформированные производственными штаммами 425а и 415б (соответственно 47,8 и 107,2 %; см. рис., Б).
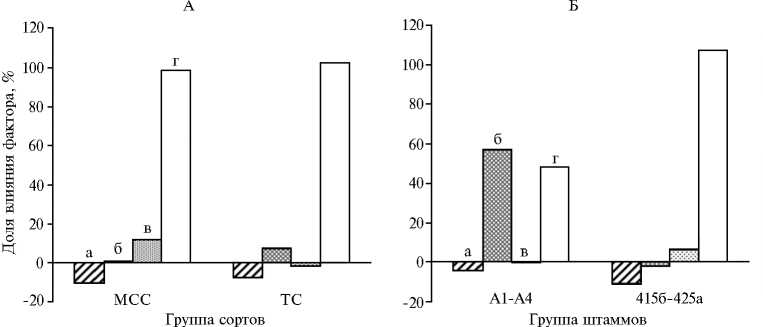
В
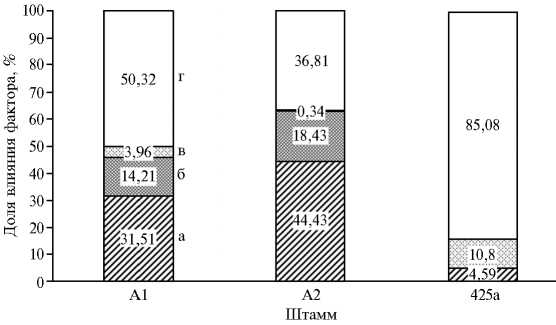
Двухфакторный анализ урожайности сорто-микробных систем на основе сортов люцерны, полученных методами традиционной и симбиотической селекции, с высокоэффективными штаммами клубеньковых бактерий Sinorhizobium meliloti : А — вклады сортов, полученных методами традиционной селекции и методом сопряженной селекции, в симбиозе с изучаемыми высокоэффективными штаммами; Б — вклады природных и производственных штаммов в формирование прибавки урожая у изучаемых сортов люцерны изменчивой; В — вклады штаммов А1, А2 и 425а в формирование прибавки урожая у изучаемых сортов люцерны изменчивой; а — комбинация сорт-штамм (с-ш), б — сорта растений (с), в — штамм (ш), г — неконтролируемые факторы (нф). МСС — сорта люцерны, полученные методом сопряженной селекции (Агния, Таисия, сортообразец Л10/2); ТС — сорта люцерны, полученные методами традиционной селекции (Пастбищная 88, Сюлинская, Вега 87, Марусинская 425); А1, А2 и 425а — высокоэффективные штаммы S. meliloti .
Этот же метод анализа мы использовали для оценки факторов варьирования в формирование прибавки урожая сорто-микробных систем на основе штаммов А1, А2 и 425а и сортов ТС (Пастбищная 88, Сюлинская, Вега 87, Марусинская 425) и МСС. Это позволило показать, что в случаях сорто-микробных систем, сформированных штаммом А1 или А2, существенный вклад принадлежал сочетаниям сорта растения-хозяина и штамма-микросимбионта (31,5 и 44,4 % по урожайности). Вклад генотипических характеристик сорта растения-хозяина в формирование урожайности для этих систем варьировал соответственно от 14,2 до 18,4 % (см. рис., В).
Следует отметить, что генотипические характеристики штамма А1 влияли на урожайность симбиотической системы (вклад 3,96 %). Анализ сортомикробной системы на основе штамма 425а, наоборот, показал, что неконтролируемые факторы — основные по влиянию на урожайность формируемых этим штаммом симбиотических систем. Генотипические характеристики штамма 425а (вклад 10,80 %) и его взаимодействие с растением-хозяином (вклад 4,59 %) определяли не более 16 % прибавки урожая.
Таким образом, нами впервые выявлено, что генотипические характеристики штамма 425а более значимо воздействуют на формирование симбиотических систем, тогда как его хозяйская специфичность по отношению к тому или иному сорту не очевидна. Обнаруженным фактом может объясняться успешность широкого применения биопрепаратов на основе этого штамма в России в различных агроценозах. В то же время использование высокоэффективных штаммов (А1-А6) — симбионтов растений люцерны, адаптированных к стрессовым условиям Приаралья, в процессе создании сортов Агния, Таисия и Л10/2 сопряженным методом селекции показало, что такие сорта обладают повышенной отзывчивостью на инокуляцию штаммами клубеньковых бактерий. Дальнейший подбор комплементарных генотипов позволяет повысить урожайность не менее чем на 50 % и создавать новые сорто-микробные системы с большей устойчивостью к абиотическим неконтролируемым факторам, что определяет возможность их выращивания в различных агроклиматических условиях.
Поскольку при выполнении работы нами была обнаружена высокая симбиотическая комплементарность штаммов А1 и А2 к сорту Агния, созданному для выращивания на средне окультуренных и неокультурен-ных почвах, и выявлена значимость генотипических характеристик штамма 425а, то изучение геномных характеристик этих высокоэффективных штаммов стало актуальным.
Молекулярно-генетический анализ штаммов. Мы провели сравнительный анализ геномов высокоэффективных штаммов А1, А2 и 425а с использованием ДНК-биочипа SM6kOligo, сконструированного на основе генома референсного штамма Rm1021 (49). Установлено, что в геноме проанализированного штамма СХМ1 (49) — стрептомицинустой-чивого мутанта штамма 425а отсутствуют 508 ОРС (открытые рамки считывания), а у штаммов А1 и А2 — соответственно 601 и 432 ОРС, однако их последовательности могут присутствовать, но иметь значительные структурные изменения. Указанные ОРС (функционально значащие последовательности или гены), как установлено, локализованы как на хромосоме, так и на двух мегаплазмидах, наличие которых характерно для этого вида ризобий. Был проведен анализ 72 ОРС, активность которых важна для формирования и функционирования симбиоза. Указанная группа ОРС включала 17 nod генов, описанных на симбиотической мегаплазмиде (SMa) референсного штамма, которые детерминируют или вовлечены в контроль процессов вирулентности, конкурентоспособности, клубенькообразования и хозяйской специфичности, а также гены fix и nif (соответственно 31 и 8), детерминирующих процесс азотфиксации и его эффективность. Установлено, что все указанные nod гены присутствуют в геноме СХМ1, тогда как в геноме штамма А1 последовательности генов nodD3 и nodN, по-види-мому, несут значительные структурные изменения (дивергентные гены). Анализ fix генов показал, что в геноме СХМ1 может отсутствовать три гена (fixL, fixT2 и fixM), а в геномах штаммов А1 и А2 — соответственно четыре (fixO3, fixT2, fixP2, fix) и шесть генов (fixO3, fixL, fixN3, fixP3, fixI2, fixH). Также значительные структурные изменения выявлены в двух nif генах штамма А1 (nifD и nifN). Анализ группы из шести nod генов, локализованных у референсного штамма на мегаплазмиде II, выявил у всех трех проанализированных штаммов структурные изменения в двух генах, расположенных на второй мегаплазмиде SMb (SMb20775 и SMb20825), продукты которых — это сигнальный рецептор клубенькообразования (предполагаемая ацетилтрансфераза NodL семейства; расположен на внешней мембране клетки). Гибридизационный анализ последовательностей шести локализованных на хромосомах проанализированных штаммов генов (трех nod, двух fix и одного nif гена), активность которых важна для формирования и функционирования симбиоза, показал их консервативность и присутствие в геномах всех штаммов.
Помимо генов, имеющих непосредственное отношение к симбиозу, были проанализированы 23 гена, имеющие отношение к солеустойчивости штаммов. Рассматривали 6 групп: kup , kdp , trk и kef , которые ответственны за внутриклеточную концентрацию катионов калия, ots / tre (кодируют систему накопления трегалозы) и bet гены (кодируют системы накопления, биосинтеза и катализа бетаинов). Установлено, что четыре группы проанализированных генов консервативно присутствовали в геномах всех изученных штаммов, вместе с тем значительные структурные изменения, имеющие функциональное значение, выявлены для штаммов CXM1 и А1 по группам bet и trk , у CXM1 отсутствовал (или изменен) ген bet B2, а у штамма А1 — ген trk D. Следовательно, гены из рассмотренных групп, имеющие измененные структурные последовательности (или дивергентные гены) наиболее часто встречаются у штаммов, адаптированных к условиям засоления, в которых они формируют симбиоз с растениями люцерны.
Был проведен анализ штаммов А1 и А2 и 425а на наличие дополнительных элементов генома, или геномных островов (ГО), которые имеют фаговое происхождения и участвуют в процессе горизонтального переноса генов (49). Анализ контигов, полученных для штаммов А1 и А2 и 425а, позволил выявить шесть ГО, наличие которых в геномах исследуемых штаммов было подтверждено с использование метода ПЦР детекции (см. раздел «Методика»). Установлено, что в отличие от референсного штамма, у которого три ГО, у высокоэффективных штаммов методом ПЦР детекции (см. раздел «Методика») выявили три, два и один ГО. Длины островов у референсного штамма варьировали 19 до 80 т.п.н, тогда как у высокоэффективных штаммов — от 10,6 до 44 т.п.н. Анализ нуклеотидных последовательностей островов по данным секвенирования показал, что один из островов (10,6 т.п.н.) штамма А2 имел гомологию с ГО Sme80S (80 т.п.н.) референсного штамма, а также с островом размером 10 т.п.н. у 425а (82 % гомологии). Второй остров штамма А2 размером 44 т.п.н. имел последовательности, гомологичные ГО (27 т.п.н.) штамма А1 (85 % гомологии), тогда как два других ГО того же штамма не имели гомологичных последовательностей как между собой, так и с третьим островом этого же штамма. Представленные данные указывают на то, что ГО, выявленные у высокоэффективных штаммов, содержат разную генетическую информацию, а также подтверждают факт участия ГО в горизонтальном переносе генов и передаче штаммам-реципиентам новой генетической информации.
Следовательно, данные молекулярно-генетического анализа, предпринятого нами для сравнения геномов высокоэффективных штаммов А1, А2 и производственного штамма 425а, уже на первых этапах исследования свидетельствуют в пользу того, что их пулы генов, важных для формирования стрессоустойчивых симбиотических систем, имеют существенные структурно-функциональные различия.
В заключение подчеркнем, что нами впервые проведен сравнительный анализ высокоэффективных штаммов из района Приаралья, подверженного засолению, и производственных штаммов 425а и 415б, которые используют для приготовления биопрепарата Ризоторфин по симбиотической эффективности и геномным характеристикам. Впервые показано, что высокоэффективные штаммы, отобранные по симбиотрофным показателям в микровегетационных лабораторных опытах, активно формируют симбиотические системы с сортами люцерны, полученными методами традиционной и современной сопряженной селекции. В то же время сортомикробные системы на основе современных сортов обладают повышенной адаптивностью и урожайностью (прибавки выше более чем на 50 % по сравнению с сортами традиционной селекции). Впервые получены данные, показывающие, что урожайность сорто-микробных систем, сформированных производственным штаммом 425а, зависит преимущественно от внешних неконтролируемых факторов (больше 80 %). Вместе с тем геномные характеристики этого штамма играют более существенную роль, чем сорто-штаммовые сочетания в варьировании прибавки урожая, что, по-видимому, обусловливает востребованность биопрепаратов на основе этого штамма для разных сортов растений в различных географических районах России.
Итак, урожайность растительно-микробных систем на основе сортов, полученных с учетом симбиотрофных показателей, и высокоэффективных штаммов клубеньковых бактерий, адаптированных к условиям засоления, достоверно превышала по показателям зеленой массы растений и сухого вещества аналогичные показатели для «случайно» сформированных симбиотических системы на основе производственных штаммов 425а и 415б. Сорта современной селекции обладают повышенной отзывчивостью на инокуляцию штаммами клубеньковых бактерий, а дальнейший подбор комплементарных генотипов будет способствовать существенному повышению урожая и созданию новых сорто-микробных систем с повышенной устойчивостью к абиотическим стрессовым факторам, что расширит возможность их выращивания в различных агроклиматических условиях. Представленные результаты оценки прибавок урожайности, полученных в результате деляночных опытов, проводимых в течение многих лет в регионах России, различающихся по природно-климатическим условиям, впервые наглядно доказывают необходимость широкого внедрения метода сопряженной симбиотической селекции для создания новых сортов люцерны.
Список литературы Высокоэффективные штаммы клубеньковых бактерий люцерны (Medicago varia L.): молекулярно-генетическая характеристика и использование в сопряженной селекции
- Иванов А.И. Люцерна. М., 1980.
- Дубовский И.И. Агроэнергетическая оценка культур и основные направления совершенствования полевого кормопроизводства в степных районах Центрально-Черноземной полосы. Автореф. канд. дис. М., 2000.
- Государственный реестр селекционных достижений, допущенных к использованию. Т. 1. Сорта растений (официальное издание). М., 2019.
- Шамсутдинов З.Ш. Селекция кормовых культур: достижения и задачи. Сельскохозяйственная биология, 2014, 6: 36-45 ( ). DOI: 10.15389/agrobiology.2014/6/36rus
- Бжеумыхов В.С., Кобозев И.В., Токбаев М.М. Повышение эффективности возделывания люцерны на основе интенсификации симбиотической азотфиксации. Известия Тимирязевской сельскохозяйственной академии, 2007, 2: 28-37.
- Проворов Н.А., Симаров Б.В. Внутрисортовая изменчивость люцерны по активности симбиоза с Rhizobium meliloti. Сельскохозяйственная биология, 1986, 12: 37-42.
- Фотев Ю.В., Сидорова К.К., Новикова Т.И., Белоусова В.П. Изучение нодуляции и азотфиксации у двух сортов вигны [Vigna unguiculata (L.) Walp.] при инокуляции разными штаммами ризобий (Bradyrhizobium sp.). Вавиловский журнал генетики и селекции, 2016, 20(3) 348-354 ( ).
- DOI: 10.18699/VJ16.099
- Шкарупа М.В. Влияние инокуляции семян аборигенными штаммами клубеньковых бактерий на формирование вегетативной массы у сортов сои на выщелоченном черноземе Краснодарского края. Сб. мат. Х Всероссийской конференции молодых ученых и специалистов "Актуальные вопросы биологии, селекции, технологии возделывания и переработки масличных и других технических культур". Краснодар, 2019: 231-235.
- Ddelić D., Stajković-Srbinović O., Radović J., Kuzmanović D., Rasulić N., Simić A., Knežević-Vukčević E. Differences in symbiotic N2 fixation of alfalfa, Medicago sativa L. cultivars and Sinorhizobium spp. strains in field conditions. Romanian Biotechnological Letters, 2013, 18(6): 8743-8750.
- Shamseldin A., Youseif S.H., Abd El-Megeed F.H., Abdelkhalek A., Sadowsky M.J., Saleh S.A. Selection and use of effective, competitive, clover-nodulating rhizobium strains for use as commercial inoculants in alkaline and salt affected egyptian soils. Asian Academic Research Journal of Multidisciplinary, 2016, 3(7): 2319-2801.
- Yadav J., Verma J.P., Rajak V.K., Tiwari K.N. Selection of effective indigenous rhizobia strain for seed inoculation on chickpea (Cicer aritenium L.) production. Bacteriology Journal, 2011, 1(1): 24-30 ( ).
- DOI: 10.3923/bj.2011.24.30
- Гасанов Г.Н., Усманов Р.З., Мусаев М.Р., Абасов М.М. Экологическое состояние и возможности фитомелиорации засоленных почв Западного Прикаспия. Сельскохозяйственная экология, 2007, 1: 79-85.
- Румянцева М.Л., Степанова Г.В., Курчак О.Н., Онищук О.П., Мунтян В.С., Дзюбенко Е.А., Дзюбенко Н.И., Симаров Б.В. Отбор солеустойчивых растений разных видов люцерны и анализ их морфобиологических и симбиотрофных показателей. Сельскохозяйственная биология, 2015, 50(5): 673-684 ( ).
- DOI: 10.15389/agrobiology.2015.5.673rus
- Aranjuelo I., Arrese-Igor C., Molero G. Nodule performance within a changing environmental context. Journal of Plant Physiology, 2014, 171(12): 1076-1090 ( ).
- DOI: 10.1016/j.jplph.2014.04.002
- Mahajan S., Tuteja N. Cold, salinity and drought stresses: an overview. Archives of Biochemistry and Biophysics, 2005, 444(2): 139-58 ( ).
- DOI: 10.1016/j.abb.2005.10.018
- O'Hara G., Yates R., Howieson J. Selection of strains of root nodule bacteria to improve inoculants performance and increase legume productivity in stressful environments. In: Inoculants and nitrogen fixation of legumes in Vietnam /D. Herridge (ed.). ACIAR Proceedings, 2002: 75-80.
- Sańko-Sawczenko I., Łotocka B., Mielecki J., Rekosz-Burlaga H., Czarnocka W. Transcriptomic changes in Medicago truncatula and Lotus japonicus root nodules during drought stress. International Journal of Molecular Sciences, 2019, 20(5): 1204 ( ).
- DOI: 10.3390/ijms20051204
- Salim A., Cheloufi H., Attab S., Bouras N. Improvement of alfalfa growth under water stress by inoculation with Sinorhizobium meliloti strains from the Algerian Sahara. International Journal of Sciences and Research. 2019, 75(7/1): 35-40 ( ).
- DOI: 10.21506/j.ponte.2019.7.4
- Vriezen J.A., de Bruijn F.J., Nüsslein K. Responses of rhizobia to desiccation in relation to osmotic stress, oxygen, and temperature. Applied and Environmental Microbiology, 2007, 73(11): 3451-3459 ( ).
- DOI: 10.1128/AEM.02991-06
- Xu J., Li X.L., Luo L. Effects of engineered Sinorhizobium meliloti on cytokinin synthesis and tolerance of alfalfa to extreme drought stress. Biotechnology, 2012, 78(22): 8056-8061 ( ).
- DOI: 10.1128/AEM.01276-12
- Лазарев Н.Н. Продуктивность люцерно- и клеверо-злаковых травостоев при двух и трехкратном скашивании. Вестник ОрелГАУ, 2006, (2-3): 55-56.
- Bourion V., Heulin-Gotty K., Aubert V., Tisseyre P., Chabert-Martinello M., Pervent M., Delaitre C., Vile D., Siol M., Duc G., Brunel B., Burstin J., Lepetit M. Co-inoculation of a Pea Core-Collection with diverse rhizobial strains shows competitiveness for nodulation and efficiency of nitrogen fixation are distinct traits in the interaction. Frontiers in Plant Science, 2018, 8: 2249 ( ).
- DOI: 10.3389/fpls.2017.02249
- Тихонович И.А., Андронов Е.Е., Борисов А.Ю., Долгих Е.А., Жернаков А.И., Жуков В.А., Проворов Н.А., Румянцева М.Л., Симаров Б.В. Принцип дополнительности геномов в расширении адаптационного потенциала растений. Генетика, 2015, 51(9): 831-846 ( ).
- DOI: 10.7868/S001667581509012X
- Gubry-Rangin C., Garcia M., Bena G. Partner choice in Medicago truncatula-Sinorhizobium symbiosis. Proceedings. Biological sciences, 2010, 277(1690): 1947-1951 ( ).
- DOI: 10.1098/rspb.2009.2072
- Wang D., Yang S., Tang F., Zhu H. Symbiosis specificity in the legume-rhizobial mutualism. Cellular Microbiology, 2012, 14(3): 334-342 ( ).
- DOI: 10.1111/j.1462-5822.2011.01736.x
- Хапчаева С.А., Дидович С.В., Топунов А.Ф., Мулюкин А.Л., Зотов В.С. Специфичность симбиотических взаимодействий бактерий рода Rhizobium leguminosarum bv. viciae с растениями трибы Vicieae. Экологическая генетика, 2018, 16(4): 51-60 ( ).
- DOI: 10.17816/ecogen16451-60
- Argaw A. Symbiotic effectiveness of inoculation with Bradyrhizobium isolates on soybean [Glycine max (L.) Merrill] genotypes with different maturities. Springerplus, 2014, 3: 753 ( ).
- DOI: 10.1186/2193-1801-3-753
- Воробейков Г.А., Бредихин В.Н. Микроорганизмы в агробиотехнологиях и защите природной среды. СПб, 2018.
- Кожемяков А.П., Лактионов Ю.В., Попова Т.А., Орлова А.Г., Кокорина А.Л., Вайшля О.Б., Агафонов Е.В., Гужвин С.А., Чураков А.А., Яковлева М.Т. Агротехнологические основы создания усовершенствованных форм микробных биопрепаратов для земледелия. Сельскохозяйственная биология, 2015, 50(3): 369-376 ( ).
- DOI: 10.15389/agrobiology.2015.3.369rus
- Arafa M.M., El-Batanony N.H., Nofal A.M. Inoculation effect of rhizobial strains on growth, yield and chemical composition of some legume crops in new reclaimed soil. Middle East Journal of Agriculture Research, 2018, 7(2): 352-363.
- Buntic A.V., Stajkovic-Srbinovic O.S., Knezevic M.M., Kuzmanovic D.Z., Rasulic N.V., Delic D.I. Development of liquid rhizobial inoculants and pre-inoculation of alfalfa seeds. Archives of Biological Sciences, 2019, 71(2): 379-387 ( ).
- DOI: 10.2298/abs181008062b
- Solomon T., Pant L.M., Angaw T. Effects of Inoculation by Bradyrhizobium japonicum strains on nodulation, nitrogen fixation, and yield of soybean (Glycine max L. Merill) varieties on Nitisols of Bako, Western Ethiopia. ISRN Agronomy, 2012, Article ID 261475 ( ).
- DOI: 10.5402/2012/261475
- Атласова Л.Г. Симбиотическая деятельность клубеньковых бактерий Medicago falcata L. в условиях Центральной Якутии. Известия Самарского научного центра Российской академии наук, 2015, 17(5): 77-80.
- Цоциева В.П., Басиева Л.Ж., Козырев А.Х. Динамика накопления сухого вещества и урожайность посевов клевера в зависимости от штамма клубеньковых бактерий. Известия Горского государственного аграрного университета, 2015, 52(4): 57-62.
- Deaker R., Roughley R.J., Kennedy I.R. Legume seed inoculation technology - a review. Soil Biology and Biochemistry, 2004, 36(8): 1275-1288 ( ).
- DOI: 10.1016/j.soilbio.2004.04.009
- Дробышева Л.В., Зятчина Г.П. Cелекция различных видов бобовых трав на повышение эффективности симбиоза. Адаптивное кормопроизводство, 2016, 3: 94-108.
- Степанова Г.В., Золотарев В.Н. Биотехнология сопряженной селекции люцерны на повышение адаптивной способности. Адаптивное кормопроизводство, 2015, 1: 28-38.
- Ибрагимова М.В., Румянцева М.Л., Онищук О.П., Белова В.С., Курчак О.Н., Андронов Е.Е., Дзюбенко Н.И., Симаров Б.В. Симбиоз клубеньковых бактерий Sinorhizobium meliloti с люцерной Medicago sativa в условиях засоления. Микробиология, 2006, 75(1): 94-100.
- Beringer J.E. R factor transfer in Rhizobium leguminosarum. Journal of General Microbiology, 1974, 84: 188-198 ( ).
- DOI: 10.1099/00221287-84-1-188
- Румянцева М.Л., Симаров Б.В., Онищук О.П., Андронов Е.Е., Чижевская Е.П., Белова В.С., Курчак О.Н., Мунтян А.Н., Румянцева Т.Б., Затовская Т.В. Биологическое разнообразие клубеньковых бактерий в экосистемах и агроценозах. Теоретические основы и методы /Под ред. М.Л. Румянцевой, Б.В. Симарова. СПб, 2011.
- Черкасова М.Е., Мунтян В.С., Саксаганская А.С., Симаров Б.В., Румянцева М.Л. Sinorhizobium meliloti: хромосомные типы и геномные острова. Экологическая генетика, 2019, 17(3): 23-38 ( ).
- DOI: 10.17816/ecogen17323-38
- Giuntini E., Mengoni A., De Filippo C., Cavalieri D., Aubin-Horth N., Landry C.R., Becker A., Bazzicalupo M. Large-scale genetic variation of the symbiosis-requiered megaplasmid pSymA revealed by comparative genomic analysis of Sinorhizobium meliloti natural strains. BMC Genomics, 2005, 6: Article number 158 ( ).
- DOI: 10.1186/1471-2164-6-158
- Kim C.C., Joyce E.A., Chan K., Falkow S. Improved analytical methods for microarray-based genome-composition analysis. Genome Biology, 2002, 3(11): RESEARCH0065 ( ).
- DOI: 10.1186/gb-2002-3-11-research0065
- Районированные и перспективные сорта кормовых культур селекции ВНИИ кормов им. В.Р. Вильямса. Каталог. М., 2007.
- Пустыльник Е.И. Статистические методы анализа и обработки наблюдений. М., 1968.
- Лакин Г.Ф. Биометрия. М., 1990.
- Гмурман В.Е. Теория вероятностей и математическая статистика. М., 2004.
- Hammer O., Harper D.A.T., Ryan P.D. PAST: paleontological statistics software package for education and data analysis. Palaeontologia Electronica, 2001, 4(1):1-9.
- Румянцева М.Л., Мунтян В.С., Черкасова М.Е., Андронов Е.Е., Саксаганская А.С., Дзюбенко Е.А., Дзюбенко Н.И., Симаров Б.В. Сравнительный анализ геномных характеристик у референтных штаммов Sinorhizobium meliloti - симбионтов люцерны (обзор). Сельскохозяйственная биология, 2017, 52(5): 928-939 ( ).
- DOI: 10.15389/agrobiology.2017.5.928rus


