Взаимодействие протеаз с синтетическими химическими субстратами у термофильной бактерии Se-1-10
Автор: Раднагуруееа А.А., Лаврентьева Е.В., Намсараев Б.Б., Дунаевский Я.Е.
Журнал: Вестник Бурятского государственного университета. Философия @vestnik-bsu
Рубрика: Химия
Статья в выпуске: 3, 2010 года.
Бесплатный доступ
Изучена внеклеточная протеазная активность культуры Se-1-Ю, выделенной из поверхностного микробного мата термального источника Сея. Показано, что протеиназы относятся к классу сериновых и металлопротеаз.
Протеиназы, ингибиторы, активный центр
Короткий адрес: https://sciup.org/148179505
IDR: 148179505 | УДК: 577.151.01
Текст научной статьи Взаимодействие протеаз с синтетическими химическими субстратами у термофильной бактерии Se-1-10
Протеазы относятся к классу гидролаз, в составе которого образуют подкласс пептидгидролазы. Ранее было показано [1], что протеиназы в основном действуют по четырем каталитическим механизмам, что и было положено в основу их классификации: сериновые (КФ 3.4.21), цистеиновые (КФ 3.4.22), аспартатные (КФ 3.4.23) и металлопротеиназы (КФ 3.4.24). На сегодняшний день показано, что микроорганизмы, выделенные из горячих источников Байкальского региона, относятся к сериновым и металлопротеазам. Активность сериновых протеиназ зависит от каталитической триады аминокислот – аспарагиновая кислота/гистидин/серин (Asp/His/Ser), расположенных в активном центре. Гидроксильная группа серина (Ser) выступает как нуклеофил, атакующий пептидную связь, остаток гистидина (His), расположенный в активном центре, играет роль донора протона, а остаток аспарагина (Asp) участвует в ориентации имидазольного кольца гистидина.
Металлопротеиназы содержат в молекуле ионы различных металлов, например, цинка, кобальта или марганца, принимающие непосредственное участие в процессах протеолиза. В роли лигандов, связывающих ионы металлов, выступают три аминокислотных остатка: гистидин (His), глутаминовая кислота (Glu), аспарагиновая кислота (Asp) или остаток лизина (Lys). Кроме связывания ионов металлов один из трех аминокислотных остатков принимает участие в катализе. У одних металлопротеиназ это может быть остаток глутаминовой кислоты, у других эту роль могут играть лизин или аргинин [2].
Целью данного исследования явилось изучение взаимодействия протеаз с синтетическими химическими субстратами у культуры Se-1-10, выделенной из термального источника Сея.
Объекты и методы исследования
В качестве источника секретируемых протеолитических ферментов использовали культуральную жидкость культуры Se-1-10, выделенную из поверхностного микробного мата горячего источника Сея (Бурятия).
Определение внеклеточной протеазной активности в культуральной жидкости проводили по методу Эрлангера с соавт. [3], используя 5 мМ пара-нитроанилидные субстраты протеаз -трипсиноподобных: ВАРА (N-бензоил-L-аргинил-п-нитроанилид), субтилизиноподобных: GlpAALpNA (пироглутамил-аланил-аланил-лейцил-п-нитроанилид), и аминопептидаз: TpNA (L-тирозил-п-нитроанилид), ApNA (L-аланил-п-нитроанилид-гидрохлорид), LpNA (L-лейцил-п-нитроанилид), ZAAGlupNa (N-карбобензокси-аланил-аланил-глютамин-п-нитроанилид) и на белковом субстрате азоказеине, используемом для определения общей активности. Для изучения зависимости секреции ферментов от суток культивирования культуральную жидкость отбирали через 12, 24, 36, 48, 60, 72, 84, 96 и 108 ч. В работе использовались ингибиторы металлопротеаз– этилендиаминтетраацетат Na (ЭДТА) и о-фенантролин, цистеиновых протеаз - иодацетамид (ИAA) и сериновых протеаз – фенилметилсульфонилфторид (ФМСФ).
Результаты исследования
Определение субстратной специфичности показало, что изученный штамм не гидролизует субстрат, специфичный для трипсинподобных протеиназ, независимо от времени культивирования (до 108 ч). Культура наиболее активна в отношении субстрата для субтилизинподобных протеиназ -GlpAALpNA и аминопептидаз - ZAAGlupNa. Максимальные значения определены на 96-108 ч культивирования и составили 1,325 и 1,099 ед. соответственно (рис.).
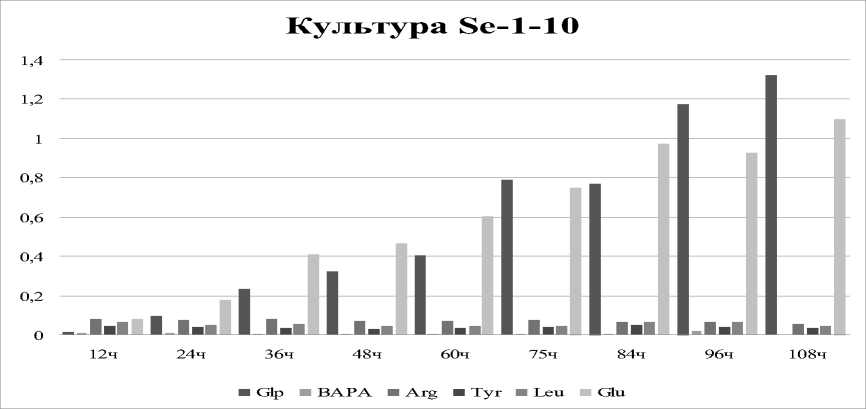
Рис. Внеклеточная протеазная активность на различных субстратах
Оптимум активности протеаз лежит в широком пределе значений рН от 7,4 до 11,3, что характерно для сериновых протеаз. Протеазы стабильны в диапазоне от 6,26 до 11,3.
Результаты исследования зависимости активности протеиназ от температуры культивирования показали, что протеиназа стабильна в диапазоне температур от 23 до 60оС, максимум активности наблюдался при температуре 40-50оС. Исследование влияния ингибиторов на активность протеаз показало низкие значения. Все металлопротеазы инактивируются хелатными реагентами, такими как ЭДТА или о-фенантролин. В свою очередь, все сериновые протеиназы чувствительны к специфическим ингибиторам, взаимодействующим с каталитическим остатком серина: эфирам фосфорной кислоты (диизопропилфторфосфат) и фенилметансульфогалогенидам (ФМСФО) [2]. Важно отметить, что могут существовать значительные различия в сродстве тех или иных ингибиторов к разным ферментам этой группы.
Проведенный анализ функциональных групп активного центра показал, что активность внеклеточных протеиназ по субстрату GlpAALpNA у культуры Se-1-10 подавляется специфическим ингибитором сериновых протеиназ – ФМСФ на 86,4%, причем интересно, что в отношении другого субстрата ZAAGlupNa, он не был столь эффективным, подавляя лишь 15% активности при концентрации 0,01 М (табл.). Таким образом, субстрат GlpAALpNA, использованный нами для определения активности субтилизинподобных протеиназ у культуры Se-1-10, эффективно гидролизуется сериновой протеиназой. Ингибирование на 92,5% ЭДТА, по-видимому, является ошибочным, т.к. активность о-фенантролином не ингибировалась. По субстрату ZAAGlupNa протеиназы культуры Se-1-10 ингибируется ЭДТА на 77%. Ингибирование о-фенантролином было слабым и составило 4,5%. Ингибирование ЙАА не дал никаких результатов.
Таблица.
Влияние ингибиторов на активность протеиназ культуры Se-1-10
|
Эффектор |
Концентрация эффектора (М) |
Активность ферментов в присутствии эффекторов (% от контрольной) |
|
|
Субстрат |
|||
|
GlpAALpNA |
ZAAGlupNa |
||
|
ФМСФ |
0,01 |
86,4 |
15 |
|
ЭДТА |
0,01 |
67,9 |
н.о. |
|
0,1 |
92,5 |
77 |
|
|
о-фенантролин |
0,01 |
2,78 |
4,5 |
|
ЙАА |
0,01 |
1,1 |
0 |
Примечание: н.о. - не определено
С помощью гель-хроматографии на колонке Superdex-75 была определена молекулярная масса протеиназы культуры Se-1-10, которая составила 85000 Да.
Таким образом, можно заключить, что культура Se-1 секретирует, по крайней мере, два фермента принадлежащих к двум классам протеиназ – сериновым и металлопротеазам.
Работа выполнена при поддержке грантов МО РФ РНП 2.1.1/2165, НОЦ «Байкал».


