Взаимодействие родия с хлорокомплексами палладия при повышенных температурах
Автор: Белоусов О.В., Белоусова Н.В.
Журнал: Журнал Сибирского федерального университета. Серия: Техника и технологии @technologies-sfu
Статья в выпуске: 4 т.8, 2015 года.
Бесплатный доступ
Синтезированы порошки высокодисперсного родия моно-и полиблочной структуры. Исследованы процессы укрупнения кристаллитов нанодисперсного родия. Методами электронной просвечивающей микроскопии и рентгенофазового анализа детально изучен процесс укрупнения родиевой черни при 130 и 180 °С. Установлено, что в растворах соляной кислоты наблюдается растворение родия (0), связанное с наличием на его поверхности хемосорбированного кислорода. Впервые показана возможность образования твердых родийпалладиевых растворов замещения при протекании реакции цементации.
Автоклавные технологии, родий, палладий, металлические наночастицы, твердые растворы замещения
Короткий адрес: https://sciup.org/146114976
IDR: 146114976 | УДК: 541.91
Текст научной статьи Взаимодействие родия с хлорокомплексами палладия при повышенных температурах
В последнее время интенсивное развитие исследований в области методов синтеза би- и полиметаллических частиц привело к появлению новых материалов, которые нашли широкое применение в самых различных областях, таких как гетерогенный катализ, водородная энергетика, электроника, электротехника, фармацевтика, медицина и биология. В ряде случаев, например в катализе, биметаллические наночастицы более эффективны по сравнению с их монометаллическими аналогами. Более высокая эффективность катализаторов на основе биметаллических наночастиц проявляется в более высокой степени селективности и синергетичном поведении компонентов таких систем.
Биметаллические наночастицы на основе родия и палладия находят свое применение в качестве компонентов автомобильных катализаторов для нейтрализации выхлопных газов. Rh-Pd биметаллические катализаторы более активны в реакциях окисления СО по сравнению с аналогичными монометаллическими катализаторами в идентичных реакционных условиях благодаря повышенной способности родия расщеплять О 2 и тенденции палладия избирательно связывать СО [1].
Кроме того, катализаторы на основе родия часто используют в реакциях гидрирования аренов [2]. В частности, родий-палладиевые катализаторы показали себя весьма эффективно в реакции гидрирования бензола при комнатных температурах по сравнению с различными монометаллическими катализаторами на основе благородных металлов [3]. Это лишь некоторые примеры применения биметаллических наночастиц Rh-Pd.
Структура Rh-Pd наночастиц зависит главным образом от метода их получения. Согласно диаграмме состояния в системе родий-палладий возможно образование ряда твердых растворов [4]. В работе [5] предложен интересный подход к получению твердых родий-палладиевых растворов замещения при помощи восстановительного термолиза. При восстановлении из растворов некоторые авторы получали механическую смесь индивидуальных компонентов [6, 7]. В частности, в работе [6] биметаллические наночастицы Rh-Pd синтезированы методом одновременного восстановления двух прекурсоров в среде аргона при использовании поли(винилпирролидона) в качестве ПАВ. Полученные частицы, размер которых составлял около 15 нм, представляли собой частицы со структурой «ядро-оболочка»: ядро палладия, окруженное родиевой оболочкой.
При этом необходимо отметить, что получение наноматериалов на основе родия сопряжено с определенными трудностями, связанными с кинетической инертностью солей родия. В работе [7] интенсифицировали процесс получения наночастиц Rh-Pd путем применения автоклавных технологий, обладающих в отличие от открытых систем рядом преимуществ: высокой скоростью и глубиной протекания процессов, отсутствием потерь летучих компонентов реакционной смеси, относительной простотой стандартизации условий эксперимента. Установлено, что при контакте высокодисперсного родия с солянокислым раствором хлорида палладия при температуре 180 °С происходит образование механической смеси индивидуальных компонентов.
Биметаллические системы разнообразны по составу и структуре, что открывает широкие возможности для получения материалов на их основе с улучшенной функциональностью [8]. Такое разнообразие задает огромный горизонт поисковых работ для оптимизации этих систем.
Однако окончательного ответа на вопрос о влиянии различных факторов на структуру полученных материалов не найдено до сих пор.
Основные подходы к методам химического синтеза таких материалов сводятся к последовательному либо одновременному восстановлению из растворов их комплексных соединений и были нами подробно описаны ранее [9–11].
Экспериментальная часть
Исходный родий был синтезирован согласно стандартной методике [12]. В работе использовали PdCl 2 (х.ч.). Растворы готовили на 1М НСl, очищенной изотермической перегонкой. Все реакции проводили в среде аргона.
Эксперименты выполнены в разработанных нами кварцевых автоклавах по методике, описанной в [10]. Преимуществами данной конструкции автоклава являются: возможность визуального наблюдения за процессом, разделение компонентов смеси до начала процесса, а также вращение автоклава в вертикальной плоскости, что позволяет осуществить максимальный контакт фаз, что крайне важно при изучении гетерогенных процессов.
Рентгеновские дифракционные данные получены на порошковом дифрактометре PANalytical X’Pert PRO MPD. Микроструктурные характеристики материалов определяли с помощью полнопрофильного анализа рентгенограмм по методу Ритвельда [13].
Содержание комплексных соединений металлов в растворе устанавливали атомноабсорбционным и спектрофотометрическим методами, количество твердой фазы – весовым анализом. Химический состав твердой фазы находили путем растворения навески порошка с последующим анализом на соответствующие элементы на атомно-абсорбционном спектрофотометре марки A Analyst-400 (Perkin Elmer) с электротермическим атомизатором.
Адсорбционные измерения проводили на приборе ASAP 2420 фирмы Micromeritics Instrument Corporation (США) методом низкотемпературной адсорбции азота при 77 К. До начала измерений образцы нагревали до 70 °C и проводили дегазацию при 1,2 Па. Удельную площадь поверхности рассчитывали по изотермам адсорбции по методу БЭТ.
Микроструктура (размеры и морфология частиц) образцов исследована с помощью просвечивающего электронного микроскопа ПРЭМ200 (при ускоряющем напряжении 100 кВ). Образцы родиевой черни препарировали для электронно-микроскопических исследований путем диспергирования порошка в дистиллированной воде с помощью ультразвукового диспергатора (УЗДНА) в течение 5 мин. После этого полученную взвесь порошка в воде распыляли с помощью ультразвукового диспергатора на коллодиевую пленкуподложку (толщиной ~ 10 нм), высаженную на медную электронно-микроскопическую просмотровую сеточку.
Обсуждение результатов
По рентгенографическим данным (рис. 1) исходная Rh-чернь состоит из одной кристаллической фазы, имеющей блоки когерентного рассеяния размером 6,2 нм. По данным электронной микроскопии изображение исходного порошка родия свидетельствует о том, что частицы имеют форму, близкую к сферической, и агрегированы между собой в достаточно длинные цепочки, частицы кристаллической фазы имеют размеры около 15 нм (рис. 1). Это позволяет прийти к заключению, что структура исходной родиевой черни близка к моноблочной.
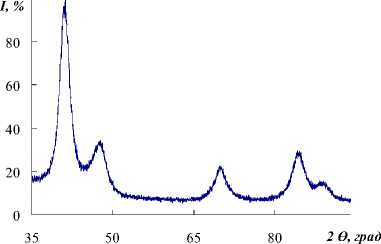
Рис. 1. Исходная родиевая чернь: рентгенограмма и изображение частиц, полученное с помощью электронной микроскопии
Ранее [7] было установлено, что родиевая чернь укрупняется в одноименных растворах соляной кислоты, однако по сравнению с палладием скорость укрупнения родия очень мала [14]. При использовании родия с полиблочной структурой, размеры частиц которого по рентгенографическим данным составляли 60Å, а по данным электронной микроскопии – более 300Å, процессы его укрупнения в солянокислых растворах протекали крайне медленно. После укрупнения при 180 °С в течение 6 ч размер поверхностных блоков более чем в 1,5 раза превышал размер блоков исходной черни. Значения параметров кристаллической решетки внутренних блоков были близки к значениям этих параметров для исходной черни (размеры внутренних блоков меняются незначительно). Авторы работы [7] объясняют это тем, что если справедлив электрохимический механизм перекристаллизации, подробно описанный в работах [7, 14], то укрупняться должны только соприкасающиеся с раствором поверхностные блоки.
В подтверждение этой гипотезы в настоящей работе исследовали процессы укрупнения родия, имеющего моноблочную структуру. Результаты исследования показали значительное увеличение скорости укрупнения родия: при контакте родиевой черни с раствором RhCl 3 в 1 М соляной кислоте при 180 °С укрупнение происходит до 11,6 нм, а при 130 °С – до 8 нм.
В ходе данной работы было установлено, что при температуре 130 °С одновременно с укрупнением наблюдается растворение родия. Окислительным агентом в рассматриваемом случае может быть кислород, содержащийся в газовой фазе, растворенный в объеме раствора и (или) адсорбированный на поверхности родия. При этом, вне зависимости от источника кислорода, процесс растворения описывается следующим уравнением реакции:
4Rh + 3O 2 + 24HCl = 4H 3 RhCl 6 + 6H 2 O. (1)
Растворение заканчивается в течение 15 мин после приведения черни в контакт с соляной кислотой.
Количество растворившегося металла определяли по убыли массы, атомно-адсорбционным и спектрофотометрическим анализами. Отсутствие потерь мелкодисперсного металла при отделении осадка от раствора подтверждалось сходимостью определения количества металла независимыми методами в пределах 2 %. Максимальное количество моль кислорода, находящегося в газовой и жидкой фазах, равно 2,74∙10-4 моль; причем количество кислорода в газовой – 510 – фазе примерно в шесть (5,7) раз больше, чем в растворе при стандартной степени заполнения автоклава. Для исключения из рассмотрения растворения родия кислородом газовой фазы или растворенным в растворе осуществляли его тщательное удаление барботированием аргона через систему. Изменения объема газовой фазы и объема раствора не приводили к изменению процента растворимости при той же температуре, что указывает на то, что используемая в настоящей работе методика удаления кислорода воздуха вполне приемлема, и в соляной кислоте отсутствовали примеси, способные окислять металл. Таким образом, основной причиной растворения родиевой черни является наличие на ее поверхности кислорода. В таблице представлены результаты исследований растворения высокодисперсных порошков Rh в 1М соляной кислоте при температурах 130 и 180 °C.
При данных температурах исследования шли в кварцевых автоклавах, из газовой и жидкой фаз которых предварительно удаляли кислород путем барботирования аргоном, тем самым добиваясь исключения реакции (1). Таким образом, растворение металла проходило без доступа воздуха. Процессы частичного растворения мелкодисперсного родия протекают с достаточно большой скоростью и заканчиваются за 15 мин. При увеличении времени обработки до 1 ч доля растворенного металла практически не изменяется.
Растворение родия происходит за счет хемсорбированного кислорода на поверхности металла. Зависимость концентрации родия в растворе ( С Rh(III) ) от количества кислорода (α), адсорбированного на единице площади, описывается формулой
4/3 С Rh(III) V = 6α m 0 / d ρ, (2)
где ρ – плотность металлического родия.
На рис. 2 представлена зависимость числа молей n трехвалентного родия в растворе (растворившегося) от отношения навески к диаметру частиц m o /d. Данная зависимость подчиняется линейному уравнению (2).
На основании формулы (2) и данных, представленных на рис. 2, было рассчитано количество кислорода, адсорбированного на единице площади палладия α = 1,55∙10-5 моль/м2, которое удовлетворительно согласуется с данными работы [15] α = 9,5∙10-6 моль/м2.
Исходя из значений, приведенных на рис. 2, было рассчитано число молекул кислорода n O2 = 9∙1019 на 1 м2 поверхности, а также площадь, занимаемая молекулой кислорода S O2 = 5∙10-20 м2.
Таблица. Растворение высокодисперсных порошков родия в 1М соляной кислоте при температурах 130 и 180 °С в течение 1 ч
|
Масса родия m 0, мг |
Объем раствора V , мл |
Размер частиц d , Å |
Температура t , °С |
Степень растворения β, % |
|
186,30 |
20 |
62 |
130 |
8,2 |
|
96,60 |
29 |
62 |
180 |
11,5 |
|
99,50 |
29 |
62 |
130 |
11,3 |
|
490,10 |
29 |
62 |
130 |
9,2 |
|
93,35 |
29 |
80 |
130 |
4,7 |
|
74,20 |
29 |
112 |
130 |
3,1 |
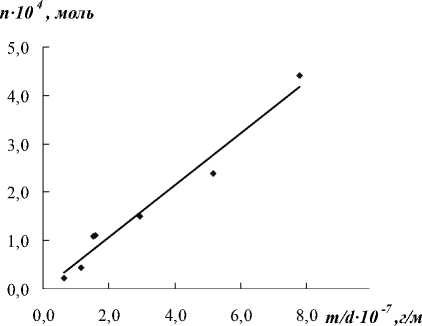
Рис. 2. Зависимость числа молей n трехвалентного родия в растворе от отношения навески к диаметру частиц m 0 / d
Последнее значение неплохо согласуется с данными работы [16], где приведена площадь одного центра адсорбции кислорода σ0 = 10-19 м2 для никеля.
Взаимодействие высокодисперсного родия с раствором хлорида палладия протекает по уравнению реакции (3)
3 Pd2+ + 2 Rh 0 = 3 Pd 0 + 2 Rh 3+ , ΔG = -147 кДж. (3)
Диаграмма состояния Rh-Pd представляет собой неограниченный ряд твердых растворов, однако ранее [7] было установлено, что при использовании родия с полиблочной структурой процесс контактного восстановления палладия при температуре 180 °С заканчивается в течение нескольких часов и вызавает образование механической смеси двух металлов.
Нами установлено, что при мольном соотношении Rh/Pd, равном 2, и температуре 130 °С процесс контактного восстановления палладия родием, имеющим моноблочную структуру, заканчивается в течение 90 мин, дальнейшее увеличение времени эксперимента не изменяет концентраций родия и палладия в растворе. Уже спустя 30 минут от начала эксперимента по данным масс-спектрометрического анализа из раствора восстанавливается около 45 % палладия, а к концу процесса степень его восстановления достигает 70 %.
Согласно данным газовой адсорбции в результате реакции происходит уменьшение площади поверхности полученных порошков. Так, спустя 30, 90 и 120 мин удельная площадь равна 57,1, 44,15 и 29,4 м2/г соответственно. Изменение удельной поверхности частиц после окончания контактного восстановления можно объяснить процессами электрохимической перекристаллизации палладия, которые приводят к значительному укрупнению частиц.
По данным РФА в результате протекания реакции (3) зафиксировано образование твердого (Rh, Pd) раствора замещения.
Выводы
-
1. Установлена значительная роль хемисорбированного кислорода в процессах растворения нанодисперсного родия в растворах соляной кислоты при повышенных температурах.
-
2. Впервые было обнаружено образование твердого раствора замещения при цементации палладия родием, имеющим моноблочную структуру.
-
3. Установлено, что при взаимодействии высокодисперсного порошка родия с солянокислым раствором хлорида палладия (II) решающую роль в образовании твердого раствора или механической смеси играет структура металла-восстановителя.
Авторы благодарят С.М. Жаркова за проведение электронно-микроскопических исследований и В.А. Парфенова за измерения удельных поверхностей.
Список литературы Взаимодействие родия с хлорокомплексами палладия при повышенных температурах
- Araya, P., Diaz A.V.//Faraday Trans. 1997. № 93. Р. 38-87.
- Dehm N. A., Zhang X., Buriak J. M.//Inorg. Chem. 2010. № 49. Р. 27-06.
- Yoon B., Pan H-B., Wai Ch. M. // J. Phys. Chem. 2009. № 113. Р. 15-20.
- Massalski T. B., Okamoto H., Subramanian P. R. and L. Kacprzak (ed.)//Binary Alloy Phase Diagrams 2-nd ed., ASM International, Materials Park, Ohio. 1990. Р. 17-51.
- Коренев С.В., Шубин Ю.В., Беляев А.В.//ЖНХ. 2001. № 1. С. 70.
- Tao F., Grass M.E., Zhang Y. et al.//J. Am. Chem. Soc. 2010, № 132, Р. 86-97.
- Коваленко Н.Л., Белоусов О.В., Дорохова Л.И. и др.//ЖНХ. 1995. № 4. С. 678.
- Grass M. E., Park M., Aksoy F. et al.//Langmuir. 2010. № 21. Р. 16362.
- Belousov O., Belousova N., Burlo A.//Smart Nanocomposites. 2010.1. № 1. Р. 91.
- Belousov O., Belousova N., Sirotina A. et al.//Langmuir. 2011. 18. P. 11697.
- Белоусова Н.В., Сиротина А.В., Белоусов О.В. и др.//ЖНХ. 2012. № 1. C. 18.
- Коваленко Н.Л., Дорохова Л.И.//ЖНХ 1991. № 10. C. 25-71.
- Rietveld H.M.//J. Appl. Cryst. 1969. 2. Р. 65.
- Белоусов О.В., Дорохова Л.И., Соловьев Л.А. и др.//ЖФХ. 2007. № 8. С. 14-79.
- Буянова Н.Е. Определение поверхности и дисперсности нанесенных металлов восьмой группы хемосорбционными методами. М.: Наука, 1976. 137 с.
- Адамсон А. Физическая химия поверхностей. М: Мир, 1979. 586 с.


