Взаимодействие валина с хлоридами биометаллов в водной среде при 25°C
Автор: Бекташева У.К., Алтыбаева Д.Т., Абдуллаева Ж.Д., Матаипова А.К.
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Химические науки
Статья в выпуске: 4 т.10, 2024 года.
Бесплатный доступ
Исследования в области медицинской биологии и фармакологии могут расширить понимание о взаимодействии биометаллов с аминокислотами, которые являются ключевыми компонентами биологических систем. Это может привести к разработке новых комплексов, которые могут быть использованы в медицине, например, для разработки новых препаратов с антимикробной активностью или для поддержания равновесия метаболизма в организме. Цель исследования: получение комплексных соединений биометаллов, хлорида кобальта, хлорида никеля и хлорида марганца с аминокислотой валин а также изучение их физико-химических и биологических свойств. Для анализа был использован метод Кьельдаля для определения содержания азота. Состав образованных кристаллов был проанализирован ИК спектроскопией. Строение и форма кристаллов кобальта, никеля и марганца были определены микроскопом. Индивидуальность полученных соединений подтверждена методом ИК спектроскопии и микроскопическим анализами. Можно сделать вывод о том, что валин в комплексе координирован к ионам металла через атомы кислорода карбоксильной и азота аминной групп.
Валин, хлориды биометаллов, растворимость, ик-спектры, лиганд
Короткий адрес: https://sciup.org/14129913
IDR: 14129913 | УДК: 546.212:546.47 | DOI: 10.33619/2414-2948/101/05
Текст научной статьи Взаимодействие валина с хлоридами биометаллов в водной среде при 25°C
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 546.212:546.47
Изучение влияния соединений аминокислот на химические и биологические свойства неорганических веществ имеет большое значение. Оно раскрывает, что при формировании таких соединений происходит изменение биологической активности аминокислот, которая в свободной форме для них не характерна. С другой стороны, соединения аминокислот с металлами и неметаллами приобретают новые химические и биологические свойства, становясь менее токсичными и способствуя катализу различных биохимических процессов. В результате, на основе таких соединений возможно создание новых коферментных препаратов, биокатализаторов, а также разработка новых лекарственных средств и добавок, способствующих улучшению качества пищевых продуктов, так как они включены в состав многих ферментов и могут использоваться для более глубокого изучения жизненно важных биохимических процессов.
Интерес к соединениям аминокислот с неорганическими веществами возник сравнительно недавно. В этой области первым исследователем стал A. Albert в 1953 году. Он обнаружил, что витамин В 2 (рибофлавин) и витамин В 3 (фолиевая кислота) могут образовывать комплексные соединения с ионами переходных металлов, подобные о-оксихинолину, и определил константы устойчивости таких соединений в водных растворах. Это исследование подтвердило, что соединения витаминов и аминокислот с металлами подчиняются общим законам координационной химии и могут быть изучены методами этой науки. Кроме того, в [1] впервые указано на важную роль соединений металлов с аминокислотами в механизме действия ферментов. Важным этапом было также открытие витамина В 12 и его определение как комплексного соединения с кобальтом, что было сделано в 1971 году [2].
Аминокислоты представляют собой гетерофункциональные соединения, включающие карбоксильную группу и аминогруппу в их молекуле. Они проявляют кристаллические свойства и растворимы в воде, однако оказываются малорастворимыми в органических растворителях и подвержены плавлению при повышенных температурах, при этом распадаясь. Интересно, что многие из них обладают сладким вкусом.
Наибольшее значение в аминокислотах имеют альфа-аминокислоты, среди которых 20 являются особенно важными, поскольку они входят в состав белков и выполняют ключевые функции в жизнедеятельности организма. Каждая аминокислота [3, 4] содержит, по меньшей мере, две ионизированные группы: аминную и карбоксильную. Кроме того, аминокислоты могут содержать и другие функциональные концевые группы, такие как амидная группа (NH 2 ), что предоставляет им различные реакционные центры, способные связывать протоны и ионы металлов.
Образование комплексов аминокислот с неорганическими веществами приводит к изменению их химических и биологических свойств. Витамины, включенные в такие соединения, обнаруживают биологическую активность. Комплексы металлов с аминокислотами могут быть менее токсичными и способствовать различным биохимическим процессам. Это позволяет создавать новые препараты, биокатализаторы, лекарства и биологически активные добавки [5–7].
Кобальт занимает особое положение среди микроэлементов в контексте физиологической активности в организме человека. Следовательно, вопрос об обеспечении организма кобальтом сводится в первую очередь к источникам и усвоению витамина B 12 , а не самого кобальта [8, 9].
Никель также участвует в процессах кроветворения. Особое внимание уделяется свойствам никеля как потенциального канцерогена. В настоящее время проводятся исследования, направленные на изучение физиологической роли никеля и его воздействия на здоровье в зависимости от окружающей среды [10].
Марганец является микроэлементом, крайне важным для течения множества физиологических процессов, включающих метаболизм аминокислот, липидов, белка, углеводов, необходимый для нормального функционирования иммунной системы, регуляции внутриклеточных энергетических процессов и свертывания крови, роста костной и соединительной тканей [11, 12].
Материалы и методы исследования
Для обеспечения достоверности полученных результатов проводились комплексные анализы данных при использовании наиболее современных и актуальных научноисследовательских методов, и инструментов.
Все эксперименты выполнялись с повторяемостью не менее 5 раз, чтобы обеспечить надежность данных.
Опыты проводились с использование реактивов CoCl 2 ×6H 2 O (ГОСТ H525-77) ч., NiCl 2 ×6 H 2 O (ГОСТ 4038-79) х. ч., MnCl 2 ×4 H 2 O (ГОСТ 612-75) ч. д. а.
Состав и строение образованных кристаллов были анализированы ИК спектроскопией и микроскопом.
Результаты и обсуждение
Глубина образования комплексов в растворе, в контексте взаимодействия с растворителем, существенно зависит от качества связи между центральным ионом и лигандом. Эта прочность связи зависит от нескольких факторов, включая природу металла, его степень окисления, электронную структуру и размеры его электронных оболочек, а также химические свойства лиганда. Меньшие радиусы и более высокие заряды ионов комплексообразующего металла способствуют образованию более прочных комплексов, особенно в случае электростатического взаимодействия [13].
Биологическая значимость кобальта существенно связана с его участием в активации витамина B 12 и процессах, которые связаны с образованием метильных групп, а также повышением термостабильности группы SH в белках и поддержанием активности кофермента А и других биологически активных молекул [14].
Витамин B 12 играет ключевую роль в процессе эритропоэза, и его недостаток, в сочетании с дефицитом фолиевой кислоты (витамина B 9 ), вызванным отсутствием в желудочном соке специфического гликопротеина, известного как «внутренний фактор», может привести к развитию мегалобластических анемий, включая пернициозную анемию [14].
Дефицит кобальта может также замедлить биохимическую реакцию, отвечающую за превращение рибонуклеотидов в дезоксирибонуклеотиды и снизить синтез ДНК [15].
Состав образованных комплексных соединений идентифицирован ИК спектроскопией после чего были выделены спектры поглощения комплексных соединений (Рисунок 1).
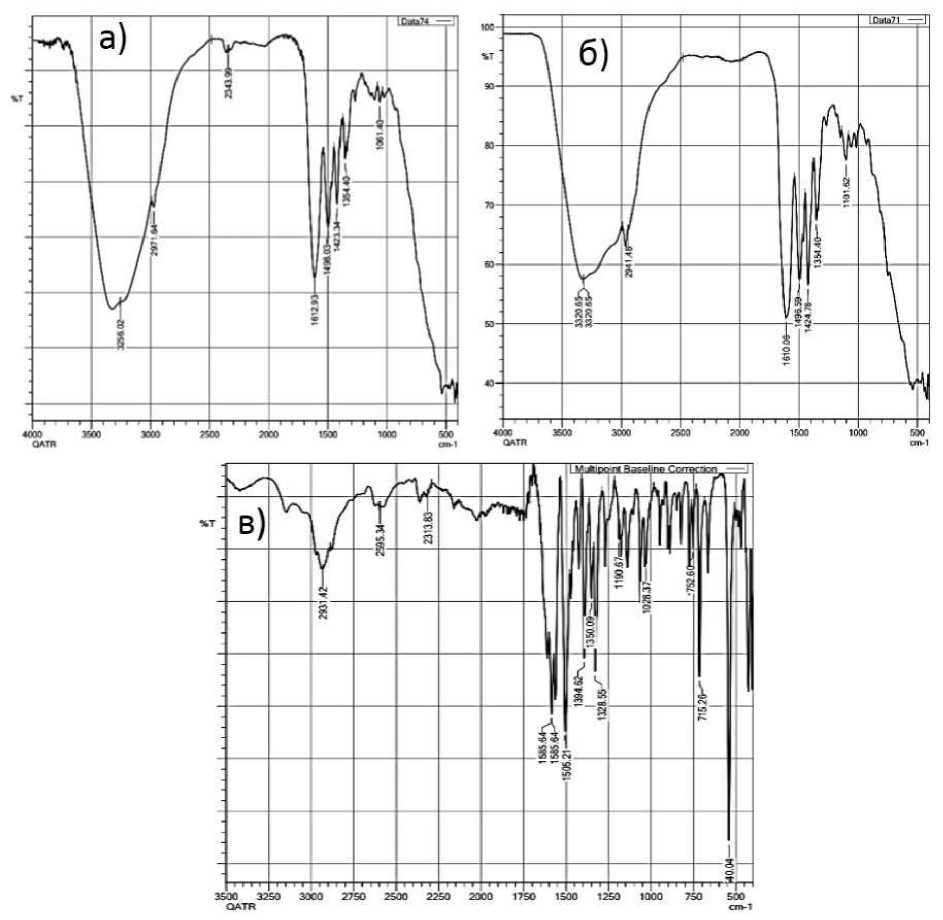
Рисунок 1. ИК-спектры поглощения комплексных соединений: а) хлорида кобальта с валином СоСl 2 ×2C 5 H 11 O 2 N; б) хлорида никеля с валином NiСl 2 ×2C 5 H 11 O 2 N; в) хлорида марганца с валином MnСl 2 ×2C 5 H 11 O 2 N
Колебательные частоты комплексного соединения хлорида никеля с валином NiСl 2 ×2C 5 H 11 O 2 N даны на Таблице. Микроскопическое строение кристаллов комплексного соединения хлорида кобальта с валином СоСl 2 ×2C 5 H 11 O 2 N изображены на Рисунке 2.
В ИК-спектре нового комплексных соединений СоСl 2 ×2C 5 H 11 O 2 N, NiСl 2 ×2C 5 H 11 O 2 N и MnСl 2 ×2C 5 H 11 O 2 N в длинноволновой области проявляющиеся пики 2931, 3256, 3320 см-1 соответствуют валентному колебанию аминогруппы, что свидетельствует о коомплексообразовании, в котором принимает участие аминогруппа. Кроме того, наблюдается сдвиг полосы поглощения валентного колебания карбоксильной группы (ν as СОО-) на 60 см-1, т. е. смещена в низкочастотную область от 1564 см-1 до 1612 см-1, что подтверждает возможность комплексообразования через атом кислорода карбоксильной группы.
Таблица
ОСНОВНЫЕ КОЛЕБАТЕЛЬНЫЕ ЧАСТОТЫ (см-1) в ИК-спектрах валина и новых комплексных соединений СоСl 2 ×2C 5 H 11 O 2 N, NiСl 2 ×2C 5 H 11 O 2 N и MnСl 2 ×2C 5 H 11 O 2 N.
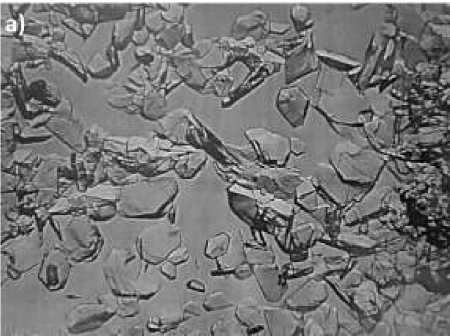
Рисунок 2. Строение кристаллов: a) аминокислоты валина; b) комплексного соединения хлорида кобальта с валином СоСl 2 ×2C 5 H 11 O 2 N
|
Отнесение |
C 5 H 11 O 2 N |
СоСl 2 ×2C 5 H 11 O 2 N |
|
v as (NH 2 ) |
— |
3256,02 |
|
v s (NH 2 ) |
2973,08 |
2971,64 |
|
v as (COO-) |
1564,10 |
1612,94 |
|
v s (COO-) |
1328,55 |
1498,03 |
|
δ as (NH 2 ) |
— |
1354,40 |
|
δ s (NH 2 ) |
1064,28 |
1061,40 |
|
Отнесение |
C 5 H 11 O 2 N |
NiСl 2 ×2C 5 H 11 O 2 N |
|
v as (NH 2 ) |
— |
3320,65 |
|
v s (NH 2 ) |
2979,08 |
2941,48 |
|
v as (COO-) |
1564,10 |
1610,06 |
|
v s (COO-) |
1328,55 |
1424,78 |
|
δ as (NH 2 ) |
— |
1354,40 |
|
δ s (NH 2 ) |
1064,28 |
1101,62 |
|
Отнесение |
C 5 H 11 O 2 N |
MnСl 2 ×2C 5 H 11 O 2 N |
|
v as (NH 2 ) |
— |
2931,42 |
|
v s (NH 2 ) |
2979,08 |
2595,34 |
|
v as (COO-) |
1564,10 |
1585,64 |
|
v s (COO-) |
1328,55 |
1394,64 |
|
δ as (NH 2 ) |
— |
1028,3 |
|
δ s (NH 2 ) |
1064,28 |
715,26 |
Выводы
ИК-спектры валина и комплексного соединения СоСl 2 ×2C 5 H 11 O 2 N свидетельствуют о том, что химическая связь между металлом и лигандом осуществляется через атомы кислорода карбоксильной и азота аминной групп.
Синтезированы комплексные соединения на основе хлоридов марганца, никеля, кобальта в соотношении 1:2.
Микроскопическим методом сняты кристаллы СоСl 2 ×6H 2 O.
Список литературы Взаимодействие валина с хлоридами биометаллов в водной среде при 25°C
- Albert A. Quantitative studies of the avidity of naturally occurring substances for trace metals. 3. Pteridines, riboflavin and purines // Biochemical Journal. 1953. V. 54. №4. P. 646. https://doi.org/10.1042%2Fbj0540646
- Smith A. D., Warren M. J., Refsum H. Vitamin B12 // Advances in food and nutrition research. 2018. V. 83. P. 215-279. https://doi.org/10.1016/bs.afnr.2017.11.005
- Newman J. M., Bear C. A., Hambley T. W., Freeman H. C. Structure of bis (glycinato) zinc (II) monohydrate, a five-coordinate zinc (II) complex // Acta Crystallographica Section C: Crystal Structure Communications. 1990. V. 46. №1. P. 44-48. https://doi.org/10.1107/S0108270189005664
- Steren C. A., Calvo R., Piro O. E., Rivero B. E. Molecular structure of bis (L-leucinato) zinc (II) and single-crystal EPR spectra of the substitutionally copper (II)-63-doped complex // Inorganic Chemistry. 1989. V. 28. №10. P. 1933-1938. https://doi.org/10.1021/ic00309a032
- Литвинова Т. Н., Выскубова Н. К., Ненашева Л. В. Биогенные элементы. Комплексные соединения. Ростов-на-Дону: Феникс, 2009. 283 с.
- Наканиси К. Инфракрасные спектры и строение органических соединений. М.: Мир, 1965. 216 с.
- Фридман Я. Д., Кебец Н. М., Усубалиев Д. У. Об устойчивости соединений солей металлов с аминокислотами // Журнал неорганической химии. 1990. Т. 35. №1. С. 2868.
- Мелентьева Г. A. Антонова Л. Фармацевтическая химия. М. Медицина, 1993. 575 с.
- Banerjee R. (ed.). Chemistry and Biochemistry of B12. John Wiley & Sons, 1999.
- Ершов Ю. А., Плетнева Е. В.. Механизмы токсического действия неорганических соединений. М.: Химия, 1989. 350 с.
- Азизов М. А. О комплексных соединениях некоторых микроэлементов с биоактивными веществами. Ташкент: Медицина, 1969. 200 с.
- Erikson K. M., Aschner M. Manganese neurotoxicity and glutamate-GABA interaction // Neurochemistry international. 2003. V. 43. №4-5. P. 475-480. https://doi.org/10.1016/S0197-0186(03)00037-8
- Гликина Ф. Б., Ключников Н. Г. Химия комплексных соединений. М.: Просвещение, 1982. 160 с.
- Hill H. A. O. Metals, models, mechanisms, microbes and medicine // Chemistry in Britain. 1976. V. 12. №4. P. 119-123.
- Frieden E. The evolution of metals as essential elements [with special reference to iron and copper] // Protein-metal interactions. 1974. P. 1-31. https://doi.org/10.1007/978-1-4684-0943-7_1


