Взаимодействие желатины с хитозаном: влияние концентрации полисахарида
Автор: Воронько Николай Георгиевич, Деркач Светлана Ростиславовна, Соколан Нина Ивановна
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Рубрика: Технология продовольственных продуктов
Статья в выпуске: 1 т.18, 2015 года.
Бесплатный доступ
Методами капиллярной вискозиметрии, УФ спектроскопии и дисперсии светорассеяния исследовано взаимодействие между желатиной и катионным полисахаридом хитозаном с образованием стехиометричных (био)полиэлектролитных комплексов в водной фазе, pH которой меньше изоэлектрической точки желатины. Водные дисперсии комплексов характеризуются увеличением размера частиц дисперсной фазы и, соответственно, относительной вязкости по сравнению с исходными золями отдельных компонентов - желатины и полисахарида. Обсуждаются модели и механизм формирования (био)полиэлектролитных комплексов в результате электростатических взаимодействий между положительно заряженными аминогруппами хитозана и отрицательно заряженными аминокислотными остатками (глутаминовой Glu и аспарагиновой Asp кислот) желатины.
Желатина, полисахарид, хитозан, (био)полиэлектролитные комплексы, вязкость, спектры поглощения
Короткий адрес: https://sciup.org/14294784
IDR: 14294784 | УДК: 544.77
Текст научной статьи Взаимодействие желатины с хитозаном: влияние концентрации полисахарида
В последние годы в пищевой промышленности, биотехнологии и медицине наблюдается увеличение спроса на новые материалы на основе (био)полиэлектролитных комплексов (ПЭК) ( Изумрудов , 2008; Gubbala , 2012). Подобные комплексы формируются из противоположно заряженных (комплементарных) биополимеров: белков, полисахаридов, нуклеиновых кислот. Если соотношение между противоположно заряженными группами биополимеров в комплексе составляет 1:1, то ПЭК называют стехиометричными, в противном случае – нестехиометричными ( Зезин, Кабанов , 1982; Kramarenko et al. , 2006). Теоретические аспекты формирования, физико-химические свойства и направления практического использования полиэлектролитных комплексов, образованных как из природных, так и из синтетических полиэлектролитов достаточно подробно изложены, например в обзорах ( Зезин, Кабанов , 1982; Изумрудов и др. , 1991; Кабанов , 2005; Kramarenko et al. , 2006; Изумрудов , 2008; Gubbala , 2012).
Использование катионного полисахарида хитозана в качестве своеобразной "матрицы" для формирования (био)полиэлектролитных комплексов является перспективным с точки зрения рационального использования биоресурсов. Биологическим предшественником хитозана является целлюлозоподобный биополимер хитин. Хитин – это основа скелетной системы членистоногих и второй после целлюлозы по распространенности в природе полисахарид. Линейные цепи хитина состоят из связанных (1-4)–гликозидной связью хитобиозных единиц (остатки 2-дезокси-2-ацетамидо- β -D-глюкана) (рис. 1а). В макромолекуле хитозана, в отличие от хитина, значительная часть хитобиозных единиц деацетилирована (рис. 1б) ( Быкова, Немцев , 2002; Muzzarelli, Muzzarelli , 2009).
В кислой среде макромолекулы хитозана обладают высокой плотностью положительного заряда благодаря ионизации свободных аминогрупп. По этой причине в кислых растворах хитозана в присутствии отрицательно заряженных полиэлектролитов возникает самосборка (био)полиэлектролитных комплексов (Изумрудов, 2008; Изумрудов и др., 2011). Формирование и стабильность (био)ПЭК на основе хитозана зависит от множества факторов: степень ионизации и плотность зарядов полиэлектролитов, распределение зарядов вдоль полимерных цепей, природа и расположение ионных групп на полимерных цепях, молекулярная масса и массовое соотношение полиэлектролитов, гибкость полимерных цепей, порядок смешивания и длительность взаимодействия полиэлектролитов, температура, ионная сила и pH среды (Il'ina, Varlamov, 2005; Краюхина и др., 2008; Hamman, 2010).
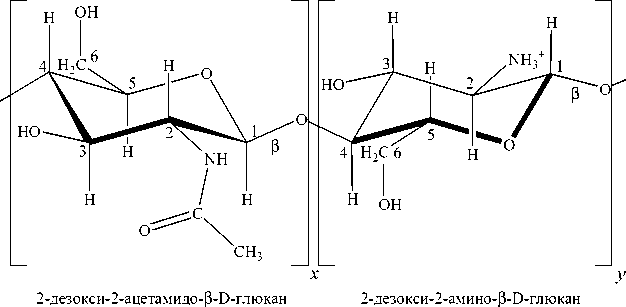
(а) (б)
Рис. 1. Структурная формула хитозана
Полиэлектролитные комплексы хитозана с отрицательно заряженными полиэлектролитами исследованы достаточно хорошо, например с ДНК ( Евдокимов , 2002; Patel et al. , 2010), каррагинанами ( Mitsumata et al. , 2003; Pinheiro et al. , 2012; Briones, Sato , 2013; Li et al. , 2013), натриевой солью КМЦ ( Mitsumata et al. , 2003), сульфатом ацетата целлюлозы ( Шибайло и др. , 2008), полистиролсульфонатами и полиметакрилатами ( Изумрудов и др. , 2011). В зависимости от условий (главным образом – соотношение компонентов и рН среды) хитозан с данными полиэлектролитами может образовывать как стехиометричные, так и нестехиометричные комплексы, которые являются предшественниками различных самоорганизующихся ( self-assembling ( Hamman , 2010)) структур (гелей, пленок, нанослоев, нано- и микрокапсул для доставки лекарств и т.д.).
Вместе с тем вопросы формирования (био)ПЭК хитозана с полиамфолитами изучены не так подробно. Биополимер желатина – продукт деструкции белка коллагена – имеет положительно и отрицательно заряженные группы в составе макромолекулы. В тканях хордовых коллаген несет те же структурирующие функции, что и хитин в тканях членистоногих. Подобно хитину коллаген имеет практически неисчерпаемый природный источник (до 60 % белковых веществ в тканях млекопитающих). Отрицательный заряд желатины создается остатками глутаминовой Glu и аспарагиновой Asp кислот, число которых на 1 000 аминокислотных остатков полиамфолита из разных природных источников составляет соответственно 69 ÷ 72 и 47 ÷ 48 ( Veis , 1964; Yannas , 1972; Haug, Draget , 2009).
Ранее авторы данной статьи исследовали особенности формирования (био)полиэлектролитных комплексов желатины с анионными полисахаридами из морских водорослей: альгинатом натрия ( Derkatch et al. , 2001; Воронько и др. , 2002; 2004) и κ -каррагинаном ( Деркач и др. , 2014; Маклакова и др. , 2014) вблизи изоэлектрической точки (pI) желатины. Согласно некоторым данным ( Yin et al. , 2005) устойчивые комплексы щелочной желатины с хитозаном формируются в диапазоне рН выше 4.7 (выше pI щелочной желатины) и ниже 6.7 (до начала выпадения хитозана в виде осадка из раствора).
Целью настоящей работы является исследование формирования (био)ПЭК желатины с хитозаном и коллоидно-химических свойств водных дисперсий комплексов при рН ниже pI желатины, где хитозан имеет положительный заряд, а диссоциация остатков Glu и Asp желатины в значительной степени подавлена. Интерес к данной области pH вызван тем, что хитозан растворяется исключительно в кислой среде ( Быкова, Немцев , 2002; Muzzarelli, Muzzarelli , 2009).
2. Экспериментальная часть
В работе использовали щелочную желатину типа B из бычьей кожи с твердостью по Блуму 225 ( Gelatin Type B from bovine skin 225 Bloom ) производства Sigma-Aldrich (США). В использованном образце желатины массовая доля: белка 75 %, влаги 10.2 %, золы (в сухом остатке) 1.6 %, изоэлектрическая точка pI 4.7 (определяли вискозиметрическим и турбидиметрическим методами).
Использовали хитозан из панцирей креветки ( Chitosan from shrimp shells ) производства Sigma-Aldrich (Исландия). В образце хитозана степень деацетилирования составляла 86 %.
Средневязкостную молекулярную массу биополимеров M η определяли по их характеристической ( intrinsic ) вязкости [η] в натрий-ацетатном буфере, используя уравнение Марка – Куна – Хаувинка:
-
- для желатины при условиях: 35 °С, pH 4.7, I = 0.1 ( Veis , 1964)
[ п ] = 1.66 - 10 - 5 M п 0.885, (1)
-
- для хитозана при условиях: 25 °С, pH 4.5, I = 0.2 ( Лопатин , 2010)
[ п ] = 13.8 - 10 " 5 M п 0.85. (2)
Эффективный радиус макромолекулярного клубка биополимеров при бесконечном разбавлении Ref ^ рассчитывали по формуле ( Тагер , 2007):
3 Ы М n
V10 П N A
R } ef,
Экспериментальные исследования показали: для желатины M n = 96 kDa, Rf ^ = 9 нм; для хитозана M = 260 kDa, АП = 29 нм.
П ef. “
Золи желатины готовили по стандартной методике с предварительным набуханием в воде или 0.1 M растворе уксусной кислоты при 20 ° С и последующим растворением при 40 ° С. Золи желатины в воде имели pH от 4.8 до 4.9 ( = pI), в уксусной кислоте - pH 3.4. Хитозан растворяли в 0.1 M уксусной кислоте при 70 оС с предварительным набуханием в течение суток при 20 ° С. Значения pH золей хитозана лежали в диапазоне от 3.1 до 3.9, незначительно возрастая при увеличении концентрации хитозана.
Исходные золи желатины и хитозана смешивали при температуре 40 ° С в пропорциях, соответствующих установленным концентрациям биополимеров в образце. рН полученных смесей от 3.2 до 3.9 (< pI желатины). В этой области рН во всем исследованном диапазоне концентраций биополимеров фазового разделения и коацервации системы не наблюдалось.
Относительную ( related) вязкость n rel золей измеряли методом капиллярной вискозиметрии при температуре (30.00 ± 0.01) °С, время термостатирования перед началом измерений 30 мин. Использовали капиллярный вискозиметр ВПЖ (вискозиметр Оствальда – Фенске), внутренний диаметр капилляра 0.56 мм, длина 85 мм. Максимальная скорость сдвига на стенках капилляра у r составила 14.0 с-1, а напряжение сдвига τ r – 11.2 мПа. Критерий Рейнольдса для всех исследованных жидкостей был на несколько порядков ниже критического значения Re c = 2300, что указывает на ламинарный характер течения ( Малкин Исаев , 2010).
УФ-спектры поглощения исследованных систем в области ближнего ультрафиолета (диапазон длин волн λ от 190 до 360 нм) были получены методом абсорбционной спектроскопии ( Рабек , 1983).
Эффективный радиус R ef частиц дисперсной фазы в золях желатины, хитозана и их смесей определяли турбидиметрически методом дисперсии светорассеяния ("спектра мутности") ( Klenin , 1999) в диапазоне длин волн λ от 450 до 550 нм. Экспериментально полученные данные аппроксимированы степенными моделями Ангстрема:
A = k X n , (4)
где A – оптическая плотность ( absorbance ); λ – длина волны, нм; k – константа, не зависящая от размера частиц дисперсной фазы и длины волны падающего света; n – волновой экспонент (функция размера частицы, не зависящая от длины волны). Коэффициент парной корреляции составил r = 0.959 + 0.998. R ef частиц определяли из рассчитанного по уравнениям Ангстрема (4) значения волнового экспонента n .
Спектрометрические и турбидиметрические измерения проводили на спектрометре T 70 UV / visibl e ( PG Instruments , Великобритания), толщина кюветы 1 см, температура измерений 23 °С. Перед началом измерений растворы выдерживали в кювете спектрометра при данной температуре в течение 2.5 ч, так как предварительно было установлено, что за это время в объеме растворов формируются частицы постоянного размера.
3. Результаты и обсуждение
На рис. 2 представлена кривая турбидиметрического титрования золя желатины золем хитозана. Видно, что при увеличении массового соотношения биополимеров Z в системе, оптическая плотность A растет, достигая максимального значения 1.312 при Z = 0.78 г хит./г жел. До этого массового соотношения биополимеров при низком содержании хитозана и избытке желатины формируются стехиометричные (био)полиэлектролитные комплексы постоянного состава. Увеличение оптической плотности связано с увеличением концентрации комплексов в смеси. Дальнейшее увеличение Z (увеличение содержания хитозана) приводит к уменьшению оптической плотности смесей. При этом формируются нестехиометричные комплексы желатины с хитозаном переменного состава. При уменьшении содержания желатины в комплексе, положительный заряд полисахарида становится нескомпенсированным, растворимость полиэлектролитных комплексов растет и оптическая плотность уменьшается. Все дальнейшие исследования проводили в области Z ≤ 0.5 г хит./г жел., где формируются стехиометричные (био)ПЭК "желатина – хитозан".
Α

1,4
1,3
1,2
1,1
0,9
0,8
0,7
0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,6 1,8 2
Z , г хит./г жел.
Рис. 2. Зависимость оптической плотности A смесей желатины с хитозаном в 0.1 М уксусной кислоте от массового соотношения биополимеров Z при титровании золя желатины (Cg = 1.0 %, Vg = 20.5 см3) золем хитозана (Cch = 2.0 %); λ = 400 нм, l = 5 см, t = 23 ºС
На рис. 3 представлена зависимость относительной вязкости η rel золей желатины от концентрации желатины С g (1), а также золей хитозана (2) и смесей желатины (1.0 %) с хитозаном (3) от концентрации хитозана С ch . Из рис. 3 видно, что с увеличением концентрации желатины (кривая 1) и концентрации хитозана (кривая 2) вязкость возрастает. Однако вязкость смесей желатины с хитозаном имеет несколько меньшие значения, чем вязкость золя хитозана без желатины в одной и той же области значений pH и концентрации полисахарида (рис. 3, кривые 2 и 3).
Такое понижение вязкости золей хитозана при внесении желатины можно объяснить следующим. Макромолекулы хитозана в кислой среде сильно вытянуты благодаря электростатическому отталкиванию положительно заряженных аминогрупп (см. рис. 1б). Это благоприятствует взаимной ориентации макромолекул и установлению межмолекулярных водородных связей, что в итоге приводит к высоким значениям вязкости золя хитозана ( Гамзадзе , 2002; Muzzarelli, Muzzarelli , 2009). В смеси же хитозана с желатиной отрицательно заряженные группы макромолекул желатины (остатки Glu и Asp ) блокируют положительные заряды аминогрупп хитозана, электростатически взаимодействуя с ними. Такой эффект напоминает влияние низкомолекулярных противоионов в солевых растворах хитозана, которое выражается в экранировании положительных аминогрупп и понижении вязкости ( Сафронов , 2002; Muzzarelli, Muzzarelli , 2009). По-видимому, модифицированные желатиной макромолекулы хитозана способны к образованию внутримолекулярных, а не только межмолекулярных связей.
На рис. 4 представлены УФ-спектры поглощения золей желатины (1.0 %) в уксусной кислоте с добавками хитозана разных концентраций. Там же для сравнения приведены спектры поглощения уксуснокислых золей биополимеров, взятых в отдельности: желатины (1.0 %, кривая 1) и хитозана (0.5 %, кривая 6). Наблюдается неаддитивное влияние хитозана на спектр поглощения желатины в кислой среде. При введении хитозана происходит батохромный сдвиг максимума поглощения желатины λ max с 234 нм до 237 нм независимо от концентрации хитозана. Максимальная оптическая плотность A max увеличивается при увеличении концентрации хитозана. В УФ-спектре золя хитозана длина волны максимальной оптической плотности (кривая 6) лежит в более коротковолновой области ( λ max = 224 нм).
A
3,0
2,5
2,0
1,5
1,0
0,5
0,0
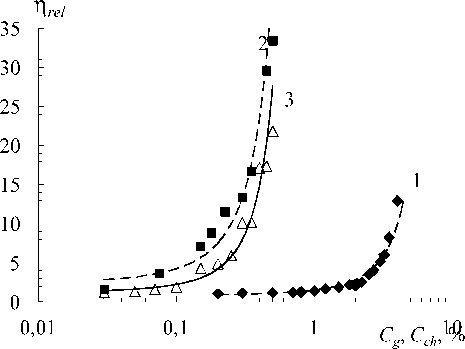
Рис. 3. Зависимость относительной вязкости η rel золей желатины в воде
(pH 4.8 + 4.9 = pI желатины) от концентрации желатины C g (1), а также золей хитозана (pH 3.1 + 3.9) (2) и желатины (1.0 %) с хитозаном (pH 3.2 + 3.9) (3) в уксусной кислоте от концентрации хитозана C ch
234 237
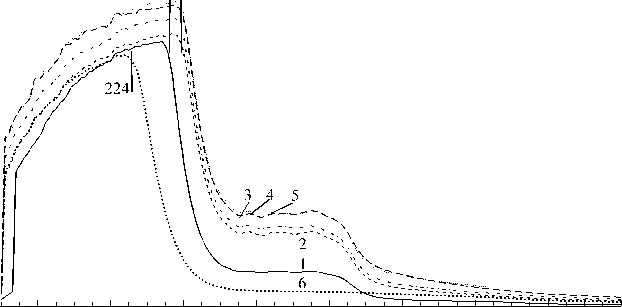
200 220 240 260 280 300 320 340 360
X , нм
Рис. 4. УФ-спектры поглощения золей желатины (1), желатины с хитозаном (2 + 5) и хитозана (6).
C g = 1.0 %; C ch , %: 0.2 (2), 0.3 (3), 0.4 (4), 0.5 (5, 6). pH 3.4 - 3.9
Батохромный сдвиг в спектре желатины можно объяснить электростатическим взаимодействием аминогрупп хитозана с типичными хромофорами, поглощающими излучение в области ближнего ультрафиолета – карбоксильными группами Glu и Asp ( Рабек , 1983). Полученные результаты подтверждают межмолекулярное взаимодействие желатины и хитозана в объеме золя в кислой области pH наряду с вискозиметрическими данными.
Подобные эффекты в золях желатины с другим полисахаридом – анионным биополимером к -каррагинаном авторы наблюдали в работе ( Маклакова и др. , 2014), используя метод ИК-спектроскопии. Было обнаружено, что благодаря электростатическому взаимодействию желатины с полисахаридом в ИК-спектре желатины возникает сдвиг A v = 2 см-1 в низкочастотную область независимо от концентрации введенного к -каррагинана C car , при этом интенсивность полосы пропускания с ростом C car увеличивается.
На рис. 5 представлена зависимость эффективного радиуса частиц, определенного методом "спектра мутности", R ef в смесях желатины с хитозаном от концентрации хитозана C ch в кислой области pH. При увеличении C ch R ef возрастает от 45 нм ( C ch = 0 %) до 260 нм ( C ch = 0.5 %). Для сравнения, в золе хитозана без желатины при C ch = 0.5 % R ef = 120 нм, что указывает на неаддитивный характер укрупнения частиц в смесях желатины с хитозаном. Зависимость R ef от концентрации хитозана C ch в исследованном диапазоне при постоянной концентрации желатины C g = 1.0 % хорошо описывается экспоненциальной моделью:
R ef. = 52.3e 2.93 C ch , r = 0.954. (5)
Ранее установлено, что в гидрозолях желатины с анионными полисахаридами морского происхождения при pH = pI желатины в той же области соотношений желатины и полисахарида R ef частиц достигал гораздо больших значений: 920 нм для альгината натрия ( Воронько и др. , 2002) и 1400 нм для к -каррагинана (Деркач и др. , 2014). При этом R ef частиц в гидрозоле желатины (1.0 %) без полисахаридов при данном рН составлял 110 нм ( Деркач и др. , 2014).
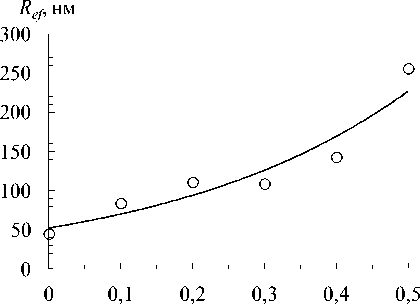
C ch , г/ 100 см3
Рис. 5. Зависимость эффективного радиуса частиц R ef в золях желатины (1.0 %) с хитозаном от концентрации хитозана Cch . pH 3.4 + 3.9
Образование частиц небольших размеров в случае хитозана можно объяснить влиянием уксусной кислоты. В кислой среде (pH 3.4 + 3.9 < pI) количество отрицательно заряженных остатков Glu и Asp желатины относительно невелико и практически все они вступают в электростатические взаимодействия с хитозаном. Дальнейшее укрупнение частиц в результате взаимодействия концевых цепей желатины по-видимому происходит в незначительной степени из-за отталкивания их положительных зарядов (остатки лизина Lys , гидроксилизина Hyl , гистидина His и аргинина Arg , число которых на 1000 аминокислотных остатков желатины составляет соответственно 22 + 28, 4 + 9, 4 + 11 и 47 + 49 ( Veis , 1964; Yannas , 1972; Haug, Draget , 2009)). В случае взаимодействия желатины в области pl с анионными полисахаридами альгинатом натрия или к -каррагинаном эффект взаимного отталкивания частиц отсутствует, так как на концевых цепях желатины остается достаточное количество как положительных, так и отрицательных зарядов.
Размер частиц дисперсной фазы, возникающих в объеме уксуснокислых золей желатины с хитозаном, оказывает непосредственное влияние на вязкость золей. На рис. 6 показана корреляция между относительной вязкостью золей желатины с хитозаном и эффективным радиусом R ef частиц дисперсной фазы золя. Зависимость n rel от R ef (нм) частиц хорошо аппроксимируется квадратичной моделью:
n re, = KR ef , r = 0.924, (6) где K = 0.001.
Совместный анализ результатов вискозиметрических и спектрометрических исследований золей желатины с хитозаном, а также литературных данных, позволяет осветить общую картину формирования (био)полиэлектролитных комплексов в кислой среде (рис. 7).
Хитозан (Mη = 260 kDa) является более высокомолекулярным биополимером, чем желатина (Mη = 96 kDa). Макромолекулярные клубки в золях хитозана (Rf^ = 29 нм) значительно крупнее клубков в золе желатины (Ref ^ = 9 нм). При смешивании исходных кислых золей желатины и хитозана в объеме полученной смеси устанавливаются значения pH в диапазоне от 3.2 до 3.9 в зависимости от концентрации хитозана. В данной области pH ниже pI желатины, аминогруппы хитозана почти полностью ионизированы, а карбоксильные группы остатков Glu и Asp желатины ионизированы в незначительной степени. Это позволяет предположить, что с положительно заряженной матрицей – макромолекулой хитозана электростатически связывается несколько макромолекул желатины. Учитывая, что верхняя граница формирования стехиометричных (био)ПЭК соответствует соотношению Z = 0.78 г хит./г жел. (см. рис. 2) и зная молекулярные массы биополимеров, можно определить, что в среднем с одной макромолекулой хитозана связано от 3 до 4 макромолекул желатины.
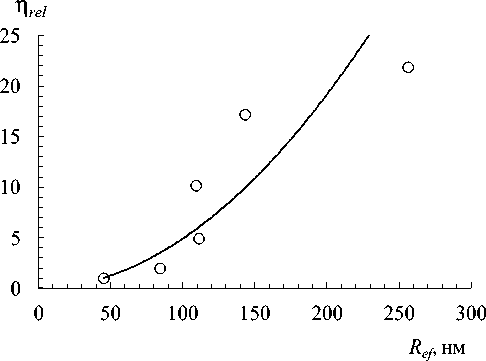
Рис. 6. Корреляция между относительной вязкостью η rel и эффективным радиусом частиц R ef в уксуснокислых золях желатины с хитозаном. pH 3.4 + 3.9
Высокозаряженный хитозан вызывает дополнительную ионизацию карбоксильных групп желатины в кислой области pH ( Изумрудов , 2008). Это способствует образованию устойчивого (био)ПЭК "желатина – хитозан", в котором хитозан играет роль лиофилизирующего, а желатина – блокирующего полиэлектролита ( Зезин, Кабанов , 1982; Изумрудов и др. , 1991) или, соответственно, полиэлектролита-хозяина ( host-polyelectrolyte ) и полиэлектролита-гостя ( guest-polyelectrolyte ) ( Кабанов , 2005; Изумрудов , 2008). Так как в исследованной области массовых соотношений биополимеров ( Z ≤ 0.5 г хит./г жел.) формируются стехиометричные (био)ПЭК "желатина – хитозан" (см. рис. 2), все положительные заряды хитозана нейтрализованы отрицательными зарядами желатины. Поэтому макромолекулы хитозана испытывают тенденцию к формированию внутримолекулярных связей. Это может приводить к компактизации комплекса путем образования внутримолекулярных двойных спиралей лиофилизирующего полиэлектролита – хитозана ( Гамзадзе , 2002; Muzzarelli, Muzzarelli , 2009).
Образовавшиеся стехиометричные (био)полиэлектролитные комплексы "желатина – хитозан" в исследованной области соотношений биополимеров и рН имеют высокую плотность положительного заряда за счет ионизированных свободных концов макромолекул желатины. Поэтому в смесях желатины с хитозаном не наблюдалось фазового разделения и коацервации, что происходило бы, если бы стехиометричные комплексы не несли заряда ( Зезин , Кабанов , 1982; Изумрудов и др. , 1991).
4. Заключение
Исследовано взаимодействие между макромолекулами хитозана и желатины при образовании (био)полиэлектролитных комплексов "желатина – хитозан" при постоянной концентрации желатины 1.0 % в диапазоне концентраций полисахарида от 0.03 до 0.5 % при pH от 3.2 до 3.9 (< pI желатины). Установлено, что в данном диапазоне массовых соотношений биополимеров и рН среды формируются стехиометричные комплексы. Методами капиллярной вискозиметрии, УФ-спектроскопии и дисперсии светорассеяния показано, что введение хитозана в золь желатины приводит к значительному увеличению относительной вязкости водных дисперсий и размера частиц дисперсной фазы. Корреляция между этими параметрами хорошо описывается квадратичной моделью.
Показано, что (био)полиэлектролитные комплексы "желатина – хитозан" формируются в результате электростатических взаимодействий между положительно заряженными аминогруппами хитозана и отрицательно заряженными аминокислотными остатками Glu и Asp желатины. Несмотря на стехиометричный состав образовавшихся (био)ПЭК во всем исследованном диапазоне массовых соотношений биополимеров не наблюдалось фазового разделения и коацервации благодаря высокой плотности положительного заряда на свободных концах макромолекул желатины.
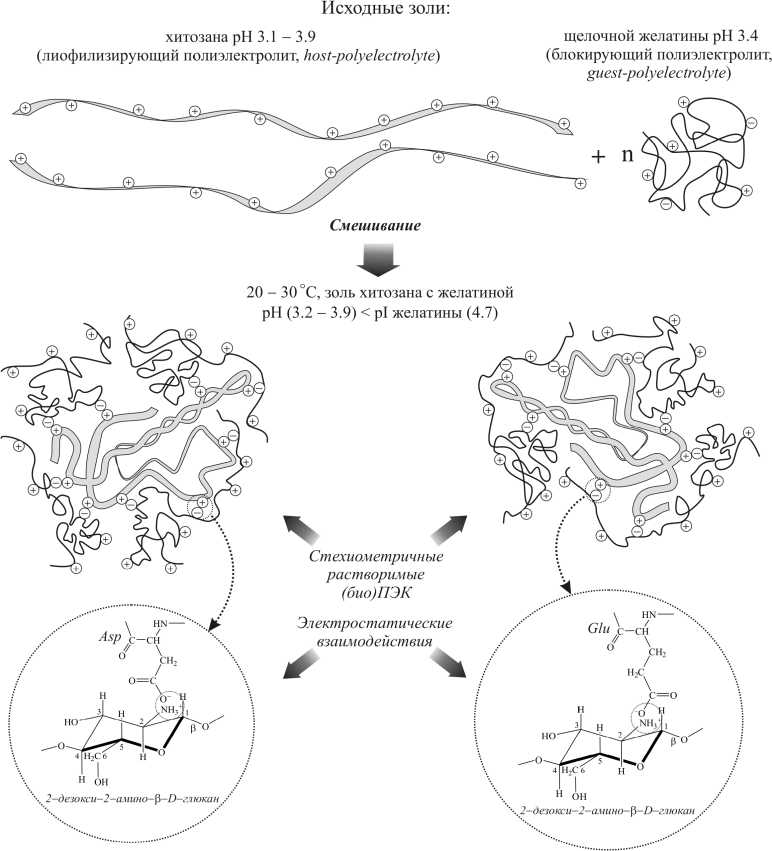
Рис. 7. Качественная схема образования стехиометричных (био)ПЭК "желатина – хитозан" в кислой среде
Список литературы Взаимодействие желатины с хитозаном: влияние концентрации полисахарида
- Briones A.V., Sato T. Ability of chitosan/carrageenan complex to encapsulate bovine serum albumin (BSA) for potential use in protein delivery. Asian Journal of Biological and Life Sciences. 2013. V. 2, N 2. P. 163-169
- Derkatch S.R., Voronko N.G., Izmailova V.N. Rheological properties of gelatin gels with sodium alginate. International J. Applied Mechanics and Engineering. 2001. V. 6, N 3. P. 659-673
- ubbala S.K. Polyelectrolyte complex: A pharmaceutical review. Review Article Pharmaceutical Sciences. 2012. V. 2, N 3. P. 399-407
- Hamman J.H. Chitosan based polyelectrolyte complexes as potential carrier materials in drug delivery systems. Marine Drugs. 2010. V. 8. P. 1305-1322
- Haug I.J., Draget K.I. Gelatin. Handbook of hydrocolloids. G.O. Phillips, P.A. Williams (Edition). Boca Raton, Boston, New York, Washington DC: CRC Press, 2009. P. 142-163
- Il'ina A.V., Varlamov V.P. Chitosan-based polyelectrolyte complexes: A review. Appl. Biochem. Microbiol. 2005. V. 41. P. 5-11
- Klenin V.J. Thermodynamics of systems containing flexible-chain polymers. Amsterdam, Lausanne, New York, Oxford, Shannon, Singapore, Tokyo, Elsevier, 1999. 850 p
- Kramarenko E.Y., Khokhlov A.R., Reineker P. Stoichiometric polyelectrolyte complexes of ionic block copolymers and oppositely charged polyions. J. Chem. Phys. 2006. V. 125. P. 1-8
- Li C., Hein S., Wang K. Chitosan -carrageenan polyelectrolyte complex for the delivery of protein drugs. Hindawi Publishing Corporation. ISRN Biomaterials. 2013. V. 2013. P. 1-6
- Mitsumata T. et al. pH-response of chitosan, κ-carrageenan, carboxymethyl cellulose sodium salt complex hydrogels. Polymer. 2003. V. 44. P. 7103-7111
- Muzzarelli R.A.A., Muzzarelli C. Chitin and chitosan hydrogels. Handbook of hydrocolloids. G.O. Phillips, P.A. Williams (Edition). Boca Raton, Boston, New York, Washington DC, CRC Press, 2009. P. 849-888
- Patel M.P., Patel R.R., Patel J.K. Chitosan mediated targeted drug delivery system: A Review. J. Pharm. Pharmaceut. Sci. 2010. V. 13, N 3. P. 536-557
- Pinheiro A.C. et al. Interactions between κ-carrageenan and chitosan in nanolayered coatings -Structural and transport properties. Carbohydrate Polymers. 2012. V. 87. P. 1081-1090
- Veis А. The macromolecular chemistry of gelatin. New York, London, Academic Press, 1964. 478 p
- Yannas I.V. Collagen and gelatin in the solid state. Polymer Review. 1972. V. 7, N 1. P. 40-106
- Yin Y., Li Z., Sun Y., Yao K. A preliminary study on chitosan/gelatine polyelectrolyte complex formation. J. Mater. Sci. (Letters). 2005. V. 40. P. 4649-4652
- Быкова В.М., Немцев С.В. Сырьевые источники и способы получения хитина и хитозана//Хитин и хитозан: получение, свойства и применение. Под ред. К.Г. Скрябина, Г.А. Вихоревой, В.П. Варламова. М., Наука, 2002. С. 7-18
- Воронько Н.Г. Деркач С.Р., Беляевский А.Т. Структурные свойства пищевых многокомпонентных гелей по данным растровой электронной микроскопии. Вестник МГТУ. 2004. Т. 7, № 1. С. 47-49
- Воронько Н.Г., Деркач С.Р., Измайлова В.Н. Реологические свойства гелей желатины с альгинатом натрия. Журнал прикладной химии. 2002. Т. 75, Вып. 5. С. 808-812
- Гамзадзе А.И. Структурная неоднородность как фактор изменчивости свойств хитина и хитозана//Хитин и хитозан: получение, свойства и применение. Под ред. К.Г. Скрябина, Г.А. Вихоревой, В.П. Варламова. М., Наука, 2002. С. 112-118
- Деркач С.Р., Воронько Н.Г., Маклакова А.А., Кондратюк Ю.В. Реологические свойства гелей желатины с k-каррагинаном: роль полисахарида. Коллоидный журнал. 2014. Т. 76, № 2. С. 164-170
- Евдокимов Ю.М. Нуклеиновые кислоты и хитозан//Хитин и хитозан: получение, свойства и применение. Под ред. К.Г. Скрябина, Г.А. Вихоревой, В.П. Варламова. М., Наука, 2002. С. 178-200
- Зезин А.Б., Кабанов В.А. Новый класс комплексных водорастворимых полиэлектролитов. Успехи химии. 1982. Т. 51, Вып. 9. С. 1447-1483
- Изумрудов В.А. Явления самосборки и молекулярного "узнавания" в растворах (био)полиэлектролитных комплексов. Успехи химии. 2008. Т. 74, Вып. 4. С. 401-415
- Изумрудов В.А., Волкова И.Ф., Григорян Э.С., Горшкова М.Ю. Водорастворимые нестехиометричные полиэлектролитные комплексы модифицированного хитозана. Высокомолекулярные соединения, Серия А. 2011. Т. 53, № 4. С. 515-524
- Изумрудов В.А., Зезин А.Б., Кабанов В.А. Равновесие интерполиэлектролитных реакций и явление молекулярного узнавания в растворах интерполиэлектролитных комплексов. Успехи химии. 1991. Т. 60, Вып. 7. С. 1570-1595
- Кабанов В.А. Полиэлектролитные комплексы в растворе и в конденсированной фазе. Успехи химии. 2005. Т. 74, № 1. С. 5-23
- Краюхина М.А., Самойлова Н.А., Ямсков И.А. Полиэлектролитные комплексы хитозана: формирование, свойства и применение. Успехи химии. 2008. Т. 77, № 9. С. 854-869
- Лопатин С.А. Проблемы определения молекулярно-массовых характеристик хитозана. Рыбпром. 2010. № 2. С. 82-85
- Маклакова А.А., Воронько Н.Г., Деркач С.Р., Кадырова Г.И., Зотова К.В. Взаимодействие желатины с κ-каррагинаном по данным ИК-спектроскопии. Вестник МГТУ. 2014. Т. 17, № 1. С. 53-60
- Малкин А.Я., Исаев А.И. Реология: концепции, методы, приложения. СПб., ЦОП "Профессия", 2010. 560 с
- Рабек Я. Экспериментальные методы в химии полимеров. В 2 ч. Ч. 1. М., Мир, 1983. 384 с
- Сафронов А.П. Термохимия водных растворов солей хитозана: суперпозиция межмолекулярных взаимодействий и структурных особенностей полимера//Хитин и хитозан: получение, свойства и применение. Под ред. К.Г. Скрябина, Г.А. Вихоревой, В.П. Варламова. М., Наука, 2002. С. 132-141
- Тагер А.А. Физико-химия полимеров. М., Научный мир, 2007. 576 с
- Шибайло Т.Н. и др. Комплексообразование хитозана и сульфата ацетата целлюлозы в уксуснокислых растворах. Коллоидный журнал. 2008. Т. 70, № 5. С. 709-714


