Взаимоотношения «ген-среда» при психических расстройствах: трансляция прогресса нейронаук в персонифицированную медицину (по материалам XXI конгресса Европейского общества психиатров)
Автор: Сюняков Т.С.
Журнал: Сибирский вестник психиатрии и наркологии @svpin
Рубрика: Лекции. Обзоры
Статья в выпуске: 3 (84), 2014 года.
Бесплатный доступ
Данная статья является одной из серии публикаций, посвященных материалам XXI конгресса Европейской ассоциации психиатров, прошедшего 6-9 апреля в Ницце (Франция). Приведен обзор наиболее важных сообщений, посвященных последним достижениям в области понимания взаимоотношений «ген-среда» при психических расстройствах и их значению с позиций трансляционной психиатрии и персонифицированной медицины.
Взаимоотношения "ген-среда", депрессия, тревожные расстройства, шизофрения, конгресс epa
Короткий адрес: https://sciup.org/14295740
IDR: 14295740 | УДК: 616.895.4
Текст обзорной статьи Взаимоотношения «ген-среда» при психических расстройствах: трансляция прогресса нейронаук в персонифицированную медицину (по материалам XXI конгресса Европейского общества психиатров)
Во французской Ницце с 6 по 9 апреля 2013 г. прошел XXI конгресс психиатрии под эгидой Европейского общества психиатров (EPA).
Противоречия между доказательной и персонифицированной медициной являются предметом широких дискуссий. Потенциалом к достижению компромисса между этими направлениями обладают исследования в области нейронаук ввиду того, что они на доказательном уровне предоставляют более тонкий подход, учитывающий состояние отдельного пациента, особенности его заболевания, генетической предиспозиции, факторов, сопутствующих развитию, состояние биологических систем организма, стрессовых факторов и условий окружающей среды. Обсуждение этих вопросов стало одной из основных тем конгресса, а ключевое место при их освещении заняла теоретическая лекция проф. Джулио Лицинио (Julio Licinio) из Южно-австралийского исследова-
Сюняков Т. С., старший научный сотрудник тельского института здоровья и медицины (Аделаида, Австралия) «От взаимодействий между генетическими и средовыми факторами к терапии и профилактике», отразившая результаты многолетних работ и наметившая дальнейшие перспективы исследований.
В начале сообщения Лицинио указал, что экономическое бремя психических расстройств велико (800 млрд евро в год для стран Европы), а для фармакологических компаний рынок психотропных препаратов является крайне прибыльным (оборот около 80,5 млрд долларов только в США). Парадокс в том, что прагматичные фармакологические компании закрывают подразделения, занимающиеся разработкой психотропных лекарственных средств. Комментируя данную проблему, докладчик отметил, что это связано с трудностями, возникающими «при наведении мостов между фундаментальной наукой и клиническими дисциплинами», т. е. перед трансляционными нейронауками. Наиболее красноречивой иллюстрацией данного тезиса является тот факт, что на сегодняшний день широко используемые антидепрессанты опираются на механизмы, выявленные 60 лет назад Джулиусом Аксельродом, а открытия позднего периода практически не внедрены в практическую сферу. Это связано с тем, что осуществление комплекса процесса трансляции (научная идея/открытие → апробирование на людях → клинические исследования → внедрение результатов в руководства и политику здравоохранения → отслеживание долгосрочных эффектов (позитивных и негативных) → распространение новых данных по миру и окончательное понимание значимости открытия для глобального здравоохранения) является затратным по ресурсам и времени. В этой связи Лицинио предлагает фокусировать усилия на устранении пробелов между научной гипотезой, доказательными данными и эмпирическими свидетельствами. Таких слабых мест, по мнению докладчика, три: 1) может возникнуть расхождение на уровне знаний, когда эмпирические наблюдения не имеют под собой ни доказательной базы, ни гипотезы, в этом случае необходимо направить усилия на поиск лежащих в основе эмпирических наблюдений причин и механизмов; 2) может наблюдаться ситуация, когда пробел между эмпирическими данными и научной гипотезой заключается в отсутствии доказательной базы, данный пробел должен быть устранен путем повышения «транслируемости» научных данных; 3) эмпирический опыт может не соответствовать ожиданиям, основанным на научном открытии, подтвержденном на доказательном уровне. Рациональным объяснением подобного рода разногласий может служить несоблюдение рекомендаций. Решением проблемы может быть только приведение действий и поведения больных и врачей в соответствие рекомендациям. По ходу доклада подчеркивается значимость правильного выбора объекта и методологии исследований для более эффективного переноса научных данных в практическую деятельность.
В качестве иллюстрации автор привлек результаты собственных исследований депрессий и ожирения. Предпосылками для рассмотрения этих патологических состояний в одной связке явились также примерно одинаковая распространенность (порядка 25 %) ожирения и аффективных / тревожных (родственных генетической основой, механизмами и терапией) расстройств и их частое сосуществование. Оба заболевания обусловлены генетическими механизмами и средовыми влияниями (стрессами). Они взаимно повышают риск возникновения друг друга, имеют пересекающийся круг осложнений и коморбидных состояний. При депрессивных расстройствах нарушается функционирование основных органов и систем, что наряду с суицидальным поведением является причиной высокой смертности при данном расстройстве. Так, большое депрессивное расстройство в 2 раза повышает риск ишемической болезни сердца и на 60 % вероятность возникновения сахарного диабета второго типа, которые также являются осложнение ожирения. Депрессивным нарушениям в долгосрочной перспективе часто сопутствуют кардиометаболические расстройства и увеличение веса, а при сосуществовании депрессивных нарушений и сахарного диабета увеличение веса даже на 5 кг в 1,5 раза повышает риск возникновения ИБС. Предпосылками фактически начавшейся эпидемии ожирения считаются снижение физической активности и повышенное потребление пищи, которые часто встречаются при депрессивных состояниях. Важно, что некоторые нейропептидные и нейротрансмиттерные системы, в том числе кортиколиберин, нейропептид Y, серотонин и норадреналин, вовлечены в контроль и настроения, и веса тела. При этом препараты, применяемые при лечении ожирения (механизм их действия заключается во влиянии на содержание серотонина и норадреналина в ЦНС), часто приводят к формированию пониженного настроения, а терапия депрессивных расстройств осуществляется антидепрессантами (главным образом, влияющими на обратный захват серотонина и норадреналина), которые часто приводят к увеличению веса в долгосрочной перспективе, а также повышают риск сахарного диабета, независимо от исходного индекса массы тела. В свою очередь, с увеличением веса также связан повышенный риск и других болезней, в частности онкологических (на 60 %). На актуальность изучения данной проблемы также указывает то, что все указанные последствия в клинической практике недооцениваются и должным образом не лечатся. Таким образом, депрессия и ожирение значительно больше связаны друг с другом, чем представлялось раньше. При этом существуют биологические системы, значение которых для этих двух заболеваний не вполне ясно – это нейропептиды стресса, медиаторы иммунитета, ади-покины и нейрокины. И хотя постановка данной проблемы отнюдь не заслуга последних достижений, новые науки (фармакогеномика и геномика) позволяют взглянуть на нее с иной стороны.
В связи с указанными фактами правомерны следующие вопросы. Совпадение ли это или следствие общих биологических механизмов? Каков характер взаимоотношений между депрессией и ожирением,. каково место стрессовой системы в этих взаимоотношениях? Любое ли из этих состояний может являться отправной точкой для других? Какие взаимодействия возникают у людей, склонных к ожирению, на фоне приема антидепрессантов? Отличается ли ожирение в контексте приема антидепрессантов от ожирения вследствие нарушений энергетического обмена?
Пытаясь ответить на часть поставленных вопросов, Джулио Лицинио продемонстрировал результаты эксперимента, направленного на выявление взаимодействий между стрессом, средовыми и фармакологическими факторами. В рамках этого исследования крыс подвергали воздействию краткосрочного (на протяжении 1 недели) стрессового воздействия (ограничение активности). При этом части животных в этот период давали антидепрессанты, а части – вводили физиологический раствор. После завершения этого этапа животным в течение длительного времени давалась пища, обогащенная жирами. Оказалось, что животные, которым назначались антидепрессанты, не только компенсировали снизившийся на фоне стресса вес, но и прибавили в весе значительно больше, чем крысы из контрольной группы. Таким образом, даже краткосрочный прием антидепрессантов вызывает длительно существующую сенситизацию к повышению веса. При этом антидепрессанты в условиях стрессового воздействия оказывали на животных и благоприятное («антидепрессивное») действие. Оказалось, что у животных опытной группы повышена экспрессия ряда факторов роста: мозгового нейротрофного фактора (BDNF), фактора роста нервов (NGF) и, что важнее всего, инуслиноподобного фактора роста (IGF-1), который и мог обусловить увеличение веса животных. Таким образом, данный эксперимент (парадигма стресс-диета-антидепрессанты), с одной стороны, продемонстрировал влияние даже краткосрочного приема антидепрессантов на вес (и это при том, что антидепрессанты занимают в мире второе место по продажам, а многие больные принимают их бесконтрольно). С другой стороны, показана важность стрессовой реакции – координированного ответа нейроэндокринной системы на неблагоприятные внешние или внутренние факторы – в повышении веса в долгосрочном периоде.
В патогенезе ожирения играют роль взаимодействия генетической предрасположенности и средовых факторов (обнаружена взаимосвязь ожирения с доступностью пищи, снижением физической активности, инфекционными заболеваниями, возрастом матери, высокой плодовитостью и ассортативностью браков, содержанием в окружающей среде химических веществ, вызывающих эндокринные расстройства, малыми перепадами температуры окружающей среды, внутриутробными факторами, приемом препаратов).
Таким образом, складывается континуум в ряду влияния на вес внешних и генетических факторов: у части людей большую роль играют алиментарные факторы, у части – повышенное потребление пищи возникает в связи со стрессами и эмоциональными проблемами, а еще одна часть людей страдает избытком веса в связи с генетической предрасположенностью. При ожирении, в отличие от депрессии, генетический фактор может играть колоссальную роль. Несмотря на то что контроль веса тела также вовлекает множество генетически детерминированных систем (моноамины, нейропептид Y – NPY, гормоны и про-гормоны гипоталамуса и гипофиза, галанин, оре-хины, холецистокинин, бомбезин), настоящим прорывом в области знаний об ожирении является выявление роли лептина при данной патологии. Лептин является передаточным звеном между жировой тканью и головным мозгом, а МРТ-исследования показали, что лептин регулирует активность островковой зоны головного мозга в ответ на предоставление пищи. Видимо, при ожирении играет роль также другой нейропептид – гхрелин, который вызывает активацию в тех же областях, что и лептин. Похоже, что влияния содержания гхрелина и лептина на повышение аппетита находятся в реципрокных взаимоотношениях. Также автор приводит данные собственных исследований, показавших, что терапия лептином при тяжелых семейных формах ожирения, при которых выявляются дефекты гена, кодирующего лептин, терапия данным нейропептидом приводит к драматическому снижению веса, появлению контроля за приемом пищи и увеличению продолжительности жизни.
Переходя к следующей части доклада, проф. Лицинио указал, что сложность анализа депрессивных расстройств с позиций взаимодействия генетических и средовых факторов заключается в разнообразии их фенотипических проявлений, которые могут различаться по течению, его этапу, периодичности, синдромальной картине, тяжести, причинам и времени возникновения в течении жизни. И это поднимает вопрос о нозологическом единстве депрессивных нарушений. Является ли депрессивный фенотип проявлением эквифи-нальности разных патогенетических процессов, какие причины лежат в основе болезни и сколько их, могут ли они быть связаны со специфическим генетическим фактором или с влиянием на генетическую уязвимость других факторов, не являющихся причинными, насколько состояние обусловлено несколькими большими генетическими факторами, а на сколько – множеством генетических факторов с небольшим эффектом, и какова роль внешней среды, особенностей развития и эпигенетических факторов?
Депрессивные расстройства являются следствием сложной констелляции генетических и средовых факторов (пренатальных стрессов, стрессов, связанных с потерями близких, горем, лишениями, естественными катастрофами, войной, а также с социальным окружением и поддержкой, питанием, заболеваниями и применяемыми препаратами). При этом давно известно, что депрессивные расстройства носят полигенный характер и не выделено какого-либо одного генетического фактора, который бы по значимости для патогенеза намного превосходил другие.
В этих условиях Джулио Лицинио предлагает для оптимальной оценки взаимоотношений между генетическими и средовыми факторами проводить систематическую оценку социальных и средовых влияний (особенно в перинатальном периоде) и изучать состояние биологических систем-кандидатов на хорошо охарактеризованных группах больных, а поиск новых механизмов, с его точки зрения, должен осуществляться без оглядки на предварительно сформулированные концепции, которые могут внести искажение при интерпретации новых данных. Докладчик указывает, что одним из наиболее жестко детерминированных фенотипов при рассмотрении депрессий является терапевтический ответ на антидепрессивную терапию, в связи с чем он наилучшим образом подходит для оценки взаимоотношений между генетикой и внешней средой. И уже с учетом разделения депрессивных фенотипов по наличию или отсутствию антидепрессивного ответа должна осуществляться оценка генотипа, рассмотрение вовлеченных систем-кандидатов (как специфических, так и выявляемых на всех этапах патогенетических путей с использованием биоинформаци-онного подхода по поиску однонуклеотидных полиморфизмов), поиск новых мишеней (на основе данных по экспрессии генов с последующим генным или полногеномным секвенированием, генотипированием экзома – совокупности несущих информацию участков генов), оценки применимости этих данных в практической сфере.
Учитывая, что в патогенезе как депрессивных расстройств, так и ожирения существенная роль принадлежит стрессовой системе1, как системе, опосредующей взаимосвязь между средовыми и генетическими факторами, и, основываясь на позитивном опыте выявления связи между терапевтическим ответом и вариантами генов, кодирующих рецепторы к кортиколиберину (CRHR1), при бронхиальной астме, Лицинио предположил, что такого рода взаимосвязи могут быть выявлены и при депрессивных расстройствах. В исследование по тестированию данной гипотезы вошли 80 пациентов с депрессивными расстройствами (американские мексиканцы). У больных генотипи-рованы гаплотипы CRHR1 и выявлены их частоты и варианты. Гаплотип-1 (GAG-гаплотип для вариантов rs1876828, rs242939 и rs242941) встречался у большинства больных (63 %), но у некоторых он находился в гомозиготном, а у некоторых в гетерозиготном состоянии. Оказалось, что у больных с высокими степенями тревоги на фоне депрессии, у которых гаплотип-1 находился в гомозиготном состоянии, терапевтический ответ на флуоксетин и дезипрамин (а для этих препаратов получены данные об их влиянии на кортиколиберин) был достоверно более выраженным. Данный пример является показательным, и с использованием данного подхода (с поэтапным смещением акцента исследований от патогенеза через однонуклеотидный полиморфизм к гаплотипам и геному) группой Лицинио выявлено 1 500 однонуклеотидных полиморфизмов в генах, имеющих значение для терапевтического ответа на антидепрессанты.
Принимая во внимание, что стрессовый ответ в целом и кортиколиберин в частности связан с иммунным ответом, состояние иммунной системы, цитокинов и нейрокинов является другой потенциальной мишенью для изучения взаимодействия генетических и средовых факторов при депрессиях. Автор отметил значительные сходства между течением аутоиммунных заболеваний и депрессий в контексте вариантов течения – хронического, периодического с усилением и послаблением симптоматики, эпизодического. Применение цитокинов в качестве терапевтических средств приводит к возникновению депрессивных расстройств. Все это указывает на возможность участия дисфункции медиаторов иммунитета при депрессии (при этом эта дисфункция может быть первичной, генетически детерминированной либо вторичной, вследствие инфекционных заболеваний или стрессовых воздействий).
Рассматривая цитокиновую теорию депрессии с позиций молекулярной биологии, экспериментальных моделей, клинических, генетических и фармакогенетических исследований, Лицинио сформулировал рабочую гипотезу о том, что ней-рокины являются синтезируемыми в головном мозге цитокинами, но их регуляция в головном мозге отличается от регуляции на периферии; нейрокины участвуют в биологии настроения, когнитивных функций и поведения; регулирование нейрокинов в головном мозге не обязательно требует присутствия инфекционных агентов или аутоиммунного процесса. В поддержку высказанной гипотезы Лицинио привел данные, полученные на той же группе американских мексиканцев. В этом исследовании продемонстрирована взаимосвязь между большим депрессивным расстройством и полиморфизмом генов PSMB4 (β4-субъединица протеосомы, играющая роль в презентации антигена) и TBX21 (кодирует одноименный белок, играющий роль в пролиферации Т-лимфоцитов). На долю их полиморфизмов rs2296840 и rs17244587 приходится 47,8 % риска, а их объединенный эффект (взаимодействие ген-ген) на 26 % выше, чем можно ожидать от простого суммирования рисков. У лиц с аллелями 1, 2 и 3 этих вариантов генов риск депрессивных расстройств возрастает в 2,3, 3,2 и 9,8 раза, что свидетельствует о значительном эффекте дозы генов.
Представляет интерес, что экспрессия гена цитокина CXCL10/IP-10 при депрессии повышена, а при реализации антидепрессивного эффекта снижается. Выявлена ассоциация других факторов, указывающих на роль Т-клеточного иммунитета (CD3E, PRKCH, PSMD9, STAT3) и функций гипоталамо-гипофизарно-надпочечниковой системы (UCN3) при реализации антидепрессивного ответа. Эти результаты согласуются с данными о преобладании при депрессии Т-хелперной активности 1-го (провоспалительного) типа над активностью 2-го (противовоспалительного) типа. Подтверждена роль интерлейкина-6 в механизмах депрессий. Эти данные подтверждены в другом исследовании – при угнетении Т-ростка иммунитета животные демонстрировали повышенную устойчивость в тестах на формирование депрессивного поведения.
Следуя намеченной последовательности изучения, Лицинио приводит результаты секвенирования генов на всех этапах реализации эффектов антидепрессантов (начиная от печеночного метаболизма, способности проникать через гематоэнцефалический барьер, взаимодействовать с первичными рецепторами, влиять на внутриклеточные мишени с отслеживанием дальнейшего каскада изменений) флуоксетина и дезипрамина для выявления ассоциированных с депрессией однонуклеотидных полиморфизмов. Только в отношении мозгового ней-ротрофного фактора (BDNF) выявлено 47 ранее идентифицированных и 83 новых однонуклеотидных полиморфизмов. В отношении других звеньев в цепи реализации механизмов терапевтического ответа (транспортеры серотонина, норадреналина, дофамина, ген CREB1, ген рецепторов к CRH и BDNF) выявлено 419 однонуклеотидных полиморфизмов, ассоциирующихся с ответом на антидепрессанты. Таким образом, существует множество свидетельств того, что терапевтический ответ на антиде-прессивную терапию во многом детерминирован генетически.
Под конец данного фрагмента своего сообщения докладчик анонсировал, что с появлением новых технологических решений становятся возможны исследования экзома, которые в настоящее время проводятся его научной группой. Кроме того, он очертил будущие направления исследований и сформулировал новый подход: поиск новых генов-кандидатов, бинарная оценка их значимости для определенной патологии с последующей их группировкой при помощи древовидного анализа в соответствии с местом, занимаемым в патогенезе, и выяснением суммарного вклада того или иного пути в предрасположенность к болезни. Таким образом, в данном разделе доклада продемонстрировано успешное использование нового подхода на примере выявления факторов, в том числе опосредующих взаимодействие генетических и средовых влияний через систему стресса и связанных с ней функций иммунитета, ассоциирующихся с риском депрессивных расстройств и фармакологическим ответом на антидепрессанты.
Переходя к завершающей стадии сообщения, Дж. Лицинио вернулся к роли стрессовой системы в генезе как депрессивных расстройств, так и ожирения с позиций теории о персистирующей патологической сигнализации. Суть этого явления заключается в том, что в ходе эволюции человека система ответа на стресс приспосабливалась к взаимодействию с краткосрочными периодическими стрессорами, в ситуации когда немедленное реагирование повышало вероятность сохранить жизнь. В условиях же современного мира, по мнению докладчика, стрессовые воздействия изменили характер, стали персистирующими, а «роль хищника принадлежит начальнику на работе, от которого не убежать». С этих позиций хронические стрессы настоящего времени могут запускать нейроэндокринные механизмы, ассоциирующиеся с эндокринным и цитокиновым ответом, провоспалительной реакцией и внутриклеточным стрессом, постоянные влияния которых и составляют суть персистирующей патологической сигнализации, выливающейся в формирование депрессивных расстройств, ожирения, диабета, гипертонии, сердечнососудистых и онкологических заболеваний.
Таким образом, если сделать вывод из всего сказанного проф. Лицинио, то необходимо отметить, что на сегодняшний день существуют значительные пробелы между результатами нейрона-учных исследований и клинической практикой, однако появление новых технологических решений и предлагаемые автором методология и новые подходы к изучению данного вопроса могут позволить их решить. В этом направлении уже сделаны существенные шаги. На примере взаимоотношений двух тесно связанных друг с другом заболеваний – депрессии и ожирения – получены новые данные об их генетической природе, участии генов, имеющих «большое» и «малое» значение», открыты многочисленные новые однонуклеотидные полиморфизмы, имеющие функциональное значение. На примере парадигмы «стресс-диета-ожирение» продемонстрировано взаимодействие патологического процесса, внешних средовых факторов и фактора применения антидепрессантов, которые в сочетании запускают внутренние механизмы, приводящие к повышению веса, показана опасность бесконтрольного применения антидепрессантов. Выявлены дополнительные доказательства генетической детерминированности антидепрессивного ответа и роли состояния иммунной системы в генезе и терапии депрессивных нарушений. С учетом новых разработок вновь осуществляется активное изучение роли стрессовой системы и, как ее части, системы иммунитета в формировании комплексных расстройств, при которых велико значение и генетических, и средовых факторов.
Переходя от общих вопросов к частным, логическим продолжением доклада Дж. Лицинио явилась исследовательская сессия «Краткосрочные и долгосрочные эффекты иммунного стресса в пренатальном и перинатальном периоде: от основ к клинике», проводившаяся под председа- тельством Ай Му Минт (AyeMuMyint) из Университетской клиники Мюнхена (Германия) ввиду отсутствия проф. Маркуса Шварца (Marcus Schwarz). Как следует из названия сессии, здесь изучались нейроиммунологические гипотезы разных психических расстройств: депрессий и шизофрении, в том числе послеродовых депрессий и психозов. В этой связи следует еще раз указать на тесные взаимоотношения между иммунной системой и нейроэндокринной системой ответа на стресс, определяющими реактивность организма к внешним факторам, а также вспомнить, что некоторые авторы рассматривают иммунную систему в качестве шестого «некогнитивного» органа чувств, а в соответствии с цитокиновой гипотезой Брайана Леонарда активация иммунитета играет важную роль в патогенезе депрессивных расстройств.
Среди представленных на сессии 4 докладов наибольший интерес представляли 2 экспериментальных исследования, данные гипотезы в них рассматривались с позиций роли нарушений нормального развития головного мозга в генезе депрессивных нарушений и шизофрении и с точки зрения взаимодействия «гены-среда». Предпосылками к проведению этих работ послужили данные литературы, что инфекционные заболевания, возникающие у матери в ходе беременности, могут влиять на ход развития головного мозга у потомства, ввиду облегченного проникновения медиаторов воспаления через несформирован-ный гематоэнцефалический барьер, последующей активации микроглии, в том числе перекисного окисления, это приводит к истощению запасов ионов железа и цинка, составляющих активные центры многих ферментов, участвующих в окислительно-восстановительных процессах, что приводит к изменению траектории развития ЦНС, формируя дополнительную уязвимость (наряду с генетической) к психическим заболеваниям.
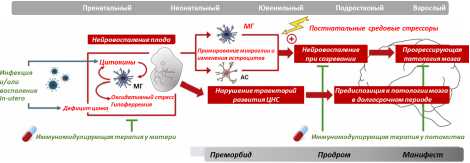
Рис. 1. Современная модель обусловленного нейровоспалительным процессом нарушения развития головного мозга, вовлеченного в патогенез шизофрении
Наряду с этим пренатальное воспаление запускает патологическую сенсибилизацию микроглии и астроцитов, что по времени совпадает с возникновением первых нарушений (мягких неврологических знаков и психомоторного дефицита). Сенсибилизированные клетки глии либо сами по себе, либо после дополнительной активации средовыми стрессорами в постнатальном периоде запускают воспалительные процессы в развивающемся головном мозге, вызывая нарастание патологических изменений, способствуя, таким образом, манифестации заболевания (рис. 1).
Для оценки влияния пренатального иммунного стресса на предрасположенность психическим заболеваниям (шизофрении) предложена экспериментальная модель с использованием иммунологической провокации. Ее суть в том, что самкам мышей на разных сроках беременности вводились антигены, провоцировавшие иммунный ответ при отсутствии инфекционного возбудителя. Затем у потомства при использовании валидных методик регистрировались поведенческие нарушения. На основании литературных данных иммунная провокация вирусным антигеном, полирибоинозиловой полирибоцитозиновой кислотой (PolyL:C – синтетический аналог двуцепочечной ДНК), в отличие от липополисахарида2 (бактериального антигена) и интерлейкина-6 (провоспалительного цитокина, хронически повышенные уровни которого вызывают нейродегенерацию) приводила к возникновению у потомства широкого круга поведенческих расстройств и изменений, характерных для шизофрении. У них отмечалось снижение преим-пульсного и латентного торможения,3 социального поведения, исследовательской активности, рабочей памяти, повышение чувствительности к агонистам дофаминовых и NMDA рецепторов. Валидность данного моделирования шизофрении, с точки зрения патологии развития, подтверждает также время возникновения поведенческих расстройств у мышей, соответствующее раннему зрелому возрасту (то есть возрасту, характерному для манифестации шизофрении), и то, что они купировались применением антипсихотиков. В экспериментальных исследованиях было показано, что при такого рода моделировании роль играет время проведения провокации: в частности угнетение преимпульсного торможения у потомства наблюдалось при введении PolyL:C на 9-й день беременности, но не на 17-й день.
Такое полноценное моделирование особенностей шизофрении, на первый взгляд, идет вразрез с расчетами об относительно малом вкладе вирусных инфекций в этиологию шизофрении. Однако в работе Clarke et al. (2009) приводятся сведения о том, что влияние пренатальных инфекций у лиц с наследственным отягощением психотическими расстройствами в 4 раза больше в сравнении с лицами без отягощения, что указывает на взаимодействие инфекционных заболеваний с генетической предрасположенностью. Данное положение подтверждено в некоторых работах: у мышей с мутантной аллелью гена mhDISC1 (mutant human disrupted in schizophrenia-1) пренаталь- ная иммунная стимуляция приводила к повышенной тревожности, «депрессивному» поведению, нарушениям «социального поведения», снижению стресс-реактивности, а также ассоциировалась с рядом структурных изменений головного мозга. Синергичное усиление дофаминергических нарушений наблюдалось и при комбинировании модели с гетерозиготной делецией гена Nurr1 (генетический фактор) с моделью PolyL:C-провокации (средовой фактор).
В своей работе Сандра Джованьоли (Sandra S. Giovanoli, Цюрих, Швейцария) предлагает использовать модель «двойного удара» средовых факторов: после проведения иммунной вирусной провокации PolyL:C на 9-й день беременности («первый удар») на 30—40-й дни жизни потомство (опытная группа) подвергали ряду субхронических стрессовых воздействий («второй удар»: удары электрическим током по лапам, ограничение активности, плавательный стресс, животным не давали пить, повторно меняли клетки). Через 1 месяц после завершения «второго удара» у животных отслеживались отдаленные эффекты.
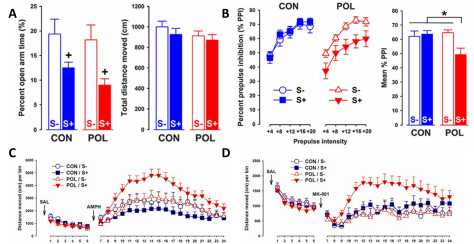
Рис. 2. Долгосрочные эффекты пренатального иммунного стресса и стрессовых воздействий в пубертатном возрасте и их взаимодействие у мышей
Животные опытной группы, подвергавшиеся стрессу (на рисунках – POL и S+), демонстрировали повышенную тревожность (рис. 2А), угнетение препульсового торможения (рис. 2В), а также повышенную чувствительность к агонистам дофаминовых рецепторов и антагонистам глутама-тергических NMDA-рецепторов (рис. 2С и 2D) в сравнении с потомством животных, у которых не проводилось иммунологической провокации (контрольная группа, на рисунках – CON, S+ и S-), и с животными опытной группы, не подвергавшимися стрессовым воздействиям в пубертатном возрасте (POL и S-). При изучении нейрохимических изменений выявлялось увеличение содержания дофамина в прилежащем ядре (обусловленное иммунной провокацией) и гиппокампе (как результат взаимодействия двух средовых влияний).
Ай Мю Минт представила результаты своего исследования, в котором она, используя модель пренатальной иммунной провокации на более поздних сроках гестации (17-й день) с липополисахаридным (бактериальным) антигеном, смоделировала нарушения нормального развития головного мозга при депрессивных расстройствах.
На 13-й неделе жизни у мышей из экспериментальной группы выявлялось «депрессивное» поведение при проведения теста с принудительным плаванием, выражающееся в достоверном увеличении частоты и продолжительности периодов прекращения двигательной активности и зависаний в воде. Наблюдалось усиление процессов эпигенетических изменений в тканях головного мозга, что выражалось в снижении активности гистон-деацитилазы, повышении активности ДНК-метилтрансферазы, изменении экспрессии генов, определяющих соотношение нейротоксических (гены Cideb, Txnip, Drd2, Nostrin, Tacr1) и нейро-протективных (Nrg1, Ngrf, Il1r1) процессов в сторону увеличения первых и снижения вторых, что может свидетельствовать об участии данного механизма в формировании депрессивных расстройств.
Таким образом, в этих двух сообщениях представлен обзор научных работ, демонстрирующих роль пренатального воспаления в формировании уязвимости к таким заболеваниям, как шизофрения и депрессивное расстройство, для которых в последние годы показана связь с состоянием иммунной системы и с нарушением нормального процесса развития головного мозга. Эти данные легли в основу создания экспериментальной модели пренатальной иммунной провокации, обладающей превосходной конструктивной валидностью в отношении шизофрении, в некоторой степени депрессивного расстройства, которая позволяет объяснить не только особенности клинической картины и течения заболеваний, но и особенности их формирования в условиях сложного взаимодействия генетической предрасположенности и внешних воздействий (иммунологических и стрессовых). Более того, работы, выполняемые в этом направлении, открывают широкие перспективы для дальнейшего изучения природы психических расстройств и создания принципиально новых подходов к их терапии и профилактике.
Конечно же, не могли обойти стороной проблему взаимодействия генетических и средовых факторов на сателлитном симпозиуме компании Pfizer «Генерализованное тревожное расстройство: почему люди беспокоятся?», проводимом под председательством профессора Кристера Аллгуландера (Christer Allgulander) из института Каролинска в Швеции. Доклад «Патологическая генетика тревоги» представила молодая профессор Катарина Домшке (Katharina Domshke) из Университетской психосоматической и психотерапевтической клиники Вюрцберга (Германия).
Свой доклад Катрина Домшке начала с того, что, как и при многих других психических заболеваниях, в этиологии тревожных расстройств значимы и биологические, и средовые факторы. Среди биологических ключевое место занимают генетические. На это указывают результаты семейногенетических исследований, выявивших 1,5—3-кратное увеличение риска тревожных расстройств у родственников первой степени родства больных, что приводит к накоплению в подверженных семь- ях случаев тревожных расстройств, указывая на их генетическую обусловленность. Эти результаты не снимают всех вопросов о наследственной основе, поскольку в семьях «наследуется» и генетический материал, и «атмосфера». Близнецовые исследования, позволяющие исключить данные влияния, свидетельствуют, что в случае генерализованного тревожного расстройства конкор-дантность составляет 20—40 %, при паническом расстройстве – 48 %, в отношении одновременного возникновения обоих заболеваний – 23 %. У ГТР есть общая генетическая основа с большим депрессивным расстройством. О чем же могут говорить эти цифры? С одной стороны, они подводят черту под доказательствами наследуемости тревожных расстройств, с другой – свидетельствуют, что в 50—80 % случаев роль в возникновении тревожных расстройств играют внешние, негенетические факторы, а также указывают на значимость взаимоотношений «ген-среда».
Однако семейно-генетические и близнецовые исследования не решают вопросов о том, какие гены играют ключевую роль в предрасположении. К ним адресованы молекулярно-генетические исследования, анализ сцепленных генов и изучение генетических ассоциаций. В этих исследованиях выявлены общие для спектра тревожных расстройств (паническое расстройство, генерализованное тревожное расстройство и тревожная депрессия) гены риска, прежде всего гены серотонинового 5-HT1A рецептора, транспортера серотонина и моноаминоксидазы типа А (МАО-А), вовлеченной в метаболизм серотонина и норадреналина, подтверждая, таким образом, на генном уровне нейрохимические гипотезы о вовлечении серотонинергической и норадренергической систем нейропередачи в генез тревожных расстройств. За последнее десятилетие открыт ряд новых генов-кандидатов, вовлеченных в контроль тревоги: ген рецептора к нейропептиду S (NPS), нейропептид Y(NPY), ген небольшого пептида RGS2, участвующего в качестве сигнальной молекулы в каскадах основных нейротрансмиттерных систем. 4В докладе приведено незначительное число из рассматриваемых в настоящее время генов-кандидатов. В 2011 г. в журнале Translational Psychiatry вышла экспериментальная работа, показавшая, что с тревожными состояниями ассоциировано порядка нескольких сотен генов.
Переходя к анализу взаимоотношений генетических и средовых факторов, проф. Домшке ссылается на исследование о влиянии полиморфизма гена NPY(NPY 399C/T) на возникновение тревожных расстройств среди жертв урагана. Носители гомозиготной аллели NPY 399C/С имели наибольшую подверженность по сравнению с носителями С/Т и T/T аллелей, причем в сравнении с гомозиготами по T варианту гена риск тревожных расстройств возрастал в 8 раз.
4 Эти нейропептиды и короткие пептиды модифицируют работу основных вовлеченных в патогенез тревоги систем передачи.
Этиологическую мозаику тревожных расстройств осложняют эпигенетические влияния: процессы метилирования ДНК и ацетилирования гистонов. Суть их в следующем: ацетилирование гистонов вызывает активацию процессов транскрипции на определенном участке ДНК, который может содержать патологический ген, а при соединении метильной группы с промотором гена, наоборот, происходит «выключение» гена. Особенностью подобных эпигенетических процессов является их нестабильность и динамичность. Таким образом, даже наличие генетического предрасположения может не проявляться в случае, например, если экспрессия патологических генов не осуществляется ввиду их инактивации. Однако процессы метилирования и деметилирования обратимы, что привело к гипотезе об индукции эпигенетических процессов стрессорами, которая получила подтверждение. Так, у больных паническим расстройством отмечается недостаточное метилирование гена МАО-А. Показано, что негативно окрашенные события в течение года, предшествовавшего возникновению заболевания, усиливали процессы деметилирования гена МАО-А, тогда как позитивные события вызывали его метилирование (инактивацию) (рис. 3).
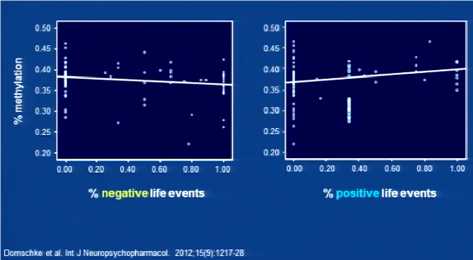
Рис. 3. Влияние позитивного и негативного опыта на процессы метилирования гена МАО-А
Другим аспектом патогенетики тревожных расстройств, затронутым в данном сообщении, явилось то, что гены оказывают свое влияние не только в рамках одной клетки, но и на уровне нейрональных систем. Раскрыть данную сторону проблемы позволяют нейровизуализационные исследования. Ключевыми структурами в системе тревоги-страха являются миндалевидные тела. У больных ГТР выявляется их повышенная активация в ответ на предоставление негативно или нейтрально окрашенных стимулов, а применение анксиолитиков (бензодиазепинов, СИОЗС и пре-габалина) снижало активность этих структур. Другой важной анатомической структурой, имеющей значение при тревожных расстройствах, является дорсолатеральная префронтальная кора (DLPFC), представляющая собой зону, отвечающую за когнитивный контроль – ингибирующие влияния на гиперактивные лимбические области. Ее активность при тревожных расстройствах (ГТР и паническом расстройстве) снижена, что указывает на нарушение кортикально-лимбических связей, лежащее в основе нарушений регулирования эмоций. Важно, что в исследованиях у больных тревожными расстройствами показаны эффекты генетического предрасположения на активность этих структур. Так, у носителей короткой аллели полиморфизма гена транспортера серотонина (5HTTLPRs/l) и патологического C-полиморфизма гена NPY выявляется повышенная активность миндалевидных тел. Пониженная же активации DLPFC ассоциируется с G-полиморфизмом гена 5-HT1A рецептора и с TT-полиморфизмом гена рецептора к нейропептиду S.
Наконец, профессор Домшке продемонстрировала, что генетические факторы опосредуют и анксиолитическую эффективность противотре-вожных препаратов. Больные ГТР, гомозиготные по А-варианту гена 5-HT2A рецепторов, демонстрировали менее выраженный ответ на терапию венлафаксином. Аналогичные результаты продемонстрированы в отношении S/sаллели гена транспортера серотонина при изучении терапии эсциталопрамом больных ГТР и в исследованиях эффективности пароксетина при паническом расстройстве и тревожных депрессиях. Таким образом, докладчик очертила основные достижения в понимании взаимоотношений между генетическими и средовыми факторами в этиопатогенезе тревожных расстройств, которые необходимо учитывать при терапии анксиолитиками.
В заключение вернемся к основному назначению трансляционной психиатрии – переносу научных данных в практическую плоскость. Какова же область применения этих представленных на XXI Конгрессе EPA данных? Эта информация может быть полезна при проведении психообразования пациентов, она может позволить снизить ассоциирующуюся с заболеванием самостигматиза-цию, дать надежду и настроить больных на соблюдение терапевтических предписаний. Обнаружение новых звеньев этиопатогенеза от генетических до средовых факторов может помочь в определении новых мишеней для терапевтического воздействия и являться точкой приложения усилий, направленных на поиск перспективных лекарственных средств. В-третьих, углубленное понимание нюансов заболевания может позволить более точно осуществлять выбор терапевтических подходов – лечить больного, а не болезнь, а в глобальном плане – навести мосты между экспериментальной и клинической психиатрией, устранить противоречия между персонифицированной и доказательной медициной, расширив их возможности.


