Взаимосвязь нарушений углеводного обмена и маркеров дисфункции эндотелия у животных с абсолютной недостаточностью инсулина при биостимуляции аутотрансплантацией кожного лоскута
Автор: Попыхова Э.Б., Иванов А.Н., Степанова Т.В., Пронина Е.А., Лагутина Д.Д.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Патологическая физиология
Статья в выпуске: 2 т.15, 2019 года.
Бесплатный доступ
Цель: выявить взаимосвязь нарушений углеводного обмена и маркеров дисфункции эндотелия у животных с абсолютной недостаточностью инсулина при биостимуляции аутотрансплантацией кожного лоскута. Материал и методы. Исследование проведено на 60 самцах белых беспородных крыс, которые были разделены на контрольную, сравнительную и опытную группы. У животных группы сравнения вызывали аллоксановый сахарный диабет (СД). У крыс из опытной группы проводили аутотрансплантацию полнослойного кожного лоскута (АТПКЛ) на фоне развившегося аллоксанового диабета. Определяли уровень гликированного гемоглобина (HbA1c), глюкозы, С-реактивного белка (СРБ) и васкулоэндотелиального фактора роста (VEGF). Так, СД вызывает повышение уровня HbA1c на 69 % и СРБ на 11 %, в то время как АТПКЛ приводит к снижению концентрации HbA1c на 28 % и СРБ на 7 %. Результаты. АТПКЛ вызывает нормализацию гликемического профиля у животных экспериментальной группы, а также снижает субклиническое воспаление, вызванное гипергликемией, и стабилизирует экспрессию VEGF. Заключение. АТПКЛ снижает риск развития микроциркуляторных нарушений, обусловленных гипергликемией и хроническим субклиническим воспалением.
Аллоксановый диабет, аутотрансплантация полнослойного кожного лоскута, биостимуляция, эндотелиальная дисфункция
Короткий адрес: https://sciup.org/149135309
IDR: 149135309 | УДК: 616.43:616.08:616.003.93
Текст научной статьи Взаимосвязь нарушений углеводного обмена и маркеров дисфункции эндотелия у животных с абсолютной недостаточностью инсулина при биостимуляции аутотрансплантацией кожного лоскута
-
1 В ведение. Распространенность среди взрослого населения такого заболевания, как СД, — актуальная медико-социальная проблема. Основной причиной ранней инвалидизации и смертности при СД являются сосудистые нарушения (микро- и макроангиопатии). Перед эндокринологами и специалистами других профилей стоит задача изучения механизма развития данных нарушений при СД и разработки новых методов их коррекции [1, 2]. В последние годы в патогенезе СД и его сосудистых осложнений обсуждается роль нарушения ангиогенеза. В физиологических условиях процесс ангиогенеза контролируется балансом про-и антиангиогенных факторов [1]. Ключевым стимулятором ангиогенеза является VEGF [1, 3].
Хроническая гипергликемия, окислительный стресс, гипоксия, конечные продукты гликолиза, воспаление при СД приводят к нарушению процесса ангиогенеза за счет усиления синтеза VEGF, основного проангиогенного фактора, что способствует прогрессии микрососудистых осложнений, вызывая нестабильность новообразованных сосудов [1, 2, 4]. В связи с этим очевидна актуальность совершенствования методов коррекции метаболических нарушений, лежащих в основе развития одного из осложнений СД — ангиопатии.
Цель: изучить взаимосвязь нарушений углеводного обмена и маркеров дисфункции эндотелия у жи-
вотных с абсолютной недостаточностью инсулина при биостимуляции аутотрансплантацией кожного лоскута.
Материал и методы . Опыты проведены на 60 самцах белых беспородных крыс массой 200–250 г, разделенных на следующие группы: контрольную, в которую вошли 20 крыс; две группы сравнения по 10 животных с аллоксановым СД; опытную группу, состоящую из 20 животных с аллоксановым СД, которым проведена АТПКЛ. Животных содержали в стандартных условиях вивария при естественном освещении, свободном доступе к воде и пище. Все экспериментальные процедуры проводились в соответствии с принципами Хельсинкской декларации о гуманном отношении к животным.
СД у крыс вызывали подкожным введением 5%-го раствора аллоксана в 9%-м растворе NaCl из расчета 100 мг на 1 кг веса животного [5].
Животным, которым проводили АТПКЛ для достижения наркоза за 10 минут до проведения манипуляции внутримышечно вводили телазол (Zoetis Inc, Испания) из расчета 0,1 мл/кг и ксиланит (ООО «Нита-Фарм», Россия) в дозе 1 мг/кг веса животного. АТПКЛ осуществлялась в межлопаточную область. Полнослойный кожный лоскут размером 0,1% от площади поверхности тела животного иссекали на депилированном участке кожи в асептических условиях. Для удаления разрушенных клеток и дезинфекции кожный лоскут обрабатывали в 3%-м растворе перекиси водорода, 70%-м этиловом спирте и физиологическом растворе. Обработанный таким образом
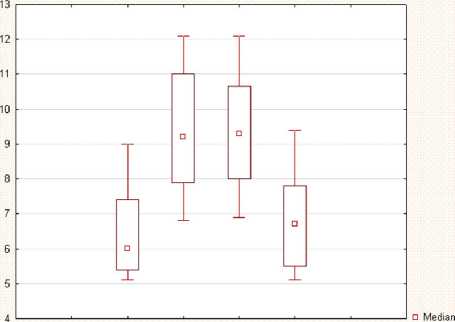
Контроль СД (42 сут.) □ 25%-75%
СД (21 сут.) СД+АТПКЛ I 1%-99%
Рис. 1. Изменение уровня гликированного гемоглобина при немедикаментозной коррекции сахарного диабета
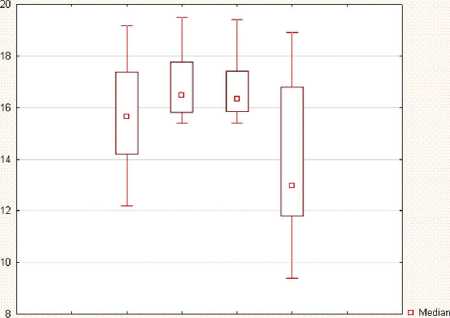
контроль СД42сут, П25%-75%
СД21 сут. СД+АТПКЛ I 1%-99%
Рис. 2. Изменение уровня глюкозы при немедикаментозной коррекции сахарного диабета
лоскут помещали в карман, сформированный в ране между кожей и собственной фасцией. Для фиксации лоскута в сформированном канале рану ушивали послойно наглухо [6].
Для диагностики СД в цельной крови определяли HbA1c с использованием реактивов фирмы DiaSys (Германия) на анализаторе Sapphire 400 (Hirose Electronic System, Япония). Проявление субклинического хронического воспаления оценивали по содержанию в сыворотке крови СРБ, который определяли методом турбо-диметрии с использованием наборов реактивов фирмы DiaSys Diagnostic Systems GmbH (Германия), на анализаторе Sapphire-400 (Япония). Ангиогенез оценивали по содержанию в сыворотке крови VEGF, определяемого методом твердофазного ИФА с использованием наборов «VEGF Rat» фирмы RnD Systems (США), измерение оптической плотности проводили на автоматическом микропланшетном спектрофотометре EpochBioTek Instruments, (Bio-Tek Instruments, Inc., США).
Статистическую обработку экспериментальных данных проводили с помощью программы Statistica 10 (StatSoft, США). Данные представлены в формате медианы и квартильного диапазона. Для сравнения полученных показателей использовали непараметрический U-критерий Манна-Уитни. Различия считались достоверными при p<0,05.
Результаты. Развитие аллоксанового диабета у крыс сопровождалось активацией начальных реакций неферментативного гликозилирования. Через 21 сутки после введения аллоксана у животных первой сравнительной группы верифицировали СД путем определения в цельной крови HbA1c (рис. 1).
На 42-е сутки у животных сохранялся аллоксановый диабет, о чем свидетельствовало повышенное, по сравнению с контрольной группой, содержание HbA1c. Значимых различий между уровнем HbA1c у крыс первой и второй сравнительных групп не выявлено, что свидетельствовало о стойком нарушении углеводного обмена. У животных опытной группы под влиянием АТПКЛ к 42-м суткам происходило снижение уровня HbA1c, его концентрация приближалась к значениям, наблюдаемым в контрольной группе, и имела статистически значимые различия со значениями в группе сравнения. Еще одним признаком СД является уровень глюкозы в крови (базальная гликемия). Так, уровень содержания глюкозы в сыворотке крови животных с СД повышался на 21-е сутки эксперимента и оставался высоким до 42-х суток, однако различия и в первом, и во втором случае с контрольной группой были статистически не значимы. После АТПКЛ к 42-м суткам уровень глюкозы имел тенденцию к снижению до нормальных значений, но не имел статистически значимых различий ни с контрольной группой, ни с группой сравнения (рис. 2).
При оценке изменений концентрации СРБ в сыворотке крови животных группы сравнения выявлено повышение его уровня на 42-е сутки относительно контрольной группы. АТПКЛ вызывала снижение уровня СРБ к 42-м суткам эксперимента, однако его концентрация оставалась высокой по сравнению с группой контроля (таблица).
Установлено, что при аллоксановом СД уровень VEGF в сыворотке крови значимо увеличивался на 42-е сутки. У животных опытной группы также наблюдалось
Изменение показателей воспаления и ангиогенеза при немедикаментозной коррекции экспериментального сахарного диабета
|
Показатель |
Группа |
||
|
Контроль |
Группа сравнения (аллоксановый СД) |
Опытная группа (СД + АТПКЛ) |
|
|
VEGF |
9,4 (7,3; 15,7) |
85,2 (79,6; 97,5) p1<0,001 |
83,3 (78,9; 86,3) p =0,001 p12=0,286 |
|
СРБ |
18,6 (18,5; 19,3) |
20,6 (19,9; 22,0) p <0,001 |
19,3 (19,3; 20,4) p =0,025 p1=0,043 |
Примечание: р1 — значимость различий по сравнению с контролем; р2— значимость различий по сравнению с группой сравнения повышение концентрации VEFG и отсутствие значимых различий с группой сравнения (см. таблицу).
Обсуждение. Аллоксан по химической природе является нестабильным пиримидином (2,4,5,6-тетра-оксогексагидропиримидин) и обладает выраженным диабетогенным действием. При введении в организм он связывается с мембранными рецепторами β-клеток поджелудочной железы и вызывает снижение секреции инсулина. В механизме возникновения и развития аллоксанового диабета отсутствует аутоиммунная составляющая, тем не менее токсическое действие аллоксана индуцирует процессы, происходящие при аутоиммунном повреждении β-клеток поджелудочной железы в условиях СД 1-го типа, а именно: свободнорадикальное повреждение, гликозилирование белков, возникновение апоптоза. Через несколько минут после введения в организм наблюдается токсический эффект аллоксана, а инсулиновая недостаточность начинает проявляться через несколько суток [5].
Известно, что измерение глюкозы в крови позволяет оценить ее уровень в конкретный момент, который зависит от многих факторов, в том числе от приема пищи и ее состава, физической активности и др. [5]. В связи с этим становится понятной высокая вариабельность концентрации глюкозы в организме, поэтому определение ее текущего уровня в крови не отражает степень выраженности и компенсации СД. Ценность определения HbA1c состоит в том, что он характеризует среднее содержание глюкозы в крови на протяжении длительного промежутка времени, в связи с этим HbA1с используют в качестве показателя компенсации СД, поскольку существует четкая взаимосвязь между HbA1с и уровнем гликемии [5]. Кроме того, HbA1с рассматривается как достоверный предиктор микро- и макрососудистых осложнений диабета [4, 5]. Следовательно, уменьшение содержания HbA1с при АТПКЛ свидетельствует о компенсации СД и снижении риска развития микро-циркуляторных нарушений.
Подтверждением того, что одним из патогенетических звеньев СД является воспаление, служит достоверное повышение в сыворотке крови животных с аллоксановым диабетом содержания белка острой фазы — СРБ по сравнению с показателем в группе контроля. Рядом авторов показано, что метаболические нарушения, обусловленные хронической гипергликемией, ишемией и субклиническим воспалением при СД, приводят к повышенной экспрессии VEGF [2, 7, 9, 10]. Увеличение продукции последнего способствует прогрессии микрососудистых осложнений за счет нестабильности вновь образованных сосудов. Под действием АТПКЛ уровень СРБ в сыворотке крови крыс достоверно снизился относительно аналогичного показателя в группе сравнения.
Значит, АТПКЛ у крыс с СД вызывает уменьшение содержания HbA1с, СРБ и стабилизацию экспрессии VEGF, следствием чего является снижение риска развития микроциркуляторных нарушений.
Заключение. Результаты проведенного исследования позволяют сделать следующее заключение: АТПКЛ оказывает положительный эффект на уровень гликемии при экспериментальном СД у крыс, а также приводит к снижению субклинического воспаления, вызванного хронической гипергликемией, и, как следствие, к снижению риска развития микро-циркуляторных нарушений.
Список литературы Взаимосвязь нарушений углеводного обмена и маркеров дисфункции эндотелия у животных с абсолютной недостаточностью инсулина при биостимуляции аутотрансплантацией кожного лоскута
- Искакова С. С., Жармаханова Г. М., Дворацка М. Место ангиогенеза в развитии сахарного диабета и его осложнений (обзор литературы). Вестник КазНМУ 2014; 2 (2): 303-7
- Chawla A, Chawla R, Jaggi S. Microvasular and macrovascular complications in diabetes mellitus: Distinct or continuum? Indian J Endocr Metab 2016; 20: 546-53
- Степанова Т. В., Иванов А. Н., Терешкина Н. Е. и др. Маркеры эндотелиальной дисфункции: патогенетическая роль и диагностическое значение (обзор литературы). Клиническая лабораторная диагностика 2019; 64 (1): 34-41
- Mahdy RA, Nada WM, Hadhoud KM, El-Tarhony SA. The role of vascular endothelial growth factor in the progression of diabetic vascular complications. Eye 2010; 24: 1576-84
- Бухтиярова И. П., Дроговоз С. М., Щёкина Е. Г. Исследование гипогликемических свойств ралейкина на модели аллоксанового диабета у крыс. Вестник КазНМУ 2014; (4): 301-4
- Иванов А. Н., Шутров И. Е., Норкин И. А. Аутотрансплантация полнослойного кожного лоскута как способ биостимуляции микроциркуляции в условиях нормальной и нарушенной иннервации. Регионарное кровообращение и микроциркуляция 2015; 14 (3): 59-65. URL: https://doi.org / 10.24884 / 1682-6655-2015-14-3-59-65 DOI: 10.24884/1682-6655-2015-14-3-59-65
- Zhang Q, Fang W, Ma L, et al. VEGF levels in plasma in relation to metabolic control, infammation, and microvascular complications in type-2 diabetes A cohort study. Medicine 2018; 97: 15 (e0415). URL: http://dx.doi.org / 10.1097 / MD. 0000000000010415 DOI: 10.1097/MD.0000000000010415
- Штода Ю. М., Слесаренко Н. А., Родионова Т. И. и др. Некоторые аспекты общности патогенеза сахарного диабета 2 типа и псориаза. Фундаментальные исследования 2014; 4 (3): 647-54
- Пучиньян Д. М., Гладкова Е. В., Карякина Е. В. и др. Факторы роста фибробластов и эндотелия сосудов при начальных стадиях артроза коленного сустава. Саратовский научно-медицинский журнал 2018; 14 (3): 583-6
- Kolluru GK, Bir SC, Kevil CG. Endothelial Dysfunction and Diabetes: Efects on Angiogenesis, Vascular Remodeling, and Wound Healing. Int J Vasc Med Vol 2012, Article ID 918267, 30 pages. 10.1155 / 2012 / 918267 DOI: 10.1155/2012/918267


