Взаимосвязь NKT-клеток и активированных CD25+ лимфоцитов периферической крови с продолжительностью безрецидивной и общей выживаемости больных трижды негативным раком молочной железы
Автор: Черткова Антонина Ивановна, Славина Елена Григорьевна, Заботина Татьяна Николаевна, Кадагидзе Заира Григорьевна, Шоуа Эсма Константиновна, Гордеева Ольга Олеговна, Колядина Ирина Владимировна, Жукова Людмила Григорьевна, Ганьшина Инна Петровна, Мещеряков Андрей Альбертович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 т.19, 2020 года.
Бесплатный доступ
Введение. Ранее мы обнаружили, что снижение количества NKT-клеток и активированных CD25+ лимфоцитов периферической крови до начала неоадъювантной химиотерапии ассоциировалось с повышением вероятности прогрессирования заболевания у больных трижды негативным раком молочной железы ii и iii стадии. Цель исследования - изучение взаимосвязи исходного количества NKT- и CD25+ лимфоцитов периферической крови с безрецидивной и общей выживаемостью больных трижды негативным раком молочной железы, получивших неоадъювантную химиотерапию цисплатином и паклитакселом и последующее оперативное лечение. Материал и методы. В исследование были включены больные трижды негативным раком молочной железы ii и iii стадии. Период наблюдения составил 36 и 66,9 мес. До начала лечения определяли процент CD3+CD16+CD56+ (NKT)- и CD25+-лимфоцитов периферической крови методом проточной цитометрии. Статистический анализ данных проводили с использованием пакета статистических программ «Статистика 7». Для определения взаимосвязи иммунологических показателей с безрецидивной и общей выживаемостью больных трижды негативным раком молочной железы использовался метод Каплана-Мейера. Результаты. Сниженный до начала лечения по сравнению с контролем процент NKT-клеток периферической крови ассоциировался с уменьшением трехлетней безрецидивной выживаемости больных [Me - 20,1 (0,533 и 39,7) мес] по сравнению с больными, у которых процент этих клеток был выше, чем в контроле (Me не достигнута). Статистически значимых различий в трехлетней общей выживаемости между данными группами пациенток не наблюдалось. Исходно сниженное по сравнению с контролем количество CD25+ лимфоцитов ассоциировалось как с уменьшением безрецидивной, так и общей выживаемости, по сравнению с больными, у которых количество этих клеток до лечения было выше нормы. Различие в продолжительности безрецидивной и общей выживаемости было еще более выражено при сравнении группы пациенток, у которых одновременно было повышено исходное количество и NKT- и CD25+ клеток, с больными, у которых оба показателя были ниже нормы. Заключение. Исходное (до начала химиотерапии) количество NKT-клеток и активированных CD25+ лимфоцитов периферической крови, вероятно, может являться предиктивным фактором у больных трижды негативным раком молочной железы, получавших неоадъювантную химиотерапию цисплатином и паклитакселом.
Трижды негативный рак молочной железы, nkt-клетки, cd25+ лимфоциты, безрецидивная выживаемость, общая выживаемость, неоадъювантная химиотерапия
Короткий адрес: https://sciup.org/140254400
IDR: 140254400 | УДК: 618.19-006.6-08-037-092.18 | DOI: 10.21294/1814-4861-2020-19-6-66-72
Текст научной статьи Взаимосвязь NKT-клеток и активированных CD25+ лимфоцитов периферической крови с продолжительностью безрецидивной и общей выживаемости больных трижды негативным раком молочной железы
Рак молочной железы (РМЖ) характеризуется клеточной и молекулярной гетерогенностью и является наиболее распространенным злокачественным новообразованием среди женщин во всем мире. В клинике для прогноза РМЖ используют различные клинико-патологические, молекулярные и генетические факторы, тем не менее исход этого заболевания во многих случаях трудно предсказать. Установление надежных прогностических факторов при РМЖ имеет решающее значение для разработки методов эффективной индивидуальной помощи пациенткам [1]. Важную роль в контроле над возникновением и ростом злокачественных новообразований играет иммунная система [2, 3]. Появляется все больше свидетельств того, что взаимодействие между иммунными и опухолевыми клетками оказывает значимое влияние на развитие и прогрессирование рака молочной железы [4]. Опухоль индуцирует как локальный, так и системный иммунный ответ, и иммунные клетки, как инфильтрирующие опухоль, так и лимфоциты периферической крови (ПК), могут иметь прогностическое значение [5–7]. Иммун- ная система пациента активно взаимодействует с различными видами противоопухолевой терапии [8, 9]. Ключевыми эффекторными клетками противоопухолевого иммунитета являются CD8+ T-лимфоциты, положительное прогностическое значение которых продемонстрировано в различных клинических исследованиях [10]. В то же время в ответе на опухоль участвует значительное число лимфоцитарных популяций как адаптивного, так и врожденного иммунитета, которые также могут иметь прогностическое значение. Ранее при изучении субпопуляционного состава лимфоцитов периферической крови больных с трижды негативным (ТН) РМЖ мы обнаружили, что снижение количества NKT-клеток и активированных CD25+ лимфоцитов до начала неоадъювантной химиотерапии ассоциировалось с повышением вероятности прогрессирования заболевания [11]. В данной работе проводилось дальнейшее изучение возможной прогностической значимости этих популяций лимфоцитов у пациенток c ТН РМЖ.
Проведенное в настоящей работе определение взаимосвязи исходного количества NKT-клеток и CD25+лимфоцитов ПК с выживаемостью больных ТН РМЖ, получавших стандартную противоопухолевую терапию, является актуальным и может послужить основой для установления прогностической значимости этих популяций лимфоцитов, а также более точного предсказания исхода заболевания.
Цель исследования – изучить взаимосвязь исходного количества NKT- и CD25+ лимфоцитов ПК с продолжительностью безрецидивной (БРВ) и общей выживаемости (ОВ) больных ТН РМЖ, получивших неоадъювантную химиотерапию цисплатином и паклитакселом с последующей операцией.
Материал и методы
В исследование было включено 50 больных ТН РМЖ II и III стадии. Медиана возраста составила 50 лет (от 26 до 76 лет). После 4–6 курсов химиотерапии (паклитаксел 80 мг/м2, в 1, 8, 15-й дни + цисплатин 75 мг/м2, в 1-й день, цикл 28 дней) все пациентки подвергались хирургическому лечению. Период наблюдения составил 36 и 66,9 мес. Данные о прогрессировании заболевания и выживаемости в течение 3-летнего периода были получены относительно 50 (у 24 из них отмечалось прогрессирование заболевания) и 42 (13 из них умерли) пациенток соответственно.
Иммунологическое обследование пациенток (многопараметровый цитометрический анализ на пятипараметровом проточном цитофлуориметре аналитического типа FACSCalibur «BectonDickinson», CШA) проводилось непосредственно перед началом химиотерапии. Лимфоциты выделялись по параметрам светорассеяния и экспрессии CD45. Для двух-, трех- и четырех- цветного окрашивания клеток использовали моноклональные антитела, конъюгированные с FITC, PE, PC5 (Bekman Coulter США; «Сорбент», Россия), к следующим маркерам лимфоцитов: CD45, CD3, CD16, CD56, CD25. В группу сравнения (К) вошли практически здоровые женщины соответствующего возраста (n=26). Все пациентки дали информированное согласие на проведение иммунологического обследования.
Для статистического анализа данных использовали пакет статистических программ «Статистика 7». Результаты представлены в виде Ме (Медиана) и 95 % доверительного интервала Me (95 % ДИ). Анализ выживания проводили с помощью метода Каплана–Майера. Для сравнения кривых выживания использовали лог-ранговый критерий (log-rank test) или критерий Кокса–Мантеля (Cox– Mantel test) и F-критерий Кокса (Cox’s F-Test). В качестве точки отсчета для определения уровня каждого иммунологического показателя принимали значение его медианы в контрольной группе Mecontr (N). Уровень статистической значимости был принят равным 0,05.
Результаты
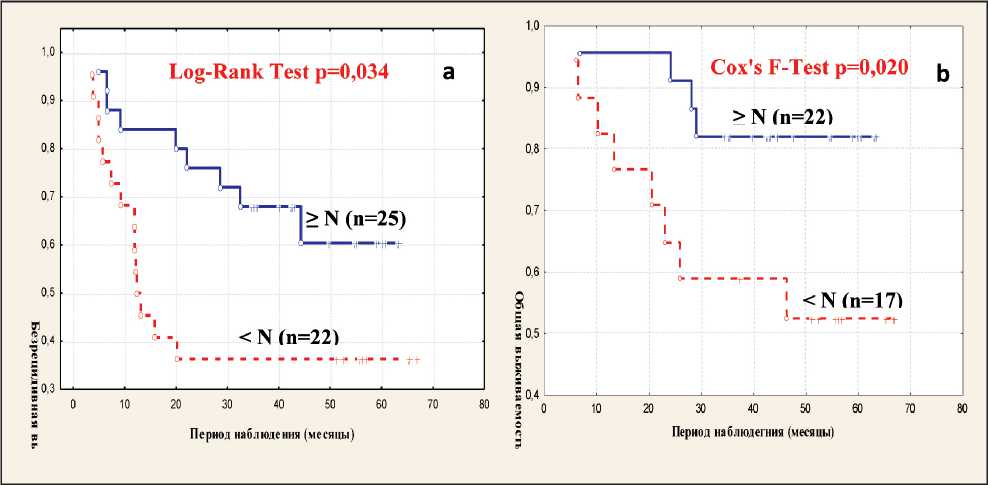
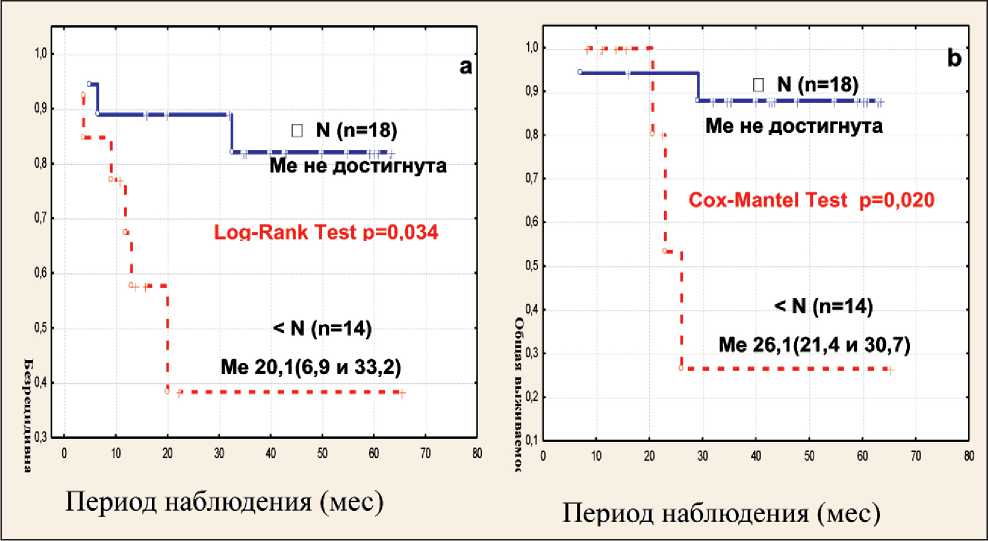
Исследовалось значение исходного количества CD3+CD16+CD56+ NKT-клеток для трехлетней БРВ (n=50) и ОВ (n=42) больных ТН РМЖ, получавших неоадъювантную химиотерапию (паклитаксел + цисплатин) и последующее оперативное лечение. У пациенток, у которых количество NKT-клеток до лечения было ниже контрольного значения, БРВ была статистически значимо уменьшена по сравнению с пациентками, у которых процент этих клеток был выше, чем Mecontr (8,7 %). При этом БРВ у больных с количеством NKT-клеток Рис. 1. Взаимосвязь трехлетней без-рецидивной (a) и общей (b) выживаемости больных ТН РМЖ с количеством CD3+CD16+CD56+ (NKT%) лимфоцитов до начала химиотерапии (по методу Каплана–Мейера). Примечание: о– нецензурированные данные: (a) n=24, (b) n=13; +– цензурированные данные (больные с безрецидивным течением заболевания или живые пациентки на момент анализа): (a) n=26, (b) n=29 Fig. 1. The relationship between the three-year relapse-free (a) overall (b) survival of breast cancer patients and the number of CD3+CD16+CD56+(NKT%) lymphocytes before chemotherapy (according to the Kaplan–Meier method). Note: o– Complete: (a) n=24, (b) n=13; +– Censored: (a) n=26, (b) n=29 Рис. 2. Взаимосвязь безрецидивной (a) и общей (b) выживаемости больных ТН РМЖ с количеством CD25+ лимфоцитов (CD25+ %) периферической крови до начала химиотерапии (по методу Каплана– Мейера). Примечание: о– нецензурированные данные: (a) n=23, (b) n=12; +– цензурированные данные (больные с безрецидивным течением заболевания или живые пациентки на момент анализа): (a) n=24, (b) n=27 Fig. 2. The relationship between the three-year relapse-free (a)/overall (b) survival of breast cancer patients and the number of CD25+ (CD25+ %) lymphocytes before chemotherapy (according to the Kaplan–Meier method). Note: o– Complete: (a) n=23, (b) n=12; +– Censored: (a) n=24, (b) n=27 Рис. 3. Взаимосвязь безрецидивной (a) и общей (b) выживаемости больных ТН РМЖ с количеством NKT- и CD25+ (NKT%& CD25+ %) лимфоцитов периферической крови до начала химиотерапии (по методу Каплана–Мейера). Период наблюдения – 66,9 мес. Примечание: о– нецензурированные данные: (a) n=9, (b) n=5; +– цензурированные данные (больные с безрецидивным течением заболевания или живые пациентки на момент анализа): (a) n=23, (b) n=27 Fig. 3. The relationship between the three-year relapse-free (a) overall (b) survival of breast cancer patients and the number of NKT- and CD25+ (NKT%&CD25+%) lymphocytes before chemotherapy (according to the Kaplan–Meier method). Note: o– Complete: (a) n=9, (b) n=5; +– Censored: (a) n=23, (b) n=27 Обсуждение NKT-клетки врожденного иммунитета составляют небольшую часть лимфоцитов, однако они способны эффективно уничтожать опухолевые клетки. В настоящее время выделяют три типа NKT-клеток: тип I NKT (iNKT), тип II NKT и NKT-подобные клетки. Наивысшую противоопухолевую активность проявляют iNKT-клетки, которые повреждают опухоль как с помощью прямого цитотоксического действия, так и непрямого путем секреции различных цитокинов, активирующих противоопухолевые механизмы, а также активизации истощенных CD8+ Т- и NK-клеток [12]. Снижение количества iNKT в ПК было обнаружено при различных злокачественных новообразованиях [13]. Выраженный дефицит iNKT- клеток ПК ассоциировался с неблагоприятным клиническим исходом у больных раком головы и шеи [14], а восстановление количества периферических iNKT-клеток обеспечивало длительную ремиссию у детей с различными гемобластозами [15]. В настоящем исследовании популяция NKT-клеток определялась по экспрессии наиболее часто используемых при исследовании этих лимфоцитов маркеров: CD3, CD16 и CD56 (CD3+CD16+CD56+), что не позволяет определить, к какому типу относятся эти клетки. Было обнаружено, что повышение процента (CD3+CD16+CD56+) NKT-клеток до лечения у части больных ТН РМЖ явилось благоприятным фактором и ассоциировалось с увеличением БРВ, по сравнению с больными, у которых этот показатель был снижен. Исходный уровень этих клеток, вероятно, не имел значимого влияния на ОВ. У пациенток, у которых до лечения количество CD25+ лимфоцитов было ниже контроля, и БРВ, и ОВ были статистически значимо снижены по сравнению с больными, у которых число этих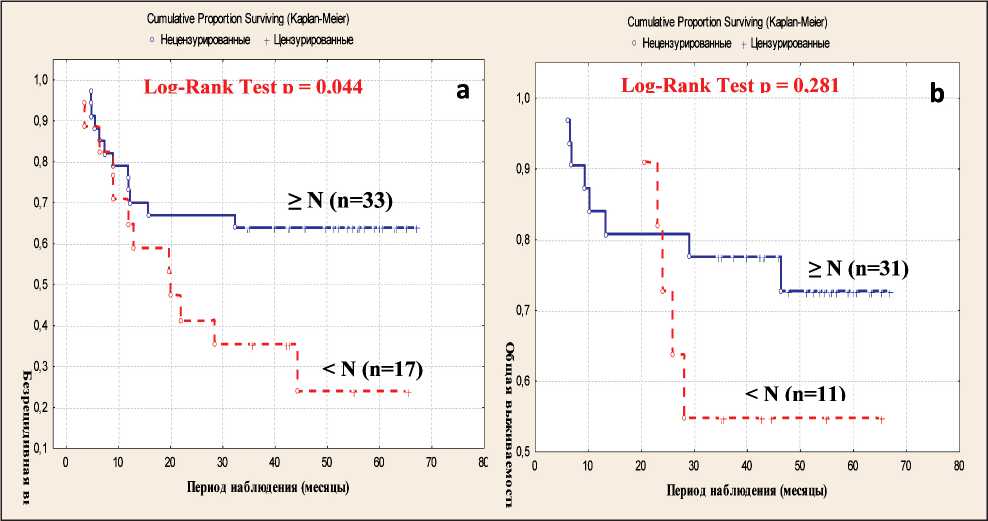
Список литературы Взаимосвязь NKT-клеток и активированных CD25+ лимфоцитов периферической крови с продолжительностью безрецидивной и общей выживаемости больных трижды негативным раком молочной железы
- Rivenbark A.G., O'Connor S.M., Coleman W.B. Molecular and cellular heterogeneity in breast cancer: challenges for personalized medicine. Am J Pathol. 2013 Oct; 183(4): 1113-1124. doi: 10.1016/j. ajpath.2013.08.002.
- Teng M.W., Galon J., Fridman W.H., Smyth M.J. From mice to humans: developments in cancer immunoediting. J Clin Invest. 2015; 125(9): 3338-46. doi: 10.1172/JCI80004.
- Finn O.J. A Believer's Overview of Cancer Immunosurveillance and Immunotherapy. J Immunol. 2018 Jan 15; 200(2): 385-91. doi: 10.4049/ jimmunol.1701302.
- Huang Y., Ma C., Zhang Q., Ye J., Wang F., Zhang Y., Hunborg P., VarvaresM.A., HoftD.F., HsuehE.C., Peng G. CD4+ and CD8+ T cells have opposing roles in breast cancer progression and outcome. Oncotarget. 2015 Jul 10; 6(19): 17462-78. doi: 10.18632/oncotarget.3958.
- StandishL.J., Sweet E.S., Novack J., WennerC.A., Bridge C., Nelson A., Martzen M., Torkelson C. Breast cancer and the immune system. J Soc Integr Oncol. 2008 Fall; 6(4): 158-68.
- Peguillet I., Milder M., Louis D., Vincent-Salomon A., Dorval T., Piperno-Neumann S., Scholl S.M., Lantz O. High numbers of differentiated effector CD4 T cells are found in patients with cancer and correlate with clinical response after neoadjuvant therapy of breast cancer. Cancer Res. 2014 Apr 15; 74(8): 2204-16. doi: 10.1158/0008-5472.CAN-13-2269.
- RühleP.F., Fietkau R., Gaipl U.S., FreyB. Development of a Modular Assay for Detailed Immunophenotyping of Peripheral Human Whole Blood Samples by Multicolor Flow Cytometry. Int J Mol Sci. 2016 Aug 11; 17(8): 1316. doi: 10.3390/ijms17081316.
- Wu J., WaxmanD.J. Immunogenic chemotherapy: Dose and schedule dependence and combination with immunotherapy. Cancer Lett. 2018 Apr 10; 419: 210-221. doi: 10.1016/j.canlet.2018.01.050.
- Haikerwal S.J., Hagekyriakou J., MacManus M., Martin O.A., Haynes N.M. Building immunity to cancer with radiation therapy. Cancer Lett. 2015 Nov 28; 368(2): 198-208. doi: 10.1016/j.canlet.2015.01.009.
- Burugu S., Asleh-Aburaya K., Nielsen T.O. Immune infiltrates in the breast cancer microenvironment: detection, characterization and clinical implication. Breast Cancer. 2017 Jan; 24(1): 3-15. doi: 10.1007/ s12282-016-0698-z.
- ЧертковаА.И., СлавинаЕ.Г., Шоуа Э.К., Жукова Л.Г., Окруж-нова М.А., Нуртдинова В.А., Борунова А.А., Джгамадзе Н.Т., Кадагидзе З.Г. Основные параметры клеточного иммунитета у больных раком молочной железы с тройным негативным фенотипом. Cвязь с эффективностью химиотерапии. Медицинская иммунология. 2018; 20(5): 667-680. [ChertkovaA.I., SlavinaE.G., ShouaE.K., ZhukovaL.G., Okruzhnova M.A., Nurtdinova V.A., Borunova A.A., Dzhgamadze N.T., Kadagidze Z.G. The main parameters of cellular immunity in patients with triple-negative breast cancer: relationship with efficiency of chemotherapy. Medical Immunology. 2018; 20(5): 667-680. (in Russian)].
- Bae E.A., Seo H., Kim I.K., Jeon I., Kang C.Y. Roles of NKT cells in cancer immunotherapy. Arch Pharm Res. 2019 Jul; 42(7): 543-548. doi: 10.1007/s12272-019-01139-8.
- Giaccone G., Punt C.J., Ando Y., RuijterR., NishiN., PetersM., von Blomberg B.M., Scheper R.J., van der VlietH.J., van den EertweghA.J., Roelvink M., Beijnen J., Zwierzina H., Pinedo H.M. A phase I study of the natural killer T-cell ligand alpha-galactosylceramide (KRN7000) in patients with solid tumors. Clin Cancer Res. 2002 Dec; 8(12): 3702-9.
- Molling J.W., Langius J.A., Langendijk J.A., Leemans C.R., Bontkes H.J., van der Vliet H.J., von Blomberg B.M., Scheper R.J., van den Eertwegh A.J. Low levels of circulating invariant natural killer T cells predict poor clinical outcome in patients with head and neck squamous cell carcinoma. J Clin Oncol. 2007 Mar 1; 25(7): 862-8. doi: 10.1200/ JCO.2006.08.5787.
- Casorati G., de Lalla C., Dellabona P. Invariant natural killer T cells reconstitution and the control of leukemia relapse in pediatric haploidentical hematopoietic stem cell transplantation. Oncoimmunology. 2012 May 1; 1(3): 355-357. doi: 10.4161/onci.18399.
- BenczikM., Gaffen S.L. The interleukin (IL)-2 family cytokines: survival and proliferation signaling pathways in T lymphocytes. Immunol Invest. 2004 May; 33(2): 109-42. doi: 10.1081/imm-120030732.
- Ellery J.M., Nicholls P.J. Possible mechanism for the alpha subunit of the interleukin-2 receptor (CD25) to influence interleukin-2 receptor signal transduction. Immunol Cell Biol. 2002 Aug; 80(4): 351-7. doi: 10.1046/j.1440-1711.2002.01097.x.


