Взаимосвязь солевой чувствительности и морфофункционального состояния сердца у больных артериальной гипертензией
Автор: Касымов С. Э.
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Оригинальные статьи
Статья в выпуске: 1, 2020 года.
Бесплатный доступ
Целью данного исследования явилось сравнительная оценка патологических изменений морфофункционально состояния сердца в группах больных артериальной гипертензией, разделенных по солевой чувствительности.Материал и методы. 93 больных с артериальной гипертензией (АГ) и сопутствующей ишемической болезнью сердца были включены в исследование. Всем больным была проведена солевая нагрузка, после которой все пациенты были разделены на группы солечувствительных (СЧ) и несолечувствительных (НСЧ) пациентов. Наряду с этим больным была воспроизведена эхокардиографическое исследование сердца для определения функционального состояния сердечной мышцы. Больные в группах СЧ и НСЧ были сравнены между собой по результатам эхокардиографии сердца.Результаты. Гипертрофия левого желудочка в большей степени была выявлена в группе СЧ больных по сравнению с НСЧ группой (82,6% против 17,0%) и различия между группами были статистически достоверными (p
Артериальная гипертензия, солевая нагрузка, солевая чувствительность, гипертрофия сердца
Короткий адрес: https://sciup.org/143171844
IDR: 143171844 | DOI: 10.24411/2076-4766-2020-10003
Текст научной статьи Взаимосвязь солевой чувствительности и морфофункционального состояния сердца у больных артериальной гипертензией
Сведения об авторах:
Касымов Заведующий отделения кардиологии Госпиталя Министерства Внутренних дел
Сирадж Элдениз Азербайджанской Республики имени А. Гейдарова, полковник-лейтенант. Диссертант Научно исследовательского Института Кардиологии имени академика Дж. Абдуллаева.
Qasimov Sirac Eldeniz The chief of cardiology department in thе Hospital of Internal Affairs of Azerbaijan Republic named after A.Heyderov, lieutenant colonel. The doctorant in Scientific-research institute of cardiology named by academician C.Abdullayev
И SIRAC.SIRAC@MAIL.RU
Известно, что одним из важных факторов, оказывающих влияние на реактивность сосудов, является избыточное потребление поваренной соли (ПС), что приводит к увеличению периферического сопротивления и, тем самым, прогрессированию артериальной гипертензии (АГ) [1]. Одним из фундаментальных способов нефармакологической коррекции у пациентов АГ считается ограничение потребления ПС [2, 3].
Одним из предложенных методов оценки реакции прессорных и депрессорных систем на поваренную соль у пациентов АГ является применение солевых нагрузок [4]. Этот метод представляет собой определение чувствительности пациентов АГ к ПС, что в последующем дает возможность оптимизировать диуретическую терапию и гипонатриевую диету.
У здоровых лиц, а также у пациентов, страдающих от гипертонии, длительная нагрузка хлоридом натрия приводит к изменению гуморальной регуляции водно-электролитного равновесия, которое выражается изменениями функционального состояния калликреин-кининовой, ренин-ангиотензиновой, симпатико-адреналовой системы почек, стероидной функции надпочечников.
В то же время, предполагается что, описанные различия гемодинамических изменений у сравниваемых группах больных обусловлены влиянием высокой концентрации ПС на трансмембранный ионный градиент гладких мышечных клеток сосудистой стенки, а также дополнительно повышением активности симпатико-адреналовой системы. В связи с чем, восприимчивость гладких мышечных клеток вазоактивным веществам значительно возрастает [5].
Показано, что острая солевая нагрузка может использоваться как наиболее безопасный и информативный тест, так как, обеспечивает дифференцированный подход, как на режим питания, так и на лечение пациентов АГ [6].
Учитывая вышесказанное, целью данного исследования явилось сравнительная оценка патологических изменений морфофункционально состояния сердца в группах больных артериальной гипертензией, разделенных по солевой чувствительности.
МАТЕРИАЛ И МЕТОДЫ
В исследование были включены 93 больных с ишемической болезнью сердца (ИБС) в сочетании c АГ 2-й и 3-й степени. Диагноз ИБС и АГ верифицировался в соответствии с существующими современными клиническими рекомендациями. Клинико-анамнестическое и инструментальное обследование пациентов с верификацией диагнозов производилась с оценкой имеющегося у них варианта ремоделирования миокарда.
Всем пациентам, включенным в исследование, была проведена острая солевая нагрузка. За 4-5 дней до проведения пробы было прекращено медикаментозное лечение и больные находились в обычном водно-солевом режиме. В день пробы утром натощак больные принимали 0,22 г поваренную соль на 1 килограмм веса, растворенную в 150 мл дистиллированной воде. В течение 3 часов после выпитой смеси больные находились под наблюдением, каждые 20-30 минут измерялись АД и ЧСС.
Повышение среднего АД более чем на 10% после солевой нагрузки воспринималось как «солевая чувствительность». Таким образом, больные, включенные в исследование, были разделены на две группы: 46 больных оказались солечувствительными (СЧ) и 47 - несолечувствительными (НСЧ) (табл. 1).
С помощью эхокардиографического исследования (ЭхоКГ) в режиме одномерного (М) и двухмерного (B) режимов сканирования исследовался ряд параметров, отражающих состояние внутрисердечной гемодинамики и ремоделирования миокарда. Для оценки центральной гемодинамики и сократительной функции миокарда проводилась трансторакальная ЭхоКГ с импульсно-волновой допплерографией на аппарате GE Vivid S60 с применением датчика 2,5 МГц с импульсным режимом и цветовым допплером.
Использовались стандартные доступы ЭхоКГ (парастернальный по длинной и короткой осям, апикальный и субкостальный) с оценкой конечно-диастолического (КДР) и систолического (КСР) размеров левого желудочка (ЛЖ), конечно-диастолического (КДО) и систолического (КСО) объемов ЛЖ, толщину межжелудочковой перегородки (МЖП) и задней стенки ЛЖ (ЗСЛЖ), переднезаднего размера левого предсердия (ЛП), правого желудочка (ПЖ) и правого предсердия (ПП).
При проведении эхокардиографического исследования сердца оценивались некоторые показатели сократительной способности миокарда: фракция выброса (ФВ), фракция укорочения ( Δ S%), выявлялись участки регионарного гипокинеза и акинеза, оценивалась диастолическая функция.
Расчёты сократительной функции сердца и центральной гемодинамики производились биплановым методом Simpson et al. (1972).
Полученные данные были статистически обработаны в программе Microsoft Windows Excell 2010, были вычислены средние показатели (M), ошибка среднего (±m), а также минимальные и максимальные значения данных показателей. Статистическая значимость полученных данных была определена с помощью t-критерия Стюдента и критерия χ 2 Пирсона. Значение p<0,05 рассматривалось как статистически значимое.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
При наличии солечувствительности у больных АГ отмечалось быстрое (в среднем за 19,3±0,04 минут) и острое повы-
Таблица 1. Количество и диагностическая характеристика больных в группах солечувствительных (СЧ) и несолечувствительных (НСЧ) больных.
|
Группа СЧ |
Группа НСЧ |
||
|
Количество больных (n) |
46 (49,5%) |
47 (50,5%) |
|
|
Средний возраст, год |
57,3 |
51,7 |
|
|
Функциональный класс стабильной стенокардии напряжения и количество больных |
I ФК |
0 |
0 |
|
II ФК |
30 (32,3%) |
25 (26,9%) |
|
|
III ФК |
12 (12,9%) |
11 (11,8%) |
|
|
I |
2 (2,15%) |
3 (3,23%) |
|
|
Степень АГ и количество больных |
II |
36 (38,7%) |
38 (40,9%) |
|
III |
8 (8,6%) |
6 (6,45%) |
|
|
Функциональный класс хронической сердечной недостаточности и количество больных |
I ФК |
1 (1,08%) |
1 (1,08%) |
|
II ФК |
2 (2,15%) |
1 (1,08%) |
|
|
3 III ФК |
1 (1,08%) |
2 (2,15%) |
|
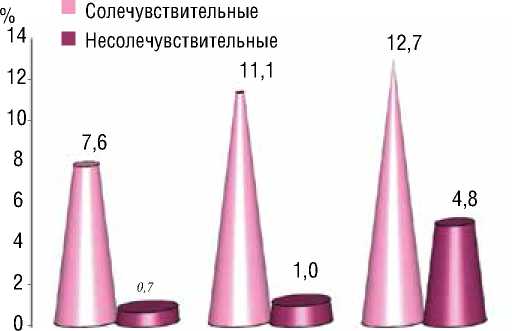
САД ДАД ЧСС
Рисунок 1. Изменения САД, ДАД и ЧСС после солевой нагрузки в группах СЧ и НСЧ шение АД, в частности повышение систолического АД (САД) составило в среднем 10,4±1,04%, а диастолического АД (ДАД) 7,8±1,06%. Наряду с АД также отмечалось повышение частоты сердечных сокращений (ЧСС) в среднем на 11,4±2,7%. Приблизительно в течении 60-90 минут (в среднем 69,4±5,8) АД снижалось до исходных значений. Все эти изменения происходили у больных СЧ, что составило 46 больных среди общего количества. У больных НСЧ вышеизложенные показатели изменились незначительно (рис. 1).
После солевой нагрузки отмечаются выраженные различия по повышению САД, ДАД и ЧСС в сравниваемых группах: повышение изученных параметров в группе больных СЧ было статистически значимым по сравнению с исходными значениями (p<0,001), в группе больных НСЧ статистически значимых различий по данным параметрам выявлено не было. В ходе исследования были вычислены следующие средние значения данных показателей: в группе СЧ САД до солевой нагрузки был равен 149,9±1,1 мм рт.ст., а после нагрузки повысился до 162,8±1,5 мм рт.ст; ДАД до нагрузки 95,9±1,4 мм рт.ст., после нагрузки 107,6±1,3 мм рт.ст.; ЧСС до нагрузки 84,0±1,0 ударов в минуту, после нагрузки 96,0±1,3 ударов в минуту. В группе НСЧ САД до нагрузки составил 150,0±1,0 мм рт.ст, после нагрузки был равен 151,1±1,1 мм рт.ст.; ДАД до нагрузки 94,1±1,1 мм рт.ст., после нагрузки 95,1±1,1 мм рт.ст.; ЧСС до нагрузки 82,9±0,9 ударов в минуту, после нагрузки 87,3±1,2 ударов в минуту. Таким образом, различия по вышеуказанным параметрам после солевой нагрузки были статистически значимыми в сравниваемых группах (p<0,001).
Предполагается, что описанные различия гемодинамических изменений в двух сравниваемых группах больных доказывает влияние избыточного потребления ПС на гладкие мышцы сосудистой стенки. Это подтверждает неблагоприятное влияние ПС на сердечно-сосудистую систему в целом.
Наблюдались выраженные различия по некоторым эхокардиографическим показателям и признакам между группами больных СЧ и НСЧ. В таблице 2 обозначены средние значения
Таблица 2. Средние значения эхокардиографических показателей в группах СЧ и НСЧ (M± m)
|
Эхокардиографические показатели |
СЧ (n = 46) |
НСЧ (n = 47) |
статистическая значимость |
|
Толщина межжелудочковой перегородки (ТМЖП, мм |
12,6 ±0,2 (9,3 – 15) |
11,90 ±0,3 (9 – 18) |
x 2=4,937; p=0,026 |
|
Толщина задней стенки левого желудочка (ТЗСЛЖ), мм |
10,9 ± 0,1 (9 – 14) |
10,6 ± 0,1 (9 – 15) |
x 2=2,627; p=0,105 |
|
Фракция выброса (ФВ), % |
53,3 ±0,9 (36 – 64) |
53,0 ±1,1 (33 – 64) |
x 2=0,0001; p=0,994 |
|
Фракция укорочения (ФУ) D S, % |
24,7 ± 0,6 (17 – 33) |
25,6 ±0,7 (16 – 34) |
x 2=1,038; p=0,308 |
%
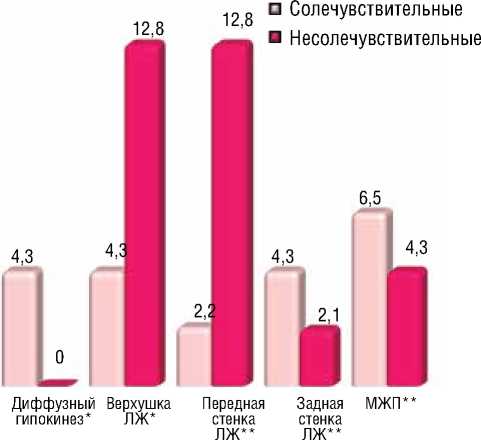
Рисунок 3. Частота встречаемости акинетических участков различной локализации в группах больных СЧ и НСЧ
Примечание: * - р<0,05; ** -р>0,05.
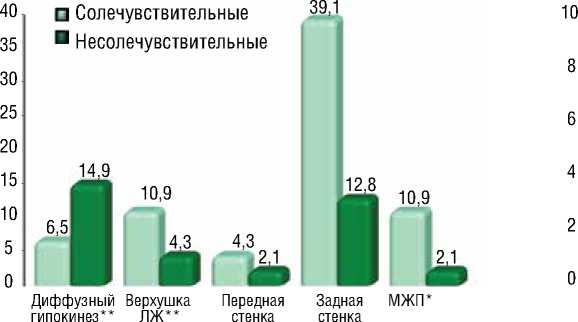
Рисунок 2. Частота встречаемости гипокинетических участков различной локализации в группах больных СЧ и НСЧ
Примечание: * - р<0,05; ** -р>0,05.
эхокардиографических показателей и приведены статистические значимости различий.
Как видно из таблицы, среднее значение ТМЖП был значительно выше в группе СЧ больных, по сравнению с группой НСЧ, различия носили статистически значимый характер. Наряду с этим, среднее значение ТЗСЛЖ было выше в группе СЧ больных, по сравнению с группой НСЧ, но различия не были статистически достоверными. Средние значения ФВ и ФУ не различались между группами. Таким образом, во многих случаях некоторые эхокардиографические показатели, такие как ТМЖП и ТЗСЛЖ имеют более высокие значения у больных СЧ, что указывает на более раннее и глубокое ремоделирование сердца у этого контингента больных.
Полученные данные дают возможность судить о более выраженном и раннем возникновении гипертрофии миокарда у СЧ больных.
С помощью эхокардиографического обследование левого желудочка сердца были получены данные о нарушении кровоснабжении миокарда левого желудочка различной локализации. Ниже на рисунках приведены частота встречаемости гипокинетических (рис. 2) и акинетических участков (рис. 3) миокардиальной стенки различной локализации в группах больных СЧ и НСЧ:
Как описано в рисунках, частота встречаемости гипокинеза и акинеза в различных локализациях отличалась в группах больных СЧ и НСЧ. Так как, в группе СЧ больных диффузный гипокинез был отмечен у 3 пациентов из 46 (6,5%), а в группе НСЧ больных у 7 пациентов из 47 (14,9%). Диффузный акинез выявился у 2 пациентов из 46 больных (4,3%) в группе СЧ больных, а в группе НСЧ больных данного эхокардиографического признака выявлено не было. Различия по вышеупомянутому эхо признаку между двумя группами не были статистически значимыми ( χ 2=0,233; p=0,630). Гипокинез верхушки левого желудочка в группе СЧ больных был определен у 5 пациентов из 46 (10,9%), а в группе НСЧ больных у 2 пациентов из 47 (4,3%). Акинез верхушки левого желудочка в группе СЧ больных был определен у 2 пациентов из 46 (4,3%), а в группе НСЧ больных у 6 пациентов из 47 (12,8%). Различия по данному эхо признаку между двумя группами не были статистически достоверными ( χ 2=0,152; p=0,696). Гипокинез передней стенки левого желудочка в группе СЧ больных был определен у 2 пациентов из 46 (4,3%), а в группе НСЧ больных у 1 пациента из 47 (2,1%). Аки-
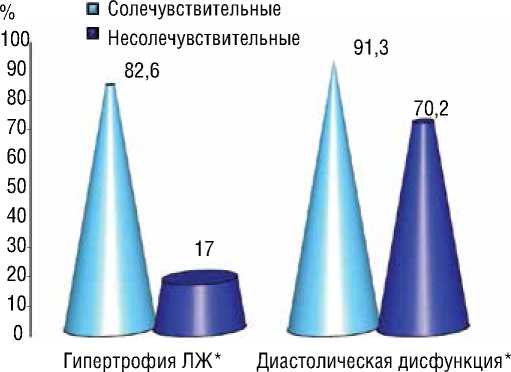
Рисунок 4. Частота встречаемости гипертрофии и диастолической дисфункции левого желудочка в группе СЧ и НСЧ больных
Примечание: * - р<0,05.
нез передней стенки левого желудочка в группе СЧ больных был определен у 1 пациента из 46 (2,2%), а в группе НСЧ больных у 6 пациентов из 47 (12,8%). Таким образом, частота встречаемости акинеза в этом участке левого желудочка был значительно выше в группе НСЧ больных, но данное различие не было статистически значимым ( χ 2=3,050; p=0,081). Гипокинез задней стенки левого желудочка в группе СЧ больных выявлялся у 18 пациентов из 46 (39,1%), а в группе НСЧ больных у 6 пациентов из 47 (12,8%). Данный эхо признак встречался три раза больше в группе СЧ больных. Акинез задней стенки левого желудочка в группе СЧ больных был определен у 2 пациентов из 46 (4,3%), а в группе НСЧ больных у 1 пациента из 47 (2,1%). В группе СЧ больных нарушение кровоснабжения вышеуказанной локализации выявлялась в значительно большей степени и различия между группами были статистически достоверными ( χ 2=8,840; p=0,003). Гипокинез межжелудочковой перегородки в группе СЧ больных был отмечен у 5 пациентов среди 46 (10,9%), а в группе НСЧ у 1 пациента среди 47 (2,1%). Акинез межжелудочковой перегородки в группе СЧ больных был отмечен у 3 пациентов среди 46 (6,5%), а в группе НСЧ у 2 пациентов среди 47 (4,3%). Несмотря на то, что нарушение кровоснабжения в данной локализации было выявлено в больней степени в группе СЧ больных, различия между группами не были статистически значимыми ( χ 2=1,116; p=0,291).
Гипертрофия левого желудочка в большей степени была выявлена в группе СЧ больных по сравнению с НСЧ группой (82,6% против 17,0%) и различия между группами были статистически достоверными (p<0,001). В том числе, диастолическая дисфункция левого желудочка значительно чаще выявилась у СЧ больных (91,3% против 70,2%) и различия между группами также были статистически значимыми (p=0,01) (рис. 4).
ОБСУЖДЕНИЕ
Полученные результаты исследования сопоставимы с результатами недавних исследований, в которых гипертрофия желудочков, индуцированная высоким потреблением ПС, преимущественно возникала в перегородке желудочков. Эти результаты представляют особый интерес, поскольку предыдущие исследования на людях показали высокую распространенность непропорциональной гипертрофии перегородки желудочка при различных патологиях (болезни аорты, легочной артерии или легочной гипертензии) [7, 8]. Причины, по которым межжелудочковая перегородка более восприимчива к развитию гипертрофии, остаются неясными. Это может быть связано с его эмбриональным развитием, при котором в его формировании участвуют три компонента, или с относительно более плоским контуром по сравнению со свободной стенкой ЛЖ, в результате чего на нее воздействует большее систолическое напряжение [9].
Тем временем доказано, что избыточное потребление ПС независимо от его влияния на повышение АД, приводит к возникновению сердечной и сосудистой гипертрофии [10, 11]. СЧ лица по сравнению с НСЧ лицами в большей степени подвержены патологическим изменениям в сердечно-сосудистой системе и у таких пациентов повреждения сердца и сосудов носят более выраженный и тяжелый характер. В перекрестных исследованиях показано, что у гипертензивных и нормотензивных лицах, а также в животных моделях экскреция натрия мочой в течение 24 часов имело положительную корреляционную связь с массой левого желудочка (ЛЖ) [12].
Во многих современных исследованиях показаны различные механизмы возникновения гипертрофии сердца, в том числе роль ренин-ангиотензиновой системы (РАС) у гипертензивных лиц и животных [13, 14].
Таким образом, в данном исследование подтвердились предположения о негативном влияние избыточного потребления ПС на морфофункциональное состояние сердца.
Список литературы Взаимосвязь солевой чувствительности и морфофункционального состояния сердца у больных артериальной гипертензией
- Rust P., Ekmekcioglu C. Impact of Salt Intake on the Pathogenesis and Treatment of Hypertension. Adv Exp Med Biol. 2017;956:61-84. DOI: 10.1007/5584_2016_147
- Rakova N., Kitada K., Lerchl K. et al. Increased salt consumption induces body water conservation and decreases fluid intake. J. Clin. Invest. 2017; 127: 1932-43.
- Taylor RS., Ashton KE., Moxham T., Hooper L., Ebrahim S. Reduced dietary salt for the prevention of cardiovascular disease: a meta-analysis of randomized controlled trials (Cochrane Review) Am J Hypertens. 2011;24:843-853.
- Бахшалиев А.Б. Оптимизация терапии гипертонической болезни с помощью диагностических тестов и дифференцированного приминения фармакологических и нефармакологических методов лечения. - 1990. Авторефер….докт.мед.наук.
- Rik H.G. Olde Engberink, Nienke M.G. Rorije, Jaap J. Homan van der Heide, Bert-Jan H. van den Born, and Liffert Vogt Role of the Vascular Wall in Sodium Homeostasis and Salt Sensitivity// J Am Soc Nephrol. 2015 Apr; 26(4): 777-783. Published online 2014 Oct 7. DOI: 10.1681/ASN.2014050430
- Akira T., Tsutomu I., Toshiaki A., Motbomi N. Characteristics of responses to salt loading and deprivation in hypertensive subjects // Circ. Res. 1982. - Vol.51, №4. - p.457-464.
- Dunn RB. Regional blood flow and metabolic levels in the left ventricular free wall and septum during aortic insufficiency: implications for the development of asymmetric septal hypertrophy. J Am Coll Cardiol. 1986;8:1182-1188.
- Nunez B.D., Lavie C.J., Messerli F.H., Schmieder R.E., Garavaglia G.E., Nunez M. Comparison of diastolic left ventricular filling and cardiac dysrhythmias in hypertensive patients with and without isolated septal hypertrophy. Am J Cardiol. 1994;74:585-589.
- Philippe Le Corvoisier, Christophe Adamy, Lucien Sambin, Bertrand Crozatier, Alain Berdeaux, Jean-Baptiste Michel, Luc Hittinger, and Jinbo Su. The cardiac renin-angiotensin system is responsible for high-salt diet-induced left ventricular hypertrophy in mice. Eur J Heart Fail. 2010 Nov; 12(11): 1171-1178.
- Safar M.E., Thuilliez C., Richard V., Benetos A. Pressure-independent contribution of sodium on large artery structure and function in hypertension, Cardiovasc Res, 2000, vol. 46 (pg. 269-276).
- Schmieder RE, Messerli FH, Garavaglia GE, Nunez BD. Dietary salt intake. A determinant of cardiac involvement in essential hypertension, Circulation, 1988, vol. 78 (pg. 951-956).
- Bochud M., Staessen J.A., Maillard M., Mazeko M.J., Kuznetsova T., Woodiwiss A., Richart T., Norton G., Thijs L., Elston R., et al. Ethnic differences in proximal and distal tubular sodium reabsorbtion are heritable in black and white populations. J. Hypertens. 2009;27:606-612.
- Ding Y., Lv J., Mao C., Zhang H., Wang A., Zhu L., Zhu H., Xu Z. High-salt diet during pregnancy and angiotensin-related cardiac changes. J Hypertens. 10.1097/HJH.0b013e328337da8f. Published online ahead of print 3 March 2010.
- DOI: 10.1097/HJH.0b013e328337da8f.Publishedonlineaheadofprint3March2010
- Takeda Y., Yoneda T., Demura M., Miyamori I., Mabuchi H. Sodium-induced cardiac aldosterone synthesis causes cardiac hypertrophy. Endocrinology. 2000;141:1901-1904.


