Взаимосвязь структурных и энтальпийных характеристик мета- и ортосиликатов щелочных и щелочноземельных металлов
Автор: Груба Оксана Николаевна, Германюк Нина Васильевна, Рябухин Александр Григорьевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия твёрдого тела
Статья в выпуске: 1 (260), 2012 года.
Бесплатный доступ
С использованием модели эффективных ионных радиусов, принципа метаморфозы кристаллических структур в квазикубические и авторской методики расчета энтальпии кристаллической решетки впервые рассчитана стандартная энтальпия образования газообразного аниона SiO 2- 3, составившая 715,648 ± 0,067 кДж-моль -1. В качестве исходных данных для расчетов использованы справочные сведения о рентгеновских и термодинамических (стандартные энтальпии образования) характеристиках метасиликатов щелочных Na, K и щелочноземельных Ca, Sr, Ba металлов, а также ортосиликатов Ca, Sr, Ba. Для метасиликатов Rb, Cs, Fr, Ra и ортосилика тов Ra сделаны предсказательные вычисления энтальпий межструктурных взаимодействий, энтальпий кристаллических решеток и стандартных энтальпий образования кристаллических соединений.
Ортосиликаты, метасиликаты, силикат-ион, щелочные металлы, щелочноземельные металлы, стандартная энтальпия образования
Короткий адрес: https://sciup.org/147160217
IDR: 147160217 | УДК: 548.3+548.314+348.314.5+536.75
Текст научной статьи Взаимосвязь структурных и энтальпийных характеристик мета- и ортосиликатов щелочных и щелочноземельных металлов
Мантия Земли основана на изверженных силикатных (базальты ~50 % SiO 2 ) и алюмосиликатных (граниты ~70 % SiO 2 , ~15 % Al 2 O 3 ), породах, содержащих их различные минералы, продукты превращений, разрушений до осадочных пород. Это главные источники рудных масс.
Силикаты кристаллизуются во всех семи сингониях в разнообразных структурах. Поэтому возникла необходимость расчета минимального радиуса SiO 2 - как основной анионной структурной единицы. Хотя газообразный силикат-ион – редкость в обычных условиях, но он и его свойства являются ключевым и связующим звеном в цепочке расчетов авторской модели: близкие значения A f H ° ( siO 2 - , г ) , полученные для однотипных силикатов щелочных и щелочноземельных металлов, кристаллизующихся в одинаковых структурах, подтверждают адекватность модели в целом. Проведение подобных расчетов стало возможным в результате использования моделей эффективных ионных радиусов [1] и метаморфозы кристаллических структур в квази-кубическую [2], что показано в работе [3]. Полученные результаты открыли возможность решения интересной и актуальной задачи – расчетов ряда энтальпийных характеристик (энтальпии межструктурного электромагнитного взаимодействия, энтальпии кристаллической решетки, стандартных энтальпий образования (СЭО) веществ и их составляющих) экспериментальное определение которых или затруднено, или невозможно. В свое время это уже было показано на примерах вычислений СЭО 24 однозарядных простых и сложных анионов халькогенов, первого и второго сродства к электрону, уточнений третьего и четвертого потенциалов ионизации редкоземельных металлов и Th–Pu [1]. В соответствии с моделью [1] были выполнены расчеты энтальпии кристаллической решетки для веществ, кристаллизующихся в различных вариантах кубической сингонии. Следующая задача, которая может быть решена – установление взаимосвязи структурных и термических характеристик в веществах, кристаллизующихся в других сингониях.
Результаты расчетов и их обсуждение
По определению энтальпия (разрушения) кристаллической решетки
A р Н ( К y A z ) = y A f H ° ( К z + , г ) + z A f H ° ( A y - , г ) -A f H ° ( К y A z , к ) . (1)
С другой стороны, в соответствии с моделью [1]
А р Н ( К y A z ) = A H о + A H вз . (2)
Здесь АН о = 114,174 z к z а f — энтальпия нуля отсчета, АН вз = 103,7074 А м z к z а Kf 2 Гр1 — энтальпия электромагнитного взаимодействия. Числовые коэффициенты (кДж·моль–1) представляют собой комбинацию фундаментальных физических констант [1]; z К , z А – формальные заряды катиона и аниона соответственно (степень окисления с учетом числа частиц) ; АМ – число Маделунга конечной структуры (квазикубической); K – координационное число катиона; f 1 и f 2 – функции структуры, представляющие собой комбинацию структурных констант исходной ( f исх , «память») и конечной ( f кк , квазикуба) структур; rр – межструктурное расстояние в ячейке квазикуба. Математический аппарат модели, по сути, сводится к совместному решению уравнений (1) и (2). Проиллюстрируем применение модели.
Энтальпийные характеристики метасиликатов щелочных металлов Ме 2 SiO 3 . Силикаты щелочных металлов кристаллизуются в ромбической (Р) сингонии. Исходные данные:
z К = z Me + • n Me + = 1 2 2- z А = z SiO2 - * n SiO2 - 2 1 2'
АМ = АМ (CaF 2 *) = 1,259695; K =6;
f 1 = f p f кк = 73^22- = 1,224745 ** , f 2 = f прим
+ fK = 1 + кк
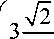
I 2
= 2,5;
А Н 0 = 114,174 * (12 • 2) • (22 * 1) • 1,224745 = 1118,672;
А Н3 = 103,7074 • 1,259695 • 2 • 2 • 6 • 2,5 r - 1 = 7838,3815 r „-1.
вз рр
Тогда окончательно уравнение (2) для соединений типа Me2SiO3 будет выглядеть следующим образом:
А рН = 1118,672 + 7838,3815 rp1.(3)
Для метасиликатов щелочных металлов уравнение (1) примет вид:
А рН (Ме2SiO3 ) = 2 А fH ° (Me+, г)+ А fH ° (siO2-, г )-А fH ° (Ме2SiO3, к).(4)
Решим это уравнение относительно неизвестной величины А f H ° ( siO 2 - , г ) :
АfH° (SiO2-, г)=АрН (Ме2SiO3) - 2 АfH° (Me+, г) + АfH° (Ме2SiO3, к).(5)
Тогда, для метасиликата калия K 2 SiO 3
А fH ° ( SiO 2 - , г ) =А рН ( K2SiO3 ) - 2 А fH ° ( K+, г ) + А fH ° ( K2SiO3, к ) .
Или, используя уравнение (3)
А fH ° ( SiO 2 - , г ) = (1118,672 + 7838,3815 r p -1) - 2 А fH ° ( K + , г ) + А fH ° ( K2SiO3, к ) .
После подставки в уравнение известных справочных данных по K2SiO3 (rр = 3,53796 Å [1]; АfH° (K+, г) = 514,007 Дж молы К [4]; АfH° (K2SiO3, к) = 1590,338 Дж молы К [5]) получим АfH° (SiO2-, г) = 715,831 Дж7молыК. Аналогичные вычисления по данным для метасиликата натрия Na2SiO3 дают значение АfH° (SiO2 , г) = 715,619 Дж/молыК. Средняя величина стандартной энтальпии образования газообразного силикат-иона по результатам двух расчетов составляет 715,725±0,106 Дж/моль·К.
Хорошая согласованность величины A f H ° ( siO 2 - , г ) позволяет использовать ее для других расчетов. В справочной литературе не найдены значения A f H ° ( Ме2SiO з , к ) для метасиликатов рубидия, цезия и франция. Поэтому уравнение (4) для этих соединений решается относительно A fH ° ( Ме2SiO3, к ) :
A fH ° ( Ме2SiO3, к ) = 2 A fH ° ( Me+, г ) + A fH ° ( SiO 2 - , г ) - A рН ( Ме^Ю3 )
с использованием полученного ранее среднего значения A f H ° ( S1O 3 , г ) .
Исходные данные и результаты некоторых расчетов представлены в табл. 1.
Таблица 1
Энтальпийные характеристики метасиликатов щелочных металлов Me 2 SiO 3
|
Ме r (Me+), [1] |
r rр , [1] |
A f H °(Me+, г ), [4] |
- A H °(Me2SiO 3, к ), [5] - A f H °(Me2SiO 3, к ), ур. (4) |
A р Н , ур. (3) |
A f H °(SiO 3 2 - , г ), ур. (5) |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
Na 0,94880 |
3,29400 |
609,542 |
1563,561±5,021 1563,453 |
3498,264 |
715,619 |
|
K 1,33053 |
3,53796 |
514,007 |
1590,338±5,021 1590,444 |
333,183 |
715,831 |
|
Rb 1,48148 |
3,65655 |
490,129 |
– 1566,345 |
3262,328 |
(715,725±0,106) |
|
Cs 1,68161 |
3,82375 |
458,402 |
– 1535,060 |
3168,589 |
(715,725±0,106) |
|
Fr 1,71438 |
3,85194 |
455,235 |
– 1527,395 |
3153,590 |
(715,725±0,106) |
Таким образом, с использованием модели расчета энтальпии кристаллической решетки [1] впервые определена стандартная энтальпия образования частицы SiO 2 - в газообразном состоянии. Вычислены энтальпии электромагнитного взаимодействия A H вз и энтальпии кристаллических решеток A р Н метасиликатов щелочных металлов. Для соединений Me2SiO3, где Ме - это Rb, Cs и Fr, полученные значения A H вз, A р Н и A f H ° ( Ме2SiO3, к ) имеют предсказательный характер.
Энтальпийные характеристики метасиликатов щелочноземельных металлов МеSiO 3 . Метасиликаты щелочноземельных металлов кристаллизуются в различных сингониях. Для исследования выбрана одна из структур моноклинной сингонии, для которой в справочной литературе приведены наиболее полные данные. Методика расчетов необходимых структурных характеристик силикатов подробно изложена в [3]. В расчетах были использованы следующие констан-333
ты: структурная постоянная а =---= 0,487139; за базовую структуру при определении де- баевского радиуса экранирования принята структура сфалерита rD = rD (ZnS) = 17,418081 [1], тогда окончательно дебаевский радиус экранирования rD = 19,051525; функция заряда f (z) = (1 + ^2 • 2 -1) = 2,732051; структурная функция f (c) =
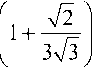
• 2 ( V2 - 1 ) = 0,396631.
Результаты вычислений межструктурных расстояний rр этих силикатов представлены в табл. 2 (колонка 2).
Таблица 2
Энтальпийные характеристики метасиликатов щелочноземельных металлов MeSiO 3
|
Ме r (Me2+), [1] |
rр , [3] |
A H °(Me2+, г ), [6] |
- A H °(MeSiO 3, к ), [6] - A H °(MeSiO 3, к ), ур. (7) |
A p H , ур. (6) |
A H °( 5 iO 2 - , г ), ур. (7) |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
Сa 1,01202 |
3,39721 |
1919,167± ±0,837 |
1633,559±1,674 1633,512 |
4268,282 |
715,556 |
|
Sr 1,15779 |
3,47351 |
1780,677± ±2,092 |
1666,613±2,052 1666,660 |
4162,940 |
715,650 |
|
Ba 1,36361 |
3,61074 |
1653,140± ±1,255 |
1615,948±2,636 1615,948 |
3984,691 |
715,603 |
|
Ra 1,38269 |
3,62467 |
1521,023± ±8,368 |
– 1630,715 |
3967,341 |
(715,603±0,030) |
Для метасиликатов щелочноземельных металлов характерны следующие исходные данные. zК = zА = 2;
А М = А М (CaF 2 ) = 1,259695; K = 6;
f i = Л Л к = • т= 0,288675, f 2 = f ‘ f « = 3V3 • 1 = 5,196152.
1 мкк 2 мкк
Слагаемые уравнения (2) после подстановки:
A H 0 = - 114,174 • (22 • I) • (22 • I) • 0,288675 = -527,347;
AH, = 103,7074 • 1,259695 • 2 • 2 • 6 • 5,196152 rn-1 = 16291,770 r„-1. вз рр
Окончательно уравнение (2) для МеSiO 3 (Ме – щелочноземельные металлы) выглядит:
AрН = -527,347 +16291,770 r-1.(6)
Уравнение (1) применительно к метасиликатам щелочноземельных металлов примет вид:
AрН(МеSiO3)= AfH0(Me2+, г)+ AfH0(SiO32-,г)-AfH0(МеSiO3, к).(7)
С помощью уравнений (6) и (7), используя справочные данные, может быть рассчитана стандартная энтальпия образования СЭО газообразного силикат-иона A f H ° ( siO 2 - , г ) .
Необходимые исходные данные и результаты расчетов по метасиликатам кальция, стронция и бария помещены в табл. 2. По результатам трех вычислении среднее значение A f H ° ( SiO 2 - , г ) составило 715,603±0,030, что хорошо согласуется с величиной, полученной ранее для метасиликатов щелочных металлов (см. табл. 1). Обратным ходом расчета с использованием среднего значения A f H ° ( siO 2 - , г ) получены предсказательные значения СЭО кристаллического метасиликата радия.
Энтальпийные характеристики ортосиликатов щелочноземельных металлов Ме 2 SiO 4 (2МеО·SiO 2 ). Ортосиликаты щелочноземельных металлов кристаллизуются в ромбической сингонии (структура K2SO4, Pnam - 4). Структурные характеристики, необходимые при определении термических констант, получены по методике, изложенной в работе [3]. При проведении 333
расчетов использованы следующие константы. Структурная постоянная а = а р а кк = 8 • —--
= 0,487139. Дебаевский радиус экранирования r D = r°D f ( z ) f ( c )= 14,892723. При этом в качестве базовой принята структура флюорита r°D = r D (CaF2) = 15,418081, что следует из общей формулы К2А. Функция заряда f ( z ) = ( 1 + z К z А - 1 ) = ( 1 + 2 • 2 - 1 ) = 2,732051. Структурная функция f ( c ) = fpf^ = — • ^^ = 0,3535534. Результаты вычислений межструктурных расстояний r 83
ортосиликатов щелочноземельных металлов представлены в табл. 3 (колонка 2).
Таблица 3
Энтальпийные характеристики ортосиликатов щелочноземельных металлов Me 2 SiO 4
|
Ме r (Me2+), [1] |
r р , [3] |
A. / /«Me + г ), [6] |
- A H °(Me2SiO 4, к ), [6] - A H °(Me2SiO 4, к ), ур. (9) |
A р Н, ур. (8) |
A H °( A iO 2 - , г ), ур. (9) |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
Сa 1,01202 |
3,56726 |
1919,167± ±0,837 |
2316,681±4,184 2316,917 |
7939,979 |
715,836 |
|
Sr 1,15779 |
3,61209 |
1780,677± ±2,092 |
2421,156±2,510 2421,143 |
7767,242 |
715,479 |
|
Ba 1,36361 |
3,72040 |
1653,140± ±1,255 |
2275,678±4,602 2276,042 |
7367,054 |
715,968 |
|
Ra 1,38269 |
3,73223 |
1521,023± ±8,368 |
– 2297,974 |
7324,752 |
(715,617±0,236) |
Исходные данные для ортосиликатов щелочноземельных металлов: z К = z А = 2;
АМ = АМ (CaF 2 ) = 1,259695; K = 6;
кк
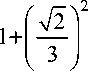
- 1
( SA 1 8
1+- —= 7,917947.
I 9 ) з7з
• 2 = 1,636364, f = f ‘ f ^ = f ‘ f'
2 p кк p тетр
Слагаемые уравнения (2) после подстановки исходных данных:
AH 0 = - 114,174 • (22 • 2) • (22 • 1) • 1,636364 = --978,-67;
A H, = 103,7074 • 1,2-969- • 2 • 2 • 2 • 1 • 6 • 7,917947 r - 1 = 496-1,106 r - 1. вз р р
Окончательно уравнение (2) для Ме 2 SiO 4 (Ме – щелочноземельные металлы):
A pH = - -978,-67 + 496-1,106 r A (8)
Уравнение (1) для ортосиликатов щелочноземельных металлов примет вид:
A pH ( Ме2SiO4 ) = 2 A fH ° ( Me2 + , г ) + A fH ° ( SiO32 - , г ) + A fH ° ( O2 - , г ) - A fH ° ( Ме2SiO4, к ) . (9)
Порядок расчетов рассмотрим на примере Са 2 SiO 4 . Для него r р = 3,56726;
A fH ° ( Са2 + , г ) = 1919,167 [6]; A fH ° ( Са2SiO4, к ) = -2316,681 [6]; A fH ° ( O2 - , г ) = 1069,128 [1].
По уравнению (8) вычислим энтальпию кристаллической решетки:
A pH = - -978,-67 + 496-1,106 • 3,-6726 = 7939,979.
Решим уравнение (9) относительно A f H ° ( S1O 3 , г ) :
A fH ° ( SiO 2 - , г ) =A рН ( Са2SiO4 ) - 2 A fH ° ( Са2 + , г ) - A fH ° ( о2 - , г ) + A fH ° ( Са2SiO4, к ) =
= 7939,979 – 2·1919,167 – 1069,128 – 2316,681 = 715,836.
Аналогичные расчеты проведены для ортосиликатов стронция и бария. Справочные данные и результаты расчетов приведены в табл. 3. По данным колонки 6 получено среднее значение стандартной энтальпии газообразного силикат-иона A f H ° ( siO 2 - , г ) = 71-,617±0,236.
Таким образом, результаты расчетов энтальпийных характеристик ортосиликатов щелочноземельных металлов (см. табл. 3) обнаруживают хорошее согласие величины СЭО силикат-иона в газообразном состоянии с данными, полученными для метасиликатов щелочных и щелочноземельных металлов (см. табл. 1, 2).
Заключение
-
1. Использование уравнений трех моделей: эффективных ионных радиусов, метаморфозы кристаллических структур в квазикубическую и энтальпии кристаллической решетки – позволило впервые рассчитать энтальпийные характеристики метасиликатов щелочных и щелочнозе-
- мельных металлов, ортосиликатов щелочноземельных металлов. Расчеты проведены, опираясь на сведения справочных (академических) изданий по термодинамическим константам и рентгеновским данным по сингониям и структурам веществ.
-
2. По данным для восьми рассмотренных соединений вычислена стандартная энтальпия образования газообразного силикат-иона A f H ° ( siO 2 - , г ) , составившая 715,648±0,067 кДж/моль^К. Это подтверждает предположение о том, что основная анионная составляющая в силикатах находится в форме SiO 2 - .
-
3. Комплексная модель обладает предсказательностью, что позволило вычислить энтальпийные характеристики (энтальпии электромагнитного взаимодействия и энтальпии разрушения кристаллической решетки) и стандартные энтальпии образования метасиликатов рубидия, цезия, франция и радия, а так же ортосиликата радия.
Список литературы Взаимосвязь структурных и энтальпийных характеристик мета- и ортосиликатов щелочных и щелочноземельных металлов
- Рябухин, А.Г. Эффективные ионные радиусы. Энтальпия кристаллической решетки. Энтальпия гидратации ионов: моногр./А.Г. Рябухин. -Челябинск: Изд-во ЮУрГУ, 2000. -115 с.
- Рябухин, А.Г. Математическая модель метаморфизма кристаллических структур в кубическую/А.Г. Рябухин//Вестник ЮУрГУ. Серия «Металлургия». -2007. -Вып. 9. -№ 21(93) -С. 3-6.
- Груба, О.Н. Структурные фрагменты силикатов на основе sp-элементов/О.Н. Груба, Н.В. Германюк, А.Г. Рябухин//Вестник ЮУрГУ. Серия «Химия». -2010. -Вып. 4. -№ 31(207). -С. 90-96.
- Термодинамические свойства индивидуальных веществ: справ. изд. в 4 т./под ред. В.П. Глушко. -М.: Наука, 1982. -Т. IV, кн. 2. -559 с.
- Термические константы веществ: справ: в 10 вып./под ред. В.П. Глушко. -М.: ВИНИТИ АН СССР, 1978. -Вып. 8. -Ч. I. -527 с.
- Термические константы веществ: спр. в 10 вып./под ред. В.П. Глушко. -М.: ВИНИТИ АН СССР, 1979. -Вып. 9. -Ч. I. -574 с.
- Справочник химика/под ред. Б.П. Никольского. -Л.: Химия. -1971. -Т. 1. -1071 с.


