Взаимосвязь уровней воспалительных цитокинов крови и числа циркулирующих опухолевых клеток с ответом на стандартную химиотерапию у больных раком яичников
Автор: Генинг Снежанна Олеговна, Ризванов Альберт Анатольевич, Абакумова Татьяна Владимировна, Долгова Динара Ришатовна, Гафурбаева Дина Урхановна, Рахматуллина Айгуль Римхатовна, Антонеева Инна Ивановна, Генинг Татьяна Петровна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.20, 2021 года.
Бесплатный доступ
Введение. Сывороточные хемокины - медиаторы воспаления, роль которых доказана в возникновении и прогрессировании злокачественных опухолей ряда локализаций. Продуцируясь лейкоцитами, стволовыми, опухолевыми и эндотелиальными клетками, хемокины контролируют их движение и позиционирование. Хроническое воспаление лежит в основе прогрессирования рака яичников (РЯ), и это повышает вероятность стимулирования или блокирования хемокинами прогрессирования опухоли. Целью исследования было изучение взаимосвязи уровней воспалительных цитокинов крови и числа циркулирующих опухолевых клеток (ЦОК) с ответом на стандартную химиотерапию у больных РЯ. Материал и методы. У пациенток с первичным РЯ до и после 2-4 курсов химиотерапии (ХТ) и пациенток с доброкачественными опухолями яичников (контроль) в сыворотке крови уровни CCL2, CCL3, CCL4, CXCL8 и CX3CL1 оценивали методом мультиплексного анализа xMAP. Количество ЦОК (популяция CD45-/ Epcam+/CK+) определяли на проточном цитометре. Пациентки с РЯ были разделены на 3 группы по критерию платиночувствительности согласно GCJG 4th, было определено время до прогрессирования (PFi). Результаты. Установлено, что уровень CCL2, CCL3, CCL4, CXCL8 и CX3CL1 при РЯ значимо не отличался от такового в контроле, отрицательно коррелировал с возрастом (за исключением уровня CCL2). Химиотерапия значимо повышала уровень CCL2 в группе рефрактерного РЯ; CCL3 - в группе чувствительного РЯ, CCL4 - в группах резистентного и чувствительного РЯ, CXCL8 -повышала в группах с резистентным и чувствительным РЯ и снижала в группе рефрактерного РЯ. Количество ЦОК у больных с РЯ значимо выше, чем в контроле. После ХТ снижение количества ЦОК достоверно коррелировало со снижением уровня CX3CL1 в группах рефрактерного и чувствительного РЯ. Максимальная продолжительность периода без прогрессирования отмечена при повышении уровней CCL3, CXCL8, снижении уровня CCL4 и неизменном уровне CX3CL1. Выводы. Уровни CCL2, CCL3, CCL4 и iL-8 значимо не различаются у больных РЯ и группы контроля. Уровни изученных хе-мокинов и количество ЦОК изменялись в группах с различной чувствительностью опухоли к ХТ. При платиночувствительном РЯ наблюдаются значимые корреляции количества ЦОК и уровня CX3CL1 в сыворотке крови до лечения.
Рак яичников, циркулирующие опухолевые клетки, химиотерапия, платинорезистентность
Короткий адрес: https://sciup.org/140254416
IDR: 140254416 | УДК: 618.11-006.6-092.18-08:615.28]:577.21 | DOI: 10.21294/1814-4861-2021-20-1-62-73
Текст научной статьи Взаимосвязь уровней воспалительных цитокинов крови и числа циркулирующих опухолевых клеток с ответом на стандартную химиотерапию у больных раком яичников
Рак яичников (РЯ) является высоко летальным злокачественным новообразованием вследствие отсутствия специфических симптомов и биомаркеров для своевременной диагностики. Хроническое воспаление лежит в основе прогрессирования РЯ, и это повышает вероятность того, что хемокины, участвующие в воспалительном процессе, могут стимулировать или блокировать прогрессирование опухоли. Растворимые воспалительные медиаторы участвуют в возникновении и прогрессировании злокачественных опухолей ряда локализаций [1]. При этом не только воспаление вызывает рак, но и рак вызывает воспаление, поскольку опухоль продуцирует de novo медиаторы воспаления, хемокины и их рецепторы. В основе воспалительных реакций, вызываемых опухолью, лежит ряд механизмов. В первую очередь это выделение опухолевыми и стромальными клетками хемоаттрактантов, которые привлекают макрофаги и нейтрофилы [2]. Эти клетки продуцируют хемо-кины, усиливающие воспалительный ответ. Хемо-кины – это группа небольших белков, имеющих свои рецепторы на клеточной мембране, которые контролируют движение и позиционирование лейкоцитов, стволовых и эндотелиальных клеток. Хемокины делят на группы: С, СС, СХС и СХ3С. При этом хемокиновые лиганды могут связываться с несколькими различными хемокиновыми рецепторами. Согласно современным представлениям, система хемокинов – жестко регулируемая сложная система с временным и пространственным контролем. Экспрессия хемокинов опухолевыми клетками яичников контролируется на уровне регуляции транскрипции, посттранскрипционной регуляции и регуляции стабильности мРНК, трансляции мРНК и механизмов, регулирующих внутриклеточное хранение, высвобождение и транспорт цитокинов [3]. CC-хемокины представляют основные аттрактанты предшественников моноцитов и макрофагов к микроокружению опухоли. Хемокины этого семейства синтезируются моноцитами/макрофа-гами, нейтрофилами, дендритными клетками и лимфоцитами. Праймированные воздействием опухолевых клеток NK-клетки продуцируют высокие уровни CCL3 и CCL4, которые в дальнейшем способствуют привлечению иммунных эффекторов в опухоль [4]. Секреция опухолевыми клетками СС-хемокинов, особенно CCL2, способствует росту и распространению опухоли [5]. Исследования с участием хемокинов in vitro и in vivo идентифицировали CCL3 в качестве основного медиатора, связывающего неопластический эпителий и периферические ткани [5]. CCL3 и CCL4 также принадлежат к семейству СС-хемокинов. Пристальное внимание исследователей привлекает CCL5 – представитель этого же семейства. Существует мнение, что CCL5 является протуморогенным хемокином, однако роль его и его рецепторов при РЯ не представляется определенной [6]. Внутрибрюшинные метастазы являются частым явлением и связаны с плохим прогнозом при РЯ. Их образование предполагает, что в брюшной полости секретируются факторы, направляющие метастатические опухолевые клетки яичника в соответствующие ниши для формирования метастазов. Показано, что CXCL-8 является ключевым хемокином в метастатическом распространении опухолевых клеток яичников в брюшной полости [7]. CXCL8/ IL-8 секретируются многими типами клеток после их стимуляции: эндотелиальными клетками, Т-лимфоцитами, макрофагами, опухолевыми клетками. Особенностью экспрессии гена CXCL8 является ее быстрая активация. CXCL8 реализует своё действие, связываясь с рецепторами CXCR1 и CXCR2. При действии CXCL8 на нейтрофилы in vitro повышается уровень внутриклеточного Ca2+, высвобождаются азурофильные и содержащие матриксную металлопротеиназу (ММП)-9 гранулы, происходит респираторный взрыв, изменяется форма нейтрофилов [8]. Действуя на рецепторы CXCR2 на мезенхимальных стволовых клетках, CXCL-8 увеличивает уровень их миграции и за- пускает в них синтез и секрецию проангиогенных факторов, в том числе васкулоэндотелиальный фактор роста [9]. Fractalkine/CX3CL1 – единственный член подкласса CX3C хемокинов, который имеет растворимую и мембраносвязанную форму. Экспрессируется в месте воспаления, привлекает и активирует NK-клетки, что приводит в дальнейшем к лизису соседних эндотелиальных клеток. Помимо NK-клеток, CX3CL1 проявляет хемотаксическую активность для моноцитов и Т-клеток, действует как молекула адгезии к лейкоцитам и усиливает экстравазацию лейкоцитов. В обзоре F. Marchesi et al. (2010) показана экспрессия CX3CL1 на различных опухолевых клетках, а его рецептор CX3CR может содействовать метастазированию. В то же время показано, что CX3CL1 обладает активностью подавления опухолей на различных моделях подкожной имплантации у мышей. Высокая экспрессия CX3CL1 – маркер лучшего прогноза у больных колоректальным раком [10].
Появляется все больше доказательств того, что экспрессия хемокинов опухолевыми клетками модулирует не только развитие рака, но и чувствительность к химиотерапии (ХТ) [11]. Циркулирующие опухолевые клетки (ЦОК) могут становиться источником будущих метастазов; они проникают в кровеносное русло, где могут находиться в виде единичных клеток и кластеров. В органе-мишени ЦОК могут находиться в состоянии покоя, длительность которого определяется в том числе и свойствами микроокружения. При этом ЦОК не только дают начало отдаленным метастазам, но, самообсеменяя опухоль, инициируют экспансию более агрессивного клона. При ряде локализаций опухоли, в том числе при РЯ, описан феномен эпителиальной пластичности, объясняющий существование различных фенотипов ЦОК, более или менее агрессивных в зависимости от состояния эпителиально-мезенхимального перехода и наличия стволовых признаков [12]. В кровотоке и микроокружении опухоли ЦОК взаимодействуют с хемокинами – основными участниками в процессе хемотаксиса, обеспечивающего ангиогенез, инвазию метастазирование и уклонение опухоли от контроля иммунной системы.
Цель исследования – изучение взаимосвязи уровней воспалительных цитокинов крови и числа ЦОК с ответом на стандартную химиотерапию (ХТ) у больных РЯ.
Материал и методы
В исследование включены 46 пациенток с первичным верифицированным РЯ I–IV стадии по FIGO в возрасте 50–70 лет (медиана – 62 года), проходивших лечение в гинекологическом отделении Областного клинического онкологического диспансера г. Ульяновска в 2018–19 гг. (табл. 1). Критериями включения в исследование были:
Таблица 1/table 1
clinical characteristics of ovarian cancer patients
|
Клиническая характеристика/Clinical characteristics |
Число пациенток/Number of patients |
|
Возраст/Age |
|
|
Репродуктивный период/Reproductive period |
6 |
|
Постменопауза/Postmenopause |
40 |
|
Стадия FIGO/FIGO stage |
|
|
I II |
4 2 |
|
III |
29 |
|
IV |
11 |
|
Стадия T/Stage T |
|
|
T1 |
4 |
|
T2 |
2 |
|
T3 |
40 |
|
Стадия N/Stage N |
|
|
Nx |
16 |
|
N0 |
11 |
|
N1 |
19 |
|
Стадия M/Stage M |
|
|
M0 |
36 |
|
M1 |
10 |
|
Гистологический подтип/Histological subtype |
|
|
Серозный/Serous |
20 |
|
Муцинозный/Mucinous |
3 |
|
Эндометриоидный/Endometrioid |
2 |
|
Светлоклеточный/Clear cell |
3 |
|
Недифференцированный/Undifferentiated |
3 |
|
Не определялся из-за CRS 3/Not determined due to CRS 3 |
3 |
|
Не получен гистоанализ (цитологическая верификация)/ Histological analysis |
12 |
|
not obtained (cytological verification) |
|
|
Режим химиотерапии/Chemotherapy regimen |
|
|
Неоадъювантная химиотерапия/Neoadjuvant chemotherapy |
34 |
|
Адъювантная химиотерапия/Adjuvant chemotherapy |
12 |
|
Циторедуктивная операция/Cytoreductive surgery |
|
|
Проводилась/Was performed |
31 |
|
Не проводилась/Was not performed |
15 |
Клинические характеристики больных раком яичников
отсутствие острых заболеваний любой этиологии, хронических инфекционных заболеваний, отсутствие хирургических вмешательств в предшествующие 12 мес и синхронно развивающихся злокачественных опухолей. В группу сравнения вошли 16 пациенток, получавших хирургическое лечение по поводу доброкачественных опухолей яичников в возрасте 40–60 лет (медиана – 55 лет) без онкологически отягощенного анамнеза. Письменное информированное согласие в соответствии с принципами Хельсинкской декларации (2013 г.) получено от всех участниц исследования. Исследование было одобрено Этическим комитетом ИМЭиФК Ульяновского государственного университета (протокол № 3 от 15.03.2017).
Образцы плазмы крови забирали до получения пациенткой какого-либо специального противоопухолевого лечения и после 2–4 курсов платиносодержащей ХТ по схеме ТР (карбоплатин AUC6 + паклитаксел 175 мг/м2 внутривенно капельно 1 раз в 3 нед) в адъювантном либо неоадъювантном режиме. У пациенток, получавших неоадъювантную терапию, второй забор крови производили до циторедуктивной операции. Решение об использовании режима ХТ принимали исходя из возможности проведения оптимальной циторедукции при первичной диагностике. Контроль эффективности неоадъювантной химиотерапии осуществлялся по клиническим, ультразвуковым параметрам, МРТ малого таза и динамике опухолевого маркера CA-125 в сыворотке крови. Хирургическое лечение включало гистерэктомию с двухсторонней сальпингоофорэктомией и оментэктомией. Получение образцов от контрольной группы производилось однократно до хирургического лечения. Все пациентки с РЯ бы разделены на 3 группы по критерию длительности бесплатинового интервала до прогрессирования болезни в соответствии с рекомендациями GCJG 4th: платинорефрактерный РЯ (прогрессирование во время и менее чем через 4 нед после окончания ХТ; платинорезистентный РЯ (ранний рецидив – менее чем через 6 мес после проведения последнего курса ХТ) и платиночувствительный РЯ (рецидив более чем через 6 мес); было определено время до прогрессирования с момента включения в исследование (progression-free interval – PFI).
В исследовании произведен подсчет количества ЦОК методом проточной цитометрии с использованием тройной флуоресцентной метки на приборе Cytoflex S (Beckman Coulter, США). Из 7,5 мл стабилизированной цитратом натрия крови выделялась мононуклеарная фракция клеток методом центрифугирования на градиенте фиколла (плотность 1,077 см3) [13, 14]. После выделения мононуклеарные клетки дважды отмывались фосфатно-солевым буферным раствором Дуль-бекко (ФСБ-Д). Окрашивание клеток выполняли следующим образом: в 1,5-мл пробирках образцы клеток ресуспендировали в ФСБ-Д с содержанием 1 % фетальной бычьей сыворотки с плотностью 1×106 клеток в 100 мкл. В пробирки с образцами вносили по 5 мкл моноклональных антител к CD45, EpCAM (CD326) (BioLegend, США) и к цитокера-тинам (CK pan) (SigmaAldrich, США), меченных FITC, Pe-Cy7 и PE соответственно, и инкубировали в течение 40 мин при 4 °С в темноте. По истечении времени инкубации в пробирки вносили двойной объем ФСБ-Д с содержанием 1 % фетальной бычьей сыворотки и осаждали клетки центрифугированием 5 мин при 400 g. Супернатант сливали и ресуспендировали клетки в 100 мкл ФСБ-Д для дальнейшего анализа на приборе.
Обработка результатов проводилась с помощью программы CytExpert Software. Анализировали не менее 100 000 событий в секторе живых клеток мононуклеарной фракции. Для разделения лейкоцитарных фракций крови и атипичных клеток нелейкоцитарной природы использовали дискриминацию по уровню связывания с CD45. Отрицательную по данному признаку популяцию использовали для дальнейшего анализа. Подсчет количества ЦОК производили по графику распределения интенсивности связывания антител к EpCAM и СК. За ЦОК была принята популяция CD45-отрицательных, EpCAM и CK-положительных клеток (CD45-/EpCAM+/ CK+) [15].
Хемокиновый профиль сыворотки крови: уровни CCL2, CCL3, CCL4, CXCL8 и CX3CL1 оценивали методом мультиплексного анализа на анализаторе Bioplex®200™ (Bio-Rad) технологии xMap Luminex с использованием набора Milliplex (HCYTMAG-60K-PX41) (Merck KGaA, Germany) в соответствии с инструкцией фирмы-производителя. Оценку нормальности распределения выборки проводили по критерию Шапиро–Уилка. Связь между клиническими и молекулярными параме- трами анализировалась с использованием One-way ANOVA и корреляционных связей по Спирмену, для оценки различий между независимыми группами использовали непараметрический критерий Манна–Уитни. Для оценки различий у больных РЯ до и после ХТ использовали критерий Вилкоксона. Для оценки PFI больных РЯ использовали критерий Каплан–Майера (Statistica 13.0). Статистически значимыми считались значения при р≤0,05.
Результаты
В результате исследования установлено, что сывороточный уровень CCL2, экспрессия которого показана для РЯ [16], значимо не отличается у больных РЯ и пациенток с доброкачественными опухолями яичников до лечения (рис. 1), не коррелирует с возрастом пациенток и с наличием у них асцита. При этом уровень CCL2 в сыворотке значимо повышается после ХТ в группе рефрактерного РЯ и положительно коррелирует с уровнем СА-125 (r=0,638, р<0,05) (табл. 2).
К семейству СС-хемокинов принадлежат также CCL3 и CCL4. В нашем исследовании сывороточный уровень CCL3 при первичной диагностике значимо не отличается от такого при доброкачественных опухолях яичников (рис. 1), не коррелирует с наличием асцита, уровнем СА-125. Уровень CCL3 достоверно повышается после ХТ в группе чувствительного РЯ (табл. 2). Также установлена отрицательная средней силы корреляция уровня CCL3 с возрастом пациентки (r=-0,443, р=0,054).
Сывороточный уровень CCL4 в нашей выборке значимо не отличается при РЯ от такового при доброкачественных опухолях яичников до лечения (рис. 1), достоверно повышается после 3 курсов первой линии платиносодержащей ХТ в группе платинорезистентного и платиночувствительного РЯ (табл. 2), не коррелирует с наличием асцита и уровнем СА-125. Однако уровень этого хемокина в целом отрицательно коррелирует с возрастом (r=-0,491, р=0,032).
Нами установлено, что сывороточный уровень CXCL8 у первичных больных РЯ значимо не отличается от такого при доброкачественных опухолях яичников до лечения (рис. 1), однако на фоне платиносодержащей ХТ уровень CXCL8 значимо снижается в группе с рефрактерным РЯ и достоверно повышается у пациенток с резистентным РЯ и чувствительным РЯ (табл. 2). Уровень CXCL-8 значимо отличается в группах с различной чувствительностью к платиносодержащей ХТ (р=0,020), не коррелирует с наличием асцита, с уровнем CA-125 и отрицательно коррелирует с возрастом (r=-0,625, р=0,016).
Мы наблюдали значимое снижение по сравнению с контролем уровня CX3CL1 до начала ХТ в группе с рефрактерным РЯ (р=0,009); с резистентным РЯ (р=0,005) и в группе с чувствительным РЯ (р=0,014). После ХТ уровень сывороточного CX3CL1 значимо снижается в группе платиночувствительного РЯ (табл. 2). При этом корреляция с возрастом отрицательная (r=-0,604, р=0,015); с СА125 – положительная средней силы (r= 0,479, р=0,023).
Весьма любопытная ситуация с уровнем CX3CL1 у пациенток с асцитом. До ХТ уровень CX3CL1 у пациенток с асцитом значимо выше, чем у больных без асцита (р=0,00047). После
ХТ уровень CX3CL1 у пациенток с асцитом еще возрастает, а у больных без асцита резко падает (р=0,0001).
В нашем исследовании количество ЦОК у пациенток с РЯ было значимо выше, чем у больных с доброкачественными опухолями яичников до лечения (2,5 (04,00)), как до (р=0,001), так и после (р=0,001) 24 курсов платиносодержащей ХТ. При этом разли-
Таблица 2/table 2
Сывороточный уровень хемокинов у больных раком яичников с различной чувствительностью к платиносодержащей химиотерапии
serum chemokine levels in ovarian cancer (oc) patients with different sensitivity to platinum-containing chemotherapy
|
Медиана/Median (LQ-UQ) |
|||
|
Показатели/ Indicators |
Платинорефрактерный РЯ / Platinum-refractory OC (n=10) |
Платинорезистентный РЯ/ Platinum-resistant OC (n=20) |
Платиночувствительный РЯ/ Platinum-sensitive OC (n=16) |
|
До ХТ/ После ХТ/ Before CT After CT |
До ХТ/ После ХТ/ Before CT After CT |
До ХТ/ После ХТ/ Before CT After CT |
|
|
CCL2/MCP-1 |
297,55 487,29 (284,36–397,39) (388,94–522,14) |
332,00 310,84 (246,50–554,75) (91,26–485,00) |
335,13 347,50 (269,33–564,50) (233,16–833,24) |
|
р |
0,038 |
0,490 |
0,780 |
|
CCL3/MIP-1α |
5,42 5,5 (3,32–11,49) (4,36–6,60) |
3,77 4,340 (2,50–6,31) (2,33–19,81) |
4,78 8,55 (2,75–7,30) (6,69–17,21) |
|
р |
0,684 |
0,678 |
0,017 |
|
CCL4/MIP-1β |
32,77 39,72 (31,33–44,50) (30,7941,03) |
22,75 36,25 (4,01–37,75) (24,77–45,55) |
33,50 44,64 (25,75–54,56) (36,31–60,72) |
|
p |
0,911 |
0,016 |
0,050 |
|
CXCL8/IL-8 |
37,17 15,05 (31,61–70,58) (9,50–17,05) |
25,15 45,99 (6,90–42,36) (10,29–110,96) |
17,14 31,02 (11,28–40,51) (27,81–32,25) |
|
р |
0,028 |
0,046 |
0,050 |
|
CX3CL1/ Fractalkine |
57,63 109,11 (8,90–103,93) (70,39–136,99) |
72,14 55,32 (8,41–108,67) (5,66–110,23) |
67,63 34,48 (28,88–92,04) (9,61–54,56) |
|
р |
0,165 |
0,658 |
0,001 |
Примечание: р – различия значимо отличаются по сравнению с показателями до ХТ.
Note: p – statistically significantly different compared with corresponding data before CT.
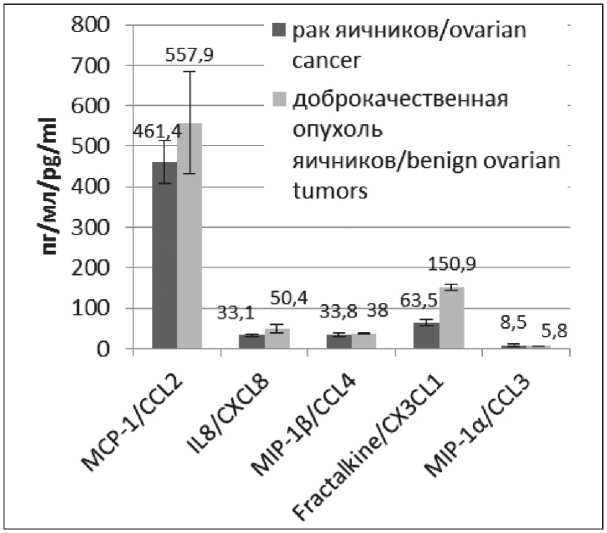
Рис.1. Соотношение хемокинов в группе женщин при РЯ и при доброкачественной опухоли яичников
Fig.1. The ratio of chemokines content in groups of women with ovarian cancer and benign ovarian tumors
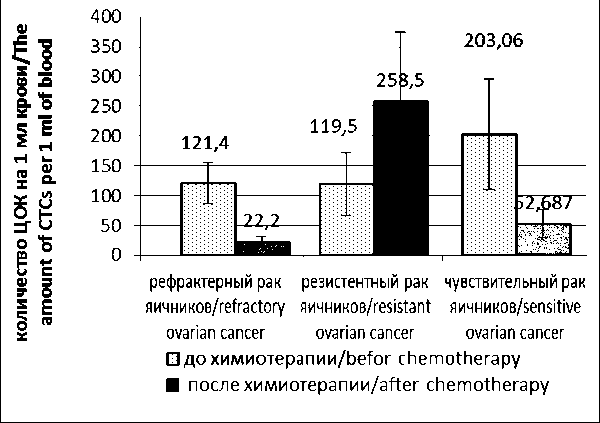
Рис. 2. Количество ЦОК у больных раком яичников с различной чувствительностью к платиносодержащей химиотерапии Fig. 2. The amount of CTCs in patients with ovarian cancer with different sensitivity to platinum-containing chemotherapy
чие в целом в группе пациенток с РЯ до и после ХТ статистически не значимо (р=0,831) (рис. 2).
После ХТ количество ЦОК значимо снижено в группе платинорефрактерного РЯ (р=0,028). У пациенток с платинорезистентным РЯ количество ЦОК после ХТ существенно возрастает (р=0,058), а в группе с платиночувствительным РЯ не изменяется (р=0,791). Однако при построении графика зависимости выживаемости без прогрессирования от динамики числа ЦОК на фоне химиотерапии существенных различий не наблюдалось (рис. 3).
При этом значителные отрицательные корреляционные связи имеют место до ХТ между уровнем ЦОК и CX3CL1 при платиночувствительном РЯ (r=-0,873, р=0,009); уровнем ЦОК и CCL4 при платинорезистентном РЯ (r=-0,728, р=0,011). Положительные корреляционные связи имеют место между уровнем ЦОК и CX3CL1 после ХТ в группах резистентного (r=0,681, р=0,035) и чувствительного (r=0,788, р=0,019) РЯ.
При анализе динамики уровней хемокинов на фоне платиносодержащей ХТ с позиций продолжительности периода до прогрессирования было выявлено, что при повышении уровня CCL3 после 3 курсов ХТ PFI статистически значимо увеличивался и составлял в среднем 315 дней (р=0,046) (рис. 4). Период до прогрессирования при неизменном уровне CX3CL1 на фоне ХТ составлял в среднем 483 дня, что статистически значимо выше, чем при повышении и понижении содержания данного хемокина после 3 курсов ХТ (р=0,047) (рис. 5). Снижение уровня CCL4 было статистически значимо связано с увеличением безрецидивного периода до 348 дней (р=0,037) (рис. 6). При повышении уровня CXCL8 после 3 курсов ХТ период без прогрессирования (PFI) статистически значимо увеличивался и составлял 315 дней (р=0,048) (рис. 7).
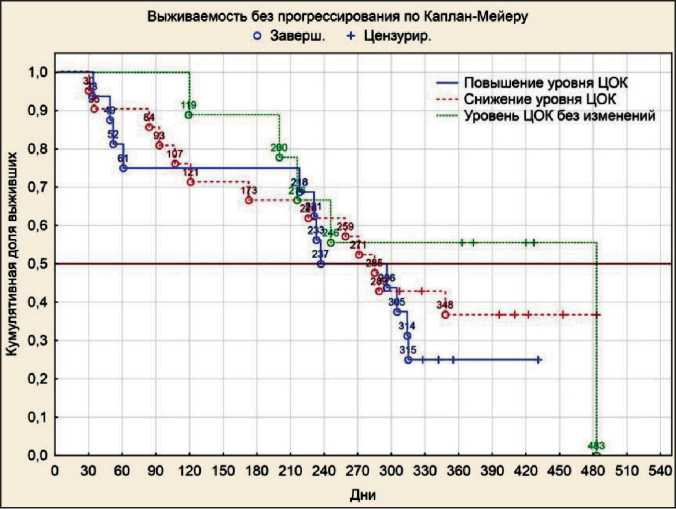
Рис. 3. Время до прогрессирования у больных РЯ после ХТ в зависимости от динамики изменения числа ЦОК
Fig. 3. Time to progression of patients with OC depending on CTC quantity change in repeated samples
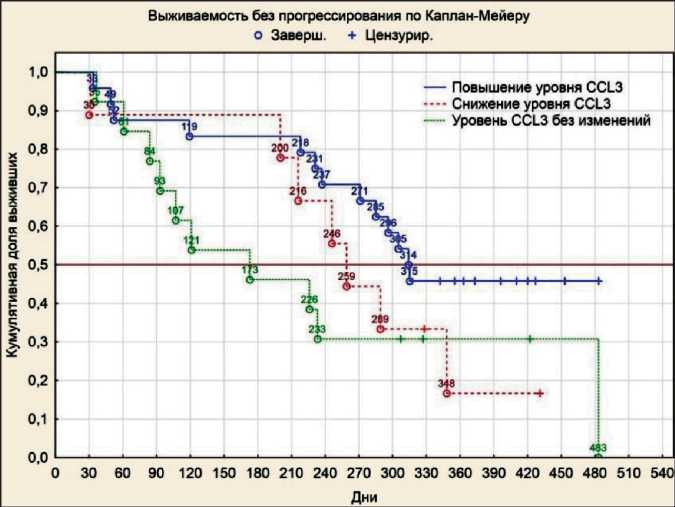
Рис.4. Время до прогрессирования у больных РЯ в зависимости от уровня CCL3
Fig. 4. Time to progression of patients with OC depending on CCL3 level
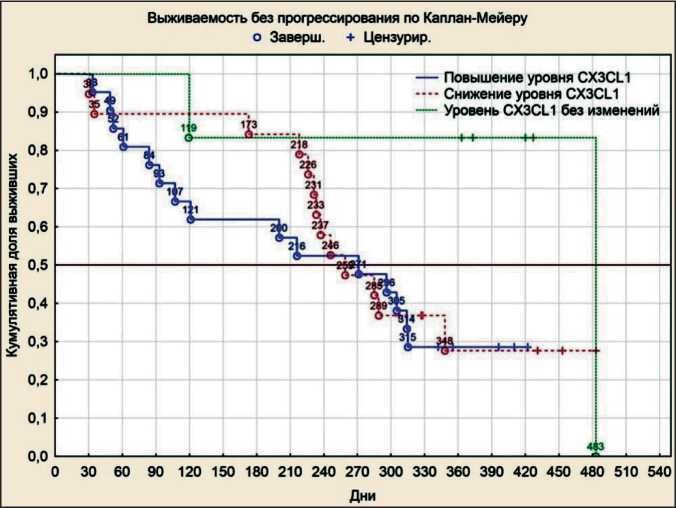
Рис. 5. Время до прогрессирования у больных РЯ в зависимости от уровня CX3CL1
Fig. 5. Time to progression of patients with OC depending on CX3CL1 level
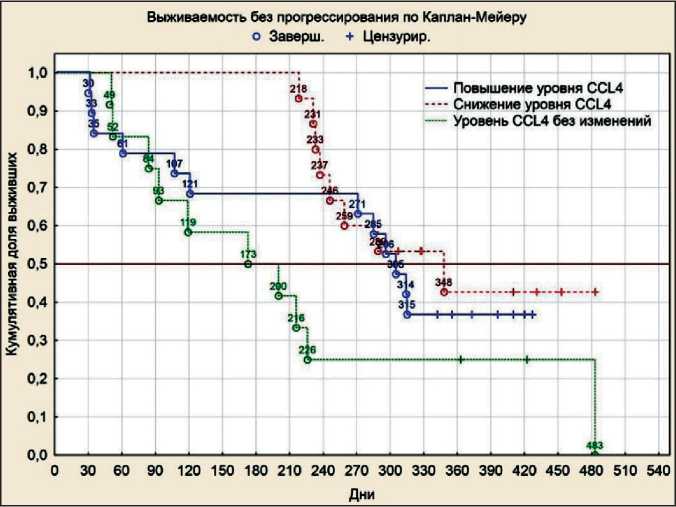
Рис.6. Время до прогрессирования у больных РЯ в зависимости от уровня CCL4
Fig. 6. Time to progression of patients with OC depending on CCL4 level
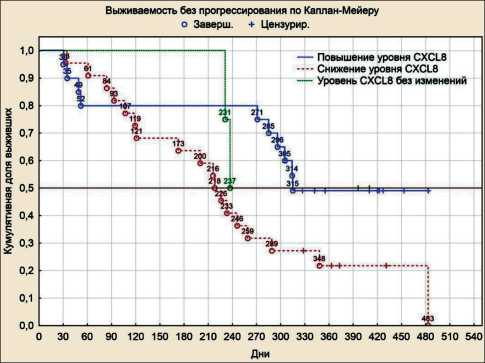
Рис. 7. Время до прогрессирования у больных РЯ в зависимости от уровня CXCL8
Fig. 7. Time to progression of patients with OC depending on CXCL8 level
Обсуждение
Первичное злокачественное новообразование приводит к значительной модификации транс-криптома и протеома, сопровождающей отбор вариантов устойчивой опухоли. Результатом таких модификаций может быть усиление секреции воспалительных хемокинов, в частности CCL2 [17]. Экспрессия CCL2 регулируется посредством ядер-ного фактора NF-kB, индуцируемого гипоксией. Рядом авторов при эпителиальном РЯ обнаружена повышенная экспрессия CCL2 в опухолевых клетках [18]. Существовала точка зрения, что CCL2, определяя инфильтрацию макрофагами опухоли яичников, ингибирует опухолевую прогрессию [19]. Однако более поздние исследования показали, что CCL2 увеличивает инвазивность клеток РЯ и устойчивость к ХТ [20]. Под влиянием хемокинов макрофаги и нейтрофилы в окружении опухоли могут приобретать проопухолевый фенотип и продуцировать собственные хемокины, подавляющие противоопухолевый иммунитет, в том числе CCL2, который выделяют также опухоль-ассоциированные клетки эндотелия [16]. Показано, что CCL2-запускаемый каскад хемокинов в макрофагах способствует метастатическому посеву клеток рака молочной железы [21]. CCL2-ингибирование уменьшало размер опухоли, рост и метастазы в экспериментальных моделях рака молочной железы, легких, предстательной железы, печени и меланомы. В сочетании с химиотерапией, анти-CCL2-антитела улучшали терапевтическую эффективность препаратов [20]. Однако антитела анти-CCL2 показали противоречивые результаты в клинических испытаниях I и II фазы у пациентов с солидными опухолями [22]. Установленное нами повышение уровня CCL2 у больных РЯ после ХТ может объясняться его двухфазным эффектом вовлечения туморассоциированных макрофагов (ТАМ) в опухоль; большие количества CCL2 спо- собствуют привлечению ТАМ с доминирующей противоопухолевой активностью [23]. CCL4 относится к хемокинам, которые продуцируются опухо-льасоциированными нейтрофилами и макрофагами и подавляют противоопухолевый иммунитет, что ассоциируется с неблагоприятным прогнозом заболевания. Хемокины не только привлекают лейкоциты, но также активируют их. Показаны высокие уровни CCL3 и CCL4 в сыворотке крови пациентов с множественной миеломой, которые коррелируют с обширным поражением кости, усиленным ангиогенезом, поздней стадией заболевания и неблагоприятным прогнозом [24]. При РЯ установлено присутствие CCL3 и CCL4 в асцитической жидкости, и их уровни положительно коррелируют со степенью инфильтрации опухоли Т-лимфоцитами [25]. В то же время на мышиных моделях рака показана возможная противоопухолевая роль CCL3 [26]. У пациентов на ранних стадиях рака легкого опухольассоциированные нейтрофилы с противоопухолевой ролью продуцировали CCL2, CCL3, CXCL8, стимулируя пролиферацию Т-клеток [27]. У пациентов с колоректальным раком III–IV стадии при высоком уровне CCL3 и CCL4 в сыворотке крови наблюдается худший прогноз по сравнению с пациентами с низким уровнем CCL3 и CCL4 [28]. Снижение уровня сывороточного CCL4 по сравнению с контролем и корреляция его с СА-125 выявлены у пациентов с эпителиальным РЯ [29].
CXCL8/IL-8 известен как хемокин, который секретируют опухолевые клетки, влияющий на опухолевый ангиогенез и вызывающий хемотаксис опухолевых клеток. В эксперименте in vivo было показано, что циркулирующие опухолевые клетки меланомы продуцировали высокие уровни CXCL-8, привлекая нейтрофилы. Последние же регулировали возникновение и развитие метастазов, способствуя сцеплению ЦОК с эндотелием сосудов [30]. Возможно, снижение уровня CXCL-8 после ХТ в группе рефрактерного РЯ может быть связано с соответствующим снижением уровня ЦОК. В эксперименте на культуре клеток РЯ было показано, что CXCL-8 индуцирует эпителиальномезенхимальный переход и усиливает метастатический потенциал [31]. Было установлено, что повышенный его уровень в сыворотке больных РЯ IIIc стадии связан с худшим прогнозом [11].
Сообщения о клинической роли CX3CL1 при злокачественных опухолях противоречивы. У него двойная функция: хемоаттрактант лейкоцитов и молекула адгезии опухолевых клеток, и его эффекты могут быть как про- [32], так и противоопухолевыми [33]. Клетки РЯ экспрессируют как CX3CL1, так и его рецептор CX3CR1. Хемотаксис на основе этих рецепторов повышал экспрессию маркеров эпителиально-мезенхимального перехода и ММП [34]. CX3CL1 через лиганд CX3CR1 регулирует органспецифическую брюшинную колонизацию опухолевыми клетками при РЯ [35]. Эпителиальные клетки поверхности яичника, маточных труб, доброкачественных пограничных и злокачественных опухолей яичника – все экспрессируют CX3CL1. При РЯ выявлено 2 кластера различных по экспрессии (иммуногистохимической) CX3CL1 и пролиферативной активности клеток [36]. CX3CL1 высоко экспрессируется в ЦНС, где регулирует связь между нейронами, глией и микроглией. При этом роль периферических нервов в канцерогенезе различных опухолей очевидна, но малоизучена [37]. Показано, что опухоли неврального происхождения, равно как и злокачественные клетки других эпителиальных раков (рак молочной железы, поджелудочной железы, предстательной железы), имеют высокий уровень рецептора CX3CR1 [16].
Мультиплексный анализ сывороточных хе-мокинов показал, что одно измерение CX3CL1 имеет хорошую трехлетнюю воспроизводимость и может быть использовано в качестве биомаркера [38]. Данные литературы о взаимосвязи уровня хемокинов, экспрессии рецепторов хемокинов и количестве ЦОК немногочисленны и достаточно фрагментарны. Повышенные концентрации CX3CL1 и наличие ЦОК при раке молочной железы предсказывают неблагоприятный исход [39], при колоректальном раке повышение уровня этого
Список литературы Взаимосвязь уровней воспалительных цитокинов крови и числа циркулирующих опухолевых клеток с ответом на стандартную химиотерапию у больных раком яичников
- Lund A.W., Medler T.R., Leachman S.A., Coussens L.M. Lymphatic Vessels, Inflammation, and Immunity in Skin Cancer. Cancer Discov. 2016; 6(1): 22-35. https://doi.org/10.1158/2159-8290.CD-15-0023.
- Bonavita E., Galdiero M.R., Jaillon S., Mantovani A. Phagocytes as Corrupted Policemen in Cancer-Related Inflammation. Adv Cancer Res. 2015; 128: 141-71. https://doi.org/10.1016/bs.acr.2015.04.013.
- Singha B., Gatla H.R., Vancurova I. Transcriptional regulation of chemokine expression in ovarian cancer. Biomolecules. 2015 Mar 17; 5(1): 223-43. https://doi.org/10.3390/biom5010223.
- Wong J.L., Berk E., Edwards R.P., Kalinski P. IL-18-primed helper NK cells collaborate with dendritic cells to promote recruitment of effector CD8+ T cells to the tumor microenvironment. Cancer Res. 2013 Aug 1; 73(15): 4653-62. https://doi.org/10.1158/0008-5472.CAN-12-4366.
- Farmaki E., Kaza V., Papavassiliou A.G., Chatzistamou I., Kiaris H. Induction of the MCP chemokine cluster cascade in the periphery by cancer cell-derived Ccl3. Cancer Lett. 2017 Mar 28; 389: 49-58. https://doi.org/10.1016/j.canlet.2016.12.028.
- Aldinucci D., Colombatti A. The inflammatory chemokine CCL5 and cancer progression. Mediators Inflamm. 2014; 2014: 292376. https://doi.org/10.1155/2014/292376.
- Mukaida N., Baba T. Chemokines in tumor development and progression. Exp Cell Res. 2012 Jan 15; 318(2): 95-102. https://doi.org/10.1016/j.yexcr.2011.10.012.
- Van den Steen P.E., Proost P., Wuyts A., Van Damme J., Opdenakker G. Neutrophil gelatinase B potentiates interleukin-8 tenfold by aminoterminal processing, whereas it degrades CTAP-III, PF-4, and GRO-alpha and leaves RANTES and MCP-2 intact. Blood. 2000 Oct 15; 96(8): 2673-81.
- Schmidt T., Carmeliet P. Blood-vessel formation: Bridges that guide and unite. Nature. 2010 Jun 10; 465(7299): 697-9. https://doi.org/10.1038/465697a
- Marchesi F., Locatelli M., Solinas G., Erreni M., Allavena P., Mantovani A. Role of CX3CR1/CX3CL1 axis in primary and secondary involvement of the nervous system by cancer. J Neuroimmunol. 2010; 224(1-2): 39-44. https://doi.org/10.1016/j.jneuroim.2010.05.007.
- Sanguinete M.M.M., Oliveira P.H., Martins-Filho A., Micheli D.C., Tavares-Murta B.M., Murta E.F.C., Nomelini R.S. Serum IL-6 and IL-8 Correlate with Prognostic Factors in Ovarian Cancer.Immunol Invest. 2017 Oct; 46(7): 677-688. https://doi.org/10.1080/08820139.2017.1360342.
- Blassl C., Kuhlmann J.D., Webers A., Wimberger P., Fehm T., Neubauer H. Gene expression profiling of single circulating tumor cells in ovarian cancer - Establishment of a multi-marker gene panel. Mol Oncol. 2016; 10(7): 1030-42. https://doi.org/10.1016/j.molonc.2016.04.002
- Alix-Panabières C., Brouillet J.P., Fabbro M., Yssel H., Rousset T., Maudelonde T., Choquet-Kastylevsky G., Vendrell J.P. Characterization and enumeration of cells secreting tumor markers in the peripheral blood of breast cancer patients. J Immunol Methods. 2005 Apr; 299(1-2): 177-88. https://doi.org/10.1016/j.jim.2005.02.007.
- Hu Y., Fan L., Zheng J., Cui R., Liu W., He Y., Li X., Huang S. Detection of circulating tumor cells in breast cancer patients utilizing multiparameter flow cytometry and assessment of the prognosis of patients in different CTCs levels. Cytometry. 2010; 77(3): 213-9. https://doi.org/10.1002/cyto.a.20838. PMID:20169594.
- Poveda A., Kaye S.B., McCormack R., Wang S., Parekh T., Ricci D., Lebedinsky C.A., Tercero J.C., Zintl P., Monk B.J. Circulating tumor cells predict progression free survival and overall survival in patients with relapsed/recurrent advanced ovarian cancer. Gynecol Oncol. 2011 Sep; 122(3): 567-72. https://doi.org/10.1016/j.ygyno.2011.05.028.
- Svitich O.A., Filina A.B., Davydova N.V., Gankovskaya L.V., Zverev V.V. Rol' faktorov vrozhdennogo immuniteta v protsesse opukholeobrazovaniya. Meditsinskaya immunologiya. 2018; 20(2): 151-162.
- Balkwill F.R. The chemokine system and cancer. J Pathol. 2012; 226(2): 148-57. https://doi.org/10.1002/path.3029.
- Singha B., Gatla H.R., Manna S., Chang T.P., Sanacora S., Poltoratsky V., Vancura A., Vancurova I. Proteasome inhibition increases recruitment of IκB kinase β (IKKβ), S536P-p65, and transcription factor EGR1 to interleukin-8 (IL-8) promoter, resulting in increased IL-8 production in ovarian cancer cells. J Biol Chem. 2014 Jan 31; 289(5): 2687-700. https://doi.org/10.1074/jbc.M113.502641.
- Wojnarowicz P., Gambaro K., de Ladurantaye M., Quinn M.C., Provencher D., Mes-Masson A.M., Tonin P.N. Overexpressing the CCL2 chemokine in an epithelial ovarian cancer cell line results in latency of in vivo tumourigenicity. Oncogenesis. 2012 Sep 10; 1: e27. https://doi.org/10.1038/oncsis.2012.25.
- Moisan F., Francisco E.B., Brozovic A., Duran G.E., Wang Y.C., Chaturvedi S., Seetharam S., Snyder L.A., Doshi P., Sikic B.I. Enhancement of paclitaxel and carboplatin therapies by CCL2 blockade in ovarian cancers. Mol Oncol. 2014 Oct; 8(7): 1231-9. https://doi.org/10.1016/j.molonc.2014.03.016.
- Kitamura T., Qian B.Z., Soong D., Cassetta L., Noy R., Sugano G., Kato Y., Li J., Pollard J.W. CCL2-induced chemokine cascade promotes breast cancer metastasis by enhancing retention of metastasis-associated macrophages. J Exp Med. 2015 Jun 29; 212(7): 1043-59. https://doi.org/10.1084/jem.20141836.
- Brana I., Calles A., LoRusso P.M., Yee L.K., Puchalski T.A., Seetharam S., Zhong B., de Boer C.J., Tabernero J., Calvo E. Carlumab, an anti-C-C chemokine ligand 2 monoclonal antibody, in combination with four chemotherapy regimens for the treatment of patients with solid tumors: an open-label, multicenter phase 1b study. Target Oncol. 2015 Mar; 10(1): 111-23. https://doi.org/10.1007/s11523-014-0320-2.
- Conti I., Rollins B.J. CCL2 (monocyte chemoattractant protein-1) and cancer. Semin Cancer Biol. 2004; 14(3): 149-54. https://doi.org/10.1016/j.semcancer.2003.10.009
- Roussou M., Tasidou A., Dimopoulos M.A., Kastritis E., Migkou M., Christoulas D., Gavriatopoulou M., Zagouri F., Matsouka C., Anagnostou D., Terpos E. Increased expression of macrophage inflammatory protein-1alpha on trephine biopsies correlates with extensive bone disease, increased angiogenesis and advanced stage in newly diagnosed patients with multiple myeloma. Leukemia. 2009 Nov; 23(11): 2177-81. https://doi.org/10.1038/leu.2009.130
- Milliken D., Scotton C., Raju S., Balkwill F., Wilson J. Analysis of chemokines and chemokine receptor expression in ovarian cancer ascites. Clin Cancer Res. 2002 Apr; 8(4): 1108-14.
- Fridlender Z.G., Kapoor V., Buchlis G., Cheng G., Sun J., Wang L.C., Singhal S., Snyder L.A., Albelda S.M. Monocyte chemoattractant protein-1 blockade inhibits lung cancer tumor growth by altering macrophage phenotype and activating CD8+ cells. Am J Respir Cell Mol Biol. 2011; 44(2): 230-7. https://doi.org/10.1165/rcmb.2010-0080OC.
- Eruslanov E.B., Bhojnagarwala P.S., Quatromoni J.G., Stephen T.L., Ranganathan A., Deshpande C., Akimova T., Vachani A., Litzky L., Hancock W.W., Conejo-Garcia J.R., Feldman M., Albelda S.M., Singhal S. Tumor-associated neutrophils stimulate T cell responses in early-stage human lung cancer. J Clin Invest. 2014 Dec; 124(12): 5466-80. https://doi.org/10.1172/JCI77053.
- Nishikawa G., Kawada K., Nakagawa J., Toda K., Ogawa R., Inamoto S., Mizuno R., Itatani Y., Sakai Y. Bone marrow-derived mesenchymal stem cells promote colorectal cancer progression via CCR5. Cell Death Dis. 2019 Mar 19; 10(4): 264. https://doi.org/10.1038/s41419-019-1508-2.
- Falcão-Júnior J.O., Teixeira-Carvalho A., Cândido E.B., Lages E.L., Ferreira Freitas G.G., Lamaita R.M., Freire Bonfim L.P., Borges Salera R., Traiman P.P, da Silva-Filho A.L. Assessment of chemokine serum levels in epithelial ovarian cancer patients. Tumori. 2013; 99(4): 540-4. https://doi.org/10.1700/1361.15108.
- Huh S.J., Liang S., Sharma A., Dong C., Robertson G.P. Transiently entrapped circulating tumor cells interact with neutrophils to facilitate lung metastasis development. Cancer Res. 2010; 70(14): 6071-82. https://doi.org/10.1158/0008-5472.CAN-09-4442.
- Yin J., Zeng F., Wu N., Kang K., Yang Z., Yang H. Interleukin-8 promotes human ovarian cancer cell migration by epithelial-mesenchymal transition induction in vitro. Clin Transl Oncol. 2015; 17(5): 365-70. https://doi.org/10.1007/s12094-014-1240-4.
- Olsen R.S., Nijm J., Andersson R.E., Dimberg J., Wågsäter D. Circulating inflammatory factors associated with worse long-term prognosis in colorectal cancer. World J Gastroenterol. 2017; 23(34): 6212-19. https://doi.org/10.3748/wjg.v23.i34.6212
- Erreni M., Siddiqui I., Marelli G., Grizzi F., Bianchi P., Morone D., Marchesi F., Celesti G., Pesce S., Doni A., Rumio C., Roncalli M.G., Laghi L., Mantovani A., Allavena P. The Fractalkine-Receptor Axis Improves Human Colorectal Cancer Prognosis by Limiting Tumor Metastatic Dissemination. J Immunol. 2016 Jan 15; 196(2): 902-14. https://doi.org/10.4049/jimmunol.1501335.
- Singh S.K., Mishra M.K., Singh R. Hypoxia-inducible factor-1α induces CX3CR1 expression and promotes the epithelial to mesenchymal transition (EMT) in ovarian cancer cells. J Ovarian Res. 2019; 12(1): 42. https://doi.org/10.1186/s13048-019-0517-1.
- Gürler H., Podhajsky E., Özen D., Leiding C, Bollwein H., Meinecke-Tillmann S. Suitability of the hemi-zona assay for the evaluation of the effect of the length of the equilibration period before cryopreservation. Theriogenology. 2018 Jan; 106: 157-163. https://doi.org/10.1016/j.theriogenology.2017.10.021.
- Gaudin F., Nasreddine S., Donnadieu A.C., Emilie D., Combadière C., Prévot S., Machelon V., Balabanian K. Identification of the chemokine CX3CL1 as a new regulator of malignant cell proliferation in epithelial ovarian cancer. PLoS One. 2011; 6(7): e21546. https://doi.org/10.1371/journal.pone.0021546.
- Zahalka A.H., Frenette P.S. Nerves in cancer. Nat Rev Cancer. 2020; 20: 143-157. https://doi.org/10.1038/s41568-019-0237-2.
- Agalliu I., Xue X., Cushman M., Cornell E., Hsing A.W., Kaplan R.C., Anastos K., Rajpathak S., Ho G.Y. Detectability and reproducibility of plasma levels of chemokines and soluble receptors. Results Immunol. 2013 Aug; 3: 79-84. https://doi.org/10.1016/j.rinim.2013.07.001.
- Divella R., Daniele A., Savino E., Palma F., Bellizzi A., Giotta F., Simone G., Lioce M., Quaranta M., Paradiso A., Mazzocca A. Circulating levels of transforming growth factor- βeta (TGF-β) and chemokine (C-X-C motif) ligand-1 (CXCL1) as predictors of distant seeding of circulating tumor cells in patients with metastatic breast cancer. Anticancer Res. 2013 Apr; 33(4): 1491-7.
- Divella R., Daniele A., Abbate I., Bellizzi A., Savino E., Simone G., Giannone G., Giuliani F., Fazio V., Gadaleta-Caldarola G., Gadaleta C.D., Lolli I., Sabbà C., Mazzocca A. The presence of clustered circulating tumor cells (CTCs) and circulating cytokines define an aggressive phenotype in metastatic colorectal cancer. Cancer Causes Control. 2014 Nov; 25(11): 1531-41. https://doi.org/10.1007/s10552-014-0457-4.
- König A., Vilsmaier T., Rack B., Friese K., Janni W., Jeschke U., Andergassen U., Trapp E., Jückstock J., Jäger B., Alunni-Fabbroni M., Friedl T., Weissenbacher T.; SUCCESS STUDY GROUP. Determination of Interleukin-4, -5, -6, -8 and -13 in Serum of Patients with Breast Cancer Before Treatment and its Correlation to Circulating Tumor Cells. Anticancer Res. 2016 Jun; 36(6): 3123-30.
- Lohmann A.E., Dowling R.J.O., Ennis M., Amir E., Elser C., Brezden-Masley C., Vandenberg T., Lee E., Fazaee K., Stambolic V., Goodwin P.J., Chang M.C. Association of Metabolic, Inflammatory, and Tumor Markers With Circulating Tumor Cells in Metastatic Breast Cancer. JNCI Cancer Spectr. 2018 Apr; 2(2): pky028. https://doi.org/10.1093/jncics/pky028.


