Заболеваемость раком щитовидной железы среди ликвидаторов: оценка радиационных рисков
Автор: Чекин С.Ю., Кащеев В.В., Туманов К.А.
Рубрика: Научные статьи
Статья в выпуске: 3-4 т.15, 2006 года.
Бесплатный доступ
В последние годы в научной литературе было опубликовано значительное число работ, посвященных росту заболеваемости раком щитовидной железы (РЩЖ) среди детского населения загрязненных радионуклидами вследствие аварии на ЧАЭС территорий Белоруссии, России и Украины. Вместе с тем, в крайне ограниченном числе исследований рассматривается проблема заболеваемости РЩЖ среди ликвидаторов. В представленной работе изучается заболеваемость РЩЖ в когорте ликвидаторов (103 427 человек), проживающих в 6 регионах России: Северо-Западном, Волго-Вятском, Центрально-Черноземном, Поволжском, Северо-Кавказском и Уральском. За период с 1986 по 2003 гг. в этой когорте выявлено 87 случаев заболевания РЩЖ. Установлен статистически значимый рост заболеваемости РЩЖ среди ликвидаторов над спонтанным (характерным для мужского населения России) уровнем, SIR=3,39 (95% ДИ: 2,73; 4,16). Вместе с тем показано отсутствие статистически значимой зависимости показателя заболеваемости от дозы внешнего облучения, ERR=1,68 (95% ДИ: -0,95; 6,46).
Короткий адрес: https://sciup.org/170169913
IDR: 170169913
Текст научной статьи Заболеваемость раком щитовидной железы среди ликвидаторов: оценка радиационных рисков
В результате аварии на Чернобыльской АЭС радиационному воздействию подверглись две основные группы: участники ликвидации последствий аварии, которые выполняли восстановительные работы в 30-километровой зоне Чернобыльской АЭС (ликвидаторы) и жители загрязненных радионуклидами территорий Белоруссии, России и Украины.
В последние годы в научной литературе опубликовано большое число работ, отражающих драматический рост заболеваемости раком щитовидной железы (РЩЖ) населения радиационно-загрязненных территорий [3, 4, 6, 11]. Дается обоснование роли радиационного фактора в росте показателей заболеваемости РЩЖ за счет инкорпорированного облучения 131I, прежде всего для детского на момент аварии населения. Отмечается возможная роль и других факторов, обуславливающих рост заболеваемости: эффект скрининга (углубленная диспансеризация населения загрязненных территорий), йодный дефицит на этих территориях, генетическая предрасположенность, недостаточная йодная профилактика сразу же после аварии на ЧАЭС.
Все указанные исследования относятся к жителям загрязненных территорий Белоруссии, России и Украины. Вместе с тем, крайне ограниченное число работ посвящено проблеме изучения заболеваемости РЩЖ среди ликвидаторов [5, 7]. В наших предыдущих работах [8, 9] отмечалось повышение частоты заболеваемости РЩЖ среди ликвидаторов. В частности отмечалось, что увеличение частоты заболеваемости (в 2-3 раза) было выявлено в первые годы поле аварии на ЧАЭС, что может быть объяснено повышенным уровнем диспансеризации ликвидаторов (эффект скрининга). В настоящей работе делается попытка оценки радиационных рисков в индукции заболеваемости РЩЖ среди ликвидаторов с использованием технологии внутреннего сравнения (internal comparison).
В настоящее время (на 01.01.2006 г.) в Российском государственном медикодозиметрическом регистре (РГМДР) имеется информация на 638 334 человек, подвергшихся радиационному воздействию в результате аварии на ЧАЭС и проживающих в России, в том числе на 187 451 участника ликвидации ее последствий (ликвидатора).
Материалы и методы
В настоящей работе рассматривается когорта ликвидаторов 103 427 человек, проживающих в 6 регионах России: Северо-Западном, Волго-Вятском, Центрально-Черноземном, Поволжском, Северо-Кавказском и Уральском. Эти регионы отличаются повышенным качеством индивидуальной медицинской информации, поступающей ежегодно в РГМДР. Уровень охвата ликвидаторов ежегодной диспансеризацией на этих территориях составляет около 85%. Рассматривается заболеваемость РЩЖ указанной когорты ликвидаторов с 1986 по 2003 гг.
На рис. 1 показано распределение ликвидаторов по годам въезда в 30-километровую зону: 1986, 1987, 1988-1990. Как известно, восстановительные работы продолжались до 1991 г. В рассматриваемой когорте 103 427 ликвидаторов принимали участие в восстановительных работах: 22 408 человек – в апреле-июле 1986 г. (когда было возможно инкорпорированное облучение щитовидной железы 131I) и 81 019 человек – с августа 1986 г. по конец 1990 г. (рис. 2).
На рис. 3 приведен грубый показатель заболеваемости (IR) ликвидаторов (на 100 тыс. человек) для рассматриваемых времен въезда в 30-километровую зону.
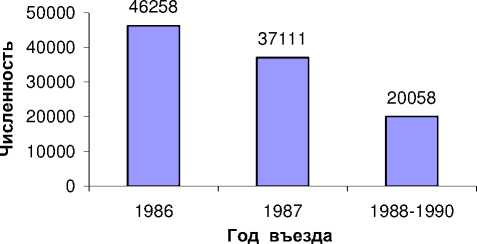
Рис . 1. Распределение ликвидаторов по годам въезда т
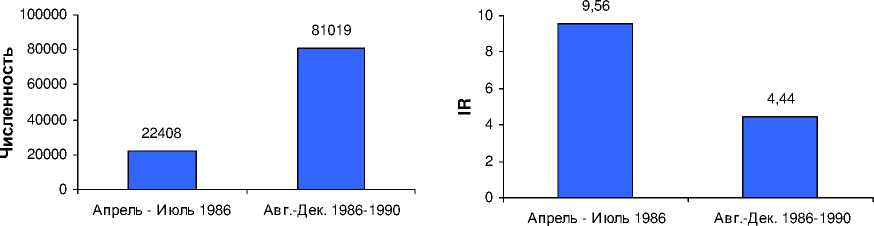
Время въе зда в зону
Время въезда в зону
Рис . 2. Распределение ликвидаторов по времени въезда в 30-километровую зону.
Рис . 3. Грубый показатель заболеваемости (IR) ликвидаторов (на 100 тыс. человек) по времени въезда в 30-километровую зону.
На рис. 4 показано возрастное распределение изучаемой когорты ликвидаторов на момент их работы в 30-километровой зоне Чернобыльской АЭС. Средний возраст ликвидаторов на этот момент времени составлял 34 года. Как видно из рисунка, указанное возрастное распределение ликвидаторов дает принципиальную возможность для проведения долгосрочных эпидемиологических исследований.
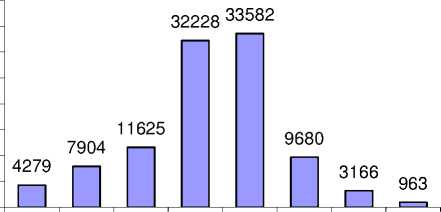
<20 20-25 25-30 30-35 35-40 40-45 45-50 >50
Возраст на момент въезда
Рис . 4. Распределение ликвидаторов по возрасту на момент въезда в 30-километровую зону.
На рис. 5, 6 показано распределение ликвидаторов по дозам внешнего облучения. Из рассматриваемой когорты ликвидаторов (103 427 человек) 76 260 имеют индивидуальные данные о полученных дозах внешнего облучения. Как видно из рис. 6, наибольшие дозы внешнего облучения получили ликвидаторы 1986 г. (средняя доза 168 мГр). Средняя доза ликвидаторов 1988-1990 гг. составила 33 мГр. На рис. 7 приведен грубый показатель заболеваемости (IR) ликвидаторов (на 100 тыс. человек) по дозовым группам.
Важно отметить, что РГМДР располагает данными только о дозах внешнего облучения ликвидаторов. РГМДР не имеет информации о возможных дозах облучения щитовидной железы среди ликвидаторов за счет инкорпорированного облучения 131I. Поэтому оценка радиационных рисков проведена с использованием индивидуальных данных о дозах внешнего облучения.
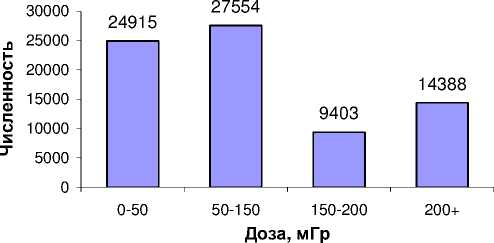
Рис . 5. Распределение ликвидаторов по дозе внешнего облучения.
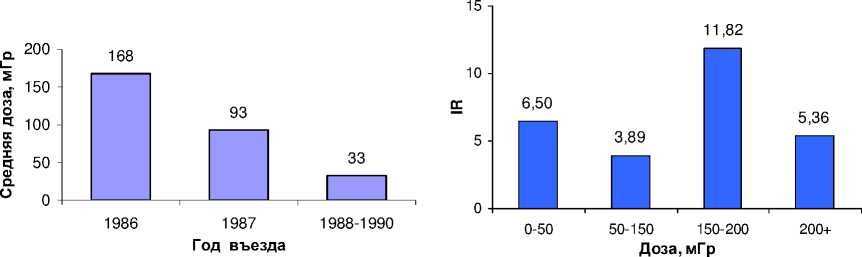
Рис . 6. Распределение средней дозы Рис . 7. Грубый показатель заболеваемости (IR)
внешнего облучения по годам въезда ликвидаторов (на 100 тыс. человек)
в 30-километровую зону. по дозовым группам.
Для нахождения величины стандартизованного отношения заболеваемости (SIR) изучаемой когорты была использована следующая модель:
λ = exp(β0)exp(β1,2 T)λrus, где λrus – повозрастные показатели заболеваемости РЩЖ мужского населения России; β0, β1,2 – неизвестные константы; Т – категориальная переменная, введенная путем стратификации даты заезда на два уровня. Это было сделано для выявления гетерогенности SIR по дате въезда.
В первом случае, в котором SIR не зависит от даты въезда в зону, значение констант β 1,2 фиксируем равным 0, тогда λ = exp(β 0 )λ rus , SIR = exp(β 0 ) .
Аналогично, во втором случае, когда SIR зависит от даты въезда, значение константы β 0 фиксируем равной 0, получаем два значения SIR 1,2 = exp(β 1,2 T) по периоду въезда, где первый уровень категориальной переменной Т соответствует датам въезда в зону с августа 1986 г. по декабрь 1990 г., а второй уровень – датам въезда с 26 апреля по конец июля 1986 г.
Для анализа радиационного риска использовалась регрессионная модель следующего вида:
λ = exp(λA+βiR+γjA R)(1+ϕD+µD A+θkD R), где А – возраст на момент въезда; R – административный регион; D – доза внешнего облучения в Гр; XY – член взаимодействия между двумя факторами X и Y; λ, βi, γj, ϕ, µ, θk – неизвестные константы, i=1,…,6; j=1,…,6; k=1,…,6.
В процессе идентификации модели было выявлено, что параметры взаимодействия являются избыточными, а шесть административных регионов группируются в 3 региона по уровню фоновой заболеваемости. Окончательно модель приобрела следующий вид:
λ = exp(λA+βiR)(1+γD), где R – группы административных регионов по уровню фоновой заболеваемости; γ=ERR/Gy, ERR – величина избыточного относительного риска, i=1,…,3.
Оценки величин ERR и SIR проводились с использованием программного пакета EPICURE [10].
Результаты и обсуждение
Для оценки величины SIR используется, в качестве контроля, спонтанный повозрастной уровень заболеваемости РЩЖ мужского населения России.
За все годы наблюдения 1986-2003, для всех периодов въезда, величина SIR оказалась статистически значимой и равной 3,39 (95% ДИ: 2,73; 4,16). Это означает, что заболеваемость ликвидаторов РЩЖ достоверно превышает ожидаемый спонтанный (национальный) уровень.
Кроме того, было показано, что величина SIR является гетерогенной по периодам въезда. Рассматривались 2 группы ликвидаторов в зависимости от даты въезда в 30-километровую зону Чернобыльской АЭС: апрель-июль 1986 г. и август 1986 г. – конец 1990 г.
Наибольшая величина SIR выявлена для ликвидаторов, принявших участие в восстановительных работах в апреле-июле 1986 г. Среди этой группы ликвидаторов, с наибольшей величиной SIR, было выявлено 34 случая заболевания РЩЖ, величина SIR равнялась 6,49 (95% ДИ: 4,54; 8,92). Среди ликвидаторов, въезжавших в зону в период с августа 1986 г. по конец 1990 г., выявлено 53 случая заболевания РЩЖ, SIR=2,72 (95% ДИ: 2,05; 3,52).
Оценка гетерогенности SIR по этим периодам въезда в зону, полученная при помощи теста отношения правдоподобий, показала статистически значимое отличие, p -value < 0,001.
В таблице 1 показаны оценки величины стандартизованного отношения заболеваемости (SIR) для изучаемой когорты ликвидаторов.
Как было отмечено выше, среди 103 427 ликвидаторов, включенных в когорту настоящего исследования, 75 283 человека (72,8%) имеют индивидуальные данные о полученных дозах внешнего облучения, из которых у 67 человек (таблица 2, группа 1986-1990 гг., период наблюдения апрель 1986-2003 гг.) выявлены заболевания РЩЖ.
Для учета фактора латентного периода были также рассмотрены два периода наблюдения, начало которых приходилось на момент времени 5 и 10 лет спустя от момента радиационного воздействия.
Как видно из таблицы 2, доза внешнего облучения не является статистически значимым фактором риска в индукции заболеваемости РЩЖ. Действительно, нижняя граница доверительного интервала величины ERR во всех рассмотренных случаях отрицательна.
Рассмотрим более подробно полученные результаты. В работе рассмотрены две группы ликвидаторов: А – принимавшие участие в восстановительных работах в 30-километровой зоне Чернобыльской АЭС в апреле-июле 1986 г.; Б – участвовавшие в ликвидации последствий аварии с августа 1986 г. по 1990 г. включительно. Понятно, что такое разделение на две группы обусловлено, прежде всего тем, что ликвидаторы группы А могли быть подвержены инкорпорированному облучению щитовидной железы радионуклидами 131I. Действительно, в работе [1] отмечается, что ликвидаторы, находившиеся на промплощадке в первые несколько недель после аварии, могли получить за счет ингаляционного поступления 131I поглощенные дозы облучения щитовидной железы в среднем 0,21 Гр. В отчете НКДАР ООН о последствиях аварии на Чернобыльской АЭС за 2000 г. [2] также отмечается (табл. 15), что лечившиеся в Больнице № 6 в Москве в апреле-мае 1986 г. ликвидаторы получили дозы облучения щитовидной железы до 20 Гр.
Таблица 1
Стандартизованное отношение заболеваемости (SIR) заболеваемости РЩЖ среди ликвидаторов
|
Период наблюдения |
Период въезда в 30-километровую зону |
|||
|
1986 апрель-июль |
1986 август - 1990 |
1986-1990 |
||
|
Число ликвидаторов |
22408 |
81019 |
103427 |
|
|
1986 1998 гг. |
Наблюдаемое число случаев Ожидаемое число случаев SIR (95% ДИ) |
18 3,44 5,23 (3,17; 8,04) |
36 12,9 2,79 (1,98; 3,8) |
54 16,43 3,29 (2,49; 4,24) |
|
1986 2003 гг. |
Наблюдаемое число случаев Ожидаемое число случаев SIR (95% ДИ) |
34 5,24 6,49 (4,54; 8,92) |
53 19,51 2,72 (2,05; 3,52) |
87 25,63 3,39 (2,73; 4,16) |
Таблица 2
Избыточный относительный риск (ERR) заболеваемости РЩЖ среди ликвидаторов
|
Период наблюдения |
Период въезда в 30-километровую зону |
||
|
1986 апрель-июль |
1986 август - 1990 |
1986-1990 |
|
|
Число ликвидаторов |
12056 |
63227 |
75283 |
|
Наблюдаемое число случаев |
21 |
46 |
67 |
|
Человеко-лет наблюдения 1986 г. |
189750 |
927990 |
1117740 |
|
ERR/Гр |
0,85 |
0,38 |
1,68 |
|
(95%-ный ДИ) |
(-2,44; 12,47) |
(-2,16; 5,43) |
(-0,95; 6,46) |
|
P (LRT) |
>0,5 |
>0,5 |
0,35 |
|
Число ликвидаторов |
11740 |
61092 |
72832 |
|
Наблюдаемое число случаев |
20 |
42 |
62 |
|
5 лет с мо- Человеко-лет наблюдения |
130006 |
615639 |
745645 |
|
мента въезда ERR/ Гр |
0,32 |
0,93 |
1,86 |
|
(95% ДИ) |
(-2,64; 10,36) |
(-1,92; 6,78) |
(-0,89; 7,00) |
|
P (LRT) |
>0,5 |
>0,5 |
0,32 |
|
Число ликвидаторов |
10829 |
55498 |
66327 |
|
Наблюдаемое число случаев |
15 |
22 |
37 |
|
10 лет с мо- Человеко-лет наблюдения |
73331,6 |
322673 |
396004 |
|
мента въезда ERR/ Гр |
2,75 |
-0,06 |
2,45 |
|
(95% ДИ) |
(-2,08; 26,16) |
(-2,96; 7,27) |
(-1,05; 10,21) |
|
P (LRT) |
0,49 |
>0,5 |
0,30 |
В таблице 1 показано, что величина SIR для ликвидаторов группы А (SIR=6,49) в 2,4 раза выше по отношению к величине SIR для ликвидаторов группы Б (SIR=2,72). С одной стороны высокое значение SIR для ликвидаторов группы Б не может исключить возможного влияния эффекта скрининга, связанного с регулярной диспансеризацией ликвидаторов по отношению к мужскому населению России, которое принято в данном случае за контроль. Вместе с тем, увеличение значения SIR в 2,4 раза по группе А конечно дает основания предполагать о возможном воздействии инкорпорированного облучения радионуклидами йода на рост частоты заболеваемости раком щитовидной железы в этой группе. Поскольку РГМДР не располагает индивидуальными данными о дозах облучения щитовидной железы среди ликвидаторов, мы не смогли выполнить расчеты рисков по этому фактору воздействия.
Как было отмечено выше, нами не определена значимая зависимость риска заболеваемости РЩЖ от дозы внешнего облучения (таблица 2). Вместе с тем, обращает на себя внимание положительное (почти во всех случаях) значение избыточного относительного риска (ERR). Представляется крайне важным продолжить исследования по оценке радиационных рисков заболеваемости РЩЖ среди ликвидаторов с учетом повышения по времени статистической мощности этих работ.
Выводы
-
1. Установлено значительное повышение частоты заболеваемости РЩЖ (SIR=3,39) среди ликвидаторов по отношению к мужскому населению страны.
-
2. Показано, что наиболее высокую частоту заболеваемости РЩЖ (SIR=6,49) имеют ликвидаторы, принимавшие участие в работах в 30-километровой зоне Чернобыльской АЭС в апреле-июле 1986 г.
-
3. Не установлено статистически значимой зависимости частоты заболеваемости РЩЖ среди ликвидаторов от дозы внешнего облучения. Вместе с тем показано, что величина избыточного относительного риска ERR/Гр после 10-летнего латентного периода выросла от значения 1,68 до 2,45.
-
4. Поскольку максимальная частота заболеваемости РЩЖ выявлена среди ликвидаторов, принимавших участие в восстановительных работах в апреле-июле 1986 г., нельзя исключить влияния инкорпорированного облучения щитовидной железы радионуклидами 131I как фактор риска.
-
5. В настоящем исследовании было рассмотрено 87 случаев РЩЖ среди ликвидаторов, из которых 67 случаев имели индивидуальные оценки полученных доз внешнего облучения и использовались для оценки радиационного риска. С учетом латентного периода 10 лет радиационно-обусловленной индукции РЩЖ приведенные выводы следует рассматривать как предварительные и требующие уточнения при повышении статистической мощности исследований.
Список литературы Заболеваемость раком щитовидной железы среди ликвидаторов: оценка радиационных рисков
- Алексахин P.M., Булдаков Л.А., Губанов В.А. и др. Крупные радиационные аварии: последствия и защитные меры/Под общей ред. Л.А.Ильина и В.А. Губанова. -М.: ИздАТ, 2001. -752 с.
- Отчет Научного комитета ООН по действию атомной радиации за 2000 год. Приложение J. Уровни облучения и эффекты в результате чернобыльской аварии/Пер. с англ. А.А.Вайнсона, М.Н.Мавкина и С.М.Шинкарева; Под ред. Ю.С.Рябухина и С.П.Ярмоненко. -М.: РАДЭКОН, 2001.
- Cardis Е., Kesminiene A., Ivanov V. et al. Risk of thyroid cancer after exposure to 131l in childhood//Journal of the National Cancer Institute. -2005. -V. 97, N. 10. -P. 724-732.
- Demidchik E.P., Mrochek A., Demidchik Yu. et al. Thyroid cancer promoted by radiation in young people of Belarus (clinical and epidemiological features)//Radiation and thyroid cancer. Thomas G., Karaoglou A., Williams E.D. (eds). Proceedings of an international seminar on radiation and thyroid cancer. -Brussels-Luxembourg: World Scientific, 1999. -P. 51-54.
- Inskip P.D., Hartshorne M.F., Tekkel M. et al. Thyroid nodularity and cancer among Chernobyl cleanup workers from Estonia//Radiat. Res. -1997. -V. 147. -P. 225-235.
- Ivanov V.K., Gorski A.I., Pitkevitch V.A. et al. Risk of radiogenic thyroid cancer in Russia following the Chernobyl accident//Radiation and thyroid cancer. Thomas G., Karaoglou A., Williams E.D. (eds). Proceedings of an international seminar on radiation and thyroid cancer. -Brussels-Luxembourg: World Scientific, 1999.-P. 89-96.
- Ivanov V.K., Tsyb A.F., Gorsky A.I. et al. Thyroid cancer among "liquidators" of the Chernobyl accident//Brit. J. Radiol. -1997. -V. 70. -P. 937-941.
- Ivanov V.K., Tsyb A.F., Ivanov S.I. et al. Medical radiological consequences of the Chernobyl catastrophe in Russia: estimation of radiation risks. -St. Petersburg: Nauka, 2004. -388 p.
- Ivanov V.K., Tsyb A.F., Petrov A.V. et al. Thyroid cancer incidence among liquidators of the Chernobyl accident: absence of dependence of radiation risks on external radiation dose//Radiation and Environmental Biophysics. -2002. -V. 41, N 3. -P. 195-198.
- Preston D.L., Lubin J.H., Pierce D.A. EPICURE User's Guide. -Seattle: Hirosoft International Corp., 1992.
- Tronko M., Bogdanova Т., Komisarenko I. et al. The post-Chernobyl incidence of childhood thyroid cancer in Ukraine//Radiation and thyroid cancer. Thomas G., Karaoglou A., Williams E.D. (eds). Proceedings of an international seminar on radiation and thyroid cancer. -Brussels-Luxembourg: World Scientific, 1999. -P. 61-70.


