Задачи компьютерной томографии при обследовании больных раком желудка в онкорадиологической клинике
Автор: Силантьева Наталья Константиновна, Агабабян Татев Артаковна, Скоропад Виталий Юрьевич, Гришина Ольга Геннадьевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 5 (71), 2015 года.
Бесплатный доступ
В специализированное онкологическое лечебное учреждение пациент поступает уже с установленным диагнозом рака желудка, и в этих условиях важно определить клинические задачи, в решении которых КТ играет определяющую роль. Целью работы явилась систематизация основных клинических задач, которые призвана решить КТ у больных раком желудка в условиях онкорадиологической клиники. Методы. Работа основана на нашем опыте применения КТ при обследовании 120 больных раком желудка на различных этапах комбинированного лечения. КТ-уточнение стадии злокачественной опухоли было проведено у 91 больного. КТ-топометрия с целью подготовки к лучевой терапии выполнена у 70 больных. КТ-мониторинг после комбинированного лечения проведен 40 больным. Статистическую обработку полученных данных провели с использованием статистического пакета SPSS 13.0. Различия считались статистически достоверными при значениях р
Компьютерная томография, рак желудка, стадирование, кт-топометрия, оценка эффектов, наблюдение за больными после лечения
Короткий адрес: https://sciup.org/14056579
IDR: 14056579 | УДК: 616.33-006.6-073.756.8
Текст научной статьи Задачи компьютерной томографии при обследовании больных раком желудка в онкорадиологической клинике
5-летняя выживаемость не превышает 25 % [20]. Аналогичные цифры общей 5-летней стандартизированной по возрасту выживаемости (25,1 %) приводят европейские исследователи [12].
КТ-исследование для планирования лучевой терапии проводили в положении больного лежа на спине с вытянутыми над головой руками. При необходимости применяли полипозиционное исследование с целью улучшения визуализации опухоли. Сначала выполняли нативное (бесконтрастное) исследование; затем сканирование с внутривенным болюсным введением контрастного вещества (Уль-травист 370) в объеме 100–150 мл, со скоростью 3–4 мл/с в артериальную, портальную и венозную фазы контрастирования (с задержкой 25–30, 45–50 и 77–80 сек соответственно) с последующей постпроцессорной обработкой данных КТ.
Все статистические расчеты проводили с использованием пакета SPSS 13.0. Для оценки эффективности диагностических тестов выполняли анализ операционной характеристической кривой (ROC – Receiver Operating Characteristic curve). Различия считали статистически достоверными при значениях р<0,05.
Результаты исследования и обсуждение
Таблица 1
Примечание: Axial – аксиальные изображения; Volume – объемные изображения; MPR – мультипланарные изображения.
Оценка статуса регионарных лимфатических узлов (категория N). Лучевой диагност должен четко представлять как анатомическую, так и КТ-топографию регионарных лимфатических узлов. На наш взгляд, с практической точки зрения наиболее целесообразно придерживаться Японской классификации [16]. Безусловно, одним из наиболее сложных и практически не разрешимых при КТ вопросов является дифференциальная диагностика реактивно увеличенных и метастатически пораженных лимфатических узлов. По данным литературы, КТ при определении метастазов в лимфоузлы имеет невысокие показатели диагностической эффективности (табл. 2).
Таблица 2
Примечание: Axial – аксиальные изображения; Volume – объемные изображения; MPR – мультипланарные изображения.
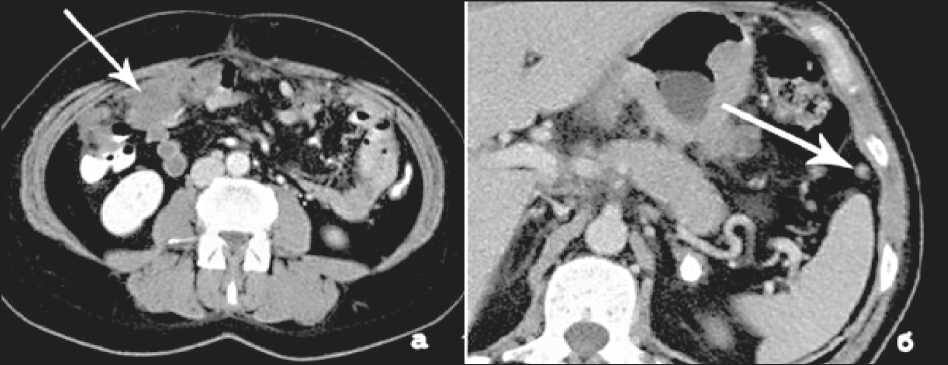
стичность положительного результата – 79 %, про-гностичность отрицательного результата – 93 %, что в целом соответствует данным литературы.
Мы проанализировали 8 случаев расхождения данных КТ и морфологических заключений относительно категории N. Ложноотрицательных результатов было три, два из них были связаны с наличием микрометастазов в неувеличенных лимфатических узлах, и в одном случае лимфатические узлы визуально не дифференцировались на фоне обширной опухолевой инфильтрации в области малого сальника. Во всех 5 случаях с ложноположительными результатами на КТ-изображениях визуализировались единичные регионарные лимфатические узлы размером более 10 мм, но при морфологическом исследовании метастазы в них обнаружены не были; гиперплазия носила реактивный характер.
Отдаленные метастазы (категория M). По данным нашего исследования, отдаленные метастазы были диагностированы у 17 больных: по брюшине – в 10 случаях, в печень – в 5 случаях, в забрюшинные лимфоузлы – в 2 случаях.
КТ-топометрия (топографо-анатомическая подготовка с применением компьютерной томо-
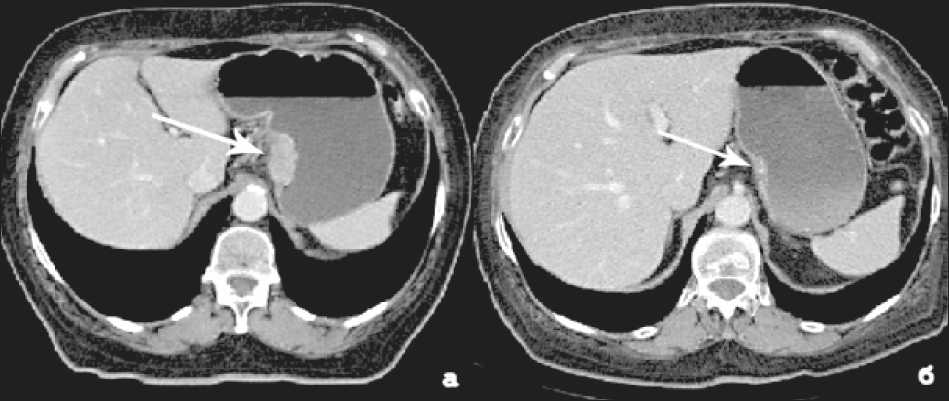
Рис. 2. КТ органов брюшной полости. КТ-симптомы регрессии опухоли:
графии) в случаях проведения предоперационной лучевой терапии
Диагностика послеоперационных осложнений
Безусловно, ведущими методами диагностики послеоперационных осложнений являются классическое рентгенологическое (при диагностике несостоятельности анастомозов) и ультразвуковое (при выявлении абсцессов) исследования. Однако в ряде сложных случаев или при получении неоднозначных результатов с помощью традиционных методов используют КТ [19]. Послеоперационные осложнения нами были диагностированы у 2 больных в раннем послеоперационном периоде: у одного больного имела место несостоятельность анастомоза (рис. 3а), у другого – формирование абсцесса в левом поддиафрагмальном пространстве (рис. 3б).
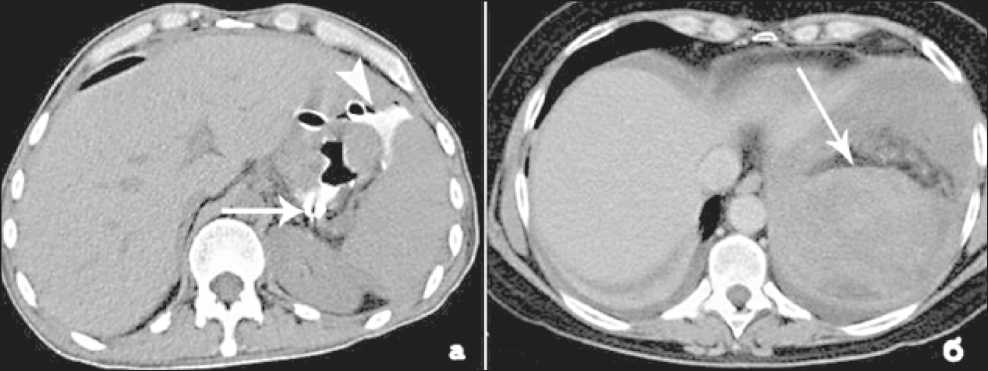
б – абсцесс в левом поддиафрагмальном пространстве (стрелка) после гастрэктомии
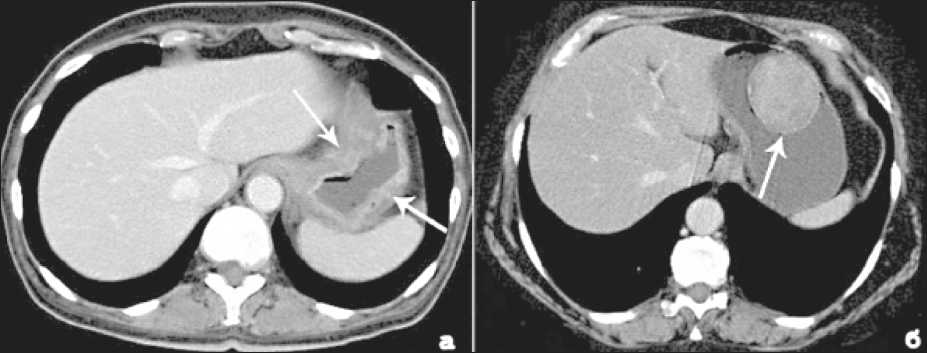
Наблюдение за больными после проведения хирургического и комбинированного лечения (КТ-мониторинг, «follow up»)
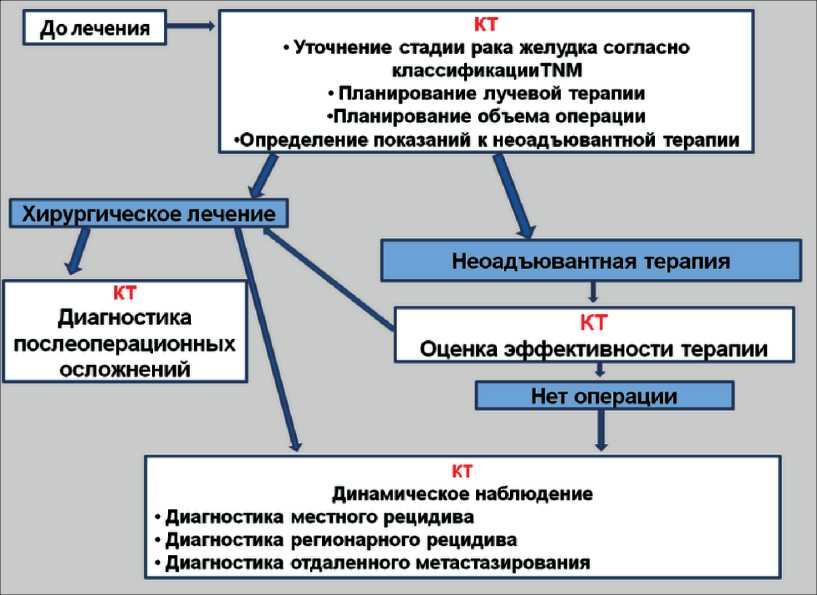
Заключение
Список литературы Задачи компьютерной томографии при обследовании больных раком желудка в онкорадиологической клинике
- Агабабян Т.А., Силантьева Н.К., Скоропад В.Ю. Диагностика внеорганного распространения рака желудка методом мультиспиральной компьютерной томографии//Медицинская визуализация. 2011. № 6. С. 21-29
- Алгоритмы диагностики и лечения злокачественных новообразований/Под ред. В.И. Чиссова. М., 2010. 543 с
- Араблинский В.М., Седых С.А., Мамонтов А.С. Роль компьютерной томографии в диагностике регионарных метастазов рака пищевода и проксимального отдела желудка//Советская медицина. 1991. № 9. С. 26-29
- Горшков А.Н., Мешков В.М., Грачева Н.И., Зарицкая В.А. Возможности лучевых методов исследования (УЗИ, КТ) в предоперационной оценке внутристеночной инвазии рака желудка//Вестник рентгенологии и радиологии. 2001. № 2. С. 27-34
- Злокачественные новообразования в России в 2013 году (заболеваемость и смертность)/Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М., 2015. 250 с
- Партс С.А., Тузиков С.А., Лесков С.В., Кузьмина Е.С., Афанасьев С.Г., Волков М.Ю. Ближайшие и отдаленные результаты комбинированного лечения больных кардиальным раком желудка с использованием предоперационной лучевой терапии//Сибирский онкологический журнал. 2011. № 2. С. 67-71
- Ahn H.S., Lee H.J., Yoo M.W., Kim S.G., Im J.P., Kim S.H., Kim W.H., Lee K.U., Yang H.K. Diagnostic accuracy of T and N stages with endoscopy, stomach protocol CT, and endoscopic ultrasonography in early gastric cancer//J. Surg. Oncol. 2009. Vol. 99 (1). P. 20-27 DOI: 10.1002/jso.21170
- Anzidei M., Napoli A., Zaccagna F., Di Paolo P., Zini C., Cavallo Marincola B., Geiger D., Catalano C., Passariello R. Diagnostic performance of 64-MDCT and 1.5-T MRI with high-resolution sequences in the T staging of gastric cancer: a comparative analysis with histopathology//Radiol. Med. 2009. Vol. 114 (7). P. 1065-1079 DOI: 10.1007/s11547-009-0455-x
- Chen C.Y., Hsu J.S., Wu D.C., Kang W.Y., Hsieh J.S., Jaw T.S., Wu M.T., Liu G.C. Gastric cancer: preoperative local staging with 3D multi-detector row CT-correlation with surgical and histopathologic results//Radiology. 2007. Vol. 242 (2). P. 472-482
- Choi H. Response evaluation of gastrointestinal stromal tumors//Oncologist. 2008. Vol. 13. Suppl. 2. P. 4-7 DOI: 10.1634/theoncologist.13S2-4
- Cidón E.U., Cuenca I.J. Gastric adenocarcinoma: is computed tomography useful in preoperative staging?//Clinical Medicine: Oncology. 2009. Vol. 3. P. 91-97
- De Angelis R., Sant M., Coleman M.P., Francisci S., Baili P., Pierannunzio D., Trama A., Visser O., Brenner H., Ardanaz E., Bielska-Lasota M., Engholm G., Nennecke A., Siesling S., Berrino F., Capocaccia R; EUROCARE-5 Working Group. Cancer survival in Europe 1999-2007by country and age: results of EUROCARE-5-a population-based study//Lancet Oncol. 2014. Vol. 15 (1). P. 23-34 DOI: 10.1016/S1470-2045(13)70546-1
- Eisenhauer E.A., Therasse P., Bogaerts J., Schwartz L.H., Sargent D., Ford R., Dancey J., Arbuck S., Gwyther S., Mooney M., Rubin-stein L., Shankar L., Dodd L., Kaplan R., Lacombe D., Verweij J. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)//Eur. J. Cancer. 2009. Vol. 45 (2). P. 228-247. doi: 10.1016/j. ejca.2008.10.026
- Horton K.M., Fishman E.K. Current role of CT in imaging of the stomach//Radiographics. 2003. Vol. 23 (1). P. 75-87
- Japan esophageal society. Japanese classification of esophageal cancer, tenth edition: parts II and III//Esophagus. 2009. Vol. 6. P. 71-94
- Japanese Gastric Cancer association. Japanese classification of gastric carcinoma: 3rd English edition//Gastric Cancer. 2011. Vol. 14. P. 101-112 DOI: 10.1007/s10120-011-0041-5
- Kim H.J., Kim A.Y., Oh S.T., Kim J.S., Kim K.W., Kim P.N., Lee M.G., Ha H.K. Gastric cancer staging at multi-detector row CT gastrography: comparison of transverse and volumetric CT scanning//Radiology. 2005. Vol. 236 (3). P. 879-885
- Kim H.S., Han H.Y., Choi J.A., Park C.M., Cha I.H., Chung K.B., Mok Y.J. Preoperative evaluation of gastric cancer: value of spiral CT during gastric arteriography (CTGA)//Abdom. Imaging. 2001. Vol. 26 (2). P. 123-130
- Kim K.W., Choi B.I., Han J.K., Kim T.K., Kim A.Y., Lee H.J, Kim Y.H., Choi J.I., Do K.H., Kim H.C., Lee M.W. Postoperative anatomic and pathologic findings at CT following gastrectomy//Radiographics. 2002. Vol. 22 (2). P. 323-336
- Kunz P.L., Gubens M., Fisher G.A., Ford J.M., Lichtensztajn D.Y., Clarke C.A. Long-term survivors of gastric cancer: a California population-based study//J. Clin. Oncol. 2012. Vol. 30 (28). P. 3507-3515
- Lee J.H., Jeong Y.K., Kim D.H., Go B.K., Woo Y.J., Ham S.Y., Yang S.O. Two-phase helical CT for detection of early gastric carcinoma: im portance of the mucosal phase for analysis of the abnormal mucosal layer//J. Comput. Assist. Tomogr. 2000. Vol. 24 (5). P. 777-782
- Makino T., Fujiwara Y., Takiguchi S., Tsuboyama T., Kim T., Nushijima Y., Yamasaki M., Miyata H., Nakajima K., Mori M., Doki Y. Preoperative T staging of gastric cancer by multi-detector row computed tomography//Surgery. 2011. Vol. 149 (5). P. 672-679. doi: 10.1016/j. surg.2010.12.003
- Ogata I., Komohara Y., Yamashita Y., Mitsuzaki K., Takahashi M., Ogawa M. CT evaluation of gastric lesions with three-dimensional display and interactive virtual endoscopy: comparison with conventional barium study and endoscopy//AJR. 1999. Vol. 172 (5). P. 1263-1270
- Polkowski M., Palucki J., Wronska E., Szawlowski A., Nasierowska-Guttmejer A., Butruk E. Endosonography versus helical computed tomography for locoregional staging of gastric cancer//Endoscopy. 2004. Vol. 36 (7). P. 617-623
- Vallböhmer D., Hölscher A.H., Schneider P.M., Schmidt M., Dietlein M., Bollschweiler E., Baldus S., Alakus H., Brabender J., Metzger R., Mönig S.P. -fluorodeoxyglucose-positron emission tomography for the assessment of histopathologic response and prognosis after completion of neoadjuvant chemotherapy in gastric cancer//J. Surg. Oncol. 2010. Vol. 102 (2). P. 135-140 DOI: 10.1002/jso.21592


