Закономерности блочного подхода для анализа структуры химических элементов и проблемы материаловедения
Автор: Гусев Б.В., Сперанский А.А.
Журнал: Нанотехнологии в строительстве: научный интернет-журнал @nanobuild
Рубрика: Структурирование химических элементов
Статья в выпуске: 1 т. 11, 2019 года.
Бесплатный доступ
Авторами разработано представление об объемной матрице химических элементов, которое позволило устранить основные недостатки табличных форм структуры химических элементов, разработанных Д.И. Менделеевым и между- народным сообществом химиков ИЮПАК. Объемная структура представлена в виде расширяющей конусной матрицы. При этом все известные химические элементы до номера 118 объединены в четыре блока. Представление о блочности позволило обосновать электронно-уровневую формулу, в том числе для предполагаемых новых химических элементов 5-го блока Е с номерами 119 по 218. Это позволяет разработать цифровую модель для расчета взаимодействий химических элементов и получения новых видов соединений и материалов.
Химический элемент, табличные формы периодической структуры, объемная матрица, механизмы периодичности, орбитальные модели электронных оболочек атомов
Короткий адрес: https://sciup.org/142218086
IDR: 142218086 | УДК: 54.01 | DOI: 10.15828/2075-8545-2019-11-1-76-88
Текст научной статьи Закономерности блочного подхода для анализа структуры химических элементов и проблемы материаловедения
In January 2019, the World community celebrated the 150 th anniversary of one of the greatest discoveries in the field of fundamental scientific knowledge – the publication of the periodic table of chemical elements of D.I. Mendeleev, and it seems relevant to express some considerations related to modern tasks of scientific and technological development.
In the structural materials science, the main task of which is to obtain a substance with high performance characteristics, it is necessary to turn to the scientific basis of natural sciences – the periodic law of D.I. Mendeleev. The author of the law himself repeatedly returned to the issues of its «incompleteness and practical ambiguities, including the reasons for the law of multiple relationships, differences in elements and changes in their atomicity, and at the same time it is necessary to understand what is mass and aggravation» [1]. And, if the first part of the problem is practically solved by the science of matter, then the understanding of the second part is still relevant.
MAIN PART
An important list of questions in terms of improving knowledge about periodicity was voiced by Nobel Prize Laureate Academician N.N. Semyonov in a stage lecture in 1951 to the students of the physics faculty: «The goal is clear – after eliminating shortcomings, new properties and interrelationships of elements will be revealed, which will allow most scientific research at a new, higher level, and solving engineering problems not only to you – engineers-physicists, but to all scientists, engineers and practitioners. So far no one in the world has managed to eliminate these obvious shortcomings! And this is necessary for advancing science, technology, and engineering». The main shortcomings of the periodic table were the following:
-
1. Rows (the so-called half-periods) in the designated periods have different lengths. The number of free cells is 37.
-
2. There are only two elements in the first row; moreover, hydrogen does not occupy a permanent place, and these two elements make up a whole period.
-
3. Lanthanides and Actinides were outside the table.
-
4. The group of inert gases discovered subsequently by scientists was added.
-
5. The position introduced later in the long-period table as a whole does not help the issue, the table continues to remain asymmetric. There are 7 periods, and 10 rows, that is, a half-period and a series are different mismatched concepts [2].
Many scientists and practitioners from different countries of the world, from well-known chemists to persistent practitioners, have made efforts to solve the proclaimed problem. From the numerous unsuccessful attempts to improve the periodic table, there follows the genius of D.I. Mendeleev and the extreme complexity of the task set by Academician Semyonov, the urgency of which is not questioned. At the same time, the universal striving for scientific and technical leadership in mastering the sixth technological order observed in the world economy indicates that informational modernization of the system of chemical elements is a subject of great importance [3].
This article presents a three-dimensional matrix of chemical elements as an identification-analytical tool that allows you to study a wide variety of physicochemical properties of already known and not yet open elements through the construction of dynamic energy models of the electronic shells of the elements themselves and their compounds. The universality of the volume matrix lies in the fact that in addition to the required sequence number and strict coordinate binding of chemical elements (or their cluster formations) to groups, there are wide possibilities for structural analysis of the physicochemical properties of elements, laws and regularities of their interactions using periodic orbital structures [3].
When studying the problems of periodicity, rather obvious assumptions were made. The world is multidimensional and is typically considered in spatial dimensions, and the table is two-dimensional. Furthermore, a more convincing idea was formulated of considering chemical elements from the position of their origin as materials of the Universe (atoms are stellar matter). During the formation and development of the Universe, at the first stage only hydrogen and helium existed and they should be at the head of the table or, more figuratively, of the three-dimensional matrix. Then light elements appeared and only stars with their high temperatures and pressures could synthesize heavy nuclei. The next assumption was that the creation of elements also took place in a spiral, as the Universe develops [4].
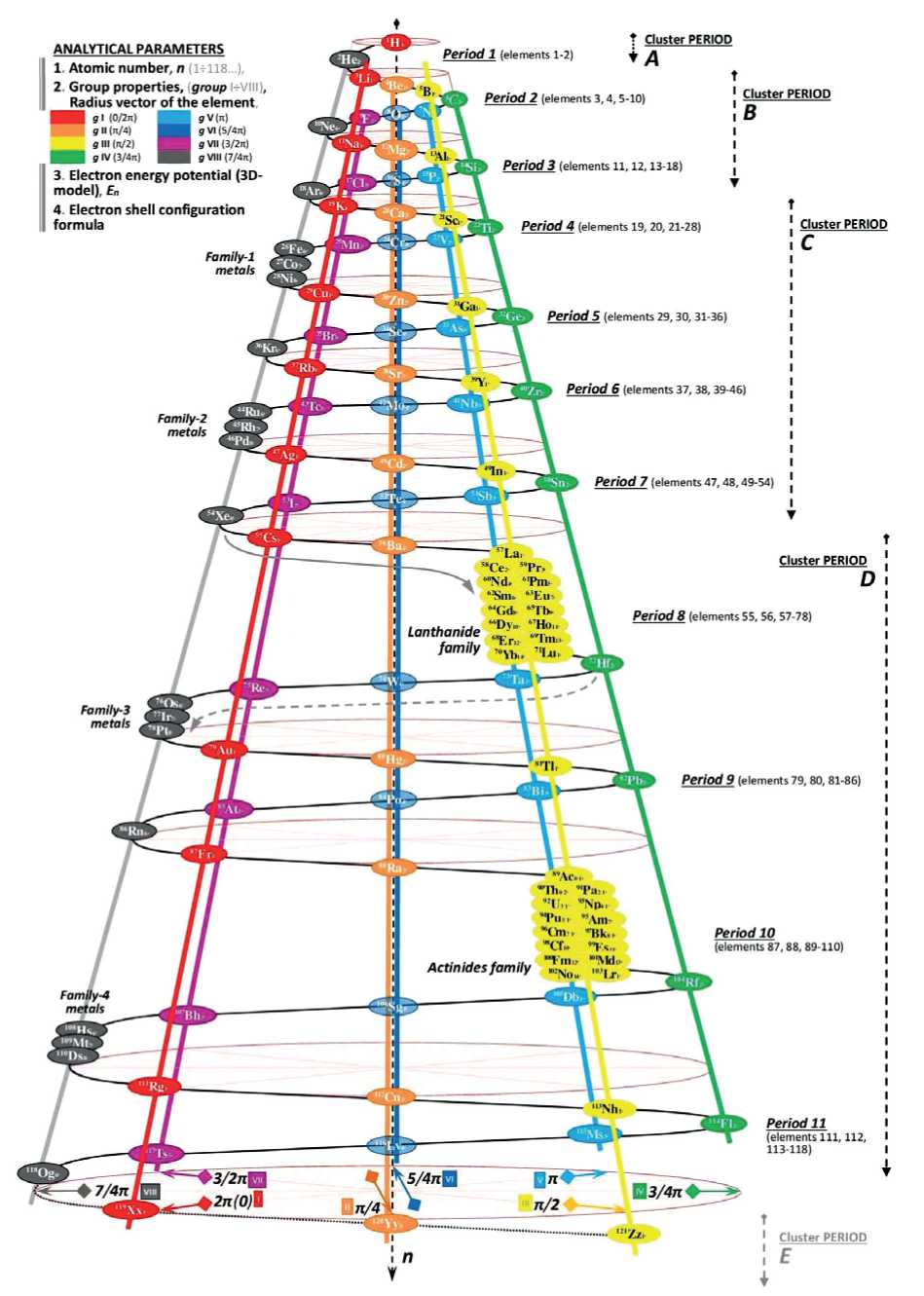
The three-dimensional matrix presents the indexes of chemical elements in the form of a continuous series of natural numbers from 1 to 118 and further, evenly distributed in a spiral from top to bottom (Fig. 1). The index number of the element coincides with the value of the nuclear charge and the same total number of energetically balanced electrons in the orbitals. The approach is universal with respect to both the short-term table of D.I. Mendeleev and the long-period IUPAC table.
The 3D-spiral matrix of chemical elements has 4 periodicity blocks [3]:
-
– in the first block A, the first elements of the emerging Universe are hydrogen and helium;
-
– the second block B consists of two identical periods of eight elements from lithium to argon;
-
– in block C, two additional cluster formations appeared: iron, cobalt, nickel and ruthenium, rhodium, palladium;
STRUCTURING OF CHEMICALS ELEMENTS • СТРУКТУРИРОВАНИЕ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Family-4
5/4nQ
Q3/4n
n/4
'3/2mQ
•2п(0)й
'Pm-
"гь.
Family-3 metals
Actinides family ш^
“Nd.
’ h2Sm.
MG(L
Lanthanide family
Tu., "Am. *On-, 41k., ЧТ- "kx„
■lm„ "Md,
^Съ
Famiiy-2 metals
ANALYTICAL PARAMETERS
Period 6 (elements 37,38, 39-46)
Period 7 (elements 47, 48,49-54)
Family-1 metals
Period 1 (elements 1-2)
Cluster PERIOD
Period 2 (elements 3,4, 5-10)
! Cluster PERIOD
♦ A
Period 3 (elements 11,12,13-18)
Period 4 (elements 19, 20, 21-28)
Period 5 (elements 29,30,31-36)
Cluster PERIOD
Periods (elements55, 56, 57-78)
Period 9 (elements 79, 80, 81-86)
Period 10
(elements 87,88,89-110)
Cluster PERIOD
Period 11 (elementsill, 112, 113-118)
i П V
f I
Cl uster PERIOD
1 Atomic number, n (14-118. .).
2 Group properties, group irVlII), Radius vector of the element
■ si
hi(n/2) [_____j plV(3/4n)
3 Electron energy potential (3Dmodel), En
4 Electron shell configuration formula
gv(n)
g VI (S/4n) g VII (3/2n) рМ11(7/4л)
Fig. 1. Three-dimensional periodic matrix of chemical elements
STRUCTURING OF CHEMICALS ELEMENTS • СТРУКТУРИРОВАНИЕ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
– in block D, the lanthanide and actinide families were additionally included, as well as two clusters: osmium, iridium, platinum, and hassium, maytnerium, and darmstadtium.
The form of the three-dimensional periodic matrix allowed structuring the anomalous families of the third (lanthanides and actinoids) and eighth (metalloids) groups of the third C and fourth D levels of block periodicity. In addition, the level formulas of electronic shells facilitate the formation of a model for studying the system regularities of periodicity, including saturation mechanisms and the interlevel valence transition through the distribution of electrons over different energy levels (orbitals, states) of the electron shells. The consistency of periodicity is relevant to the study of subtle mechanisms of interlevel transitions and stable failures of the synthesis of electronic orbitals.
In connection with the anniversary of the publication of the fundamental discovery of D.I. Mendeleev, it is appropriate to consider four levels of knowledge of the periodic law.
The first level corresponds to a generalization of the facts of changes in chemical properties depending on the structure of the nucleus and the increase in atomic masses.
The second level of knowledge corresponds to the introduction of the concept of periodicity of electron shell structure of atoms, which energetically balances the nuclear charge and demonstrates the repetition of similar types of electronic configurations of atoms as the atomic number (index number) increases.
The third level of knowledge is associated with the development of a periodic structure of electron-level orbitals of shells in the system of atomic energy levels, realized as a model of atomic-energy (valent) interaction.
The fourth level will make it possible to form methods and conditions for the formation of models of substances, taking into account the energy interactions of the chemical elements involved in this process.
The concept of block structure properties, which allows predicting chemical elements beyond the 118 th element based on electron-level formulas, should also be at-
Table 1
Energy levels of electron shells of chemical elements
|
s - elements |
p - elements |
d - elements |
f - elements |
|
№, denotation, Name of the elements |
Short electron STRUCTURE of energy shell completion in the atoms of chemical elements |
|
I ne snort DlOCK A |
Г energy level IT |
|
|
1 |
H Hydrogen |
|
|
2 |
He Helium |
K2 1st complete energy level K2 = 1 s2 |
|
Block В |
2 energy levels lC‘Lsp" |
||
|
3 |
Li |
Lithium |
КЧ1 |
|
4 |
Be |
Berillium |
|
|
5 |
В |
Boron |
КЧ2"1 |
|
6 |
c |
Carbon |
|
|
7 |
N |
Nitrogen |
kV2' |
|
8 |
0 |
Oxygen |
|
|
9 |
F |
Fluorine |
K2L2-5 |
|
10 |
Ne |
Neon |
K2L2 b 2-й заполненный энергетический уровень L2"b = 2s22pb |
|
3 энергетических уровня К5" LS-P'MS"P' |
|||
|
11 |
Na |
Sodium |
К6^ |
|
12 |
Mg |
Magnesium |
кЧ^м2 |
|
13 |
Al |
Aluminum |
k2l2-V"' |
|
14 |
Si |
Silicon |
кЧ^м2"2 |
|
15 |
P |
Phosphorus |
^L2^23 |
|
16 |
S |
Sulphur |
кч^м2"4 |
|
17 |
Cl |
Chlorine |
кЧ^м“ |
|
18 |
Ar |
Argon |
КЧ^М2"6 М2"в Е 3s23pb |
STRUCTURING OF CHEMICALS ELEMENTS • СТРУКТУРИРОВАНИЕ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Continuation of Table 1
|
Block C |
4 enerav levels |
||
|
19 |
К |
Potassium |
K^M^N1 |
|
20 |
Ca |
Calcium |
K2L2'VbN2 |
|
21 |
Sc |
Scandium |
КТ'У ^'М2 |
|
30 |
Zn |
Zinc |
K2L2' V6",0N2 3-й заполненный уровень M2'6*™ = 3s23pb3dw |
|
31 |
Ga |
Gallium |
kW1q^ |
|
32 |
Ge |
Germanium |
K2L2-6Tjf-6'10UM |
|
33 |
As |
Arsenic |
KW^N2"3 |
|
34 |
Se |
Selenium |
K^V6"^2-4 |
|
35 |
Br |
Bromine |
k2l2"V"6",uN2"5 |
|
36 |
Kr |
Krypton |
K2l2" V'wN2"b N^MsV |
|
5 enerav levels ie"-Ls"p'IVf"p"d"Ns"p"d'6s'p" |
|||
|
37 |
Rb |
Rubidium |
^Wo1 |
|
38 |
Sr Strontium |
k2l2Wo2 |
|
|
39 |
Y |
Yttrium |
^-b^^tf |
|
48 |
Cd |
Cadmium |
ti^'^d2 N^10 E 4s24pb4d,Q |
|
49 |
In |
Indium |
k2l2VW |
|
50 |
Sn |
Tin |
k2^6^-6"10^1^2-2 |
|
51 |
Sb |
Antimony |
^-б^-б-ЗО^-МО^-З |
|
52 |
Те |
Tellirium |
|
|
53 |
1 |
Iodine |
K^ivrVW |
|
54 |
Xe |
Xenon |
K2L2"bM i‘b"wN2"M V"b O2"b e 5s25pE |
|
block D |
6 enerav levels le Ls-p-IVf-p-a Ns p-a ,-Os-p-d-ps-p- |
|||
|
55 |
Cs |
Cesium |
||
|
56 57 70 71 80 81 |
Ba La Yb Lu Hg Tl |
Barium Lanthanum Ytterbium Lutetium Mercury Thallium |
,и0^ ^^^«-’" М^-'-р^ p‘ 4 K^Lf^y^^O2 tiP2 N^"10'14 = 4s24p64d’u4f14 ^2^2-6^b'1 °^6-10-1 4q2-6-1 p2 K^^s^^ СГь^Е5з25рС5и1и ^2£ 2-ti Д/^"6'7 U f^b" 7 ^ 7 4Q 2"b"1 0 p 2-1 |
|
|
82 |
Pb |
Lead |
к2к2-ь1^"в- 10^-6-10-1402-6-1 Up2-2 |
|
|
83 84 |
Bi Po |
Bismuth Polonium |
^2^ 2- b^-b-1 0^2- 6-10-1 4q 2-6-1 0 p 2-3 1^2^2-6^-6-10^-6-10-1402-6-3 0p2-4 |
|
|
85 86 |
At Rn |
Astatine Radon |
1^2[2-6l^p-6-101^-6-10-1402-6 3 0p2-5 1^2^2-6iy^-6-10^>-6-10-1402-6-1 Up2-b p2-b _ |
6s26pb |
|
7 enerav levels K=-L=-p-lvf;-p-a-l^-p-a-"os-p-a-,-ps-p-a-cls-p- |
||||
|
87 |
Fr |
Francium |
^2^2-b^-e-7y^2-6-7O-74Q2-61Up2-6Ql |
|
|
88 |
Ra |
Radium |
||
|
89 |
Ac |
Actinium |
1^2 ^2-b ^^-6-10 i^4-b-1 U-14^^2-6-1 Up2-6-1 ^^^ |
|
|
4 |
||||
|
103 |
Lr |
Lawrencium |
1^2i_2-bi^4-b-lU i^mI-O- 1U- f402.-D- 1 U- I4p2-b- 1 q2 |
|
|
4 |
||||
|
112 |
Cn |
Copernicium |
1^2^2-6jy^-b-1 u^-b-1 U-1402-6-1 U-l4 p2-b-1U Q2 p2-61U |
= 6s26pb6dw |
|
113 |
Nh |
Nihonium |
1^21_2-6 iy^-6-10^-6-10-1402-6-1 0-14p2-6-1 0q2-1 |
|
|
114 115 |
Fl Me |
Flerovium Moscovium |
p^2 ^2-6 i^j4 -b-10 i^2-b-10-14^02-6-1 0-14p2-6-1 0^^2-2 1^2 ^2-b ^-6-10 ^l-b-10-1402-6-1 0-14^-6-1002-3 |
|
|
116 117 |
Lv Ts |
Livermorium Tennessine |
к2^^-6-1 01^2-6-10-1402-6-1 0-14p2-b-lUQ2-4 1^21_2-6^-6-101^-6-10-1402-6-1 O-l 4p2-b-l uQ2"b |
|
|
118 |
Og |
Oganesson |
1^2j_2-b 1^2-6-10 ^2-6-10-1402-6-1 0-14pZ-b-1U0^6 Q2b = |
7s27pb |
STRUCTURING OF CHEMICALS ELEMENTS • СТРУКТУРИРОВАНИЕ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Continuation of Table 1
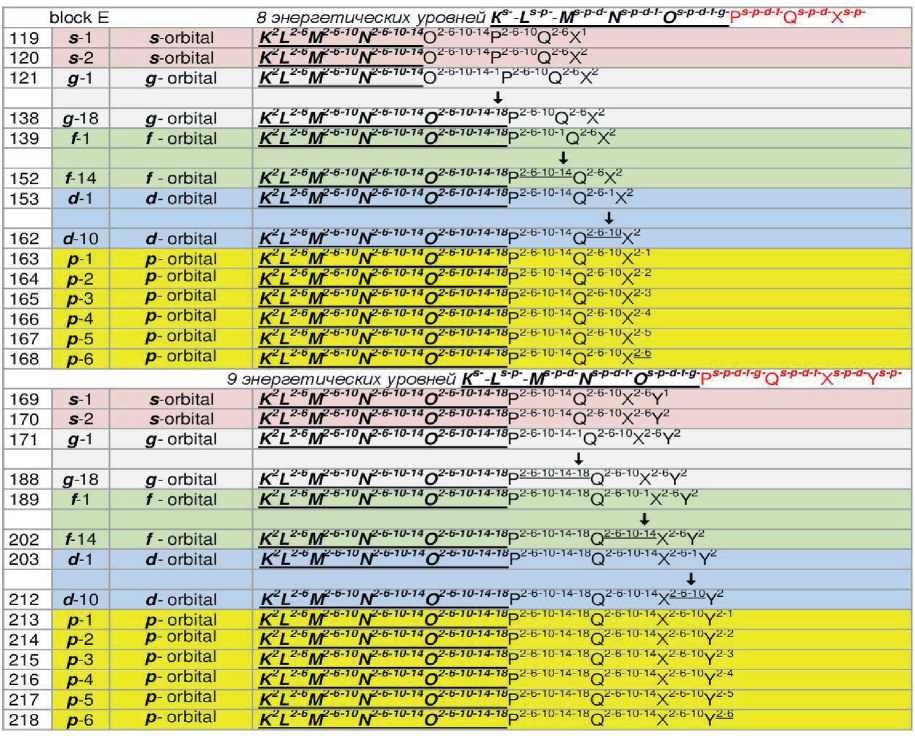
tributed to this. Tab. 1 shows the electron-orbital formulas of chemical elements for all blocks, including the fifth E block, which covers elements from 119 to 218.
From the standpoint of physics, it is advisable to consider the result of energy interactions that determine all the properties of a substance. There may be two approaches that define two energy models of the structural representation of matter. One model using electronorbital formulas (formal) (Table 1), and another model (physical) from the standpoint of structuring based on quantum phenomena and physical constants.
The physical method is different from the formal one in that it is based on the causal correspondence of the energy interactions of the physical fields (cause) of the space-time position of the electrons of the shells of ho-
mogeneous and heterogeneous chemical elements (consequence). This situation is similar to the concepts of classical mechanics and can be determined by a number of constants [4].
CONCLUSION
Further research on the formation of substance structures and the assessment of its influence on all types of interactions are the strong and weak electromagnetic and gravitational fields, which will be characterized by fundamental physical constants. The authors will continue research on the consideration of those constants that affect the processes of structure formation and the creation of new types of structural materials.
STRUCTURING OF CHEMICALS ELEMENTS • СТРУКТУРИРОВАНИЕ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
ВВЕДЕНИЕ
В январе 2019 года Мировое сообщество отметило 150-летие величайшего открытия в области фундаментальных научных знаний – опубликования периодической таблицы химических элементов Д.И. Менделеева – и представляется актуальным высказать некоторые соображения, связанные с современными задачами научно-технического развития.
В конструкционном материаловедении главной задачей является получение вещества с высокими эксплуатационными характеристиками, и неизбежно приходится обращаться к научной основе естествознания, периодическому закону Д.И. Менделеева. Сам автор выдающегося закона неоднократно возвращался к вопросам его «незавершенности и практических неясностей, в том числе к причинам закона кратных отношений, различия элементов и изменения их атомности, и в то же время нужно понять, что такое масса и тяготение» [1]. И если первая часть задачи наукой о веществе практически решена, то понимание второй её части актуально до сих пор.
ОСНОВНАЯ ЧАСТЬ
Важный перечень вопросов в плане совершенствования знаний о периодичности озвучил лауреат Нобелевской премии академик Н.Н.Семёнов в постановочной лекции 1951 года перед студентами Физтеха: «Цель ясна – после устранения недостатков обнаружатся новые свойства и взаимосвязи элементов, что позволит проводить большинство научных исследований на новом, более высоком уровне и решать стоящие инженерные задачи не только вам – инженерам-физикам, а всем ученым, инженерам и практикам. Устранить эти очевидные недостатки пока никому в мире не удалось! А это необходимо для продвижения науки, технологий, техники и инженерии вперед». Озвучены главные недостатки периодической таблицы:
-
1. Ряды (так называемые полупериоды) в обозначенных периодах имеют разную длину. При этом число свободных мест – клеток 37.
-
2. В первом ряду элементов всего два; к тому же водород не занимает постоянного места, а эти два элемента составляют целый период.
-
3. Лантаноиды и Актиноиды оказались за пределами таблицы.
-
4. Добавилась открытая впоследствии учеными группа инертных газов.
-
5. Введенная позже длиннопериодная таблица положения в целом не спасает, таблица продолжает оставаться асимметричной. Периодов 7, а рядов 10, то есть полупериод и ряд – разные несовпадающие понятия [2].
К разрешению провозглашенной проблемы приложили усилия многие ученые и практики из разных стран мира, от известных химиков до настойчивых практиков. Из многочисленных безуспешных попыток усовершенствовать периодическую таблицу следует гениальность Д.И. Менделеева и чрезвычайная сложность поставленной академиком Н.Н. Семёновым задачи, актуальность которой никто не ставит под сомнение. Вместе с тем, наблюдаемое в мировой экономике всеобщее стремление к научно-техническому лидерству в освоении VI-го технологического уклада свидетельствует о том, что информационная модернизация системы химических элементов является предметом большой значимость [3].
В настоящей статье представлена объемная матрица химических элементов в качестве идентификационно – аналитического инструмента, который позволяет изучать большое многообразие физикохимических свойств уже известных и еще не открытых элементов через построение динамических энергетических моделей электронных оболочек собственно элементов и их соединений. Универсальность объемной матрицы состоит в том, что помимо обязательного порядкового номера и строгой координатной привязки химических элементов (либо их кластерных образований) к группам имеются широкие возможности структурного анализа физико-химических свойств элементов, законов и закономерностей их взаимодействий с использованием орбитальных структур периодичности [3].
При изучении проблем периодичности в качестве идеи были сформулированы достаточно очевидные положения. Мир многомерен и, как правило, рассматривается в пространственных измерениях, а таблица – двухмерная. Далее была сформулирована более убедительная идея рассмотрения химических элементов с позиции их происхождения в качестве материалов Вселенной (атомы – это звездная материя). При образовании и развитии Вселенной на первом этапе существовали только водород и гелий, и они должны быть во главе таблицы или, что более образно, объемной матрицы. Затем возникли легкие элементы, и только звезды с их высокими температурами и давлениями могли синтезировать тяжелые ядра. В качестве следующего предположения было принято, что создание элементов так же происходило по спирали, как развивается Вселенная [4].
На объемно-каркасной матрице представлены номера химических элементов в виде непрерывного ряда натуральных чисел от 1 до 118 и далее, равномерно распределенных по спирали сверху вниз (рис. 1). Порядковый номер элемента совпадает с величиной заряда ядра и таким же суммарным количеством энергетически уравновешивающих электронов на орбиталях оболочек. Подход универсален как по
STRUCTURING OF CHEMICALS ELEMENTS • СТРУКТУРИРОВАНИЕ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
АНАЛИТИЧЕСКИЕ ПАРАМЕТРЫ
-
1. Атомный номер, п (1^118...),
-
2. Групповые свойства group 1-rVIII), ра диус-вектор элемента
=Нгг
период 1 (элементы 1-2)
период 2 (элементы
f БЛОКА
^ первый Орбитальный s-уровень
з, 4, 5-10}
д\ (0/2п) 9 II (П/4) дШ(п/2) д IV (3/4л)
gV(n)
д VI (5/4п)
д VII (3/2л)
д VIII (7/4п)
3 Электронный энергетический потенциал (ЗО-модель), Еп
период 3 (элементы 11,12,13-18)
"Th^
БЛОК В второй Орбитальный s-p-уровень
4 Электронная уровневая формула элемента
период 4 (элементы 19, 20,2136)
f БЛОКС
I третий
I Орбитальный
I s-d-р-уровень
семейство металлов-1
Mo,
'"Zt?) период 5
(элементы 37, 38, 39-54)
семейство металлов-2
Т
период 6
(элементы 55, 56,57-85)
БЛОК D четвертый Орбитальный s-f-d-р-уровень
семейство металлов-3
се Met мета.
юв-4
Д2дШ
п/4
Лантаноидов
период 7
(элементы 87, 88, 89-118)
семейство Актиноидов
5/4пП
t БЛОКD
I пятый
I Орбитальный
I s-g-f-d-р-уровень
i
Рис.1. Объемная периодическая матрица химических элементов
STRUCTURING OF CHEMICALS ELEMENTS • СТРУКТУРИРОВАНИЕ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ отношению к короткопериодной таблице Д.И. Менделеева, так и длиннопериодной таблице IUPAK.
3D-спирально пространственная расходящаяся система каркаса матрицы химических элементов имеет 4 блока периодичности [3]:
– в первом блоке A представлены первые элементы народившейся Вселенной, водород и гелий;
– второй блок B образуют два одинаковых периода из восьми элементов от лития до аргона;
– в блоке C появились два дополнительных кластерных образования: железо, кобальт, никель и рутений, родий, палладий;
– в блоке D дополнительно включились семейства лантаноидов и актиноидов, а также два кластера: осмий, иридий, платина и хассий майтнерий, дармштадтий.
Пространственная форма объемной периодической матрицы позволила структурировать аномальные семейства III-й (лантаноиды и актиноиды) и VIII-й (металлоиды) групп третьего C и четвертого D уровней блочной периодичности, а уровневые формулы электронных оболочек облегчают формирование модели изучения системных закономерностей периодичности, включая механизмы насыщения и межуровневого перехода валентности через распределение электронов по разным энергетическим уровням (орбитали, состояния) электронных
оболочек. Системность периодичности актуальна при изучении тонких механизмов межуровневых переходов и устойчивых сбоев процесса синтеза электронных орбиталей.
В связи с международным юбилеем опубликования фундаментального открытия Д.И. Менделеева уместно рассматривать четыре уровня познания периодического закона.
Первый уровень соответствует обобщению фактов изменения химических свойств в зависимости от структуры ядра и возрастания атомных масс.
Второму уровню познания отвечает введение понятия о периодичности структуры электронной оболочки ядра атома, энергетически уравновешивающей заряд ядра и демонстрирующей повторение сходных типов электронных конфигураций атомов по мере увеличения атомного номера (порядкового номера элемента).
Третий уровень познания связан с разработкой периодической структуры электронно-уровневых орбиталей оболочек в системе энергетических уровней атома, реализующих в виде модели атомно-энергетического (валентного) взаимодействия.
Четвертый уровень позволит сформировать методы и условия формирования моделей веществ с учетом энергетических взаимодействий химических элементов, участвующих в этом процессе.
Таблица 1
Энергетические уровни электронных оболочек атомов химических элементов
| $ • элементы | р - элементы [ d - элементы ] f - элементы
|
№, химический знак, название элемента |
краткая электронная СТРУКТУРА заполнения энергетических уровней электронных оболочек атомов химических элементов |
||
|
блок А короткий 1 энергетический уровень 1Г |
|||
|
1 |
Н |
Водород |
К |
|
2 |
Не |
Гелий |
К1 1-й заполненный энергетический уровень К* = 1s2 |
|
блок В |
2 энергетических уровня |
||
|
3 |
Li |
Литий |
KZL |
|
4 |
Be |
Бериллий |
|
|
5 |
В |
Бор |
Kt2'1 |
|
6 |
С |
Углерод |
|
|
7 |
N |
Азот |
^L23 |
|
8 |
О |
Кислород |
|
|
9 |
F |
Фтор |
|
|
10 |
Ne |
Неон |
KZL2 6 2-й заполненный энергетический уровень I26 = 2s22p° |
|
3 энергетических уровня ^L^M*^ |
|||
|
11 |
Na |
Натрий |
|
|
12 |
Mg |
Магний |
k47sm2 |
|
13 |
Al |
Алюминий |
kW |
|
14 |
Si |
Кремний |
КХ^М22 |
|
15 |
P |
Фосфор |
kT^m23 |
|
16 |
S |
Сера |
КУ М24 |
|
17 |
Cl |
Хлор |
|
|
18 |
Ar |
Аргон |
k47®m2 6 м2Ь = 3s23pb |
STRUCTURING OF CHEMICALS ELEMENTS • СТРУКТУРИРОВАНИЕ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
|
блок C |
6 энергетических уровней KsLsP-M=p-aMsPa-,-os-P-apsP- |
|||
|
55 |
Cs |
Цезий |
||
|
56 |
Ba |
Барий |
K2L2bM2-b’,0N2OWO2bP2 |
|
|
57 |
La |
Лантан |
K2L2^6"UN2D1UO2D,P2 |
|
|
I |
||||
|
70 |
Yb |
Иттербий |
KZL2.bM2.6.10N-2.6..0.140Z.tip2 |
N,.™ ^ 4s24 ti4(jW4f1. |
|
71 |
Lu |
Лютеций |
К21_2-6М^10^-6-10-14^2-6. A p2 |
|
|
4 |
||||
|
80 |
Hg |
Ртуть |
К2 L 2"b M "2" b'1 °N2 ’^w*14 Q2b'1u p 2 |
O2-6'™ = 5s25p65d1u |
|
81 |
T1 |
Таллий |
K2L2"6 M2'6"10 N2'6*10" 1 °p2 1 |
|
|
82 |
Pb |
Свинец |
kzl'26m2 t-105- lb- > ^Q-'-L 1 Up2-j |
|
|
83 |
Bi |
Висмут |
^^7-yM0^.MU-i«y7-6-1Lp; "J |
|
|
84 |
Po |
Полоний |
^2^2-bj^Tbn^jTBT?CM |
|
|
85 |
At |
Астат |
^2 ^з-ь ^б-ю ^-b-w-i 4 Qj-biUpZ-b |
|
|
86 |
Rn |
Радон |
К2Ь2ЬМ2'^10 N2'^10"14 O2-b"1UP^ |
P2"6 = 6s26ps |
|
7 энергетических уровней К6 L^'M5"1 |
»-d-^po-r-QS-p-S7-pS-p-d-QS-p- |
|||
|
87 |
Fr |
Франций |
||
|
88 |
Ra |
Радий |
K^L3-sM^’0'N^’8-»o«Wp2^ |
|
|
89 |
Ac |
Актиний |
K"L2"bM2"b",uN2b",t,"’4O2'ti"JP2'o"'Q2 |
|
|
4 |
||||
|
103 |
Lr |
Лоуренсий |
K2L2bM2b"1 °N26"10"14O2'b" 10-14p2-b'1 q2 |
|
|
112 |
Cn |
Коперниций |
K2L2'°/Wz"6* 10 M2*6"10"1 ’о2*6-10-14 p2-t>- W q2 |
P2-s'10 = 6s26p°6d ° |
|
113 |
Nh |
Нихоний |
^2^Z-b^2-t>-1U^Z-e>-7U.MQ2-ti-1U-14p2-b-1uQ2-1 |
|
|
114 |
Fl |
Флеровий |
^2^Z-bj^2-t>-7U^Z-ti-7O-7 4Q2-tF1U*14p2 b 1uq2-2 |
|
|
115 |
Me |
Московий |
k2l2-6m2 5-1 0^2-6-10- Mq2-6- 1U-14p2-b-1 Uq2-3 |
|
|
116 |
Lv |
Ливерморий |
^2£2'6 J IO- 7 4q2-6- 1U-14p2-6-1 Dq 2-4 |
|
|
117 |
Ts |
Теннессин |
^^2^2-b/^y2 b"^4Q2 b'^"^^p2 b"^^Q2"^ |
|
|
118 |
og |
Оганесон |
^2^Z-b^y2-b- 7U^2-b-7U-7 4Q2-6-TU-T4p2-b-lUQ22b |
7s/pb |
Продолжение таблицы 1
|
блок С |
4 энергетических уровня K,.L,.p.Ms.p.d.N«.p. |
|||
|
19 |
К |
Калий |
||
|
20 |
Са |
Кальций |
||
|
21 |
Sc |
Скандий |
К^М2*^2 |
|
|
4 |
||||
|
30 |
Zn |
Цинк |
3-й заполненный уровень М^ = 3s23p 3d u |
|
|
31 |
Ga |
Галлий |
||
|
32 |
Ge |
Германий |
||
|
33 |
As |
Мышьяк |
Kiev^1u^i |
|
|
34 |
Se |
Селен |
К2^6**2^24 |
|
|
35 |
Br |
Бром |
K‘L' ^ ° |
|
|
36 |
Kr |
Криптон |
N2b = 4s24pb |
|
|
5 энергетических уровней Ks.L*PMsP-a^*'Pa-o*P- |
||||
|
37 |
Rb |
Рубидий |
||
|
38 |
Sr |
Стронций |
wn.-.»O2 |
|
|
39 |
Y |
Иттрий |
^L^M2 ^’"N2*1©2 |
|
|
4 |
||||
|
48 |
Cd |
Кадмий |
N^10 = 4s24p°4d1u |
|
|
49 |
In |
Индий |
^^b^b-W^OQ^ |
|
|
50 |
Sn |
Олово |
K2L М2Ь",0М2,И UO2 2 |
|
|
51 |
Sb |
Сурьма |
||
|
52 |
Те |
Теллур |
^L^b’»^^.» |
|
|
53 |
I |
Йод |
^b^blU^^QZ , |
|
|
54 |
Xe |
Ксенон |
K/lW^N2* "О2"*1 |
O2 6 = 5s25pb |
STRUCTURING OF CHEMICALS ELEMENTS • СТРУКТУРИРОВАНИЕ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Окончание таблицы 1
|
блок E |
8 энергетических уровней 1?-.СР^р*^р-<”сГры |
||
|
119 |
s-1 |
s-орбиталь |
К1 L2'6 М2^10 |
|
120 |
s-2 |
s-орбиталь |
^2 L2-biyi2"^‘1^l^2'^"^"^Q2‘^^''^p2‘'b-^^^2-^Xy |
|
121 |
g-1 |
g- орбиталь |
^2 2-by^2-6>-7 U^2-t>-7 U-7 4 q2-6- TIT-74-1p2-6-1UQ2-b^2 |
|
138 |
g-18 |
g- орбиталь |
^2^61^2-6-10^2-5-10-14 q2 6-10-14-18p2 CTUQ2.bx2 |
|
139 |
f-1 |
f- орбиталь |
^2^2Ьд^2-6-10^2М0-14у2Ь-10-,4-18р^Ь-1и1у^Ьх^ |
|
152 |
f-14 |
f- орбиталь |
^2^2-biyi2-6-1U^2-6-W-14Q2-b-W-14-Wp 2-ti-1U14 Q2 by2 |
|
153 |
d-1 |
d- орбиталь |
K2L2"bM2"6"'0N2"b"w",4O2"b"w"l4,ePz"ti'1u 14Qztl'1X'2 |
|
162 |
d-10 |
d- орбиталь |
^L '^M^1 u^'^ w* 1^0^ W-14- 18 p2-b-1U-1 4q2^1L^2 |
|
163 |
P-1 |
p- орбиталь |
^^^^"^(^^ ^* ^ ^/V^ ^ ^"^ "^O^ ^ fU-f 4-f Sp2-5-1U-l 4q2-6- 1L у ^-* |
|
164 |
P-2 |
p-орбиталь |
K2L-2.bM2.6-10N'2.6-l'0-14o2-frW.14-18p2. i-1U-1dQ2-ti-W^2-2 |
|
165 |
p-3 |
p-орбиталь |
l>ml!-8-fl)^!-8-imQ5-e-lfl-l^-!8p2-e-iu 14q2*Wx2-3 |
|
166 167 |
p-4 p-5 |
p-орбиталь p- орбиталь |
K2L2 bM2 b-1uN2 b-,U.’402.^W.,4.,8p2 b W 14q2 B WX2 4 ^^ ^'^^ ^®"^4-yrip2*MU-1NQj2-ti-1U^2*b |
|
168 |
p-6 |
p- орбиталь |
^2L2"6m2'6'10N2 6'w'14O2 6‘w"’4'’8PZ 6‘1u''AQ2 B'wXtii |
|
9
энергетических уровней Ks-.Ls'i |
|||
|
169 |
s-1 |
s-орбиталь |
^2^2-Ь^12-Ь-1и^2-Ь-1и-1402-Ь-1О-14-1«р2-й-ЛиЛА^2Ь-1к)у2^ |
|
170 |
s-2 |
s-орбиталь |
K2L2'bM2"B"1uN2"ii"'0:T4O2:5:ni:Ti:^Pz*-'u"1ACiz''s"1uXz"tiVz |
|
171 |
g-1 |
g- орбиталь |
^2Libiyi2B-^M2'ti"'B^O2"6"'®"'1"'®Pz"ti"'u"'A1Q'f:e:'uX2"BVz |
|
188 |
g-18 |
g- орбиталь |
K2L2bM2-b-1 U ^2-Ъ-10-14 ^^4-b-1O-14-18 p 2-0-1U-14-1 6^ 2-0-1U ^2 ■ b ^2 |
|
189 |
M |
f- орбиталь |
^2^2b^,2-b-1U^2-b-W-14o2b-1U-14-1Sp24>1U,lA-1«Q2-6^V-1y2 -By2 |
|
202 203 |
f-14 d-1 |
f- орбиталь d- орбиталь |
K2L2bM2-6-1U ^-2-0-10-14 02-Ь.1О-14-18р2-6ЛиЛАЛво2^Д1И4у2-бу2 K2L2bM'"6''uN2"ll"1v"14O2"t,",v",4",aP2'0"1u 4"8Q2>>'1u'1‘lX2'ti'1Y2 |
|
212 |
d-10 |
d- орбиталь |
1^2 j_2-b ^j2.6.1U^-2-b.10-14Q2-b-10-14-18p2-b.10-* A-* tiQ2-^U-lAy^^y2 |
|
213 |
p-1 |
p- орбиталь |
l^2[_2"Ь(у12-6-’о1^'2-(>-<6-’«02 ьЮТП8р2-ЬЛи lA^bQZ.e-IU-ISyj-b.lUyn |
|
214 |
P-2 |
p-орбиталь |
^^^^‘^^ 1^2-6-10-14^^2-610-14-1 Ур2 0-111-14-1 Cq2-(>-1 U-14^2 -0- 1U^2 2 |
|
215 |
p-3 |
p-орбиталь |
K'L2 bM2 ®"*u/^2'®"*®■ijQ2TCT7rm3p2-ti-nU-14-,IBQ2-6-1U-14y2-ti-1UY'2-'3 |
|
216 |
p-4 |
p- орбиталь |
^2^2-bj^2-b.1UjY2-6.iti-14o2-6.iO-<4-18p2-6-1U-1A-1bQ2-6-1U-1Ay2-6-1UY2-4 |
|
217 |
p-5 |
p- орбиталь |
^2^2-bj^2-6-luiY2-b-10-14Q2t>-W-14-,8p2.6.1U-14.1bQ2-ti-1U-14y2-b-1UY2-b |
|
218 |
p-6 |
p- орбиталь |
K2t_z ьМ2 Ь",иМ21>"1о",4О2 b"lu ,4"lilPZ 0'1UJIA'1bQ2’6"1u"1'lX2 b AUY— |
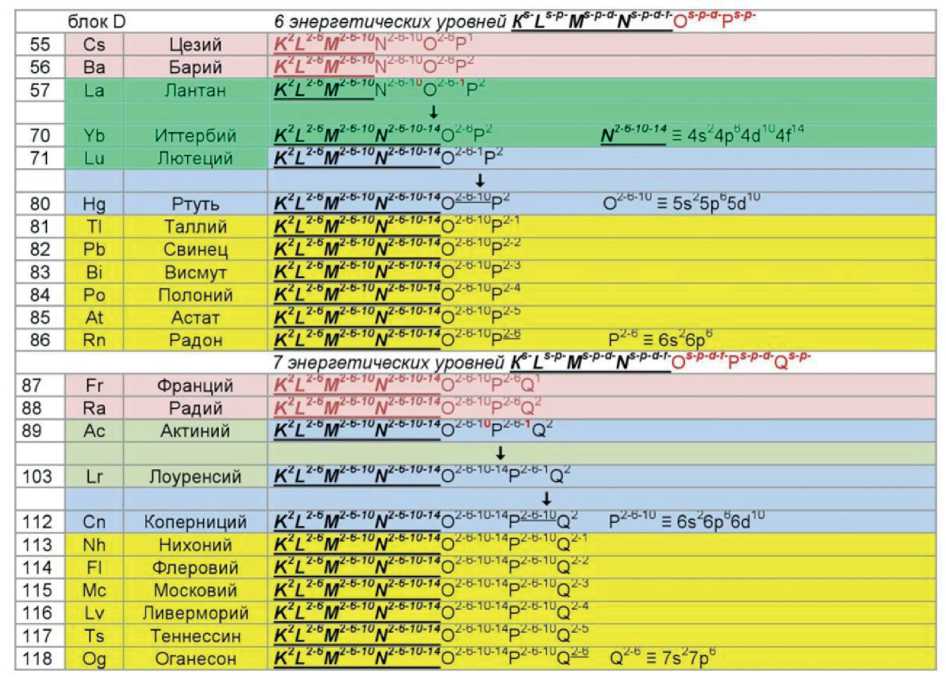
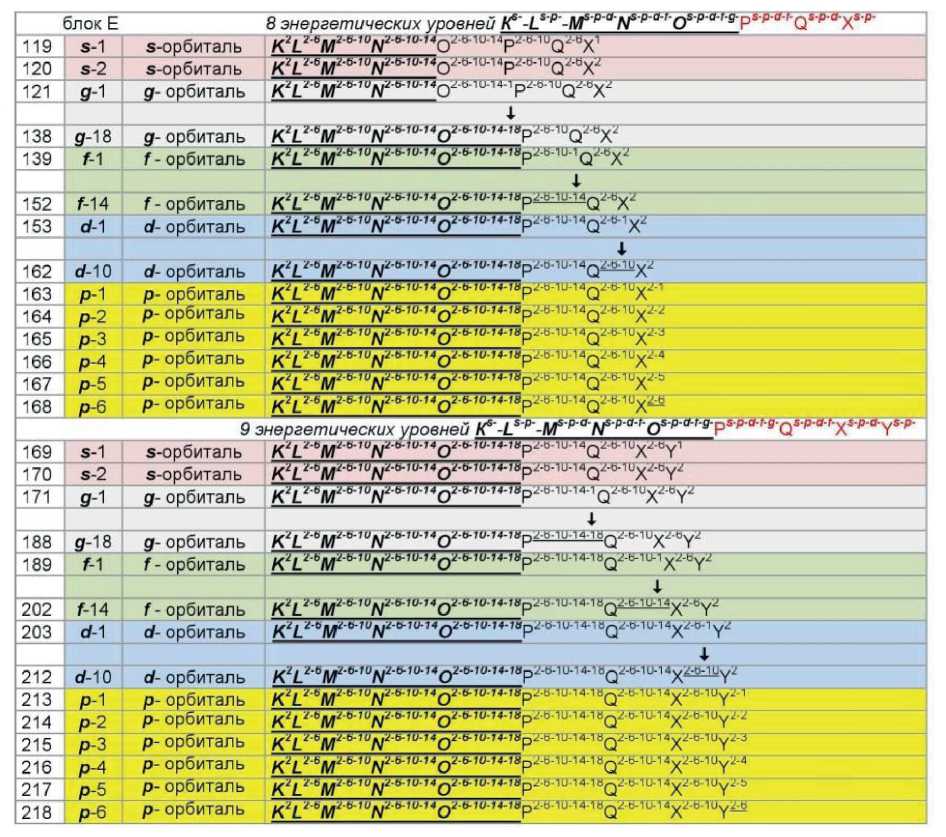
К этому же следует отнести понятие о свойствах блочной парности структур, позволяющее на основе электронно-уровневых формул прогнозировать химические элементы за пределами 118-го элемента. В табл. 1 представлены электронно-орбитальные формулы химических элементов для всех блоков, в том числе 5 блока Е, включающего элементы со 119 по 218.
С позиции физики целесообразно рассмотреть результат энергетических взаимодействий, определяющих все свойства вещества. При этом могут быть два подхода, которые определяют две энергетические модели структурного представления вещества. Одна модель с использованием электронно-орбитальных формул (ЭОФ) (табл. 1), другая модель физическая с позиций структурирования на основе квантовых явлений и физических констант (ФК).
Физический метод по сравнению с формальным отличается тем обстоятельством, что он основан на
причинно-следственном соответствии энергетических взаимодействий физических полей (причина) пространственно-временного положения электронов оболочек однородных и разнородных химических элементов (следствие). Это положение аналогично представлениям классической механики и может быть определено рядом констант [4].
ЗАКЛЮЧЕНИЕ
Дальнейшие исследования по формированию структуры вещества в направлении оценки влияния всех видов взаимодействия: сильные и слабые электромагнитные и гравитационные поля, которые будут характеризоваться фундаментальными физическими константами. Авторы продолжат исследования по рассмотрению тех констант, которые влияют на процессы структурообразования и создание новых видов конструкционных материалов.
STRUCTURING OF CHEMICALS ELEMENTS • СТРУКТУРИРОВАНИЕ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Список литературы Закономерности блочного подхода для анализа структуры химических элементов и проблемы материаловедения
- Менделеев Д.И. Основы химии. М.-Л.: Государственное научно-техническое изд-во химической литературы. В 2-х томах. 13-е издание. – 1947. – Т. 1 – 624 с.; Т. 2 – 708 с.
- Гусев Б.В., Сперанский А.А. Объемная периодическая матрица химических элементов. Техника и технология силикатов. – 2018. – Том 25, № 2. – 34–38 с.
- Гусев Б.В., Сперанский А.А. и др. Матричное представление периодичности системы химических элементов. Русский инженер. – № 4, 52 – 57 с.
- Рис М. Всего 6 чисел: главные силы, формирующие Вселенную / Мартин Рис, пер. с англ. – М., Альпина ионфикшн. – 2018. – 226 с.


