Закономерности изменений цитокинового статуса при хроническом лимфолейкозе и их роль в патогенезе прогрессирующих форм заболевания
Автор: Жевак Т.Н., Чеснокова Н.П., Шелехова Т.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Физиология и патофизиология
Статья в выпуске: 2 т.8, 2012 года.
Бесплатный доступ
Цель работы: изучить и проанализировать результаты исследования цитокинового профиля крови больных В-клеточным хроническим лимфолейкозом. Материалы и методы. Проведено комплексное обследование 60 больных с В-клеточным хроническим лимфолейкозом. Больные рандомизированы в 4 группы наблюдения в соответствии со стадией заболевания (классификация Rai К. R., 1975). В целях диагностики хронического лим-фолейкоза наряду с общепринятыми методами оценки общесоматического статуса и гематологических показателей использовался метод проточной цитометрии для установления иммунофенотипа В-лимфоцитов. Уровни цитокинов определялись методом иммуноферментного анализа. Результаты. Закономерной особенностью изменения цитокинового статуса на различных стадиях развития хронического лимфолейкоза является увеличение содержания в сыворотке крови интерлейкина-4, интерлейкина-6 и интерлейкина-7, интерлейкина-10 и фактора некроза опухоли-альфа, что может быть одним из ведущих патогенетических факторов нарушений межклеточного взаимодействия в лимфоидной ткани в динамике развития хронического лимфолейкоза. Заключение. Возрастание показателей содержания в крови указанных цитокинов может быть использовано в качестве диагностических критериев течения патологии, для оценки эффективности комплексной терапии заболевания, а также дополнить существующие классификационные признаки тяжести течения заболевания
Апоптоз, хронический лимфолейкоз, цитокины
Короткий адрес: https://sciup.org/14917501
IDR: 14917501
Текст научной статьи Закономерности изменений цитокинового статуса при хроническом лимфолейкозе и их роль в патогенезе прогрессирующих форм заболевания
Адрес: 410056, г. Саратов, ул. Бахметьевская, 34/42, кв. 215.
Тел.: +79272261977.
тивные, патогенетически обоснованные принципы комплексной терапии заболевания.
В основе инициирующих механизмов развития ХЛЛ лежит перманентная антигенная стимуляция В-системы лимфоцитов, сопровождающаяся формированием «многошагового» канцерогенеза. Как известно, функции лимфоидной ткани чрезвычайно многообразны и в значительной мере определяются гетерогенностью состава лимфоцитов крови и тканей различных органов и соответственно полимодальностью их биологических локальных и системных эффектов. Одной из важных функций лимфоидной ткани, наряду с моноцитарно-макрофагальной системой, является продукция цитокинов.
Установлено, что цитокины — это биологически активные вещества пептидной природы, регулирующие широкий спектр процессов, протекающих в организме. Термин «цитокины» был предложен Cohen S. в 1974 г. Являясь ответом на различного рода воздействия, цитокины выступают в роли регуляторов основных этапов жизнедеятельности клеток организма, модулируя процессы пролиферации, дифференцировки, миграции, специализированного функционирования, апоптоза [1–3].
Цитокины имеют ряд общих биохимических и функциональных характеристик, отличающих их от других классов регуляторных молекул. Среди этих характеристик важнейшими считаются следующие: плейотропность и взаимозаменяемость биологического действия, отсутствие антигенной специфичности, проведение сигнала путем взаимодействия со специфическими клеточными рецепторами, формирование цитокиновой сети [4].
В настоящее время уделяется достаточно большое внимание изучению роли ряда цитокинов в патогенезе онкологических заболеваний, в частности фактора некроза опухоли (TNF-α). В соответствии с данными литературы, TNF-α является одним из классических ингибиторов развития стадии промоции, обладая цитотоксическим эффектом за счет индукции образования и освобождения свободных радикалов, а также ухудшения оксигенации и трофики опухолевой ткани в связи с нарушением коагуляционного гемостаза и реологических свойств крови. Особенностью биологического действия TNF-α является и подавление апоптоза малигнизированных клеток, что приводит к их активации и развитию неконтролируемой пролиферации [4, 5]. Характер и механизмы нарушения продукции TNF-α при ХЛЛ, а также его значение в развитии опухолевой прогрессии при указанной патологии остаются в значительной степени неизученными.
В то же время представляет большую теоретическую и практическую значимость изучение баланса таких цитокинов, как интерлейкин-4 (IL-4), интерлейкин-6 (IL-6), интерлейкин-7 (IL-7) и интерлейкин-10 (IL-10) при ХЛЛ различной степени тяжести. Это положение может быть аргументировано данными литературы, в соответствии с которыми важная роль в механизмах индукции пролиферации лимфоидных клеток В-линейной принадлежности, развитии стадии промоции в случае онкогенной трансформации клеток может быть отведена IL-4 и IL-6. В то же время созревание лимфоидного ростка кроветворения связано с действием IL-7 — ростового фактора для предшественников как Т-, так и В-лимфоцитов [4, 6, 7]. Установлено, что IL-10 — иммуномодулирующий цитокин, продуцируемый активируемыми CD4+ (клонами Th0, Th1 и Th2) и CD8+ Т-лимфоцитами, активированными В-лимфоцитами, тучными клетками и активированными LPS моноцитами/макрофагами [8]. IL-10 изменяет нормальное протекание иммунных реакций, обладая противоречивым эффектом: с одной стороны, подавляет клеточный иммунитет, а с другой — активирует гуморальный иммунитет. Кроме того, установлено, что важная роль в механизмах элиминации малигнизированных клеток при развитии онкологических заболеваний отводится клеточному иммунитету и, следовательно, возможная недостаточность специфических иммунологических механизмов защиты в условиях нарушения продукции IL-10 является одним из патогенетических факторов перехода стадии онкогенной трансформации во II стадию канцерогенеза — стадию промоции. Тем не менее до настоящего момента не определены закономерности нарушений баланса цитокинов при ХЛЛ различной степени тяжести и, значит, не установлена их роль в нарушениях межклеточного взаимодействия в лимфоидной ткани, а также в развитии системных функциональных и метаболических сдвигов, способствующих или препятствующих опухолевой прогрессии при ХЛЛ.
Цель: изучение динамических сдвигов цитокино-вого профиля крови при ХЛЛ различной степени тяжести по содержанию в сыворотке крови IL-4, IL-6, IL-7, IL-10 и TNF-α, а также установление патогенетической взаимосвязи между характером изменения содержания в крови указанных цитокинов и тяжестью клинических проявлений патологии для выявления новых диагностических и прогностических критериев развития ХЛЛ.
Методы. В работе представлены результаты собственных исследований и наблюдений общесоматического статуса, клеточного состава периферической крови и цитокинового профиля крови больных В-ХЛЛ, находившихся на обследовании и стационарном лечении в клинике профпатологии и гематологии г. Саратова в период с 2007 по 2010 г.
Проведено комплексное обследование 60 больных с В-ХЛЛ в возрасте от 48 до 83 лет, среди которых были 31 мужчина и 29 женщин. Для решения поставленных в работе целей и задач исследования больные рандомизированы в 4 группы наблюдения в соответствии со стадией заболевания по классификации K. R. Rai, 1975 [5, 9]. В группу контроля вошли 15 практически здоровых доноров. В целях диагностики ХЛЛ наряду с общепринятыми методами оценки общесоматического статуса и гематологических показателей использовался метод проточной цитометрии, с помощью которого устанавливался иммунофенотип В-лимфоцитов. Для определения показателей периферической крови использовался гематологический автоматический анализатор «Micros-60» (ABX, Франция). Для оценки степени выраженности пролиферации периферической лимфоидной ткани применялась компьютерная томография (КТ). Иммунофенотип В-лимфоцитов устанавливался на проточном цитометре «Facs-Calibur» (BD, США, 2006). Уровень цитокинов (IL-4, IL-6, IL-7, IL-10 и TNF-α) определялся методом твердофазного иммуноферментного анализа с использованием иммуноферментных тест-систем («Вектор-Бест», Санкт-Петербург) на имму-ноферментном анализаторе «Alfa Prime» фирмы «Meredith Diagnostics» (Англия, 2006). Математическая обработка данных выполнена с применением современных статистических прикладных программ Microsoft Office: пакеты Excel и Microsoft Graf, Sta-tistica 6.0 (Stat Soft Inc.). Данные в тексте представлены в виде средних значений с указанием интерквартильного диапазона (25–75-й процентили). Для межгруппового сравнения использовали непараметрический U-критерий Манна — Уитни, точный Ζ-критерий Фишера и показатель достоверности р; оценка различий проводилась по общепринятому порогу значимости (p < 0,05).
Результаты. В процессе комплексного клинико-лабораторного обследования больных прове- дена сравнительная оценка клеточного состава периферической крови и содержания указанных цитокинов в четырех группах наблюдения больных с различной степенью тяжести ХЛЛ. Пальпация и КТ-исследование периферической лимфоидной ткани больных I группы наблюдения с легкой формой ХЛЛ позволили обнаружить у большинства больных увеличение лимфоузлов, в частности подчелюстных и шейных. Температура у всех пациентов этой группы наблюдения, а также размеры селезенки и печени оставались в пределах нормы. При изучении картины периферической крови выявлены следующие изменения: развитие умеренного лейкоцитоза и абсолютного лимфо- цитоза, относительное снижение содержания гранулоцитов и моноцитов в периферической крови (табл. 1). Количество эритроцитов (p=0,8682) и тромбоцитов (p=0,9174), показатель гематокрита (p=0,8195) и содержание гемоглобина (p=0,3951) у пациентов данной группы наблюдения не отличались от показателей группы контроля. Изменение количественного и качественного состава белой крови у пациентов I группы наблюдения сочеталось с увеличением продукции исследованных цитокинов, в частности содержание IL-4 достоверно превышало аналогичный показатель группы контроля (табл. 2, рисунок).
Показатели периферической крови
Таблица 1
|
Показатель |
Группы наблюдения |
||||
|
контрольная группа |
стадия I |
стадия II |
стадия III |
стадия IV |
|
|
WBC, 103/mm3 |
6,51 (5,8; 7,2) |
20,58 (12,8; 22,6) p=0,000003 Ζ=-4,67 |
39,33 (23,0; 48,4) p=0,000003 Ζ=-4,67 p =0,000724 1Ζ1=-3,38 |
38,02 (15,1; 70,6) p=0,000003 Ζ=-4,67 p =0,708923 2Ζ2=0,37 |
56,96 (21,2; 91,0) p=0,000003 Ζ=-4,67 p =0,340087 3Ζ3=-0,95 |
|
%LYM, % |
31,89 (28,5; 35,4) |
69,67 (54,1; 84,2) p=0,000003 Ζ=-4,67 |
78,09 (72,8; 86,0) p=0,000005 Ζ=-4,58 p = 0,124861 1 Ζ1=-1,53 |
76,94 (66,8; 86,0) p=0,000003 Ζ=-4,67 p =0,633364 2 Ζ2=0,48 |
77,52 (73,3; 84,8) p=0,000053 Ζ=-4,04 p = 0,506915 3Ζ3=-0,66 |
|
%MON, % |
6,43 (4,90; 7,60) |
3,71 (2,90; 4,30) p= 0,000044 Ζ=4,09 |
4,06 (2,90; 5,0) p= 0,000622 Ζ=3,42 p = 0,868226 1 Ζ1=-0,17 |
5,17 (2,70; 7,40) p= 0,019104 Ζ=2,34 p =0,900972 2Ζ2=-0,12 |
6,34 (3,80; 10,20) p= 0,245486 Ζ=1,16 p = 0,245486 3Ζ3=-1,16 |
|
%GRA, % |
61,67 (57,9; 67,0) |
26,61 (11,7; 41,6) p=0,000003 Ζ=4,67 |
17,65 (10,0; 21,8) p=0,000007 Ζ=4,50 p =0,105740 1 Ζ1=1,62 |
17,14 (7,7; 25,4) p=0,000003 Ζ=4,67 p =0,755736 Ζ2=20,31 |
16,15 (5,1; 22,0) p=0,000053 Ζ=4,04 p =0,299759 3 Ζ3=1,04 |
|
#LYM, 103/mm3 |
2,06 (1,99; 2,17) |
15,92 (7,0; 20,1) p=0,000003 Ζ=-4,67 |
27,98 (18,1; 38,1) p=0,000003 Ζ=-4,67 p =0,011401 1Ζ1=-2,53 |
27,08 (8,5; 38,7) p=0,000034 Ζ=-4,15 p =0,520283 2Ζ2=0,64 |
27,75 (11,2; 50,9) p=0,000053 Ζ=-4,04 p =0,966915 3Ζ3=0,041 |
|
#MON, 103/mm3 |
0,41 (0,35; 0,47) |
0,79 (0,3; 0,9) p=0,130040 Ζ=-1,51 |
1,52 (0,7; 2,0) p=0,000013 Ζ=-4,36 p =0,017080 1Ζ1=-2,38 |
2,12 (0,5; 2,9) p=0,007466 Ζ=-2,68 p =0,933886 2Ζ2=-0,08 |
1,99 (0,7; 3,5) p=0,003943 Ζ=-2,88 p =0,966915 3 Ζ3=0,04 |
|
#GRA, 103/mm3 |
4,04 (3,37; 4,74) |
4,48 (3,3; 6,0) p=0,633364 Ζ=-0,48 |
5,40 (3,6; 5,8) p=0,114988 Ζ=-1,58 p =0,467921 1Ζ =-0,73 |
3,83 (2,8; 4,8) p=0,177647 Ζ=1,35 p =0,046488 2Ζ=1,99 |
3,15 (2,0; 3,6) p=0,019104 Ζ=2,34 p =0,455302 3Ζ=0,75 |
П р и м еч а н и е : p, Ζ – по сравнению с показателями группы контроля; p1, Ζ1 – по сравнению с показателями I стадии заболевания; p2, Ζ2 – по сравнению с показателями II стадии заболевания; p 3, Ζ3 – по сравнению с показателями III стадии заболевания.
Таблица 2
|
Показатель |
Группы наблюдения |
||
|
контрольная группа |
стадия I |
стадия II |
|
|
IL-4, пг/мл |
1,80 (1,23; 2,25) |
3,99 (3,70; 4,50) p= 0,000007; Ζ=-4,48 |
6,67 (5,60; 7,70) p= 0,000003; Ζ=-4,67 p1= 0,000003; Ζ1=-4,67 |
|
IL-6, пг/мл |
1,38 (1,09; 1,80) |
12,52 (12,15; 13,30) p= 0,000003; Ζ=-4,67 |
10,36 (7,90; 12,20) p= 0,000003; Ζ=-4,67 p = 0,005811; Ζ =2,76 |
Окончание табл. 2
|
Показатель |
Группы наблюдения |
||
|
контрольная группа |
стадия I |
стадия II |
|
|
IL-7, пг/мл |
2,09 (1,60; 2,60) |
22,93 (18,50; 27,50) p= 0,000003; Ζ=-4,67 |
19,24 (15,90; 21,80) p= 0,000003; Ζ=-4,67 p1= 0,038089; Ζ1=2,07 |
|
IL-10, пг/мл |
2,15 (1,65; 2,70) |
49,87 (48,0; 55,0) p= 0,000003; Ζ=-4,67 |
55,73 (41,0; 71,0) p= 0,000003; Ζ=-4,67 p1= 0,361497; Ζ1=-0,91 |
|
TNF-α, пг/мл |
25,53 (22,0; 28,0) |
140,27 (119,0; 154,0) p= 0,000003; Ζ=-4,67 |
128,33 (101,0; 171,0) p= 0,000003; Ζ=-4,67 p = 0,177647; Ζ =1,35 |
Содержание цитокинов в сыворотке крови. А. I и II стадии
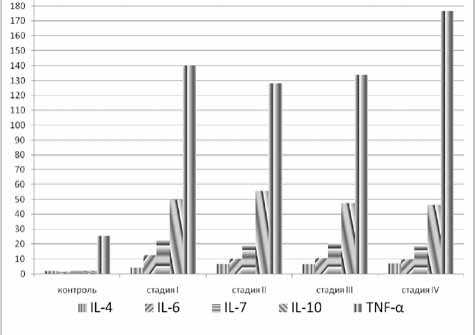
Содержание цитокинов в сыворотке крови
Относительно происхождения избыточной концентрации IL-4 в крови следует отметить, что основными продуцентами IL-4 являются активированные Т-лимфоциты, хелперы 2-го типа (Тh2), уровень которых в крови, в соответствии с данными литературы, значительно возрастает при В-ХЛЛ [5]. IL-4 может также вырабатываться базофилами и тучными клетками, в меньшей степени цитотоксическими Т-лимфоцитами, Тγδ-лимфоцитами, эозинофилами и некоторыми другими клетками. Экспрессия гена и синтез IL-4 в Т-лимфоцитах возникают под влиянием антигенного воздействия через Т-клеточный антигенный рецептор [4].
Касаясь значимости выявленного нами повышения содержания IL-4, следует отметить, что к числу особенностей биологического действия данного цитокина относится не только усиление функциональной и пролиферативной активности В-лимфоцитов, но и подавление спонтанного апоптоза в культуре лимфоцитов больных ХЛЛ, коррелирующее с повышением уровня BCL-2 в лимфоцитах. В то же время у больных ХЛЛ обнаружена повышенная восприимчивость лейкемических лимфоцитов к антиапоптоти-ческому действию IL-4 [5].
Как показали проведенные нами исследования в группе больных с начальной стадией ХЛЛ, уровень IL-6 в сыворотке крови также оказался резко повышенным.
Характеризуя биологическую активность IL-6, необходимо обратить внимание на тот факт, что, по данным литературы, IL-6 — это медиатор межклеточного взаимодействия Т- и В-лимфоцитов, вызывающий пролиферацию активированных антигеном В-лимфоцитов и дальнейшую активацию плазматических клеток с усилением синтеза анти- тел. В то же время IL-6 активирует пролиферацию и CD4-положительных Т-лимфоцитов за счет индукции экспрессии рецепторов IL-2 и увеличения продукции IL-2, а также повышает функциональную активность CD8-положительных Т-киллеров [4, 7].
Далее представлялось целесообразным изучение содержания в крови больных с легкой степенью тяжести ХЛЛ IL-7, стимулирующего в большей степени пролиферативную активность Т-системы лимфоцитов, чем В-системы [4]. В ходе исследования обнаружен чрезвычайно высокий уровень IL-7 в сыворотке крови.
Оценивая значимость обнаруженного нами феномена, следует отметить, что IL-7 стимулирует пролиферацию про-В и пре-В-лимфоцитов при отсутствии других ростовых факторов, а также может действовать синергично с SCF и fit3-лигандом. Известно также, что IL-7 усиливает пролиферацию ранних тимоцитов независимо от IL-2, IL-4, IL-6 и других цитокинов. Отсутствие IL-7 приводит к блоку Т-клеточной дифференцировки на ранней стадии еще до начала реаранжировки бета-цепи Т-клеточного антигенного рецептора, но при этом лимфопоэз не заблокирован полностью, и малая часть зрелых Т- и В-лимфоцитов (1 % от нормы) появляется в периферических лимфоидных органах. Как известно, IL-7 оказывает воздействие и на поздние стадии развития Т-лимфоцитов, обеспечивая антиген-зависимую пролиферацию зрелых лимфоцитов, продукцию IL-2 и экспрессию рецепторов IL-2 на зрелых Т-лимфоцитах [6].
Известно, что биологические эффекты цитокинов в значительной мере определяются их взаимомоду-лирующим действием. В связи с этим представляло интерес выяснить, сочетается ли возрастание уровня IL-4, IL-6 и IL-7 с нарушением продукции IL-10, обладающего способностью активировать В-зависимые иммунные реакции на фоне подавления клеточного иммунитета. Как оказалось, изменения количественного и качественного состава белой крови у пациентов I группы наблюдения сочетались и с увеличением продукции IL-10 .
Касаясь значимости выявленного нами феномена повышения содержания IL-10 в крови уже на начальной стадии развития ХЛЛ, следует отметить ряд данных литературы, согласно которым IL-10, с одной стороны, подавляет клеточный иммунитет, а с другой — активирует гуморальный иммунитет. В настоящее время очевидно, что развитие онкогенной трансформации клеток еще не означает обязательного формирования опухоли и, тем более, онкологического заболевания. Малигнизированные клетки постоянно образуются в организме, подвергаясь элиминации за счет моноцитарно-макрофагальной системы, NK-клеток, а также CD8+-Т-лимфоцитов-киллеров.
Подавление клеточного иммунитета на фоне обнаруженного нами увеличения содержания IL-10 в крови у больных ХЛЛ, по-видимому, является одним из факторов риска перехода I стадии канцерогенеза, стадии онкогенной трансформации клеток, во II стадию — стадию активации. Установлено, что IL-10 подавляет реакции клеточного иммунитета, а также ингибирует апоптоз малигнизированных клеток. Последнее, безусловно, является одним из патогенетических факторов нарушения активности контрольно-пропускного пункта (checkpoint G1/S), обеспечивающего или активацию процесса репликации ДНК, или, в условиях нормы, индукцию апоптоза в случаях возникновения мутации ДНК под влиянием онкогенных факторов.
Одновременно с увеличением содержания IL-10 в крови было отмечено и повышение уровня TNF-α. Как известно, TNF-α не только обладает антионкоген-ным действием, но и стимулирует синтез ростовых факторов и пролиферацию опухолевых клеток [4].
Таким образом, при развитии I стадии В-ХЛЛ выраженные изменения клеточного состава периферической крови, в частности развитие абсолютного лимфоцитоза и относительной нейтропении, сочетаются с возрастанием уровня в крови цитокинов — IL-4, IL-6, IL-7, IL-10 и TNF-α. Возрастание уровня указанных цитокинов в крови играет важную роль в механизмах развития стадии промоции малигнизированных клеток лимфоидной ткани.
Очевидно, что показатели содержания в крови IL-4, IL-6, IL-7, IL-10 и TNF-α могут дополнить существующие классификационные признаки I стадии ХЛЛ и соответственно использоваться в процессе верификации диагноза на начальной стадии ХЛЛ наряду с традиционными методами клинико-лабораторной оценки гематологических сдвигов.
Обследование второй группы наблюдения (пациенты со II стадией ХЛЛ по Rai) позволило обнаружить следующие клинические признаки заболевания: у всех больных обнаружены спленомегалия и/или ге- патомегалия, отсутствующие у больных первой группы наблюдения. У большинства пациентов выявлено увеличение лимфоузлов. Одновременно отмечалось нарастание лейкоцитоза и лимфоцитоза, выявлено относительное снижение содержания гранулоцитов и моноцитов в периферической крови, в то время как количество тромбоцитов (p=0,1985), показатель гематокрита (p=0,0745) и содержание гемоглобина (p=0,8682) не изменены. Выявленные нами клинические проявления заболевания и гематологические сдвиги соответствуют классификационным признакам, свойственным II стадии развития ХЛЛ [6, 9]. Тем не менее, как указывалось выше, в отечественных и зарубежных классификациях степеней тяжести ХЛЛ не используются в качестве объективных критериев оценки изменений функциональной активности лимфоидной ткани и моноцитарно-макрофагальной системы показатели содержания в периферической крови различных цитокинов.
Обращает на себя внимание тот факт, что содержание IL-4 у пациентов на II стадии ХЛЛ было увеличено в большей степени по сравнению с аналогичными показателями пациентов с легкой степенью тяжести (I стадией). Таким образом, сравнительная оценка качественного и количественного состава периферической крови у пациентов II группы наблюдения позволила обнаружить параллелизм между увеличением содержания лейкоцитов периферической крови, развитием абсолютного лимфоцитоза и уровня IL-4.
Содержание IL-10 и TNF-α в сыворотке крови у больных со II стадией развития ХЛЛ оставалось по-прежнему высоким, как и на I стадии заболевания. Между тем уровни IL-6 и IL-7 на II стадии заболевания также превышали показатели группы контроля, незначительно снижаясь в то же время по сравнению с таковыми показателями при I стадии заболевания.
Обращает на себя внимание и тот факт, что на I и II стадиях ХЛЛ показатели красной крови и содержание тромбоцитов остаются стабильными.
Содержание цитокинов в сыворотке крови. Б. III и IV стадии
Таблица 3
|
Показатель |
Группы наблюдения |
||
|
контрольная группа |
стадия III |
стадия IV |
|
|
IL-4, пг/мл |
1,80 (1,23; 2,25) |
6,29 (5,60; 6,90) p= 0,000003; Ζ=-4,67 p = 0,000003; Ζ1=-4,67 p12=0,493731; Ζ2=0,68 |
7,01 (6,20; 7,50) p= 0,000003; Ζ=-4,67 p = 0,000003; Ζ1=-4,67 p1=0,237157; Ζ2=-1,18 p32= 0,038089; Ζ3=-2,07 |
|
IL-6, пг/мл |
1,38 (1,09; 1,80) |
10,46 (8,90; 12,50) p= 0,000003; Ζ=-4,67 p = 0,015247; Ζ1=2,43 p12=0,917411; Ζ2=-0,10 |
9,45 (7,80; 12,80) p= 0,000003; Ζ=-4,67 p = 0,003230; Ζ1=2,94 p1 =0,442877; Ζ2=0,77 p32= 0,254018; Ζ3=1,14 |
|
IL-7, пг/мл |
2,09 (1,60; 2,60) |
20,77 (18,70; 23,70) p= 0,000003; Ζ=-4,67 p = 0,205843; Ζ1=1,27 p21=0,097092; Ζ2=-1,66 |
19,02 (16,50; 25,50) p= 0,000003; Ζ=-4,67 p = 0,017080; Ζ1=2,38 p1=0,851934; Ζ2=0,19 p32= 0,110288; Ζ3=1,60 |
|
IL-10, пг/мл |
2,15 (1,65; 2,70) |
47,53 (39,0; 52,0) p= 0,000003; Ζ=-4,67 p = 0,205843; Ζ1=1,27 p12=0,146577; Ζ2=1,45 |
46,20 (42,0; 52,0) p= 0,000003; Ζ=-4,67 p = 0,213375; Ζ1=1,24 p1=0,097092; Ζ2=1,66 p32= 0,933886; Ζ3=-0,08 |
|
TNF-α, пг/мл |
25,53 (22,0; 28,0) |
133,67 (121,0; 145,0) p= 0,000003; Ζ=-4,67 p = 0,418618; Ζ1=0,81 p1=0,171070; Ζ2=-1,37 |
176,47 (158,0; 194,0) p= 0,000003; Ζ=-4,67 p = 0,000262; Ζ1=-3,65 p1 =0,000533; Ζ2=-3,46 p2= 0,000125; Ζ3=-3,84 |
При обследовании больных III группы наблюдения визуально обнаруживалась бледность кожных покровов, у части больных имело место повышение температуры тела. У большинства больных отмечалось, так же как и в I и II группах наблюдения, увеличение лимфатических узлов, печени и селезенки. Гематологическая картина характеризовалась лейкоцитозом и абсолютным лимфоцитозом. Впервые у больных III группы наблюдения обнаружена анемия (p=0,000089). Количество тромбоцитов практически не изменялось по сравнению с показателями контрольной группы пациентов (p=0,3837).
Содержание IL-4 в крови пациентов с III стадией развития данного гемобластоза было увеличенным по сравнению с показателями группы контроля и пациентов c I стадией заболевания (табл. 3). Уровни IL-6, IL-7, IL-10 и TNF-α в сыворотке крови оставались стабильно высокими у больных III группы наблюдения и достоверно превышали показатели группы контроля.
Комплексное обследование больных IV группы наблюдения позволило обнаружить увеличение лимфатических узлов, развитие гепато- и спленомегалии. Картина крови на IV стадии ХЛЛ характеризовалась лейкоцитозом, абсолютным лимфоцитозом, у большинства пациентов отмечалась анемия (p=0,0037). Впервые фиксировалась тромбоцитопения (p=0,000003). Таким образом, выявленная нами динамика изменений клеточного состава периферической крови, общесоматического статуса на I, II, III и IV стадиях ХЛЛ соответствует классическим симптомам данного заболевания, указанным в общепринятых классификациях степени тяжести ХЛЛ [6, 9].
Цитокиновый статус больных с тяжелой формой ХЛЛ (IV стадия) характеризовался стабильно высоким содержанием в крови IL-6, IL-7 и IL-10 . В то же время уровень IL-4 в сыворотке крови на IV стадии достоверно превышал показатели группы контроля, а также I и III стадий развития патологии.
Обращает на себя внимание факт резкого увеличения содержания в крови и TNF-α на IV стадии заболевания не только по сравнению с показателями контроля, но и с таковыми показателями в группах больных с I, II и III стадиями. Нарастание уровня TNF-α, с одной стороны, обеспечивает развитие реакций адаптации, а с другой –обладает эффектом стимуляции пролиферативных процессов в лимфоидной ткани. Как известно, TNF-α — полипептид, выполняющий регуляторные и эфферентные функции в иммунном ответе. Системные эффекты TNF-α характеризуются развитием нарушений коагуляционного гемостаза, активацией системы фибринолиза. Последнее является одним из факторов повышения ин-вазивности опухолевых клеток и создания благоприятных условий для метастазирования. Тем не менее TNF-α, в отличие от IL-10, в соответствии с данными литературы обладает преимущественно антиканцерогенным действием за счет избирательной цитотоксичности в отношении опухолевых клеток, развития геморрагического некроза в зоне неоплазии, обусловленного усилением экспрессии под влиянием этого цитокина эндотелиальных адгезивных белков и, соответственно, адгезией тромбоцитов и лейкоцитов к сосудистой стенке, развитием явлений тромбоза, эмболии, нарушением трофики, васкуляризации и оксигенации опухоли [10].
Обсуждение. Резюмируя приведенные данные в целом, следует заключить, что закономерным признаком развития ХЛЛ является изменение цито-кинового профиля крови. Причем содержание IL-4
в крови прогрессирующе возрастает при I и II стадиях ХЛЛ, оставаясь стабильно высоким на III и IV стадиях заболевания. Уровни IL-6, IL-7 и IL-10 резко возрастали независимо от тяжести клинических проявлений патологии. Содержание TNF-α на I, II и III стадиях заболевания значительно превышало показатели контрольной группы наблюдения, прогрессивно нарастая на IV стадии заболевания. В связи с этим резкое повышение уровня TNF-α по сравнению с таковым показателем на предшествующих стадиях заболевания является одним из признаков терминальной стадии ХЛЛ наряду с тромбоцитопенией.
Анализ проведенных нами исследований на основе данных литературы делает очевидным тот факт, что в динамике развития ХЛЛ различной степени тяжести, как и при других формах патологии, возникает динамическое взаимодействие реакций адаптации и повреждения не только на системном и органном уровнях, но и на уровне молекулярно-клеточных механизмов воздействия таких цитокинов, как IL-4, IL-6, IL-7, IL-10 и TNF-α, отличающихся своей биохимической принадлежностью, селективностью рецепции, локальными и системными эффектами [2–4, 6–8].
Выявленные нами закономерности изменения цитокинового профиля периферической крови при I, II, III и IV стадиях развития ХЛЛ значительно расширяют существующие представления о молекулярно-клеточных механизмах развития ХЛЛ и позволяют патогенетически обосновать новые классификационные признаки В-ХЛЛ в динамике развития опухолевой прогрессии и, следовательно, расширить существующие в отечественной и зарубежной литературе принципы классификации В-ХЛЛ.
Оценка цитокинового статуса по показателям содержания в крови IL-4, IL-6, IL-7, IL-10 и TNF-α на различных стадиях В-ХЛЛ позволила сделать ряд значимых выводов.
Выводы:
-
1. Закономерной особенностью изменения ци-токинового статуса на различных стадиях развития В-ХЛЛ является увеличение содержания в сыворотке крови IL-4, IL-6 и IL-7, IL-10 и TNF-α, обладающих полипотентным локальным и системным действием.
-
2. Возрастание интенсивности секреции IL-4, IL-6 и IL-7, IL-10 и TNF-α при различной степени тяжести течения заболевания свидетельствует о важной роли указанных цитокинов в механизмах аутокринной и паракринной стимуляции пролиферативных процессов лимфоидной ткани и является одним из ведущих патогенетических факторов нарушений межклеточного взаимодействия в лимфоидной ткани в динамике развития ХЛЛ.
-
3. Одномоментное возрастание показателей содержания в крови IL-6, IL-7 и IL-10 может быть использовано в качестве дополнительных диагностических критериев при верификации диагноза ХЛЛ уже на начальной стадии заболевания наряду с традиционными методами клинико-лабораторной оценки гематологических сдвигов, и, следовательно, дополнить существующие классификационные признаки тяжести течения ХЛЛ.
-
4. Обнаружен параллелизм между увеличением содержания в крови IL-4, TNF-α, усугублением тяжести патологии и нарушением клеточного состава периферической крови: уровень указанных цитокинов в крови возрастает уже на I стадии ХЛЛ, достигая максимальных величин на IV стадии развития ХЛЛ. Мониторинг показателей содержания в крови IL-4 и TNF-α в качестве объективных диагностических и
- прогностических критериев прогрессирующего течения В-ХЛЛ, может сыграть важную роль для оценки эффективности комплексной терапии.
Список литературы Закономерности изменений цитокинового статуса при хроническом лимфолейкозе и их роль в патогенезе прогрессирующих форм заболевания
- Cohen S., Bigazzi P., Yoshida T. Similarities of T-cell function in cell-mediated immunity and antibody production//Cell. Immunol. 1974. Vol. 12. P. 150-159.
- Кадагидзе 3. Г. Цитокины//Практическая онкология. 2003. Т. 4, №3. С. 131-139.
- Телетаева Г. М. Цитокины и противоопухолевый иммунитет//Практическая онкология. 2007. Т. 8, № 1. С. 211-218.
- Кетлинский С. А., Симбирцев А. С. Цитокины. СПб.: ООО «Изд-во Фолиант», 2008. 552 с.
- Клиническая онкогематология: рук-во для врачей/под ред. проф. М.А. Волковой. 2-е изд. М.: ОАО «Изд-во Медицина», 2007. 1120 с.
- Webb L, Foxwell В., Feldmann М. lnterleukine-7 activates human naive CD4+ cells and primes for interleukine-4 production//Eur.J. Immunol. 1997. Vol. 27. P. 633-640.
- Kishimoto T. lnterleukin-6: discovery of a pleiotropic cytokine//Arthritis Res. Ther. 2006. Vol. 8, suppl. 2. P. 2-14.
- Moore K., de Waal Malefyt R., Coffman R. L. lnterleukine-10 and interleukine-10 receptor//Ann. Rev. Immunol. 2001. Vol. 19. P. 683-765.
- Руководство по гематологии/под ред. акад. А. И. Воробьева. 4-е изд. М.: Ньюдиамед. 2007. 1275 с.
- Канцерогенез: патофизиологические и клинические аспекты/под общ. ред. В.М. Попкова, Н.П. Чесноковой, В.Ю. Барсукова. Саратов: Изд-во СГМУ, 2011. 600 с.


