Замещение дефекта гиалинового хряща клеточной культурой фибробластов человека
Автор: Божокин М.С., Марченко Д.М., Михайлова Е.Р., Антипов А.П., Нащекина Ю.А., Вчерашний Д.Б., Новосельцев С.В., Круглов В.Н.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Морфология. Патология
Статья в выпуске: 2 (56), 2022 года.
Бесплатный доступ
Несмотря на актуальность проблемы повреждения гиалинового слоя крупных суставов, существующие меры по его восстановлению не являются достаточными. Перспективным решением данной проблемы может быть имплантация ткане-инженерной конструкции (ТИК), состоящей из культуры клеток и биодеградируемого носителя. В нашей экспериментальной работе мы создали конструкцию, состоящую из полилактидного скаффолда и культуры дермальных фибробластов человека. После имплантации ТИК в область смоделированного дефекта мы анализировали первичные результаты замещения дефекта в опытной группе кроликов по сравнению с контрольной группой.
Гиалиновый хрящ, дефект, тканеинженерная конструкция, восстановление, дермальные фибробласты
Короткий адрес: https://sciup.org/143178476
IDR: 143178476 | УДК: 617-089.844+57.085.23
Текст научной статьи Замещение дефекта гиалинового хряща клеточной культурой фибробластов человека
УДК 617-089.844+57.085.23
Повреждения суставной поверхности является актуальной проблемой для многих людей во всём мире [1, 2]. Известно, что гиалиновый хрящ обладает ограниченной способностью к регенерации, его дефекты увеличиваются со временем и ведут к дальнейшей деградации ткани [3]. Несмотря на то, что современным хирургам доступно большое количество методик по локальному восстановлению гиалинового хряща, в полном объёме данная задача до сих пор не решена [4, 5].
Одним из перспективных методов является применение тканевой инженерии [6], которая подразумевает использование биодеградируемого скаффолда с клеточной культурой внутри него. В качестве клеточной культуры были использованы фибробласты человека, которые были расположены в биодеградируемом носителе из полилактида (PLA). Для оценки данного ткане-инженерного продукта необходимо было провести анализ результатов имплантации и фиксации конструкции у экспериментальных животных в краткосрочной и среднесрочной перспективе, а также проанализировать возможное воспаление в зоне дефекта.
Цель данной работы – анализ первичных результатов замещения дефекта гиалинового хряща у кроликов с помощью ткане-ин-женерной конструкции.
Материалы и методы исследования
Клеточная культура. Клеточная культура дермальных фибробластов была получена из ЦКП «Коллекция культур клеток позвоночных» ФГБУН института цитологии РАН, поддержанного грантом Минобрнауки Российской Федерации (Соглашение № 075-15-2021-683). Клетки были выделены у 45-летнего донора женского пола и подверглись криоконсервации. После разморозки клетки помещали в культуральный пластик (Falcon, США) и культивировали в среде DMEM (Gibco, США) c добавлением 10 % эмбриональной телячьей сыворотки (Gibco, США) и смеси антибиотиков пенициллина в концентрации 50000 ед./мл и стрептомицина в концентрации 25 мкг/мл (Gibco, США) до третьего пассажа (37 °С, 5 % СO 2 ).
Приготовление биодеградируемого носителя. Для изготовления биодеградируемого носителя использовали поли-L-лактид-полимер вязкостью 4.0 г/дл (Sigma, США). Полимер растворяли в диоксане (Реактив, Россия) до конечной концентрации 5 %. В полученный раствор при перемешивании добавляли 5 % раствор коллагена концентрацией 0,1 мг/мл. Далее суспензию замораживали при температуре –20 °С в течение 24 часов. После заморозки готовый носитель лиофилизировали при давлении 1 Торр в течение 6 часов, а затем стерилизовали с помощью озонатора в течение 90 мин. Непосредственно перед трансплантацией из носителя получали цилиндры высотой 3,0 мм и диаметром 3,0 мм.
Совмещение культуры клеток с биодеградируемым носителем. Клеточную культуру помещали внутрь скаффолда динамическим способом под действием избыточного давления N 2 (1 атмосфера) с рабочей концентрацией 106 кл/мл [7]. Ткане-инженер-ную конструкцию (ТИК) культивировали в течение 7 дней перед имплантацией кролику.
Создание дефекта у экспериментальных животных. Исследование выполнено на 12 самках кролика породы «Советская Шиншилла». Экспериментальная работа прошла этическую экспертизу и соответствовала международным рекомендациям по проведению медико-биологических исследований с использованием животных. Все кролики были случайным и равным образом разделены на две группы (табл. 1).
Таблица 1. Количество животных в группах Table 1. Number of animals in groups
|
Группы кроликов |
Количество дней наблюдения |
|
|
14 дней |
30 дней |
|
|
Контрольная (n) |
3 |
3 |
|
Опытная (n) |
3 |
3 |
Наружным парапателлярным способом вскрывали суставную сумку в области коленного сустава, отодвигали надколенник и обнажали мыщелки бедра. В положении сгибания коленного сустава формировали дефект в нагружаемой зоне с помощью бормашины и специально разработанного ограничителя для создания повреждений заданного размера (d = 3,0 мм). Животным опытной группы в дефект имплантировали ТИК (рис. 1), в контрольной группе имплантацию не осуществляли. Далее коленный сустав разгибали, рассасывающейся нитью 3/0 сшивали суставную сумку, окружающие ткани послойно ушивали, на кожу накладывали швы по Хостеду.
После операции животных помещали по три особи в клетке в условиях искусственного освещения (12-часовой световой цикл) и принудительной 12-кратной в час вентиляции, при температуре 18–26 °C и относительной влажности 30–70 %. Абсолютная стерильность нахождения животных в клетках не соблюдалась. На 14-е и 30-е сутки выполняли эвтаназию животных с помощью повышенной концентрации раствора тиопентала натрия (10 % тиопентала натрия, 10 мл, внутривенно).
Вырезка и фотофиксация препаратов. Образцы коленных суставов помещали в 10 % забуференный формалин (Биовитрум, Россия) с целью предотвращения разложения тканевых структур. Затем с помощью фрезы марки Dremel (США) толщиной 0,5 мм при частоте вращения 30000 об./мин. были вырезаны фрагменты тканей. Фреза использовалась для уменьшения времени декальцинации препаратов, снижения нагрева и улучшения теплоотвода. Фотофиксацию проводили при помощи цифровой камеры Canon EOS 600D. Наличие ТИК внутри созданного дефекта гиалинового хряща оценивали визуально.
Результаты и их обсуждение
В течение срока наблюдения не выявлены летальные исходы. Обнаружены случаи поверхностного воспаления у прооперированных экспериментальных животных в двух случаях из 12 образцов (в одном при имплантации скаффолда, в другом – без имплантации скаффолда). Выявить статистически достоверные различия между группами по этому признаку не представляется возможным.
Повреждения гиалинового слоя были хорошо визуализированы через 14 и 30 суток с момента создания дефекта с помощью фотофиксации (рис. 2, 3). В образцах с применением ТИК были отмечены регенеративные изменения в отличие от образцов без импланта- ции. ТИК интегрировалась в область хирургического вмешательства и фиксировалась в нем с замещением дефекта вплоть до 30 суток. Подвижность ТИК не обнаруживалась, отсутствие ТИК в области дефекта в опытной группе не наблюдалось.
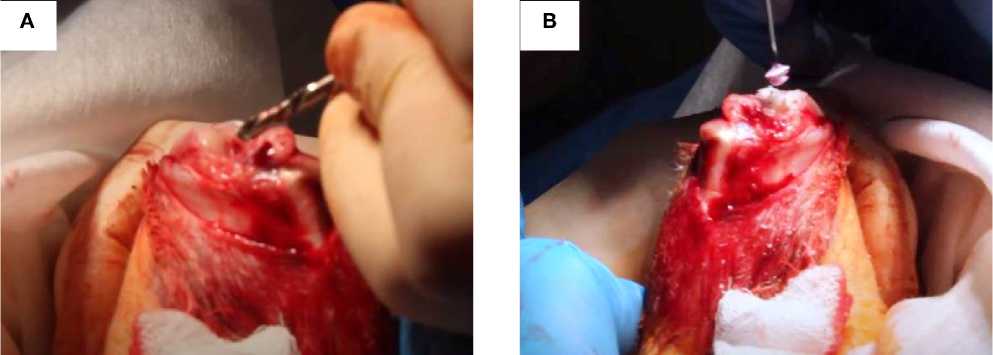
Рисунок 1. Процесс имплантации ТИК в область повреждения коленного сустава кролика. А. Создание поверхностного повреждения d = 3,0 мм. В. Процесс имплантации заранее приготовленной ТИК с культурой фибробластов
Figure 1. The process of TEC implantation in the damaged area of the rabbit knee joint. A. Creation of surface damage d = 3.0 mm. B. The process of implantation of a pre-prepared TEC with fibroblast culture
Заключение
Применение ТИК путем совмещения клеточных продуктов и биодеградируемого скаф-фолда позволяет заместить повреждённый участок аутологичным регенератом и восстановить поврежденную поверхность гиалинового хряща [6]. По мнению авторов, перспектива клеточной инженерии заключается в применении аллогенных человеческих клеточных продуктов внутри скаффолда. В связи с этим, в этой работе была использована клеточная культура дермальных фибробластов человека. Преимуществами использования фибробластов являются их доступность, возможность перепрограммирования [8] и отсутствие реакции «трансплантат против хозяина» [9]. По мнению авторов, данный тип клеток, полученный от разных доноров, в перспективе может использоваться в экспериментальной работе и клинической практике без применения иммуносупрессивных препаратов.
В качестве биодеградируемого носителя был выбран PLA, который принято считать «золотым стандартом» в тканевой инженерии [10]. Удалось добиться надежной фиксации ТИК в области искусственно созданного дефекта, и ни в одном опытном образце не отмечалось случаев нестабильности скаф-фолда. При этом, в двух образцах из 12 были обнаружены воспаления, этиология которых остается до конца неясной. Предположительной причиной данных воспалений являлось отсутствие стерильности в содержании животных в постоперационный период, этот вопрос требует дальнейших исследований.
Полученные результаты хорошо визуализируются с помощью фотокамеры, что говорит о возможности применения цифрового фото- аппарата для получения первичной информации о фиксации скаффолда. При увеличении срока наблюдения от 14 до 30 суток, наблюдается явное заполнение области повреждения регенератом в контрольной группе (рис. 1, В; 2, В), что, по-видимому, связано с собственной (хотя и ограниченной) регенерацией поврежде- ния. Для уточнения структуры регенерата требуются дополнительные исследования. Планируется проведение исследований с применением гистологических методов анализа и сканирующей электронной микроскопии (СЭМ) для получения более детальной информации о структуре регенерата.
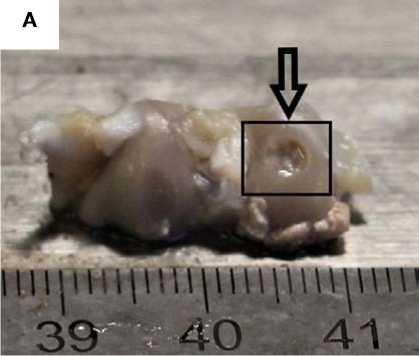
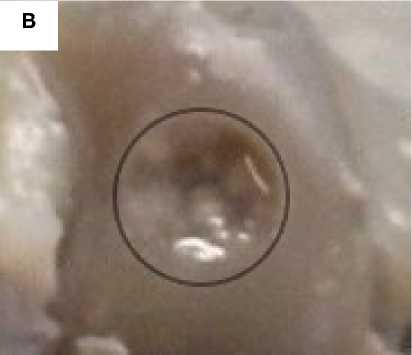
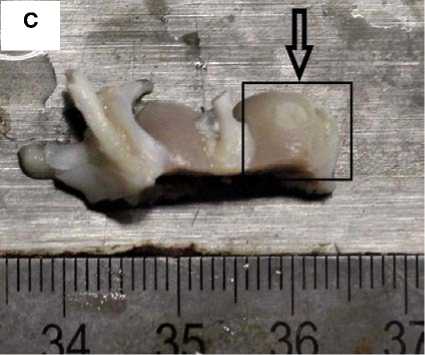
Рисунок 2. Фото области повреждения гиалинового хряща через 14 суток с момента создания дефекта. Стрелкой обозначено место создания дефекта, рамкой – увеличенная область дефекта. А. Дефект d = 3,0 мм без применения ТИК. Визуализируется сферическое повреждение без признаков замещения дефекта регенератом. B. Увеличенная область дефекта без применения ТИК. C. Дефект d = 3,0 мм с применением ТИК. Область дефекта заполнена прочно адгезированным полимерным носителем (светлый регенерат на поверхности гиалинового хряща). D. Увеличенная область дефекта с применением ТИК
Figure 2. Photo of the damage area to the hyaline cartilage 14 days after the creation of the defect. The arrow indicates the place where the defect was created, and the frame indicates the enlarged area of the defect. A. Defect d = 3.0 mm without TEC. A spherical damage is visualized without signs of replacement of the defect with a regenerate. B. Enlarged area of the defect without the use of TEC. C. Defect d = 3.0 mm using TEC. The area of the defect is filled with a firmly adherent polymer carrier (light regenerate on the surface of hyaline cartilage). D. Enlarged area of the defect with the use of TEC


А

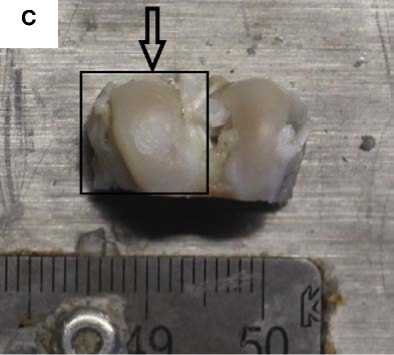
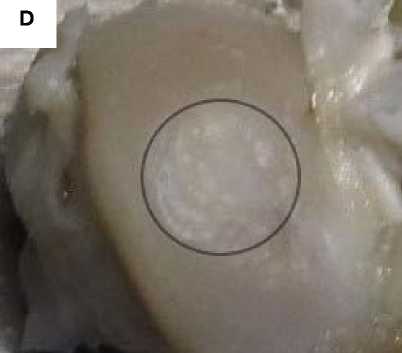
Рисунок 3. Фото области повреждения гиалинового хряща через 30 суток с момента создания дефекта. Стрелкой обозначено место создания дефекта, рамкой – увеличенная область дефекта. А. Дефект d = 3,0 мм без применения ТИК. Визуализируется сферическое повреждение без признаков замещения дефекта регенератом. B. Увеличенная область дефекта без применения ТИК. C. Дефект d = 3,0 мм с применением ТИК. Область дефекта заполнена прочно адгезированным полимерным носителем (светлый регенерат на поверхности гиалинового хряща). D. Увеличенная область дефекта с применением ТИК
Figure 3. Photo of the damage area to the hyaline cartilage 30 days after the creation of the defect. The arrow indicates the place where the defect was created, and the frame indicates the enlarged area of the defect. A. Defect d = 3.0 mm without TEC. A spherical damage is visualized without signs of replacement of the defect with a regenerate. B. Enlarged area of the defect without the use of TEC. C. Defect d = 3.0 mm using TEC. The area of the defect is filled with a firmly adherent polymer carrier (light regenerate on the surface of hyaline cartilage). D. Enlarged area of the defect with the use of TEC
D
Список литературы Замещение дефекта гиалинового хряща клеточной культурой фибробластов человека
- Widuchowski W., Widuchowski J., Trzaska T. Articular cartilage defects: study of 25,124 Knee arthroscopies. Knee. 2007;14(3):177-182.
- Kurtz, S., Ong, K., Lau, E., Mowat, F., and Halpern, M. (2007) Projections of primary and revision hip and knee arthroplasty in the United States from 2005 to 2030, J. Bone Jt. Surg. - Ser. A., 89, 780785.
- DOI: 10.2106/JBJS.F.00222
- Божокин М.С., Божкова С.А., Нетылько Г.И., Румакин В.П., Наконечный Д.Г., Чепурненко М.Н. (2017) Морфофункциональная характеристика хондрорегенераторного процесса в экспериментальном локальном дефекте поверхности суставного хряща. Международный журнал прикладных и фундаментальных исследований. 2017;8:302-306.
- EDN: ZEJESJ
- Maglio, M., Brogini, S., Pagani, S., Giavaresi, G., and Tschon, M. Current trends in the evaluation of osteochondral lesion treatments: histology, histomorphometry, and biomechanics in preclinical models. Bio. Med. Research Intern. 2019:4040236.
- Божокин М. С., Божкова С. А., Нетылько Г. И. Возможности современных клеточных технологий для восстановления повреждённого суставного хряща (аналитический обзор литературы). Травматология и ортопедия России. 2016;22:122-134.
- EDN: WYPMYH
- Jeuken R., Roth A., Peters R., Van Donkelaar C., Thies J., Van Rhijn L., and Emans P. J. Polymers in cartilage defect repair of the knee: current status and future prospects. Polymers. 2016;8(6):219.
- Патент на полезную модель № 190863 U1 Российская Федерация, МПК A61M 1/00. Устройство для совмещения клеточной культуры и биодеградируемого носителя: № 2019104311:заявл. 15.02.2019: опубл. 15.07.2019 / М.С. Божокин, С.А. Божкова, Е.М. Литвинов, В.Л. Косьмин; заявитель ФГБУ "Российский ордена Трудового Красного Знамени научно-исследовательский институт травматологии и ортопедии имени Р.Р. Вредена" Министерства здравоохранения Российской Федерации (ФГБУ "РНИИТО им. Р.Р. Вредена" Минздрава России).
- Tsumaki N. Cartilage regeneration using cell reprogramming technologies. Clin Calcium. 2013;23(11):1641-1648.
- Зорина А. И., Зорин В. Л., Черкасов В. Р. и др. Клеточные технологии в эстетической медицине. Современные проблемы дерматовенерологии, иммунологии и врачебной косметологии. 2010;4(4):76-82.
- EDN: MVIHDX
- Araque-Monrós M.C., García-Cruz D.M., Escobar-Ivirico J.L., Gil-Santos L., Monleón-Pradas M., Más-Estellés J. Regenerative and Resorbable PLA/HA Hybrid Construct for Tendon/Ligament Tissue Engineering. Ann Biomed Eng. 2020. Published online.


