Защита мелатонином нормальных тканей человека от повреждений, вызванных ионизирующим излучением
Автор: Ольховая Е.Р., Купцова П.С., Комарова Л.Н., Лапенко А.К., Чудновец Т.А., Ляпунова Е.Р., Шкавров С.В., Павлов А.Н.
Рубрика: Научные статьи
Статья в выпуске: 2 т.34, 2025 года.
Бесплатный доступ
Применение ионизирующего излучения в современном мире достаточно разнообразно и встречается во многих сферах деятельности человека. Несмотря на полезные эффекты ионизирующего излучения в медицине и промышленности, возникает необходимость в устранении негативных аспектов его действия. Защитные соединения позволяют снизить повреждающее действие радиации, однако большинство из них обладают рядом недостатков, ограничивающих их применение. Цель исследования - изучение защитных свойств мелатонина при действии гамма-излучения на нормальные клетки человека. В качестве объекта исследования использовали клетки почки эмбриона человека HEK 293. Клетки облучали гамма-квантами в дозах 1, 4, 6 и 10 Гр. Исследуемые концентрации мелатонина составили 0,1, 0,2 и 0,5 мг/мл. Сравнение величины проявления исследуемых свойств мелатонина проводили с цистамином. Цитотоксичность мелатонина оценивали с помощью МТТ-теста. Защитные свойства исследуемого соединения оценивали с помощью клоногенного анализа и расчёта времени удвоения. В результате исследования было показано, что мелатонин в концентрациях 0,1, 0,2 и 0,5 мг/мл не оказывает токсического действия на клетки человека. Выявлено, что мелатонин в исследуемых концентрациях проявляет защитные свойства. Наиболее выраженный радиозащитный эффект наблюдается при использовании мелатонина в концентрации 0,5 мг/мл. Полученные результаты свидетельствуют о перспективном и безопасном применении мелатонина в качестве защитного средства благодаря наличию у него антиоксидантных свойств и из-за эффективного поглощения свободных радикалов, образовавшихся при действии ионизирующего излучения.
Гамма-излучение, выживаемость, мтт-тест, время удвоения, антиоксиданты, мелатонин, лучевая терапия, радиобиология
Короткий адрес: https://sciup.org/170209566
IDR: 170209566 | УДК: 616-001.28/29:615.357:577.175.32 | DOI: 10.21870/0131-3878-2025-34-2-69-80
Текст научной статьи Защита мелатонином нормальных тканей человека от повреждений, вызванных ионизирующим излучением
Спектр применения ионизирующих излучений достаточно разнообразен, несмотря на потенциальную угрозу радиации для здоровья и жизни человека. Только на территории Российской Федерации располагается около 22 тыс. организаций, работающих с источниками ионизирующего излучения (ИИ), в них насчитывается свыше 295 тыс. работников [1]. Радиационная обстановка в условиях полёта в космос из-за воздействия электромагнитных и/или корпускулярных излучений также вызывает неблагоприятные реакции у членов экипажа. Медицинское применение ИИ включает лучевую диагностику и терапию (в частности, при лечении онкологических заболеваний). Однако при лучевой терапии повреждаются и нормальные ткани, что приводит к снижению терапевтической эффективности, а также к снижению качества жизни онкологических больных [2]. При загрязнении окружающей среды продуктами радиоактивного распада, образующимися в ходе испытаний ядерного оружия или в результате утечек отходов «ядерного» производства, появляется риск внутреннего и внешнего облучения населения в дозах, существенно
Ольховая Е.Р.* – зав. лаб.; Купцова П.С. – ст. преподаватель; Комарова Л.Н. – рук. образоват. программы, д.б.н., проф.; Лапенко А.К. – студент магистратуры; Чудновец Т.А. – инженер; Ляпунова Е.Р. – доцент, к.б.н.; Шкавров С.В. – с.н.с., доцент, зам. нач. фармацевтического центра, к.х.н. ОИАТЭ. Павлов А.Н. – с.н.с., к.б.н. НИЦ «Курчатовский институт» – ВНИИРАЭ..
превышающих значения естественного фона радиации [3]. Указанные факторы повышают необходимость разработки новых методов защиты персонала и населения.
Среди естественных и искусственных источников радиации присутствуют и гамма-излучатели. Для фотонов гамма-излучения характерна большая проникающая способность вглубь биологических тканей. При взаимодействии с гамма-квантами молекулы воды теряют электроны с образованием ионов разного заряда. Эти ионы в дальнейшем подвергаются превращениям, что приводит к образованию свободных радикалов (например, перекиси водорода, гидроперекисей липидов, супероксидов, гидроксидов, гидридов и пероксинитритов). Радикалы обладают повышенной способностью к окислению, вступая в реакции с молекулами организма, включая белки и ДНК. В результате возникают нарушения клеточной структуры: разрушение липидных мембран, мутации в цепях ДНК, изменение структуры белка и другие [4, 5]. Клетка реагирует на повышенные концентрации свободных радикалов, вырабатывая природные антиоксиданты, такие как су-пероксиддисмутаза, глутатион, каталаза, которые способны минимизировать или устранять повреждения клеточных структур, вызванные активными формами кислорода (АФК) [6]. Например, глутатионпероксидаза в первую очередь катализирует превращение гидроксид-ионов в воду, а супероксиддисмутаза преобразует ионы супероксида в перекись водорода, которая затем преобразуется каталазой в кислород и воду. При увеличении доз ИИ повышается экспрессия антиоксидантных ферментов клетки, однако, когда количество образовавшихся АФК начинает преобладать над защитными соединениями, это приводит к радиационным повреждениям клеточных структур [7]. Такие повреждения могут активировать механизмы канцерогенеза, тератогенеза, некроза и апоптоза.
Одной из стратегий уменьшения негативного действия ИИ на клетки человека является применение радиозащитных соединений. Радиопротекторы могут разрушать, связывать свободные радикалы, подавлять их образование, индуцировать выработку естественных радиопротекторов клетки, усиливать репарацию ДНК, уменьшать постлучевую воспалительную реакцию или даже задерживать клеточное деление, предоставляя клеткам больше времени для репарации или апоптоза [8]. Соединения из группы антиоксидантов (ингибиторов свободных радикалов) в настоящее время рассматриваются как перспективные радиозащитные средства.
Большинство разрешённых радиопротекторных препаратов характеризуется высокой острой и хронической токсичностью, за счёт чего их применение весьма ограничено. Поэтому современная радиобиология акцентирует внимание на поиске безопасных радиопротекторов среди природных соединений, которые отличаются минимальной токсичностью и лёгкой доступностью. В связи с этим исследование природных антиоксидантов в качестве соединений, способных снизить повреждающее действие ИИ, в частности, редкоионизирующего, на организм человека, является перспективным и актуальным.
Одним из таких соединений является мелатонин или 5 метокси-N-ацетилтриптамин. Главным источником мелатонина в организме является эпифиз, однако некоторое количество гормона вырабатывается другими органами (желудочно-кишечный тракт, сетчатка, клетки костного мозга, кожа и др.). Мелатонин синтезируется пинеалоцитами из триптофана: сначала образуется серотонин, который, в свою очередь, под действием ферментной системы ацетилтрансфераз превращается в мелатонин. Синтез и секреция мелатонина усиливаются в темноте и подавляются светом [9]. Физиологические эффекты мелатонина обусловлены типом рецептора и его локализацией. Мелатонин регулирует циркадные ритмы и эндогенную синхронизацию органов путём воздействия на рецепторы МТ1 и МТ2, расположенные в гипофизе, гипоталамусе и других частях головного мозга [9].
В качестве радиопротектора мелатонин интересен благодаря другим функциям в организме [10]. В основе его радиозащитного эффекта лежит антиоксидантная способность. Мелатонин может самостоятельно поглощать свободные радикалы. При поглощении мелатонином двух свободных радикалов образуется 3-гидроксимелатонин, который также обладает антиоксидантной способностью [11]. Последующие метаболиты мелатонина, такие как N-ацетил-N-формил-5-метоксикинурамин (AFMK) и N-ацетил-5-метоксикинурамин (AMK), принимают участие в радикальной детоксикации. Вследствие этого образуется антиоксидантный каскад мелатонина. Помимо самостоятельного действия, мелатонин способствует активации ферментов антиоксидантной защиты, включая глутатионредуктазу и глутатионпероксидазу, и стимулирует синтез глутатиона ‒ высокоэффективного природного антиоксиданта. Кроме того, мелатонин участвует в нейтрализации оксида азота и анион пероксинитрит, а также подавляет проокислительный фермент - синтазу оксида азота [9]. Также радиопротекторное свойство мелатонина обусловлено его иммуномодулирующим эффектом. Вещество способно восстанавливать количество и активность Т-лимфоцитов, нормализовать процесс выделения цитокинов естественными киллерами, а также стимулировать В-клетки к антителообразованию [9, 12]. Данные аспекты, в конечном счёте, на организменном уровне могут обеспечить достаточную защиту от действия ИИ.
Благодаря вышеупомянутым свойствам мелатонина актуальным является исследование его в качестве радиопротектора на культурах человеческих клеток с использованием ионизирующего излучения. Таким образом, целью исследования является изучение защитных свойств мелатонина при действии гамма-излучения на нормальные клетки человека.
Материалы и методы
Объект исследования. Объектом исследования была выбрана клеточная линия HEK 293 - клетки почки эмбриона человека, полученные из ООО «БиолоТ», Россия. Культивирование клеток проводилось по стандартной методике с использованием пластиковых флаконов («NEST», Китай) в виде монослоя в полной питательной среде DMEM (ПанЭко, Россия) [13]. В состав среды входят следующие компоненты: 10% фетальной сыворотки крупного рогатого скота («БиолоТ», Россия), пенициллин (50000 ед./л), стрептомицин (50 мг/л) и глютамин (292 мг/л) («ПанЭко», Россия). Клеточные культуры сохраняли свою жизнеспособность при выращивании в инкубаторе с содержанием углекислого газа на уровне 5%.
Исследуемый препарат: мелатонин, а также препарат сравнения цистамин. Мелатонин был синтезирован на базе ИАТЭ НИЯУ МИФИ. Время предлучевого инкубирования мелатонина - 24 ч, цистамина - 30 мин.
Тесты. Анализ клоногенной активности (выживаемость) - инкубация клеток осуществлялась в течение 7-14 дней до формирования колоний (в диаметре не менее 0,75 мм). После питательную среду удаляли, затем колонии фиксировали этиловым спиртом (95%). Окрашивание колоний было осуществлено 2% раствором метиленового синего в 50% этаноле [14].
Время удвоения: клетки после облучения высеивали в чашки Петри в концентрации 1х104 клеток на чашку. Период культивирования клеток - 48 ч. Затем питательную среду сливали и добавляли 1 мл раствора Трипсина-Версена и оставляли в термостате на 5-10 мин. Снятые клетки подсчитывали в камере Горяева. Время удвоения рассчитывали по формуле 1:
TD = tpx , (1)
1°в (4)
где tp – время культивирования; N 1 – начальное количество клеток; N 2 – конечное количество клеток.
Токсичность исследуемого соединения оценивали по стандартной методике МТТ-теста [15].
Расчёт выживаемости производили по формуле 2:
п ОП опытных лунок-ОП среды /л\
Выживаемость =--------у------р-д- х 100% , (2)
ОП контр.лунок- ОП среды где ОП – оптическая плотность.
Стандартное отклонение рассчитывали по формуле 3:
Стандартное отклонение
/ №~s)
\ (п-1) .
Фактор изменения дозы (ФИД) применяется для количественной оценки радиомодифицирующего эффекта, который обусловлен применением радиопротекторных или радиосенсибилизирующих соединений. При оценке эффективности радиопротекторов величина ФИД всегда больше 1, расчёт производится по кривым выживаемости. ФИД определяется отношением изоэффективных доз (4) [16]:
ФИД = Д оп , (4)
Дк где Доп и Дк ‒ дозы, вызывающие одинаковые по величине эффекты в опыте (т.е. с применением радиомодификатора) и в контроле (без применения радиомодификатора) соответственно.
Перед началом облучения флаконы с монослоем трипсинизировали раствором Трипсина-Версена (соотношение 1:2 для клеточной линии HEK 293), после подсчитывали в камере Горяева количество клеток в суспензии. Затем клетки в концентрации 5х104 кл./мл перемещали в пробирки типа «Эппендорф» объёмом 1,5 мл для последующего облучения. Транспортировка клеток осуществлялась при температуре тающего льда.
Источники ионизирующего излучения. Облучение гамма-квантами проводили на уникальной научной установке ФГБНУ ВНИИРАЭ (Обнинск) «ГУР-120» (источник ИИ 60Со, Е ср =1,25 МэВ). Мощность дозы составила 0,9 Гр/мин. Дозы облучения: 1, 4, 6 и 10 Гр.
Статистическая обработка. Каждая серия опытов повторялась 3-5 раз. Обработка полученной информации проводилась с использованием пакета приложений Microsoft Office 2010. Графические изображения созданы в программе Excel. Для оценки значимости различий средних величин выживаемости, полученных в разных сериях опытов, применяли непараметрический критерий Манна-Уитни. Наблюдаемые различия считали статистически значимыми при р<0,05.
Результаты и обсуждение
Одним из важных свойств радиопротектора является отсутствие его токсического действия на здоровые клетки человека, в связи с этим на первом этапе изучения мелатонина необходимо было определить степень его токсичности на клетки человека. При проведении анализа литературных источников были выбраны следующие концентрации мелатонина: 0,1; 0,2 и 0,5 мг/мл [17, 18]. Также ранее нами было проведено исследование времени предлучевого инкубирования клеток с мелатонином, исходя из этого, было подобрано оптимальное время инкубирования, которое составило 24 ч.
Для определения токсичности был проведён МТТ-тест, результаты которого представлены на рис. 1. Показано, что мелатонин в исследуемых концентрациях не проявляет токсического действия в отношении клеточной линии HEK 293 (выживаемость близка к 100%). Полученные результаты хорошо согласуются с результатами исследований других авторов, которые также говорят об отсутствии токсичности [19, 20]. По данным доклинических исследований (стандартных исследований фармакологической безопасности, токсичности многократных доз, генотоксичности, канцерогенного потенциала, токсичности для репродуктивной функции и развития) не выявлено опасности применения мелатонина для человека [21]. Примеры применения мелатонина в качестве лекарственного препарата при лечении бессонницы также являются основанием считать мелатонин нетоксичным для организма человека.
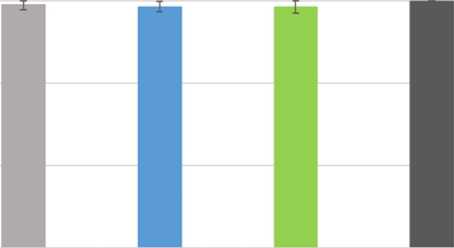
ОДмг/мл 0,2мг/мл 0,5мг/мл Контроль
Рис. 1. Влияние мелатонина на выживаемость клеток HEK 293.
Первым шагом исследования радиопротекторных свойств мелатонина в концентрации 0,1 мг/мл было определение выживаемости клеточной линии HEK 293 при действии гамма-излучения. При этом было необходимо сравнить степень радиозащитных свойств мелатонина при их выявлении с известным радиопротектором цистамином в концентрации 1,52 мг/мл (механизм действия может быть схож с предполагаемым механизмом действия мелатонина) [22]. Результаты клоногенного анализа представлены на рис. 2.
Данные, представленные на рисунке, показывают, что при добавлении цистамина и мелатонина к клеткам перед облучением наблюдается радиозащитный эффект, вследствие которого повышается выживаемость клеток. ФИД для мелатонина составляет 1,45±0,03, а для цистамина ‒ 1,34±0,05. Статистически значимые (p<0,05) различия между эффектами цистамина и мелатонина наблюдаются только при дозах 6 и 10 Гр.
Следующим шагом было определение времени удвоения клеточной линии HEK 293, результаты представлены на рис. 3.
Полученные результаты указывают на то, что повышение дозы гамма-излучения приводит к увеличению задержки деления облучённых клеток. Однако при предварительном инкубировании клеток с цистамином и мелатонином время, затраченное на деление клеток, снижается. При дозе ИИ 10 Гр мелатонин в концентрации 0,1 мг/мл в 1,26 раза уменьшает время удвоения клеток по сравнению с облучением, а цистамин снижает этот показатель в 1,15 раза.
Доза, Гр
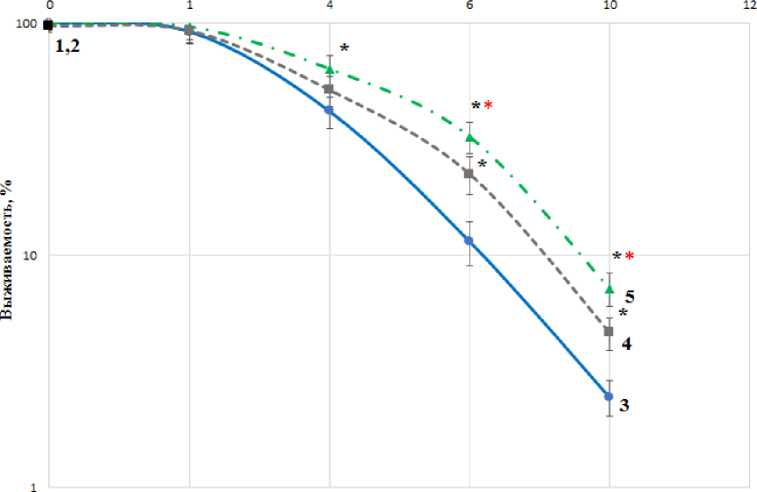
Рис. 2. Влияние мелатонина в концентрации 0,1 мг/мл и цистамина (1,52 мг/мл) на выживаемость HEK 293 человека, облучённых гамма-квантами: точки 1,2 характеризуют выживаемость клеток, инкубированных с цистамином и мелатонином; кривая 3 ‒ действие гамма-излучения на клетки; кривая 4 - действие гамма-излучения на клетки в присутствии цистамина; кривая 5 - выживаемость клеток при действии мелатонина и гамма-квантов;
* - статистически значимое отличие (p<0,05) от контроля, * - статистически значимое отличие (p<0,05) от цистамина.
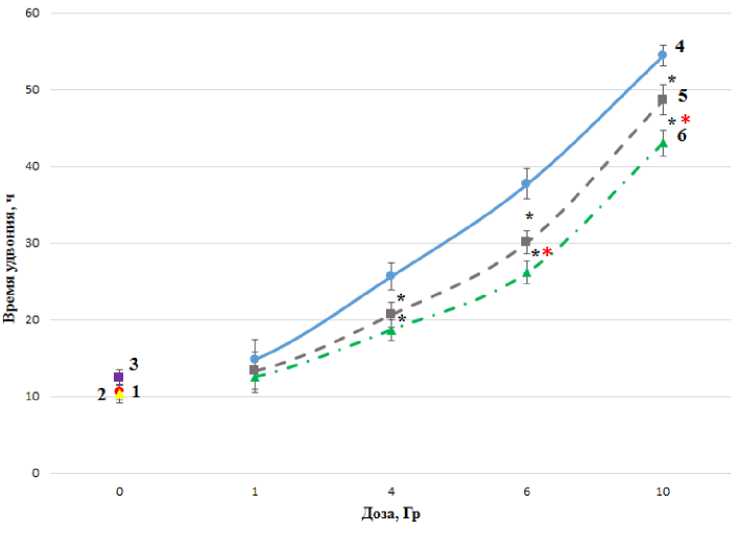
Рис. 3. Влияние мелатонина (0,1 мг/мл) и цистамина (1,52, мг/мл) на время удвоения клеточной линии HEK 293, облучённой гамма-квантами: точки 1,2, 3 отражают время удвоения клеток в контроле; клеток, инкубированных с мелатонином 24 ч и инкубированных 30 мин с цистамином; кривая 4 - действие ионизирующего излучения (Co60) на клетки; кривая 5 - сочетанное действие излучения и цистамина; кривая 6 - действие гамма-квантов и мелатонина на клеточную линию HEK 293; * - статистически значимое отличие (p<0,05) от контроля, * - статистически значимое отличие (p<0,05) от цистамина.
Таким образом, было показано, что мелатонин в исследуемой концентрации обладает ра-диопротекторными свойствами. Однако, при сравнении степени проявления радиозащитного эффекта мелатонина в концентрации 0,1 мг/мл с радиопротекторным действием цистамина в концентрации 1,52 мг/мл выявлено, что в исследуемой концентрации мелатонин не оказывает большей защиты на клетки при облучении, чем цистамин, как это предполагалось. Это объясняется тем, что, возможно, антиоксидантных свойств мелатонина в исследуемой концентрации не было достаточно для эффективного ингибирования АФК, образовавшихся при действии гамма-излучения.
В связи с этим представляет интерес исследовать большие концентрации мелатонина, ввиду того, что повышение концентрации препарата может увеличить проявление радиопротек-торного действия. Увеличение концентрации возможно за счёт того, что мелатонин не обладает токсическими свойствами. Были исследованы концентрации мелатонина 0,2 и 0,5 мг/мл, результаты клоногенного анализа отображены на рис. 4.
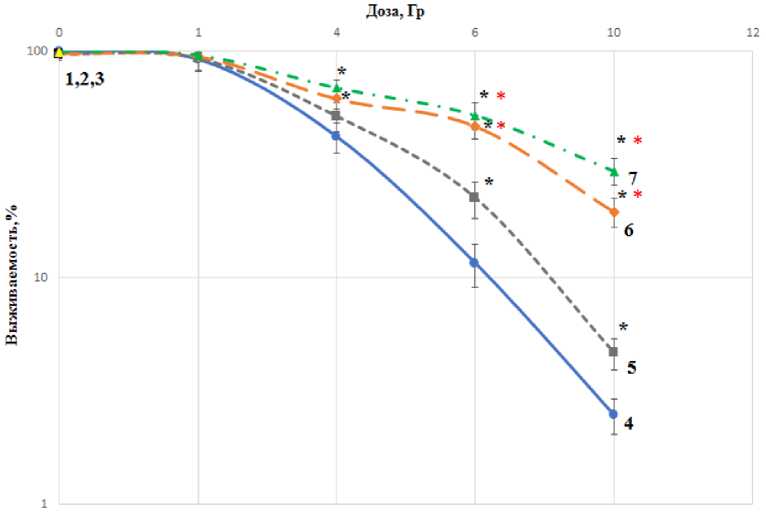
Рис. 4. Влияние мелатонина в концентрациях 0,2 и 0,5 мг/мл и цистамина (1,52 мг/мл) на выживаемость HEK 293 человека, облучённых гамма-квантами: точка 1 - клетки, предварительно инкубированные с цистамином; точки 2 и 3 - с мелатонином в концентрациях 0,2 и 0,5 мг/мл; кривая 4 показывает выживаемость клеток при действии излучения; кривая 5 -действие цистамина и гамма-излучения; кривые 6 и 7 - влияние гамма-излучения на клетки, инкубированные с мелатонином в концентрациях 0,2 и 0,5 мг/мл; * - статистически значимое отличие (p<0,05) от контроля, * - статистически значимое отличие (p<0,05) от цистамина.
Полученные результаты свидетельствуют, что действие и цистамина, и мелатонина направлено на защиту нормальных клеток человека от повреждающего действия ИИ. ФИД для мелатонина в концентрации 0,2 мг/мл составил 1,85±0,04, а для мелатонина в концентрации 0,5 мг/мл - 2,09±0,05, для цистамина - 1,34±0,05. Таким образом, при сравнении протекторного действия мелатонина в концентрациях 0,2 и 0,5 мг/мл с цистамином, видно, что при дозах ИИ 6 и 10 Гр исследуемое соединение оказывает большее радиозащитное действие на клетки человека, чем цистамин.
Далее на рис. 5 представлены данные оценки радиозащитного действия по показателю времени удвоения клеток почки эмбриона, облучённых гамма-квантами.
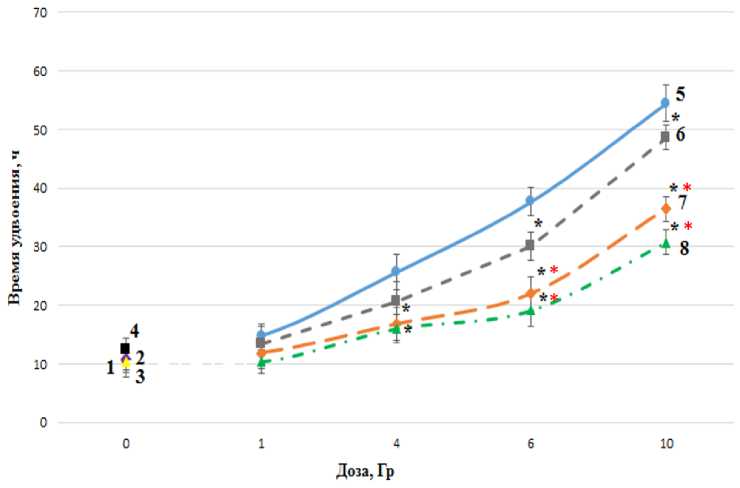
Рис. 5. Влияние мелатонина в концентрациях 0,2 и 0,5 мг/мл и цистамина (1,52 мг/мл) на время удвоения клеточной линии HEK 293, облучённой гамма-квантами: точки 1,2, 3 и 4 показывают время удвоения клеток в контроле; клеток, инкубированных 24 ч в присутствии мелатонина в концентрациях 0,2 и 0,5 мг/мл, и клеток, инкубированных с цистамином 30 мин; кривая 5 отображает влияние гамма-излучения на время удвоения HEK 293 без препаратов, кривая 6 -действие ионизирующего излучения на клетки, инкубированные с цистамином, кривые 7 и 8 - действие гамма-квантов на клетки, инкубированные с мелатонином в концентрациях 0,2 и 0,5 мг/мл; * - статистически значимое отличие (p<0,05) от контроля, * - статистически значимое отличие (p<0,05) от цистамина.
Из рисунка видно, что при дозах 6 и 10 Гр мелатонин в концентрациях 0,2 и 0,5 мг/мл более эффективно защищает клетки от повреждающего действия гамма-излучения, чем цистамин. При действии гамма-излучения в дозе 10 Гр исследуемое соединение в концентрации 0,2 мг/мл снижает время удвоения в 1,52 раза, а в концентрации 0,5 мг/мл - в 1,77 раза, тогда как цистамин снижает время, затраченное на деление клеток, в 1,15 раза при дозе 10 Гр.
Исследование мелатонина, исходя из анализа литературы, широко изучается in vivo , однако in vitro исследования проводятся в меньшей степени. Поэтому исследования радиопротек-торных свойств мелатонина не только на организменном уровне, но и на клеточном, являются актуальными с целью более точного понимания механизмов действия мелатонина на фоне ИИ. В данной работе было изучено действие мелатонина в концентрациях 0,1, 0,2 и 0,5 мг/мл на клетки почки эмбриона человека при влиянии гамма-излучения в дозах 1, 4, 6, 10 Гр. Также проведено сравнение степени проявления радиозащитного действия мелатонина с известным радиопротектором цистамином.
Исходя из полученных в ходе объёмного исследования данных, можно заключить, что мелатонин в концентрациях 0,1, 0,2 и 0,5 мг/мл обладает радиопротекторными свойствами. Стоит отметить, что, начиная с 4 Гр, при концентрациях мелатонина 0,2 и 0,5 мг/мл наблюдается более выраженный радиозащитный эффект (p<0,05), чем у цистамина. ФИД для мелатонина в концентрации 0,5 мг/мл составил 2,09±0,05 (HEK 293) и 2,00±0,06 (hTERT), в то время как для цистамина
ФИД составил 1,34±0,05 (HEK 293) и 1,32±0,02 (hTERT). При проведении сравнительного анализа используемых концентраций было показано, что мелатонин в концентрации 0,5 мг/мл обладает наибольшим протекторным действием. Различие радиозащитного эффекта у мелатонина и цистамина может быть обусловлено проявлением токсического действия последнего. Таким образом, с увеличением концентрации соединения степень защиты также повышается. Защитный механизм мелатонина обусловлен способностью захватывать свободные радикалы, образующиеся при косвенном действии гамма-излучения. Появление АФК обуславливает возникновение окислительного стресса, который негативно сказывается на целостности структуры и функциональной активности макромолекул. Кроме того, при поглощении мелатонином свободных радикалов образуются метаболиты, которые также участвуют в захвате АФК, образуя антиоксидантный каскад мелатонина.
Выводы
Показано, что мелатонин в концентрациях 0,1, 0,2 и 0,5 мг/мл не оказывает токсического действия на нормальные клетки человека. Выявлено, что мелатонин в концентрации 0,1 мг/мл обладает радиопротекторными свойствами при действии гамма-излучения в дозах 1, 4, 6, 10 Гр на клеточную линию HEK 293. ФИД составляет 1,45±0,03. Мелатонин в концентрациях 0,2 и 0,5 мг/мл защищает нормальные клетки человека при облучении гамма-квантами в дозах 1, 4, 6, 10 Гр. ФИД для мелатонина в концентрации 0,2 мг/мл составил 1,85±0,04, а для концентрации 0,5 мг/мл – 2,09±0,05.
При проведении сравнительного анализа эффективности мелатонина с цистамином показано, что степень радиозащитного действия мелатонина в исследуемых концентрациях больше.
Мелатонин представляется перспективным радиопротектором при действии редкоионизи-рующего излучения на организм человека. Представляет интерес дальнейшее исследование мелатонина на других видах клеточных линий, в более высоких концентрациях и, возможно, на фоне плотноионизирующих излучений, что может позволить снизить дозовую нагрузку вторичных продуктов, образующихся при действии протонов и ионов 12С.


