Защита миокарда от ишемически-реперфузионного повреждения посредством подачи оксида азота в контур экстракорпоральной циркуляции при проведении искусственного кровообращения
Автор: Каменщиков Николай Олегович, Мандель И.А., Подоксенов Ю.К., Михеев С.Л., Семенцов А.С., Маслов Л.Н., Козлов Б.Н., Шипулин В.М.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Экспериментальные статьи
Статья в выпуске: 4 т.21, 2017 года.
Бесплатный доступ
Цель Изучение эффективности подачи оксида азота в контур экстракорпоральной циркуляции для защиты миокарда от ишемически-реперфузионного повреждения при моделировании острого инфаркта миокарда в условиях нормотермического искусственного кровообращения в эксперименте. Методы В условиях сбалансированной анестезии, искусственных вентиляции легких и кровообращения была смоделирована острая ишемия с последующей реперфузией миокарда у кроликов (n = 20). Эксперимент включал окклюзию левой коронарной артерии путем пережатия лигатурой на 45 мин с последующей реперфузией в течение 120 мин на фоне искусственного кровообращения. Все животные были разделены на 2 равные группы: 10 кроликам проводилась подача оксида азота в контур экстракорпоральной циркуляции в дозе 40 ppm (основная группа); 10 кроликов составили контрольную группу, доставка оксида азота им не выполнялась. Определяли отношение зоны инфаркта к области риска, оценивали количество и характер желудочковых аритмий, темп диуреза. Результаты Подача оксида азота в контур экстракорпоральной циркуляции при искусственном кровообращении оказывает выраженное инфаркт-лимитирующее действие, проявляющееся в снижении отношения зоны инфаркта к области риска на 15%, р = 0,0002. В периоды ишемии и реперфузии статистически значимое меньшее количество политопных и полиморфных желудочковых экстрасистол наблюдали в основной группе (р = 0,003 и р = 0,012). Выявлено статистически значимое снижение веноартериального градиента парциального давления углекислого газа в основной группе. снижение веноартериального градиента pCO2 в основной группе было ассоциировано со значимым повышением темпа мочеотделения во время искусственного кровообращения, который составил 1,4 [1,3; 1,5] мл/кг/ч в основной группе и 1,15 [1; 1,3] мл/кг/ч в контрольной группе, p = 0,013. Выводы Полученные в ходе эксперимента данные свидетельствуют о кардиопротективных свойствах оксида азота при его подаче в контур экстракорпоральной циркуляции при моделировании ишемически-реперфузионного повреждения миокарда в виде снижения отношения зоны инфаркта к области риска на 15%, меньшего количества аритмий, а также улучшения тканевой перфузии во время искусственного кровообращения. Интраоперационная органопротекция миокарда оксидом азота у больных, оперированных в условиях искусственного кровообращения, должна стать объектом дальнейших клинических исследований.
Защита миокарда, прекондиционирование, ишемически-реперфузионное повреждение, оксид азота
Короткий адрес: https://sciup.org/142230641
IDR: 142230641
Текст научной статьи Защита миокарда от ишемически-реперфузионного повреждения посредством подачи оксида азота в контур экстракорпоральной циркуляции при проведении искусственного кровообращения
Кардиохирургическое вмешательство, выполненное в условиях искусственного кровообращения (ИК), сопровождается разнонаправленными изменениями на всех уровнях нервно-рефлекторной регуляции, гуморальной активности и метаболического статуса [1]. Интраоперационная защита органов и тканей, в частности миокарда, по-прежнему остается одним из нерешенных вопросов кардиоанестезиологии. Частота миокардиальной дисфункции в раннем послеоперационном периоде колеблется от 3 до 30% случаев [3] и обусловлена сложным взаимодействием разнообразных механизмов, включающих особый режим обменных процессов в миокарде, свободно-радикальное повреждение, ионный парадокс и эндотелиальную дисфункцию [4].
Одним из перспективных направлений является реализация клинических эффектов феномена прекондиционирования [5, 6]. Ишемическое и фармакологическое прекондиционирование представляет собой эффективный способ повышения резистентности организма к повреждающим воздействиям [7–11]. Однако у больных кардиологического профиля, ввиду возможного усугубления симптомов и сниженных резервов миокарда для защиты сердца от интраоперационной ишемии и реперфузии, наиболее подходящим и безопасным считается фармакологически индуцированное прекондиционирование [12]. При этом в качестве триггера адаптации сердца к ишемически-реперфузионно-му повреждению может выступать оксид азота (NO), запускающий инфаркт-лимитирующее действие через активацию сGMP (циклический гуанозинмонофосфат)-зависимой протеинкиназы G и образование свободных радикалов [13–16]. Стимуляция синтеза NO также играет ключевую роль и в опосредовании феномена эндогенной органопротекции, выступая медиатором поздней фазы цитопротективных эффектов [17].
Цель исследования: изучить эффективность подачи NO в контур экстракорпоральной циркуляции для защиты миокарда от ишемически-реперфузионного повреждения при моделировании острого инфаркта миокарда в условиях искусственного кровообращения.
Методы
Проспективное экспериментальное исследование проводили на 20 кроликах-самцах породы «Советская шиншилла» массой 3–3,5 кг. Все животные были разделены на 2 равные группы: 10 кроликам проводилась подача NO в контур экстракорпоральной циркуляции в дозе 40
ppm на протяжении всего периода ИК (основная группа); 10 кроликов составили контрольную группу. Животных содержали в условиях конвенционального вивария. Все болезненные процедуры и выведение животных из эксперимента осуществляли на наркотизированных животных согласно приказу Минздрава №199н «Об утверждении правил надлежащей лабораторной практики» от 1 апреля 2016 г., Принципам надлежащей лабораторной практики ГОСТ 33044-2014 и руководству Janet C. Garber, Guide for the Care and Use of Laboratory Animals: Eighth Edition National Research Council, 2011.
Эксперимент начинали с масочной индукции анестезии севофлураном. По достижении целевого уровня анестезии выполняли ретроградную интубацию трахеи по разработанной нами методике эндотрахеаль-ной трубкой № 2,5 (патент № 2611955 от 1 марта 2017 г.), животное фиксировали в положении лежа на спине. Искусственную вентиляцию легких проводили с помощью аппарата искусственной вентиляции легких Puritan Bennett 760 (США) с дыхательным объемом 30–40 мл, частотой дыхательных движений 50–55 в минуту в режиме Controlled Mandatory Ventilation (CMV) с управляемым объемом. Поддержание анестезии обеспечивали севофлураном 1,2–1,5 об% через испаритель Vapor 2000 (Drager, Германия). Использовали стандартный мониторинг анестезии, включавший непрерывный анализ электрокардиографии, инвазивный мониторинг артериального давления, пульсоксиметрию, термометрию с помощью монитора Siemens 7000 (Германия), учет темпа мочеотделения. Для инвазивного измерения артериального давления и забора крови для лабораторного анализа канюлировали бедренную артерию катетером 20G. Для инфузионной терапии канюлировали бедренную вену катетером 20G. Температурный датчик устанавливали в пищевод. Мониторировали показатели сатурации артериальной крови SаО2, сатурации венозной крови из контура искусственного кровообращения SvO2, веноартериальный градиент pCO2, уровень лактата, рассчитывали индекс экстракции кислорода O2EI, а также контролировали кислотно-щелочное состояние крови. Газовый состав крови определяли на приборе STAT PROFILE Critical Care Xpress (Nova Biomedical, США). Забор крови проводили на этапах: до ИК, начало ИК, 45 мин ишемии миокарда, 45 мин реперфузии миокарда, 90 мин реперфузии, 120 мин реперфузии. Также с помощью данного газоанализатора методом отражающей фотометрии контролировали уровень метгемоглобина. Для проведения ИК использовали роликовый насос НПМ-1, неонаталь-
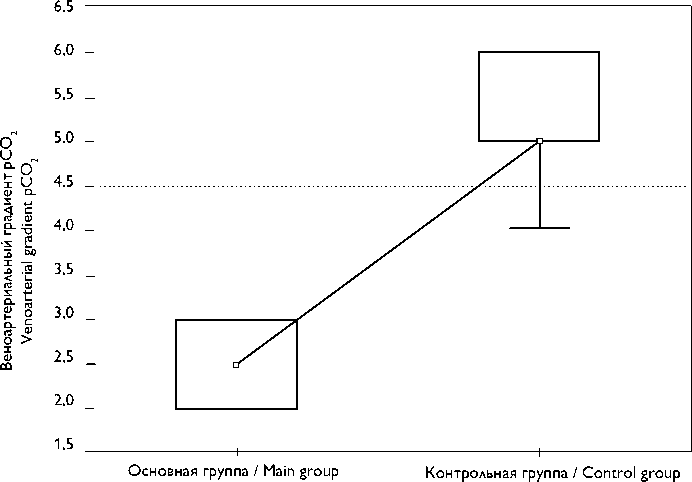
Рис. 1. Веноартериальный градиент pCO2, 45 мин ишемии, данные представлены как Ме [25; 75]; p = 0,0001
Fig. 1. Venoarterial gradient pCO2, 45 min ischemia, data are presented as Me [25; 75]; p = 0.0001
ный оксигенатор Kids D100 (Dideco, Италия). Площадь поверхности тела кролика считали равной 0,25 м2. ИК осуществляли в непульсирующем режиме, в условиях нормотермии. Подключение аппарата искусственного кровообращения осуществляли по принятой методике по схеме «аорта – правое предсердие». Перфузионный индекс составлял 1,8 л/мин/м2. Вазоактивные препараты в обеих группах не применяли. В исследуемой группе в магистраль подачи газо-воздушной смеси в асептических условиях встраивали дополнительную линию для доставки NO. Коннектор линии доставки NO был максимально приближен к оксигенатору аппарата ИК и имел бактериальный фильтр. После достижения расчетной объемной скорости перфузии осуществляли подачу NO в контур экстракорпоральной циркуляции в дозе 40 ppm. Дозирование NO осуществляли с помощью анализатора PrinterNOX (CareFusion, США). Затем проводили окклюзию левой коронарной артерии путем пережатия лигатурой на 45 мин с последующей реперфузией в течение 120 мин на фоне ИК. При этом протокол инсуффляции NO сохраняли без изменений на протяжении всего периода искусственного кровообращения.
В группе контроля подачу NO в контур аппарата ИК не проводили. Эксперимент включал окклюзию левой коронарной артерии в течение 45 мин с последующей реперфузией в течение 120 мин в условиях искусственного кровообращения.
Нарушения ритма за период коронароокклюзии регистрировали в первые 10 мин (фаза 1) и последующие 35 мин (фаза 2), поскольку механизмы возникновения аритмий в эти периоды различаются. Фаза 3 — первые 45 мин реперфузии. В фазу 1 нарушения ритма возникают по механизму reentry, в фазу ишемии 2 и при реперфузии — как по механизму reentry, так и при участии эктопического автоматизма [2].
Измерение отношения зоны инфаркта (ЗИ) к области риска (ОР) проводили с помощью модифицированного метода, предложенного J. Neckar [18]. Для определения области риска (гипоперфузии) лигатуру повторно затягивали, сердце окрашивали 5% раствором перманганата калия, который вводили через аортальную канюлю. Сердце извлекали из грудной полости, удаляли правый желудочек и готовили срезы толщиной 1 мм, которые делали строго перпендикулярно продольной оси сердца, используя слайсер HSRABBIT002-1 (Zivic Instruments, Pittsburgh, США)). Срезы сканировали с обеих сторон с помощью HP Scanjet G4050 (Hewlett-Packard, Palo Alto, США) с высоким разрешением (2400 dpi). В области гипоперфузии разграничивали зоны, в которых ткани миокарда подверглись некрозу. Величину ЗИ и ОР определяли
Основная группа / Main group
Контрольная группа / Control group
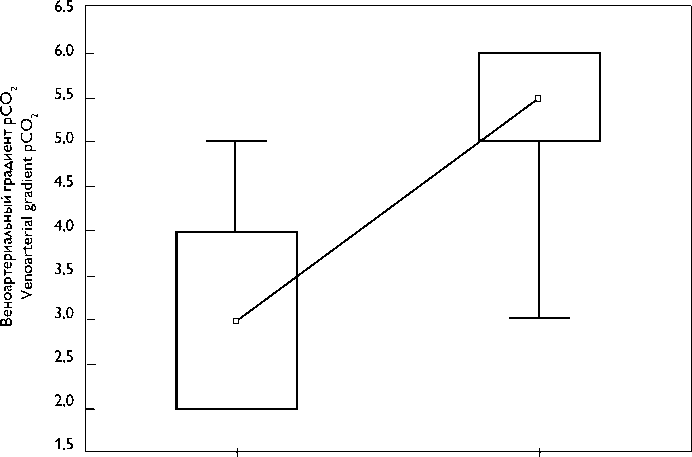
Рис. 2. Веноартериальный градиент pCO2, 45 мин реперфузии, p = 0,0016; данные представлены как Ме [25; 75]
Fig. 2. Venoarterial gradient pCO2, 45 min reperfusion, p = 0.0016; data are presented as Me [25; 75]
компьютеризированным планиметрическим методом, используя оригинальное программное обеспечение. Метод компьютерной планиметрии применяли для измерения общей площади срезов, суммарной площади зоны инфаркта и области риска для каждого сердца в отдельности. Измерение осуществляли с помощью программного обеспечения для анализа изображений ImageJ2 [19]. Величину очага инфаркта выражали в виде процентного соотношения зоны инфаркта к размеру области риска (ЗИ/ОР).
Статистический анализ
Статистический анализ полученных данных был проведен в программе Statistica 10.0 (StatSoft). Количественные значения выражали как медиану 25-го и 75-го процентилей (Me [25; 75]). Сравнение количественных характеристик проводили с помощью U-критерия Манна – Уитни (для независимых переменных) и T-критерия Уилкоксона (для зависимых переменных). Различия между группами в частоте возникновения желудочковых аритмий оценивали с помощью критерия хи-квадрат. Различия считали статистически значимыми при p<0,05.
Результаты
У животных обеих групп в течение эксперимента были стабильные показатели метаболизма, кислотноосновной состав крови и ионнограмма: рН, уровни бу- ферных оснований, концентрация лактата, глюкозы, ионов натрия, калия и кальция — находились в пределах референтных значений. При анализе межгрупповых различий отмечено значимое снижение веноартериального градиента pCO2 на этапе 45 мин ишемии (рис. 1), р = 0,0001, и на этапе 45 мин реперфузии, p = 0,0016 (рис. 2).
Снижение веноартериального градиента pCO2 в основной группе было ассоциировано со значимым повышением темпа мочеотделения во время ИК, который составил 1,4 [1,3; 1,5] мл/кг/ч в основной группе и 1,15 [1; 1,3] мл/кг/ч в контрольной, p = 0,013 (рис. 3).
В первые 10 мин ишемии миокарда в основной группе политопные и полиморфные желудочковые экстрасистолы (ЖЭС) наблюдали значимо реже, р = 0,003. В группе контроля чаще отмечены политопные и полиморфные ЖЭС; фибрилляция желудочков развилась у одного животного. В последующие 35 мин ишемии в основной группе животных наблюдали большую электрическую стабильность миокарда, по сравнению с контрольной, р = 0,001. В период реперфузии наблюдали различные виды желудочковых аритмий, статистически значимо меньшее количество политопных и полиморфных ЖЭС наблюдалось в группе NO-протекции, р = 0,012. Фибрилляция желудочков на этапе реперфузии развилась у 4 животных контрольной группы, в основ-
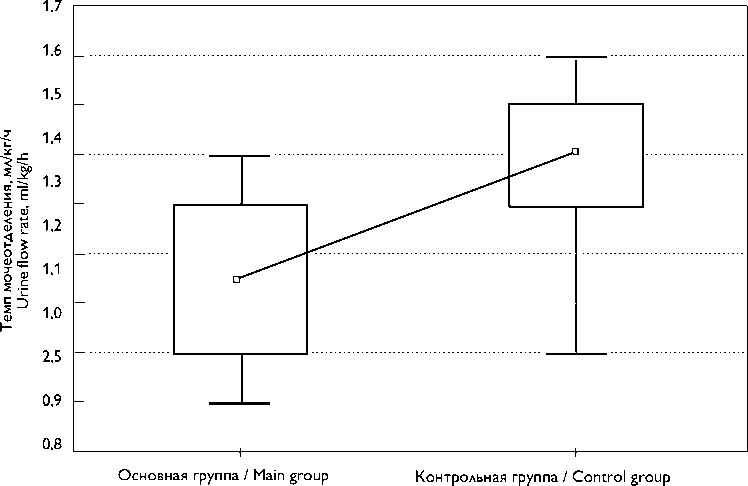
Рис. 3. Темп мочеотделения, мл/кг/ч; p = 0,013
Fig. 3. Urine flow rate, ml/kg/h; p = 0.013
ной группе фибрилляция желудочков не зарегистрирована, р = 0,04 ( таблица ).
Соотношение ЗИ/ОР в основной группе составило 55,6 [50; 61] %, что меньше на 15%, чем у животных контрольной группы — 69,9 [68; 73] %, p = 0,0002 (рис. 4).
Обсуждение
Известно, что NO участвует в реализации различных защитных эффектов адаптации через изменение функционального состояния митохондрий. Возможные механизмы органопротективного действия включают каскады внутриклеточных трансмиттеров с активацией КАТФ-каналов и ингибированием митохондриальных проводящих пор как конечных эффекторов прекондиционирования и снижения повреждения митохондрий при гипоксии/аноксии. Опосредованное NO-угнетение адренергической стимуляции и сократимости с сохранением эндотелий-зависимой вазодилатации и снижением кальциевой перегрузки клеток ведет к уменьшению феномена no-reflow. В исследовании у грызунов установлено, что ингаляция оксида азота приводит к быстрому накоплению метаболитов NO в крови и тканях, способс-
Влияние доставки NO в контур искусственного кровообращения на частоту возникновения аритмий на этапах ишемии и реперфузии
|
Фаза |
Вид нарушения сердечного ритма |
Основная группа, n (%) |
Контрольная группа, n (%) |
p |
|
10 мин ишемии |
нет аритмий либо редкие монотопные ЖЭС |
5 (50) |
6 (60) |
0,5 |
|
10 мин ишемии |
политопные и полиморфные ЖЭС |
2 (20) |
9 (90) |
0,003 |
|
10 мин ишемии |
фибрилляция желудочков |
0 |
1 (10) |
0,5 |
|
35 мин ишемии |
нет аритмий либо редкие монотопные ЖЭС |
5 (50) |
6 (60) |
0,5 |
|
35 мин ишемии |
политопные и полиморфные ЖЭС |
1 (10) |
7 (70) |
0,001 |
|
35 мин ишемии |
фибрилляция желудочков |
1 (10) |
1 (10) |
1 |
|
45 мин реперфузии |
нет аритмий либо редкие монотопные ЖЭС |
5 (50) |
4 (40) |
0,5 |
|
45 мин реперфузии |
политопные и полиморфные ЖЭС |
2 (20) |
8 (80) |
0,012 |
|
45 мин реперфузии |
фибрилляция желудочков |
0 |
4 (40) |
0,04 |
Примечание. ЖЭС — желудочковые экстрасистолы, применен критерий χ 2 Пирсона
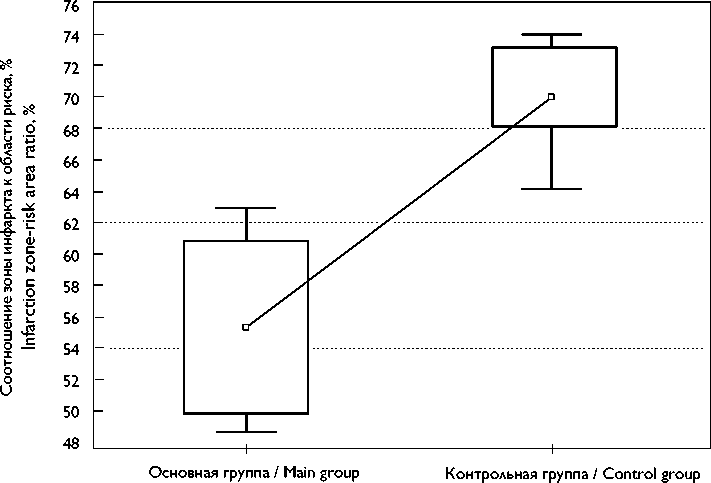
Рис. 4. Соотношение зоны инфаркта к области риска, данные представлены в % как Ме [25; 75], использован критерий Манна – Уитни; p = 0,0002
Fig. 4. Infarction zone-risk area ratio, the data are presented in % as Me [25; 75], Mann – Whitney test was used; p = 0.0002
твуя кардиопротекции при ишемически-реперфузион-ном повреждении и уменьшению ЗИ/ОР на 31% [20, 21].
Полученные нами данные также свидетельствуют о кардиопротективных свойствах NO при его подаче в контур экстракорпоральной циркуляции при моделировании ишемически-реперфузионного повреждения миокарда. Выявлен инфаркт-лимитирующий эффект со снижением ЗИ/ОР на 15% по сравнению с контрольной группой, а также антиаритмическое действие.
Кардиохирургические пациенты имеют повышенный риск острого повреждения почек и желудочно-кишечного тракта, особенно при необходимости сочетанной операции [22]. Развитие гемолиза вследствие длительного ИК и применения компонентов донорской крови, а также ограничение NO-биодоступности приводят к расстройствам микроциркуляции и системным аберрациям органного кровотока [23].
В исследованиях последних лет доказана безопасность применения оксида азота в течение 24 ч, а также не-фропротективное действие оксида азота, примененного во время ИК и в течение 24 ч после ИК в виде ингаляции, которое проявлялось в снижении развития острого почечного повреждения после кардиохирургических операций в условиях длительного перфузионного периода [24].
По нашим данным, снижение веноартериального градиента pCO2 в основной группе было ассоциировано со значимым повышением темпа мочеотделения во время ИК, что указывает на более выгодный режим кровообращения в органах спланхнического бассейна, в том числе почек во время ИК. Определение оптимального режима дозирования требует дальнейшего изучения.
Выводы
Полученные в ходе эксперимента данные свидетельствуют о кардиопротективных свойствах оксида азота при его подаче в контур экстракорпоральной циркуляции при моделировании ишемически-реперфузионно-го повреждения миокарда в виде снижения ЗИ/ОР на 15%, меньшего количества аритмий. Доставка оксида азота в контур экстракорпоральной циркуляции также приводит к улучшению тканевой перфузии во время искусственного кровообращения. Интраоперационная органопротекция миокарда оксидом азота у больных, оперированных в условиях ИК, должна стать объектом дальнейших клинических исследований.
Финансирование
Исследование не имело спонсорской поддержки.
Список литературы Защита миокарда от ишемически-реперфузионного повреждения посредством подачи оксида азота в контур экстракорпоральной циркуляции при проведении искусственного кровообращения
- Караськов А.М., Аомиворотов В.В. Биохимическая адаптация организма после кардиохирургических вмешательств. Новосибирск: Академическое издательство «Гео», 2004. 288 c.
- Маслов А.Н., Аишманов Ю.Б., Крылатов А.В., Семенцов А.С., Портниченко А.Г., Подоксёнов Ю.К., Халиулин И.Г. Сравнительный анализ кардиопротекторной и антиаритмической эффективности раннего и позднего гипоксического прекондиционирования. Бюллетень экспериментальной биологии и медицины. 2013;156(12):705-708. Режим доступа: http://www. iramn.ru/journal/bebm/2013/bbm1312.htm
- Yau J.M., Alexander J.H., Hafley G., Mahaffey K.W., Mack M.J., Kouchoukos N., Goyal A., Peterson E.D., Gibson C.M., Califf R.M., Harrington R.A., Ferguson T.B.; PREVENT IV Investigators. Impact of perioperative myocardial infarction on angiographic and clinical outcomes following coronary artery bypass grafting (from PRoject of Ex-vivo Vein graft ENgineering via Transfection [PREVENT] IV). Am J Cardiol. 2008;102(5):546-51. PMID: 18721510. https://doi. org/ DOI: 10.1016/j.amjcard.2008.04.069
- Carden D.L, Granger D.N. Pathophysiology of ischaemia- reperfusion injury. J Pathol. 2000;190(3):255-66. PMID: 10685060. - PATH526>3.0.CO;2-6 DOI: 10.1002/(SICI)1096-9896(200002)190:3
- Murry C.E., Jennings R.B., Reimer K.A. Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium. Circulation. 1986;74(5):1124-36. PMID: 3769170. https://doi. org/ DOI: 10.1161/01.CIR.74.5.1124


