ЗАЩИТНЫЕ ФИЛЬТРЫ ОТ ПЫЛЕОБРАЗНЫХ ЗАГРЯЗНЕНИЙ В ЖИДКОСТЯХ ДЛЯ ЗАДАЧ КАПЕЛЬНОЙ МИКРОФЛЮИДИКИ
Автор: Н. А. Филатов, Д. В. Панкратов, А. А. Тюшкевич, П. С. Плешаков, А. С. Букатин
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Приборостроение физико-химической биологии
Статья в выпуске: 3, 2025 года.
Бесплатный доступ
В настоящее время технологии капельной микрофлюидики активно исследуются и внедряются для решения разнообразных биологических задач: скрининга новых лекарств, молекулярной диагностики, химического синтеза и др. Однако большинство предложенных устройств подходит только для лабораторного применения из-за проблем с надежностью и воспроизводимостью результатов. Одной из ключевых проблем, возникающих при использовании микрофлюидных чипов, является забивание и блокирование микроканалов загрязняющими частицами. В литературе предложены различные конструкции фильтрующих элементов, размещающихся вблизи входных интерфейсов микрофлюидного чипа. Однако многие из них не подходят для работ с микрокаплями водных эмульсий, поскольку структура фильтра может приводить к нарушениям исходной эмульсии (разделению или объединению капель). В данной работе мы изучили 17 конструкций фильтров, интегрированных в микрофлюидные чипы, задерживающих микрочастицы пыли и пропускающих микрокапли эмульсии "вода-в-масле" через себя. В ходе исследования была определена эффективность фильтрации микрочастиц из модельного раствора пыли в воде и фторуглеродном масле. Общий диапазон эффективности фильтрации микрочастиц пыли находился в пределах 88–99% для всех исследованных конструкций фильтров. В наилучших 4 конструкциях, имеющих эффективность фильтрации свыше 98%, было проведено исследование транспорта микрокапель эмульсии "вода-в-масле". По результатам исследования была определена оптимальная конструкция фильтрующего элемента, задерживающего микрочастицы пыли с эффективностью 99% и увеличивающего коэффициент вариации диаметра микрокапель монодисперсной эмульсии "вода-в-масле" не более чем в 2 раза, с 6 до 12%.
Микрофлюидный чип, чипы ПДМС/стекло, фильтры, слияние капель, разделение капель
Короткий адрес: https://sciup.org/142245622
IDR: 142245622 | УДК: 532.5.011,57.085.23
Текст научной статьи ЗАЩИТНЫЕ ФИЛЬТРЫ ОТ ПЫЛЕОБРАЗНЫХ ЗАГРЯЗНЕНИЙ В ЖИДКОСТЯХ ДЛЯ ЗАДАЧ КАПЕЛЬНОЙ МИКРОФЛЮИДИКИ
В настоящее время микрофлюидные технологии являются быстрорастущей областью науки и техники, находящими широкое применение для решения разнообразных задач, особенно в области биоинженерии и биомедицинских исследований [1, 2]. Микрофлюидные системы и устройства предоставляют исследователям уникальные инструменты для подготовки образцов [3], тканевой инженерии [4], молекулярной диагностики и скрининга лекарственных препаратов [5].
"Микрофлюидика" (микрогидродинамика) описывает технологии управления жидкостями с характерными объемами от микролитров до фемтолитров в миниатюрных микрофлюидных устройствах (чипах) с характерными размерами микроканалов 5–500 мкм [6]. Микрофлюидные технологии в сочетании с технологиями микроэлектроники и химической инженерии предлагают новые подходы к решению традиционных задач, повышая точность дозирования образца и реагентов, увеличивая чувствительность и снижая пре- дел обнаружения детектируемых объектов, что приводит к увеличению скорости анализа и снижению его стоимости [7].
Одной из наиболее быстро развивающихся областей микрофлюидных технологий является капельная микрофлюидика [8, 9]. В ней используются микрокапли эмульсии "вода-в-масле" или "во-да-масло-вода" в качестве пиколитровых или на-нолитровых реакторов для проведения биохимических реакций. Это может значительно повысить эффективность анализов, скрининга лекарств и анализа отдельных клеток [10]. Более того, применение технологий капельной микрофлюидики обеспечивает обнаружение отдельных молекул при проведении цифровой полимеразной цепной реакции (ПЦР) [11], секвенирование мРНК из отдельных клеток [12], а также проведение транскриптомного и протеомного анализов отдельных клеток [13]. Другим востребованным применением монодисперсных эмульсий является синтез однослойных и многослойных микро- и наночастиц, которые могут использоваться в качестве контейнеров для доставки лекарств, структурных элемен- тов в тканевой инженерии, а также в качестве микролинз для фотоники и биосенсорики [14–18] .
Однако длительная и воспроизводимая работа микрофлюидных устройств лимитируется уровнем чистоты и наличием загрязняющих примесей как в самих устройствах, так и в жидкостях, прокачивающихся через чип. Одной из ключевых проблем микроканалов является их засорение загрязняющими частицами, попавшими в них в процессе изготовления устройств или из протекающих по каналам жидкостей [19]. Они могут иметь различную природу и происхождение: материал чипа и подводящих трубок, осадок в реагентах, фрагменты тканей в биологическом образце и др. Перемещаясь по микроканалам чипа, они могут агрегировать и создавать пробки, приводящие к засорению чипа и нарушению режима его работы. Очистка тонких микроканалов может быть крайне проблематичной, что приводит к необходимости замены чипа для продолжения работы.
Анализ литературных данных показал, что для защиты микрофлюидного чипа от загрязнений было предложено использовать массивы микроструктур в качестве фильтрующих элементов, расположенных во входных каналах микрофлюидно-го устройства [20–24]. Однако зачастую такие фильтры не подходят для работы с каплями эмульсии, поскольку из-за малого расстояния между микроструктурами могут разделять или сливать капли [25–27]. При этом при работе с каплями частицы пыли также могут забить каналы и остановить работу устройства. Можно выделить научную статью [24], где в микрофлюидных устройствах применяются фильтры на пути движения микрокапель. Однако в общем тема фильтров для работы c микрокаплями выглядит мало проработанной.
Целью данной работы является разработка оптимальной конструкции микрофлюидного фильтра, способного задерживать твердые частицы пылеобразного и жидкообразного загрязнений с характерными размерами 10–25 мкм, но при этом свободно пропускать микрокапли эмульсии "вода-в-масле" с характерным диаметром 50 мкм. Для этого в ходе исследования было разработано 17 вариантов конструкций микрофлюидных фильтров, которые можно условно разделить на три типа в соответствии с конструктивными особенностями используемых в них массивов микроструктур. Все предложенные варианты были протестированы на предмет фильтрации микрочастиц из модельного раствора пыли в воде и фторуглеродном масле. В наилучших 4 конструкциях фильтров, имеющих эффективность фильтрации свыше 98%, было проведено исследование транспорта микрокапель эмульсии "вода-в-масле", по результатам которого была определена наиболее эффективная конструкция фильтрующего элемента. При движении в канале фторуглеродного масла он позволяет задерживать микрочастицы пыли с характерным размером 10–25 мкм с эффективностью 99%, а при прохождении микрокапель эмульсии "вода-в-масле" увеличивает коэффициент вариации (C.V.) их диаметра не более чем в 2 раза, с 6 до 12%.
МАТЕРИАЛЫ И МЕТОДЫ
Изготовление микрофлюидных чипов
Изготовление микрофлюидных чипов из поли-диметилсилоксана (ПДМС Sylgard 184, DowSi-licones, USA) и стекла осуществлялось с помощью стандартного метода мягкой литографии [28, 29]. Для этого методом контактной оптической литографии фоторезиста SU-8 2025 (Kayaku Advanced Materials, Вестборо, Массачусетс, США) на кремниевой подложке через хромовый фотошаблон была изготовлена кремниевая мастер-форма. ПДМС Sylgard 184 представляет собой двухкомпонентную смесь основы и отвердителя, которая после тщательного перемешивания в соотношении 10 : 1 и дегазации в эксикаторе заливалась на мастер-форму. После отверждения компаунда в печи при температуре 65 °C в течение 4 ч ПДМС-реп-лика отделялась от формы и разрезалась на отдельные устройства. C помощью пробойника для биопсии кожи в устройствах были сделаны входные и выходные отверстия диаметром 1 или 2 мм. Для соединения ПДМС-реплик со стеклами применялась обработка поверхностей коронными разрядами [30].
Подготовка модельных жидкостей и эмульсий
Для приготовления модельных растворов пыли и грязи в деионизованную воду (MilliQ, Millipore, США) и фторуглеродное масло (ddPCRTM Droplet Reader Oil, Bio-Rad, США) были добавлены образцы типичной пыли из лаборатории в концентрации 0.6 мг/мл. Для формирования монодис-персных микрокапель "вода-в-масле" использовался микрофлюидный генератор эмульсий с фокусировкой потока [31]. В качестве дисперсной фазы использовалась деионизованная вода, а в качестве непрерывной фазы — фторуглеродное масло HFE-7500 (Acota Limited, США), в которое для стабилизации эмульсии был добавлен 1% поверхностно-активного вещества FluoSurf (Dolomite Microfluidics, Великобритания). Ввод жидкостей в микрофлюидный генератор эмульсий, а также ввод эмульсий в микрофлюидные чипы с фильтрами осуществлялся с помощью микрофлюидного контроллера давлений и пневматических интерфейсов собственной разработки [31]. Для ввода в микрофлюидные чипы с фильтрами модельных растворов с пылью использовался шприцевой насос PHD2000 (Harvard Apparatus, США).
Регистрация и анализ результатов
Для анализа геометрических размеров модельной суспензии пыли и микрокапель эмульсии, а также для регистрации процессов, протекающих в микрофлюидных чипах, использовался оптический микроскоп Zeiss Axiovert 200M (Carl Zeiss MicroImaging GmbH, Германия) с камерой MER-301-125U3M (Daheng Group, Inc., Китай). Обработка получаемых изображений осуществлялась с помощью оригинальных алгоритмов, разработанных на языке Python.
Для анализа эффективности работы фильтров определялось количество пыли в образцах фторуглеродного масла и воды до и после фильтрации. Для этого раствор пыли в масле или воде загружался в пластиковый шприц с фитингом и капилляром. В выходное отверстие чипа-фильтра устанавливался наконечник дозатора на 1000 мкл для сбора очищенного раствора. С помощью шприцевого насоса по капилляру раствор пыли поступал в чип-фильтр в течениe 10 мин при расходе 50 мкл/мин. После фильтрации в каждом случае происходила съемка 8 мест образца отфильтрованного раствора под микроскопом. На базе 8 снимков в каждом случае производился подсчет количества пыли на изображениях. Для этого использовалось черно-белое изображение, и вручную выставлялся определенный порог для пикселей, при котором изображение разделялось на белую область, где пыль отсутствовала, и черную область, занятую пылью. После этого рассчитывалась область изображения, занятая пылью. Затем происходило усреднение полученных значений для каждого из фильтров, и считалась его эффективность по формуле: 100 ∙ (1 – С out / C in )%, где С out — количество пыли в образце, прошедшем через фильтр, C in — количество пыли в образце, подаваемом в фильтр. При статистической обработке результатов вычислялась стандартная ошибка среднего.
Для определения среднего диаметра и коэффициента вариации диаметра микрокапель эмульсии "вода-в-масле" до и после прохождения фильтров использовался аналогичный алгоритм действий, как в случае с пылью. Однако для ввода микрокапель в масле применялся микрофлюидный контроллер давлений [31]. В чип-фильтр во входное отверстие устанавливался наконечник дозатора 200 мкл, а в выходное — специально подрезанный наконечник на 1000 мкл. Во входной наконечник была загружена проба около 20 мкл микрокапель эмульсии. Под действием давления ~5.5 кПа в течение 10 мин проба прокачивалась через чип. Для анализа микрокапель малый объем раствора эмульсии до и после фильтрации помещался в камеру Горяева (высота 100 мкм), установленную в микроскоп. Исходная эмульсия вводилась в камеру 5 независимых раз с фиксацией 5 снимков образца в каждом случае. Эмульсия после прохождения фильтра вводилась в камеру 3 независимых раза с фиксацией 8 снимков образца в каждом случае. После этого с помощью библиотеки "opencv" на языке программирования Python производилось распознавание микрокапель на изображениях. После обнаружения микрокапель значения их диаметров заносились в общую таблицу с указанием номера снимка и номера фильтра. Для каждого из исследованных фильтров было построено распределение микрокапель по диаметру, нормированное на их общее количество. Для каждого из распределений указано, на каком количестве капель производился расчет параметров и построение гистограммы.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
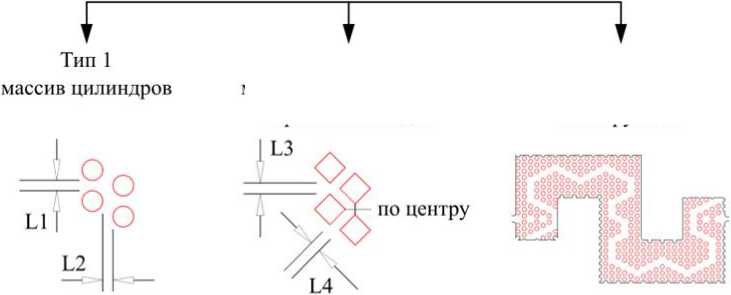
В рамках создания конструкций чипов-фильтров от пыли и грязи для реинъектирования микрокапель было разработано 17 конструкций чипов, содержащих массивы фильтрующих микроструктур разной конфигурации (см. Приложение). Общий вид чипа-фильтра показан на рис. 1, а. Чип состоит из входа с отверстием, фильтрующего элемента и выходного канала с выходным отверстием. Выходной микроканал имеет характерную ширину 100 мкм. Такая конструкция чипа-фильтра имитирует типичную конструкцию входных микроканалов в микрофлюидных устройствах. Все предложенные конструкции фильтрующих элементов можно условно разделить на 3 типа (рис. 1, б): на основе массива цилиндров (6 моделей), на основе массива прямоугольных параллелепипедов (5 моделей) и уникальные конструкции, содержащие оригинальные конфигурации массивов микроструктур (6 моделей). Все чипы обозначены условным номером вида Т1-2, где первая цифра указывает на тип, а вторая на порядковый номер фильтрующего элемента (модель). Глубина всех каналов составляла 25 мкм. Модели фильтров на основе массивов цилиндров и прямоугольных параллелепипедов отличались друг от друга количеством рядов, их расположением и общим размером массива микроструктур. При этом расстояние (L1, L2, L3, L4 на рис. 1, б) между соседними микроструктурами находилось в диапазоне 25–50 мкм. В основе "уникальных" конструкций фильтрующих элементов лежит идея создать в массиве
а

Микрокапли эмульсии
Монодисперсные микрокапли -эмульсии
б
Фильтр
Тип 2
Тип 3
Рис. 1. Конструкция микрофлюидных чипов-фильтров.
а — принципиальная схема; б — классификация фильтрующих элементов на 3 типа: на основе массива цилиндров, на основе массива прямоугольных параллелепипедов и уникальные конструкции
массив прямоугольных параллелепипедов
уникальные конструкции
микроструктур криволинейный путь для капель эмульсии, в то время как микрочастицы грязи и пыли будут двигаться по прямолинейным траекториям вместе с потоком жидкости и оседать на боковых стенках микроструктур.
Определение оптимальной конструкции фильтрующего элемента, эффективно задерживающего микрочастицы пыли и грязи, но в то же время пропускающего без повреждений капли эмульсии
"вода-в-масле", состояло из двух этапов. На первом этапе с помощью шприцевого насоса через все микрофлюидные чипы с фильтрующими элементами прокачивалось 500 мкл модельных суспензий частиц пыли и грязи в воде и масле с расходом 50 мкл/мин. В ходе эксперимента по изображениям с оптического микроскопа проводилась оценка количества пыли в жидкостях до и после прохождения фильтров (рис. 2).
Область чистого фильтра Очищенный раствор Область фильтра после использования

чип-фильтр ТЗ-4 чип-фильтр ТЗ-4 чип-фильтр ТЗ-4
Рис. 2. Примеры работы фильтрующих элементов (масштаб 200 мкм).
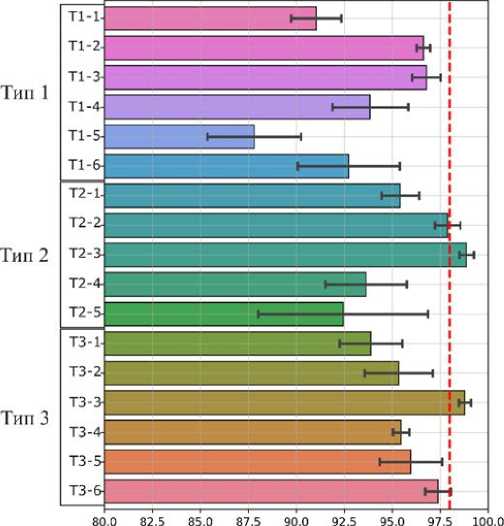
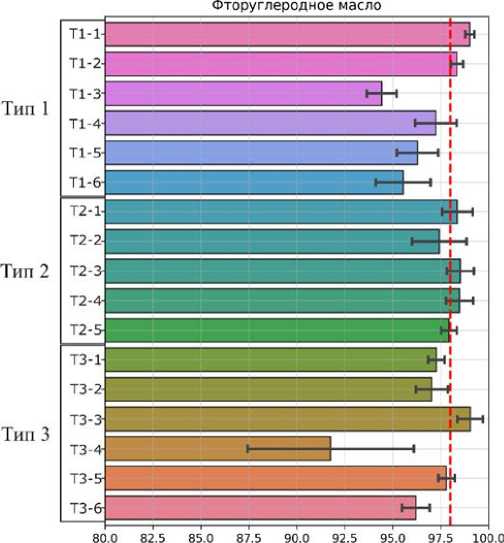
Затем вычислялась относительная эффективность фильтрации для каждой конструкции фильтрующего элемента, приведенная на рис. 3. Полученные результаты показывают, что в целом все исследованные конструкции фильтрующих элементов хорошо задерживают частицы пыли и грязи из водных и масляных суспензий с эффективностью 88–99%. При этом эффективность удаления микрочастиц пыли и грязи из фторуглеродного масла в среднем выше, чем из воды. Однако есть конструкции фильтров, например Т1-3 и Т3-4, которые показали бóльшую эффективность в фильтрации воды, чем масла. Для второго этапа тестирования были отобраны конструкции фильтров T1-1, T1-2, T2-3, T3-3, которые обеспечили эффективность фильтрации микрочастиц пыли и грязи свыше 98% из водной или масляной суспензии.
На втором этапе выбора оптимальной конструкции фильтрующего элемента через чипы-фильтры пропускались монодисперсные капли эмульсии "вода-в-масле" в течении 10 мин под давлением ~5.5 кПа. На рис. 4 приведены гистограммы распределения диаметра капель до и после прохождения фильтрующих элементов. Исходный образец монодисперсных микрокапель эмульсии, синтезированной в микрофлюидном генераторе капель с фокусировкой потока, имел средний диаметр капель 47 мкм, среднеквадратичное отклонение (SD) 3 мкм, C.V. = 6% (анализ 5844 штук капель).
Образец № T1-1 (анализ 3488 штук капель) показывает средний диаметр 47 мкм, SD = 5 мкм, C.V. = 12%.
Образец № Т1-2 (анализ 3115 штук капель) показывает средний диаметр 46 мкм, SD = 6 мкм, C.V. = 13%.
Образец № T2-3 (анализ 4976 штук капель) показывает средний диаметр 40 мкм, SD = 7 мкм, C.V. = 18%.
Образец № T3-3 (анализ 2281 штук капель) показывает средний диаметр 49 мкм, SD = 12 мкм, C.V. = 24%.
а б
Эффективность, % Эффективность, %
Рис. 3. Эффективность очистки модельных суспензий пыли в воде (а) и фторуглеродном масле (б) в микро-флюидных чипах-фильтрах.
Пунктирными линиями обозначен целевой уровень очистки 98%. Планки погрешностей иллюстрируют стандартную ошибку и построены по 8 измерениям
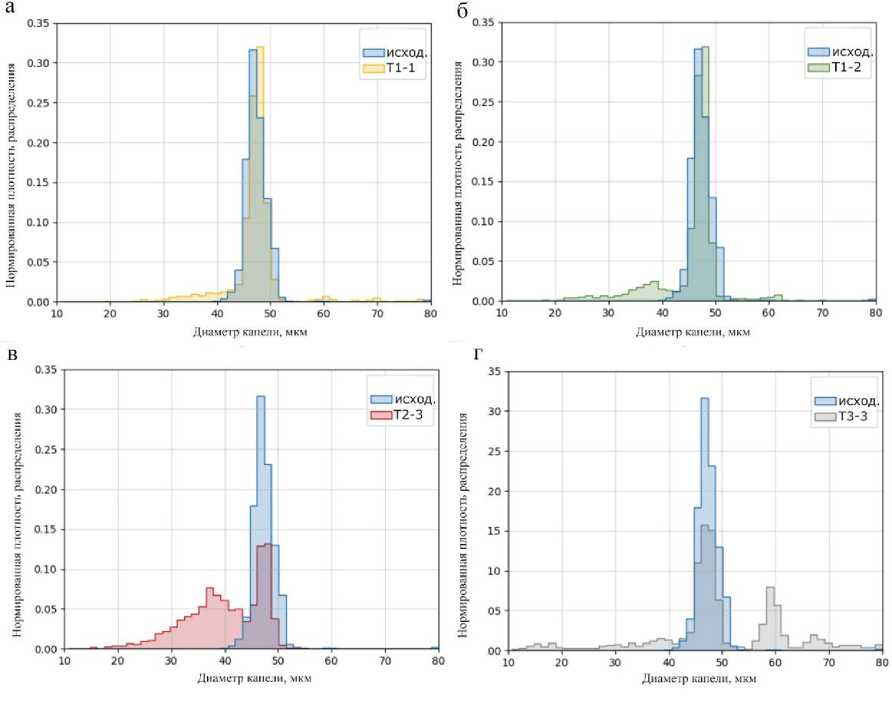
Рис. 4. Распределения диаметров микрокапель после протекания в различных чипах-фильтрах.
Обозначения: исход. — распределение диаметров исходной эмульсии микрокапель; T1-1, T1-2, T2-3, T3-3 — распределения диаметров выходной эмульсии микрокапель в различных чипах-фильтрах
Анализ полученных результатов показал, что фильтрующий элемент на основе массива цилиндрических микроструктур Т1-1 оказывает минимальное воздействие на капли эмульсии, не изменяя средний диаметр капель, увеличивая среднеквадратичное отклонение с 3 мкм до 5 мкм. На рис. 5, а, можно заметить, что увеличение среднеквадратичного отклонения может происходить из-за слияния капель в процессе движения между микроструктурами фильтра. Близкий результат показывает фильтрующий элемент Т1-2 с массивом цилиндрических микроструктур альтернативной конфигурации (см. рис. 4, б, и 5, б). Анализ результатов прохождения моно-дисперсной эмульсии через фильтрующий элемент из массива прямоугольных параллелепипедов показал, что на таких микроструктурах капли эмульсии имеют способность разделяться на две или несколько капель. Это отражается на распределении диаметров микрокапель, которое из одномо- дального превращается в бимодальное (см. рис. 4, в, и 5, в). Напротив, движение эмульсии в фильтрующем элементе уникальной конструкции Т3-3 показало склонность к слиянию нескольких капель в одну большую каплю, что выражается в появлении дополнительных пиков на гистограмме диаметров (см. рис. 4, г, и 5, г).
ЗАКЛЮЧЕНИЕ
В данной работе был проведен поиск оптимальной конструкции микрофлюидного фильтра, способного задерживать твердые частицы пыли и грязи с характерными размерами 10–25 мкм, но при этом свободно пропускать микрокапли эмульсии "вода-в-масле" с характерным диаметром 50 мкм. Для этого было изучено 17 конструкций фильтров, интегрированных в микрофлюид-ные чипы, которые были условно разделены на 3 типа: на основе массива цилиндров (6 моделей),
Область чипа у выходного канала
Микрокапли после фильтра
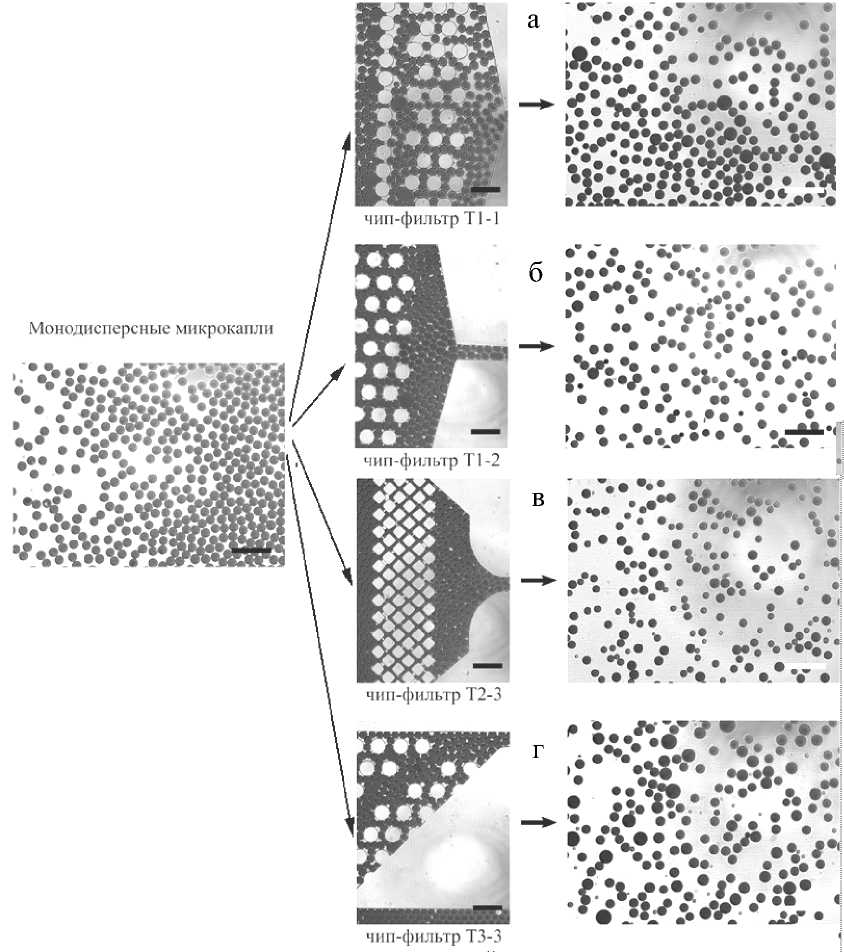
Рис. 5. Примеры движения монодисперсной эмульсии "вода-в-масле" через фильтрующие элементы.
Масштаб 200 мкм
на основе массива прямоугольных параллелепипедов (5 моделей) и уникальные конструкции, содержащие оригинальные конфигурации массивов микроструктур (6 моделей). Все предложенные варианты были протестированы на предмет фильтрации микрочастиц из модельного раствора пыли в воде и фторуглеродном масле. В наилучших 4 конструкциях фильтров, имеющих эффективность фильтрации свыше 98% в воде или в масле, было проведено исследование транспорта микрокапель эмульсии "вода-в-масле". В результате конструкция фильтрующего элемента T1-1
с массивом цилиндрических микроструктур была определена как наиболее оптимальная. Фильтр T1-1 позволяет задерживать микрочастицы пыли с характерным размером 10–25 мкм в масле с эффективностью 99%, а при прохождении микрокапель эмульсии "вода-в-масле" увеличивает коэффициент вариации их диаметра не более чем в 2 раза — с 6 до 12%. При этом близкий результат показывает фильтрующий элемент Т1-2 с массивом цилиндрических микроструктур другой конфигурации.
ПРИЛОЖЕНИЕ
Конструкции чипов-фильтров: расстояние между центрами входного и выходного отверстия 12 мм, высота всех чипов 25 мкм, на вырезах — топология микроструктур
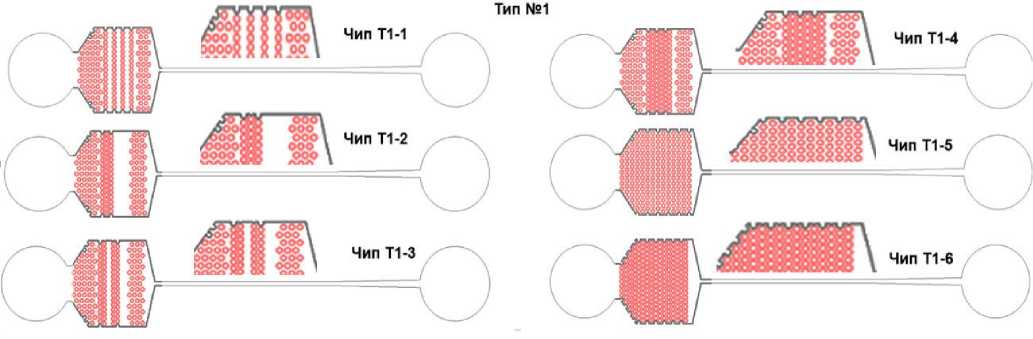
Рис. П1. Конструкции чипов-фильтров типа № 1.
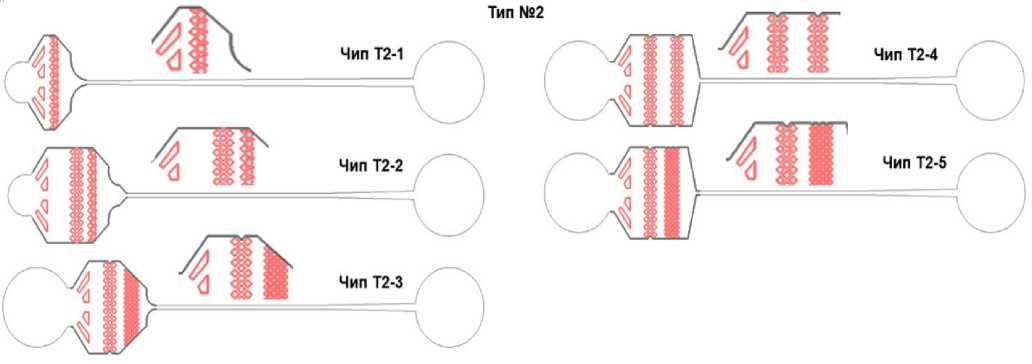
Рис. П2. Конструкции чипов-фильтров типа № 2.
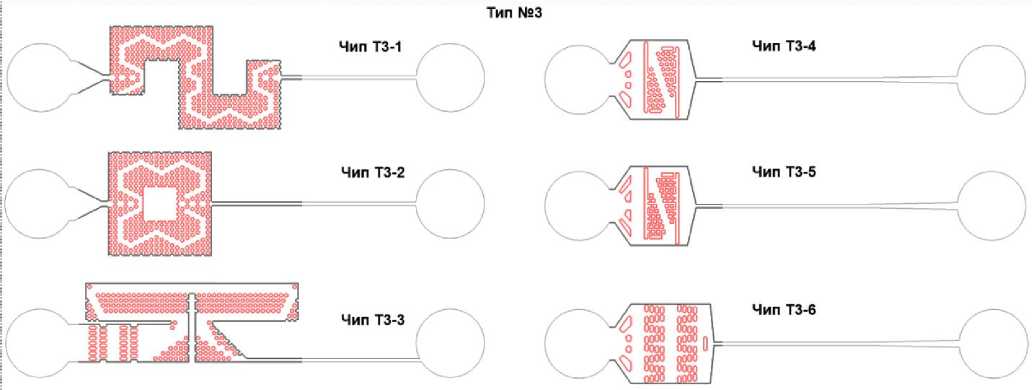
Рис. П3. Конструкции чипов-фильтров типа № 3.
Работа выполнена при поддержке Российского научного фонда (проект № 23-79-01212).
А.С. Букатин благодарит Российский научный фонд (проект №20-74-10117) за изготовление мастер-формы .
Список литературы ЗАЩИТНЫЕ ФИЛЬТРЫ ОТ ПЫЛЕОБРАЗНЫХ ЗАГРЯЗНЕНИЙ В ЖИДКОСТЯХ ДЛЯ ЗАДАЧ КАПЕЛЬНОЙ МИКРОФЛЮИДИКИ
- 1. Sackmann E.K., Fulton A.L., Beebe D.J. The present and future role of microfluidics in biomedical research // Nature. 2014. Vol. 507, no. 7491. P. 181–189. DOI: 10.1038/nature13118
- 2. Zhong Q. et al. Advances of Microfluidics in Biomedical Engineering // Adv. Materials Technologies. 2019. Vol. 4, no. 6. Id. 1800663. DOI: 10.1002/admt.201800663
- 3. Karle M. et al. Microfluidic solutions enabling continuous processing and monitoring of biological samples: A review // Analytica Chimica Acta. 2016. Vol. 929. P. 1–22. DOI: 10.1016/j.aca.2016.04.055
- 4. Chung B.G. et al. Microfluidic fabrication of microengineered hydrogels and their application in tissue engineering // Lab Chip. 2012. Vol. 12, no. 1. P. 45–59. DOI: 10.1039/c1lc20859d
- 5. Mao K. et al. Paper-based microfluidics for rapid diagnostics and drug delivery // Journal of Controlled Release. 2020. Vol. 322. P. 187–199. DOI: 10.1016/j.jconrel.2020.03.010
- 6. Verma N. et al. An introduction to microfluidics and their applications // Progress in Molecular Biology and Translational Science. Elsevier, 2022. Vol. 186. P. 1–14. DOI: 10.1016/bs.pmbts.2021.07.006
- 7. Filatov N.A., Evstrapov A.A., Bukatin A.S. Negative Pressure Provides Simple and Stable Droplet Generation in a Flow-Focusing Microfluidic Device // Micromachines. 2021. Vol. 12, no. 6. Id. 662. DOI: 10.3390/mi12060662
- 8. Feng H. et al. Droplet‐based microfluidics systems in biomedical applications // Electrophoresis. 2019. Vol. 40, no. 11. P. 1580–1590. DOI: 10.1002/elps.201900047
- 9. Mazutis L. et al. Single-cell analysis and sorting using droplet-based microfluidics // Nat. Protoc. 2013. Vol. 8, no. 5. P. 870–891. DOI: 10.1038/nprot.2013.046
- 10. Terekhov S.S. et al. Microfluidic droplet platform for ultrahigh-throughput single-cell screening of biodiversity // Proc. Natl. Acad. Sci. USA. 2017. Vol. 114, no. 10. P. 2550–2555. DOI: 10.1073/pnas.1621226114
- 11. Taylor S.C., Laperriere G., Germain H. Droplet Digital PCR versus qPCR for gene expression analysis with low abundant targets: from variable nonsense to publication quality data // Sci. Rep. 2017. Vol. 7, no. 1. Id. 2409. DOI: 10.1038/s41598-017-02217-x
- 12. Zilionis R. et al. Single-cell barcoding and sequencing using droplet microfluidics // Nat. Protoc. 2017. Vol. 12, no. 1. P. 44–73. DOI: 10.1038/nprot.2016.154
- 13. Angelidis I. et al. An atlas of the aging lung mapped by single cell transcriptomics and deep tissue proteomics // Nat. Commun. 2019. Vol. 10. P. 1–17. Id. 963. DOI: 10.1038/s41467-019-08831-9
- 14. Kim J.H. et al. Droplet Microfluidics for Producing Functional Microparticles // Langmuir. 2014. Vol. 30, no. 6. P. 1473–1488. DOI: 10.1021/la403220p
- 15. Zhu Z., Yang C.J. Hydrogel Droplet Microfluidics for High-Throughput Single Molecule/Cell Analysis // Acc. Chem. Res. 2017. Vol. 50, no. 1. P. 22–31. DOI: 10.1021/acs.accounts.6b00370
- 16. Choi A. et al. Recent advances in engineering microparticles and their nascent utilization in biomedical delivery and diagnostic applications // Lab Chip. 2017. Vol. 17, no. 4. P. 591–613. DOI: 10.1039/C6LC01023G
- 17. Liu S.-S. et al. Tunable Janus colloidal photonic crystal supraballs with dual photonic band gaps // J. Mater. Chem. C. 2014. Vol. 2, no. 44. P. 9431–9438. DOI: 10.1039/C4TC01631A
- 18. Nozdriukhin D.V. et al. Formation of Polyacrylamide and PEGDA Hydrogel Particles in a Microfluidic Flow Focusing Droplet Generator // Tech. Phys. 2018. Vol. 63, no. 9. P. 1328–1333. DOI: 10.1134/S1063784218090141
- 19. Bruggeman C.W., Haasnoot G.H., Peterman E.J.G. Microfluidics and fluorescence microscopy protocol to study the response of C.elegans to chemosensory stimuli // STAR Protocols. 2023. Vol. 4, no. 1. Id. 102121. DOI: 10.1016/j.xpro.2023.102121
- 20. Rosendahl P. et al. Real-time fluorescence and deformability cytometry // Nat. Methods. 2018. Vol. 15, no. 5. P. 355–358. DOI: 10.1038/nmeth.4639
- 21. Herbig M. et al. Label-free imaging flow cytometry for analysis and sorting of enzymatically dissociated tissues // Sci. Rep. 2022. Vol. 12, № 1. Id. 963. DOI: 10.1038/s41598-022-05007-2
- 22. Golberg A. et al. Cloud-Enabled Microscopy and Droplet Microfluidic Platform for Specific Detection of Escherichia coli in Water // PLoS One. 2014. Vol. 9, no. 1. Id. e86341. DOI: 10.1371/journal.pone.0086341
- 23. Conchouso D. et al. Integration of Droplet Microfluidic Tools for Single-Cell Functional Metagenomics: An Engineering Head Start // Genomics, Proteomics & Bioinformatics. 2021. Vol. 19, no. 3. P. 504–518. DOI: 10.1016/j.gpb.2021.03.010
- 24. Sciambi A., Abate A.R. Accurate microfluidic sorting of droplets at 30 kHz // Lab Chip. 2015. Vol. 15, no. 1. P. 47–51. DOI: 10.1039/C4LC01194E
- 25. Kim C.M. et al. Repeated geometrical T-junction breakup microfluidic filter device by injection of premixed emulsion for microdroplet production // Journal of Industrial and Engineering Chemistry. 2020. Vol. 81. P. 81–87. DOI: 10.1016/j.jiec.2019.08.055
- 26. Chen X., Ren C.L. A microfluidic chip integrated with droplet generation, pairing, trapping, merging, mixing and releasing // RSC Adv. 2017. Vol. 7, no. 27. P. 16738–16750. DOI: 10.1039/C7RA02336G
- 27. Shen F. et al. Study of flow behaviors of droplet merging and splitting in microchannels using Micro-PIV measurement // Microfluid Nanofluid. 2017. Vol. 21, no. 4. Id. 66. DOI: 10.1007/s10404-017-1902-y
- 28. Qin D., Xia Y., Whitesides G.M. Soft lithography for micro- and nanoscale patterning // Nat. Protoc. 2010. Vol. 5, no. 3. P. 491–502. DOI: 10.1038/nprot.2009.234
- 29. Bukatin A.S. et al. Fabrication of high-aspect-ratio microstructures in polymer microfluid chips for in vitro singlecell analysis // Tech. Phys. 2016. Vol. 61, no. 10. P. 1566–1571. DOI: 10.1134/S106378421610008X
- 30. Haubert K., Drier T., Beebe D. PDMS bonding by means of a portable, low-cost corona system // Lab Chip. 2006. Vol. 6, no. 12. P. 1548–1549. DOI: 10.1039/B610567J
- 31. Filatov N.A. et al. Open-Source Pressure Controller Based on Compact Electro-Pneumatic Regulators for Droplet Microfluidics Applications // IEEE Trans. Instrum. Meas. 2022. Vol. 71. Id. 4003910. DOI: 10.1109/TIM.2022.3158383


