Защитные свойства гликозаминогликанов к повреждающему действию уксусной кислоты при экспериментальном цистите
Автор: Жданов С.И., Соболев В.Е.
Журнал: Вестник аграрной науки @vestnikogau
Статья в выпуске: 6 (33), 2011 года.
Бесплатный доступ
В условиях экспериментального цистита у крыс изучен защитный эффект внутреннего применения комплексного препарата гликозаминогликанов в дозе 12 мг к повреждающему действию уксусной кислоты. Прием препарата гликозаминогликанов в течение 14 дней приводит к увеличению содержания мукополисахаридов в слизистой оболочке мочевого пузыря. У животных, получавших препарат гликозаминогликанов, действие повреждающего фактора на слизистую оболочку мочевого пузыря выражено в значительно меньшей степени по сравнению с контролем.
Гликозаминогликаны, цистит, крысы
Короткий адрес: https://sciup.org/147123807
IDR: 147123807 | УДК: 619:616.62-002-021.6:599.323.45
Текст научной статьи Защитные свойства гликозаминогликанов к повреждающему действию уксусной кислоты при экспериментальном цистите
Сравнительно недавно на поверхности слизистой оболочки мочевого пузыря у человека, крупного рогатого скота и некоторых видов животных обнаружен тонкий слой мукополисахаридов (гликозаминогликанов) [3,4,5,8,9]. В ряде исследований [6,7,11] установлено, что слой гликозаминогликанов обеспечивает защиту слизистой оболочки мочевого пузыря от агрессивных компонентов мочи и тем самым предупреждает развитие в нем воспалительного процесса. Выявлен положительный терапевтический эффект применения различных лекарственных форм на основе гликозаминогликанов при лечении циститов человека и некоторых видов животных [10,12]. В этой связи изучение влияния гликозаминогликанов на морфологию мочевого пузыря в условиях экспериментального цистита является актуальным звеном изучения патогенеза воспалительного процесса в мочевом пузыре.
Методика исследования
В настоящем исследовании изучалось влияние перорального приема комплексного препарата гликозаминогликанов на морфологию мочевого пузыря в условиях экспериментального цистита. Моделирование цистита производилось у белых лабораторных крыс. Опытные и контрольные группы формировались с соблюдением принципа параналогов. Были сформированы 3 группы животных по 3 особи в каждой группе.
В течение 14 дней до начала эксперимента крысы 1 и 2 групп с питьевой водой получали 12 мг комплексного препарата, содержащего 4 мг сульфата хондроитина и 8 мг глюкозамина гидрохлорида. Ж ивотные 3 группы препарат не получали. В дальнейшем у крыс 1 и 2 групп воспалительный процесс мочевого пузыря вызывали инъекцией через брюшную стенку в полость мочевого пузыря 0,5 мл 9% водного раствора уксусной кислоты. Раствор вводили дважды с интервалом 7 дней. С целью лучшего выявления мочевого пузыря за 15 минут до введения раствора кислоты животным 1 и 2 групп внутримышечно инъецировали 1 мг фуросемида. 92
Cystitis in domestic animals often treated with exogenous glycosaminoglycans such as heparin, chondroitine sulphate, or the N-acethyl glycosamine (Furinaid®, TRM). The mechanism of action is presumed to be due to a coating of the bladder surface to replace the normally present chondroitine sulphate and glycosamine lost as a result of the disease. The study used to experimental damage of the bladder in rats, with an injection 9%vinegar acid. As a result was revealed a protective effect of glycosaminoglicans for chemical cystitis. Identification glycosaminoglicans in bladder mucous was observed with using methods of hystochemical analysis.
Ж ивотным 3 группы в мочевой пузырь вводили стерильный 0,9% раствор натрия хлорида в дозе 0,5 мл.
Спустя 8 часов с момента начала эксперимента и далее ежедневно проводили учет клинических симптомов у крыс всех четырех групп. Ж ивотные 1 и 2 групп продолжали получать препарат с комплексом гликозаминогликанов в указанной дозе 12 мг до завершения исследований. Через 10 дней после повторного введения раствора в мочевой пузырь крысам 3 группы в мочевой пузырь введен раствор кислоты в дозе аналогичной для крыс 1 и 2 групп . Спустя 48 часов проведена эвтаназия крыс всех групп. Проведено вскрытие брюшной полости и отбор мочевых пузырей с фиксацией их тканей в 10% нейтральном формалине для гистологического исследования. Гистологические срезы стенки мочевых пузырей крыс толщиной 5 - 7 мкм готовились на санном микротоме, окрашивали гематоксилин-эозином. Для выявления «кислых» мукополисахаридов гистологические срезы окрашивали по Хейлу, «нейтральные»
мукополисахариды определяли в Ш ИК – реакции.
Морфометрический анализ структур мочевого пузыря на срезах проводили с использованием окуляр-микрометра МОВ 1-16. Объем ядер и цитоплазмы клеток эпителия мочевого пузыря вычислялся по формуле, предложенной В.В. Малашко
п
[2]: V= ~~ X ав 2; где v — Объем; А — Большой 6
диаметр клетки; В – малый диаметр клетки» р =3,14. Вычисление ядерно-цитоплазматического отношения (ЯЦО) клеток в относительных цифрах проводилось
Vz-Vk по формуле: ЯЦО= [2]; где Vz – объем
Vz цитоплазмы; Vk – объем ядра клетки. Удельную площадь клеток переходного эпителия мочевого пузыря определяли методом линейного интегрирования по A. Rosival [1]. Статистическая обработка цифрового материала выполнена в компьютерной программe Biostat 2007.
Результаты исследований
При вскрытии брюшной полости у одной крысы в 1 группе выявлены признаки слипчивого воспалительного процесса и как следствие образование спайки серозной оболочки мочевого пузыря с кишечником. Вероятно, это явилось следствием попадания в брюшную полость некоторого количества раствора кислоты при цистоцентезе.
При изучении обзорных гистологических срезов стенки мочевого пузыря у крыс всех групп выявлены признаки воспалительного процесса, характерные для цистита. В частности, это проявляется интенсивной лейкоцитарной инфильтрацией в подслизистой основе мочевых пузырей крыс всех групп. Слизистая оболочка переходного эпителия мочевого пузыря у крыс 1 и 2 групп представлена 3-6 слоями клеток, на поверхности эпителиальных клеток присутствует тонкий слой слизи. Слизистая оболочка мочевого пузыря крыс 3 группы разрушена, присутствует только базальный слой клеток, поверхностный слой слизи отсутствует. Клетки переходного эпителия мочевого пузыря крыс 1 группы содержат большие округлой формы ядра, отчетливо просматриваются ядрышки, кариоплазма с участками просветления.
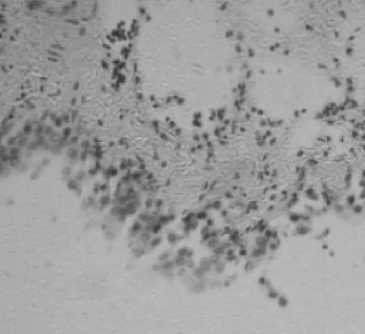
Рисунок 1 – Ок .10; Об .10. Окраска по Хейлу
Группа № 1 Слизистая мочевого пузыря
Эпителиоциты мочевого пузыря крыс 2 группы содержат гомогенное ядро без участков просветления кариоплазмы и видимых ядрышек, цитоплазма клеток интенсивно окрашивается красителями.
Гистохимическим окрашиванием срезов по Хейлу выявлено присутствие «кислых» мукополисахаридов (гликозаминогликанов) в слизистой оболочке мочевого пузыря крыс 1 и 2 групп. Наиболее яркая реакция отмечается в слизистой оболочке мочевого пузыря крыс 2 группы (рис.2). В срезах мочевого пузыря 3 группы при окрашивании методом Хейла качественной реакции на гликозаминогликаны не наблюдали. Ш ИК-реакция на нейтральные полисахариды слизистой оболочки мочевого пузыря крыс 1-3 групп была положительной. Наибольшая интенсивность окрашивания отмечена в срезах мочевого пузыря, полученных от животных 2 группы (рис. 4). Таким образом, по результатам гистохимического исследования мочевого пузыря на гликозаминогликаны имеются основания предполагать, что у крыс опытных групп наряду с гистологической картиной цистита, наблюдаются признаки активизации регенеративных процессов в мочевом пузыре, вязанные с накоплением гликозаминогликанов в слизистой оболочке.
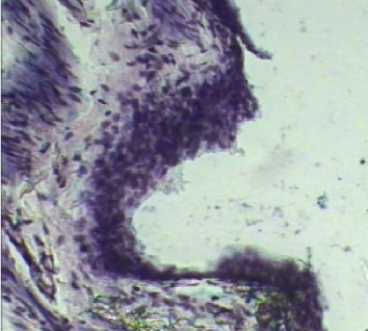
Рисунок 2 – Ок .10; Об .10. Окраска по Хейлу Группа № 2 Слизистая мочевого пузыря
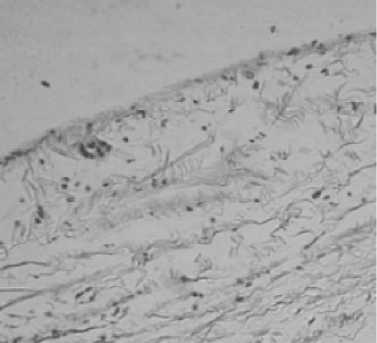
Рисунок 3 – Ок . 10; Об . 10. Окраска по Хейлу Группа № 3 Слизистая мочевого пузыря
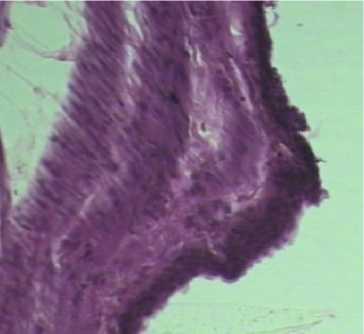
Рисунок 4 – Ок . 10; Об . 10. Ш ИК - реакция Группа № 2 Слизистая мочевого пузыря
Морфометрические измерения в срезах мочевого пузыря у животных опытных и контрольной группы выявили определенные различия по ряду показателей.
Таблица 1 – Морфометрический анализ мочевого пузыря
|
Показатели |
Группа 1 |
Группа 2 |
Группа 3 |
|
Толщина слизистой оболочки , мм : |
0,022±0,003 |
0,032±0,007** |
0,023±0,006 |
|
Толщина подслизистой основы , мм : |
0,019±0,004 |
0,018±0,003 |
0,026±0,005** |
|
Толщина мышечной оболочки , мм : |
0,363±0,044* |
0,406±0,045 |
0,410±0,022 |
|
Объем ядер эпителиоцитов , мкм 3: |
252,579±48,840*** |
146,474±81,508*** |
48,274±30,975 |
|
Объем цитоплазмы эпителиоцитов , мкм 3: |
893,872±458,479*** |
389,835±208,962** |
234,722±193,357 |
|
ЯЦО 1 клеток эпителия |
0,673±0,134*** |
0,599±0,168*** |
0,292±0,092 |
|
Удельная площадь эпителиоцитов , мм 2/ мм 2 |
6,755±2,146 |
6,997±2,135 |
- |
ЯЦО 1 - Ядерно - цитоплазматическое отношение ; - р <0,001; - р <0,01; - р <0,05
Данные таблицы 1 демонстрируют статистически достоверные отличия морфометрии мочевого пузыря у животных контрольной и опытных групп с высоким уровнем значимости. У крыс, получавших препарат гликозаминогликанов, значительно увеличены объем ядер и цитоплазмы эпителиоцитов, а также ЯЦО клеток эпителия мочевого пузыря в сравнении с животными контрольной группы .
Выводы
У животных, получавших препарат гликозаминогликанов, методами гистохимического исследования выявлено присутствие «кислых» мукополисахаридов в слизистой оболочке мочевого пузыря. Повреждение слизистой оболочки мочевого пузыря у крыс, получавших препарат, менее выражены, чем в контрольной группе, что подтверждается изучением обзорных гистологических срезов и данными количественной морфометрии мочевого пузыря . Таким образом , в условиях проведенного эксперимента прием комплексного препарата гликозаминогликанов в дозе 12 мг защищает слизистую оболочку мочевого пузыря крыс от повреждающего действия раствора уксусной кислоты.
Теоретический и научно - практический журнал . Основан в 2005 году
Учредитель и издатель : Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования « Орловский государственный аграрный Университет »
Адрес редакции : 302019, г . Орел , ул . Генерала Родина , 69. Тел .: +7 (4862) 45-40-37 Факс : +7 (4862) 45-40-64
Свидетельство о регистрации ПИ №ФС 77–21514 от 11.07.2005 г .
Сдано в набор 2.12.2011 г . Подписано в печать 13.12.2011 г . Формат 60 х 84/8. Бумага офсетная .
Гарнитура Таймс .
Объём 13,8 усл . печ . л .
Тираж 300 экз . Издательство Орел ГАУ , 302028, г . Орел , бульвар Победы , 19. Лицензия ЛР № 021325 от 23.02.1999 г .
Ж урнал рекомендован ВАК Минобрнауки России для публикаций научных работ , отражающих основное научное содержание кандидатских и докторских диссертаций
Содерж ание номера
Список литературы Защитные свойства гликозаминогликанов к повреждающему действию уксусной кислоты при экспериментальном цистите
- Гуцол, А.А., Кондратьев Б.Ю. Практическая морфометрия органов и тканей: Для врачей патологоанатомов/А.А. Гуцол, Б.Ю. Кондратьев -Томск: Изд-во Том. ун-та, 1988. -136 с
- Малашко, В.В. Гистологические и морфометрические методы исследования/В.В. Малашко -Белорус. С.-х. акад. -Горки, 1993. -24 с
- Grist, M. Identification of a mucin layer in the urinary bladder/M. Grist, J. Chakraborty -Urology, 1994, 44. -P. 26-33
- Hurst, R.E. Functional and structural characteristics of the glycosaminoglycans of the bladder luminal surface/R.E. Hurst, SW. Rhodes, P.B. Adamson, C.L. Parsons, J.B. Roy -J. Urol. 1987, 138. -P. 433-437
- Hurst, R.E. Identification of proteoglycans present at high density on bovine and human bladder luminal surface/R.E. Hurst, R. Zebrowski -J. Urol. 1994, 152. -P. 1641-1645
- Hurst, R.E., Roy J.B, Parsons C.L: The role of glycosaminoglycans in normal bladder physiology and the pathophysiology of interstitial cystitis. In Interstitial Cystitis Edited by: Sant GR. Philadelphia, Lippincott-Raven; 1997, P.93-100
- Kyker K.D, Coffman J., Hurst R.E. Exogenous glycosaminoglycans coat damaged bladder surfaces in experimentally damaged mouse bladder. BMC Urology 2005, 5:4 doi: 10. 1186/1471-2490-5-4
- Merete Holm-Bentzen, Ammitzboll T, Hald T. Glycosaminoglycans on the surface of the human urothelium: A preliminary report Neurourology and Urodynamics.1986, 5:6. -P. 519 -523
- Nickel J.C, Cornish J: Ultrastructural study of an antibody-stabilized bladder surface: a new perspective on the elusive glycosaminoglycan layer. World J. Urol. 1994, 12. -P. 11-14
- Parsons C.L, Housley T, Schmidt J.D, Lebow D: Treatment of interstitial cystitis with intravesical heparin. Br. J. Urol. 1994, 73. -P. 504-507
- Parsons C.L, Stauffer C, and Schmidt J.D. Bladder-surface glycosaminoglycans: an efficient mechanism of environmental adaptation. Science, Vol 208, Issue 4444. -P. 605-607
- Steinhoff G, Ittah B, Rowan S: The efficacy of chondroitin sulfate 0.2% in treating interstitial cystitis. Can. J. Urol. 2002, 9. -P. 1454-1458


