Защитный материал на основе тебуконазола семян «бункер» вызывает синтез дегидринов во время холодного отверждения и повышает морозостойкость посевов пшеницы
Автор: Корсукова А.В., Боровик О.А., Грабельныч О.И., Войников В.К.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 4 т.11, 2015 года.
Бесплатный доступ
Производные триазола широко используются в сельском хозяйстве для защиты семян зерновых от инфекции семян и почвы. Производные триазола могут влиять на биохимические и физиологические функции растений. Защитный материал на основе тебуконазола семян «Бункер» (содержание тебуконазола 60 г на литр, г / л) является системным фунгицидом профилактического и терапевтического действия. Изучено влияние обработки семян препаратом «Бункер» на рост побегов и жизнеспособность клеток, синтез дегидринов в побегах и морозостойкость этиолированных посевов зимней и яровой пшеницы. Было показано, что обработка семян озимой и яровой пшеницы препаратом «Бункер» вызывает подобное зависящее от концентрации ингибирование длины колеоптилей. При рекомендуемой дозе (0,5 литра на тонну семян, л / т) ингибирование роста составляло 28-30% при концентрации 1 л / т - 33-36% при концентрации 1,5 л / т - 40-42% при концентрации 3 л / т - 43 - 47% при концентрации 4 л / т - 48 - 51% и при 5 л / т - 53 - 56%. Обработка семян пшеницы препаратом «Бункер» не имела фитотоксического воздействия на клетки колеоптила в любой из исследуемых концентраций, напротив, при увеличении концентрации препарата наблюдалось увеличение жизнеспособности клеток, измеряемое восстановлением 2,3,5 -трифенилтетразолия. Мы можем предположить, что обладающие запатентованными свойствами, тебуконазол не только тормозит рост растений, но и замедляет их старение. Обработка семенного защитного вещества при концентрации 1,5 л / т индуцировала синтез дегидринов с молекулярными массами около 19, 21, 22, 25 и 27 кД в побегах озимой пшеницы и 18,6, 27 и 28,5 кД в яровой пшенице побеги во время холодной закалки. Среди идентифицированных дегидринов дегидрин 27 кДа наиболее значительно индуцируется как в зимней, так и в яровой пшенице. Обработка семенного защитного средства «Бункер» в той же концентрации повышала морозостойкость саженцев зимней и яровой пшеницы. Предполагается, что повышение холодостойкости и морозостойкости зимней и яровой пшеницы, вызванное обработкой семян защитного средства на основе тебуконазола, может быть связано с увеличением содержания абсцизной кислоты - одного из триггеров низкотемпературной адаптации растений. Сделан вывод о том, что защитный материал на основе тебуконазола семян «Бункер» повышает устойчивость пшеницы до низкой температуры, влияя на процессы роста и синтез стрессовых белков.
Короткий адрес: https://sciup.org/14323972
IDR: 14323972
Текст научной статьи Защитный материал на основе тебуконазола семян «бункер» вызывает синтез дегидринов во время холодного отверждения и повышает морозостойкость посевов пшеницы
Одной из важнейших сельскохозяйственных задач было и остается решение проблемы холодо-, морозо- и зимостойкости возделываемых культур. В настоящее время в сельском хозяйстве активно используются системные фунгициды – ингибиторы C14-деметилирования, среди которых ведущие позиции занимают азолы, содержащие в своей молекуле триазольную или имидазольную группы. Наибольшее применение получили производные триазола – ингибиторы синтеза стеринов и терпеноидов (Popov et al. , 2003). Производные триазола – ретарданты, которые не только подавляют биосинтез гиббереллина, но и увеличивают содержание эндогенной абсцизовой кислоты (АБК), оказывая, таким образом, ингибирующее влияние на прорастание семян и рост осевых органов растений, имеют ростостимулирующее действие на корневую систему (Prusakova and Chizhova, 1998). Триазолы характеризуются низкой фитотоксичностью по сравнению с другими ретардантами, эффективны в малых дозах и экологически безопасны (Prusakova and Chizhova, 1998).
Увеличение содержания эндогенной АБК рассматривается как один из триггеров низкотемпературной адаптации растений (Titov et al. , 2006). АБК индуцирует синтез стрессовых белков при действии низких температур (Chinnusamy et al. , 2006; Theocharis et al. , 2012). АБК-зависимая экспрессия генов регулируется транскрипционными факторами, которые принадлежат к семействам bZIP, MYC и MYB
(Theocharis et al. , 2012). Одной из основных групп белков при низкотемпературном стрессе является группа COR/LEA - белков (Monroy et al. , 2007; Hara, 2010; Hanin et al. , 2011). Эта группа включает LEA-II белки, к которым относятся дегидрины, содержание которых возрастает при обезвоживании. Благодаря своей гидрофильности и шапероноподобной активности дегидрины предотвращают деградацию и коагуляцию ряда макромолекул клеточных структур при обезвоживании их внеклеточным льдом (Skriver and Mundy, 1990; Goyal et al. , 2005). Кроме этого, дегидрины проявляют криопротекторную, антифризную и антиоксидантную активности (Rorat, 2006; Hara, 2010; Hanin et al. , 2011). Показано, что содержание дегидринов увеличивается при закаливании растений в осенний период и снижается во время деакклимации весной (Bubjakina et al. , 2011; Petrov et al. , 2011; Ponomarev et al., 2014).
Одним из представителей соединений триазолиевого ряда является тебуконазол (1-(4-хлорфенил)-4,4-диметил-3-(1H-1,2,4-триазол-1-илметил)-3-пентанол). Тебуконазол обладает профилактическим и лечебным системным действием, эффективен против всех видов ржавчины зерновых культур, подавляет головнёвые грибы, возбудителей корневых гнилей и плесневения семян (Popov et al., 2003). Учитывая, что производные триазола обладают ретардантным действием и повышают содержание эндогенной АБК, можно предположить, что эти вещества будут влиять на синтез стрессовых белков и холодо- и морозоустойчивость растений.
Тебуконазол-содержащий препарат «Бункер» (содержание тебуконазола составляет 60 г/л) является системным фунгицидом профилактического и лечебного действия для протравливания семян зерновых культур против семенной и почвенной инфекции (производитель ЗАО Фирма «Август»). В настоящей работе изучалось влияние обработки семян препаратом «Бункер» на синтез дегидринов при холодовом закаливании и морозоустойчивость проростков озимой и яровой пшеницы.
MATERIALS AND METHODS
В работе использовали этиолированные проростки мягкой яровой (сорт «Новосибирская 29») и озимой (сорт «Иркутская») пшеницы ( Triticum aestivum L.). Обработку семян протравителем проводили непосредственно перед их размещением на подложки кювет. Для обработки использовали водный раствор препарата «Бункер» разной концентрации (0,5, 1, 1,5, 3, 4 и 5 литров на тонну семян, л/т). В лабораторных экспериментах проводили пересчёт на вес семян в граммах (мкл/г).
Для определения степени ингибирования роста и жизнеспособности клеток колеоптилей семена проращивали в течение 5-ти суток на влажной фильтровальной бумаге при 24 °С в темноте. Степень ингибирования роста побегов этиолированных проростков злаков (I, %) определяли согласно (Ivanov, 1974), замеряя длину колеоптилей 5-ти суточных проростков, выращенных из необработанных (контроль) и обработанных препаратом «Бункер» семян.
Для определения жизнеспособности клеток колеоптилей использовали метод восстановления красителя 2,3,5-трифенилтетразолий хлорида (ТТХ) (Enikeev et al., 1995). Для этого колеоптили 5-ти суточных проростков злаков (0,1 г) инфильтровали раствором K-Na фосфатного буфера (pH 7,0), содержащего 0,5% ТТХ, и инкубировали в анаэробных условиях при 26 °C в течение 12 ч в темноте. Затем краситель удаляли 3х кратным промыванием дистиллированной водой. Продукт восстановления ТТХ – формазан экстрагировали 96%-м этиловым спиртом в течение 15 мин при 60 °C. Концентрацию формазана рассчитывали по оптической плотности раствора при 490 нм. Расчёт проводили в относительных единицах (отн. ед.) на 1 г сырого веса (восстановление ТТХ, A 490 /г сырого веса). Контролем служили колеоптили 5-ти суточных этиолированных проростков, гибель которых вызывали кипячением в течение 15 мин.
Холодовому закаливанию подвергали 3-х суточные этиолированные проростки пшеницы, выращенные из необработанных и обработанных препаратом «Бункер» семян. Закаливание проводили в темноте при температуре 2 °С в течение 7-ми суток в камере тепла/холода MKT-240 (ЦКП Фитотрон СИФИБР СО РАН). Закалённые проростки промораживали при температурах –2, – 4, –6, –8, –10 °С (снижение температуры происходило со скоростью 1 °С/ч один раз в сутки). После этого температуру повышали, моделируя условия раззакаливания: –8, –6, –4, 0, 4 °С (продолжительность обработки каждой температурой составляла 24 ч за исключением обработок температурами –8 и 4 °С, которые длились 12 ч). Для изучения изменений в синтезе дегидринов отбирали побеги до закаливания (контроль в возрасте 3-х суток), закаленные в течение 7-ми суток при 2 °С и подвергнутые раззакаливанию 4 °С в течение 12 ч.
Для оценки морозоустойчивости проростков закалённые этилированные проростки из необработанных и обработанных препаратом «Бункер» семян промораживали при температуре -7 °С в течение 24 ч. Затем проростки оттаивали при 2 °С в течение суток, после чего оставляли растения отрастать в темноте при 24 °С в течение 3-х – 7-ми суток. Количество выживших после промораживания проростков выражали в процентах от общего числа проростков.
Выделение общего белка из побегов проростков озимой и яровой пшеницы проводили по ранее описанной методике (Pobezhimova et al., 2004). Содержание дегидринов в побегах изучали с помощью электрофореза в 12,5% полиакриламидном геле с додецилсульфатом натрия и вестерн-блоттинга (Pobezhimova et al., 2004) с поликлональными антителами против дегидринов (антитела против синтетического пептида, содержащего последовательность KIKEKLPG, являющуюся частью уникального К-сегмента дегидринов) (ADI-PLA-100, “StressGen”, США). Использовали вторичные антитела, конъюгированные с щелочной фосфатазой, а детекцию белков проводили с 5-бромо-4-хлоро-3-индолил фосфатом и нитротетразолием синим.
Проводили не менее трёх независимых экспериментов. На рисунках 1, 2 и 4 представлены средние арифметические значения и их стандартные отклонения. На рисунке 3 представлены типичные иммуноблоты. « n » (в подписях к рисункам) означает количество независимых экспериментов.
RESULTS AND DISCUSSION
Ретардантный эффект тебуконазол-содержащего протравителя семян «Бункер» и отсутствие его фитотоксичного эффекта
Для подтверждения данных, имеющихся в литературе, относительно наличия у тебуконазола ретардантных свойств (Prusakova and Chizhova, 1998), было изучено влияние протравителя «Бункер» на длину колеоптилей этиолированных проростков яровой и озимой пшеницы. Одновременно с изучением ретардантных свойств препарата «Бункер» проводили подбор его рабочей концентрации для дальнейших исследований. В инструкции по применению данного препарата рекомендованная концентрация для достижения фунгицидного эффекта составляет 0,5 л/т, возможно, что для проявления ретардантных свойств концентрация препарата «Бункер» будет несколько отличаться от рекомендованной для применения в качестве фунгицида.
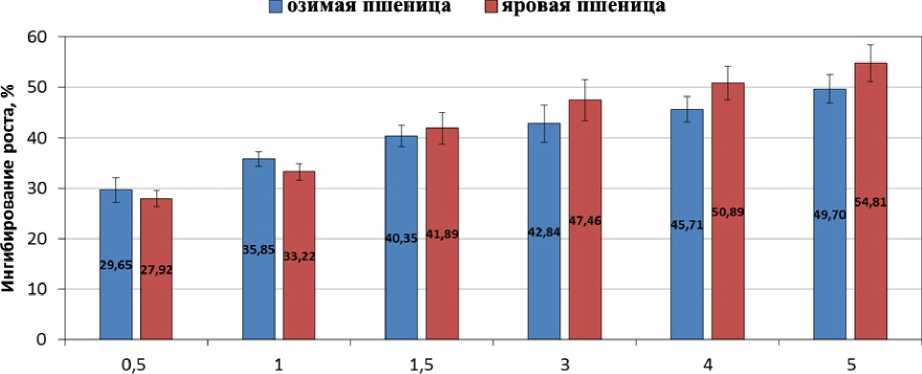
Действительно, обработка семян препаратом «Бункер» сопровождалась ингибированием длины колеоптилей яровой и озимой пшеницы, при этом степень ингибирования роста возрастала с увеличением концентрации препарата. Так, препарат «Бункер» приводил к ингибированию длины колеоптилей проростков яровой пшеницы и озимой пшеницы в концентрации 0,5 л/т на 28 и 30%, в концентрации 1 л/т – на 33 и 36%, в концентрации 1,5 л/т – на 42 и 40%, в концентрации 3 л/т – на 47 и 43%, в концентрации 4 л/т – на 51 и 48%, а в концентрации 5 л/т – на 56 и 53%, соответственно (рис. 1). Эти данные подтверждают, что тебуконазол-содержащий протравитель семян «Бункер» является ретардантом и оказывает концентрационнозависимое ингибирующее действие на рост побегов озимой и яровой пшеницы.
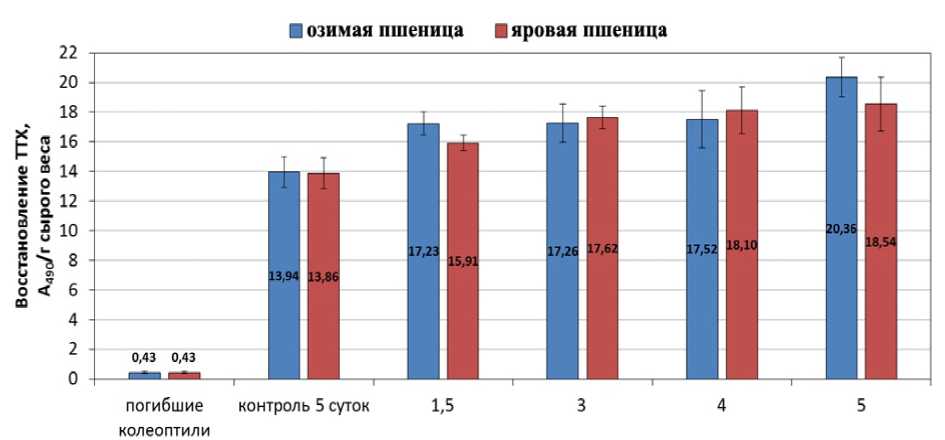
Чтобы определить безопасность использования протравителя семян «Бункер» для растений яровой и озимой пшеницы в концентрации выше рекомендованной производителем, далее была изучена жизнеспособность клеток колеоптилей изучаемых злаков. Величина восстановления ТТХ, которая наблюдалась в колеоптилях 5-ти суточных проростков злаков, подвергнутых кипячению, считалась значением, характеризующим «погибшие» растения. Как оказалось, обработка семян препаратом «Бункер» в концентрациях 1,5, 3, 4 и 5 л/т не приводит к гибели клеток колеоптилей озимой и яровой пшеницы (рис. 2). Наоборот, с повышением концентрации препарата наблюдается увеличение восстановления ТТХ в клетках, что свидетельствует о том, что жизнеспособность клеток колеоптилей выше, по сравнению с колеоптилями проростков из необработанных семян. Наблюдаемое нами отсутствие гибели клеток колеоптилей озимой и яровой пшеницы соответствует данным, имеющимся в литературе, характеризующим производные триазола как ретарданты, обладающие низкой фитотоксичностью (Mel’nikov et al., 1995; Prusakova and Chizhova, 1998). На основании результатов по увеличению степени восстановления ТТХ в клетках колеоптилей из проростков, выращенных из семян, обработанных препаратом «Бункер», можно предполагать, что обладая ретардантными свойствами, тебуконазол не только замедляет процессы роста, но и отодвигает сроки старения. В этом случае обработка семян злаков тебуконазол-содержащим препаратом «Бункер» привела к замедлению роста растений и торможению программы старения и по своим физиолого-биохимическим параметрам проростки из обработанных препаратом «Бункер» семян не соответствовали 5-ти суточным проросткам из необработанных семян. При этом, чем более выраженный ретардантный эффект оказывал препарат на проростки яровой и озимой пшеницы (рис. 1), тем выше была жизнеспособность клеток колеоптилей этих проростков (рис. 2). Ранее нами было показано, что гибель клеток колеоптилей этиолированных проростков злаков (кукурузы и озимой пшеницы) происходит на 5-6-ые сутки роста (Korsukova et al., 2013a, b). Возможно, поэтому жизнеспособность клеток колеоптилей 5-ти суточных проростков озимой и яровой пшеницы из необработанных семян была ниже жизнеспособности клеток колеоптилей злаков этого же биологического возраста, выросших из обработанных препаратом «Бункер» семян.
В дальнейшем в качестве рабочей концентрации протравителя «Бункер» была выбрана концентрация 1,5 л/т.
Индукция синтеза дегидринов и повышение морозоустойчивости пшеницы после обработки семян препаратом «Бункер»
Синтез стрессовых белков является одним из механизмов низкотемпературной адаптации растений (Chinnusamy et al., 2006; Trunova, 2007 Hanin et al., 2011). Закаливание индуцировало синтез дегидринов в побегах этиолированных проростков озимой и яровой пшеницы (рис. 3). В проростках озимой пшеницы после закаливания обнаруживались дегидрины с относительными молекулярными массами 209, 200, 70, 55, 51, 43, 34, 33, 17, 16 и 15,7 кДа. В побегах проростков озимой пшеницы, выросших из семян, обработанных протравителем «Бункер», при закаливании наблюдали появление новых полипептидов с относительными молекулярными массами 27, 25, 22, 21, 19 и 18,6 кДа (рис. 3). Наиболее значительно индуцировался полипептид с молекулярной массой 27 кДа. Моделируя условия раззакаливания обнаружено, что в побегах проростков озимой пшеницы, выращенных из обработанных препаратом «Бункер» семян, дегидрины с молекулярными массами 27, 25, 22, 21 и 19 кДа продолжали присутствовать и в период раззакаливания.
С помощью антител против дегидринов в побегах этиолированных проростков яровой пшеницы после закаливания обнаруживались полипептиды с относительными молекулярными массами 209, 200, 70, 56, 51, 43, 32, 12,3 и 11,5 кДа (рис. 3). Обработка семян протравителем «Бункер» приводила к появлению при закаливании в побегах яровой пшеницы трех новых полипептидов с относительными молекулярными массами 19, 27 и 28,5 кДа, при этом полипептид с молекулярной массой 27 кДа индуцировался значительнее других. После раззакаливания проростков полипептид с молекулярной массой 27 кДа продолжал детектироваться в побегах яровой пшеницы (рис. 3).
Торможение ростовых процессов и синтез дегидринов являются одними из механизмов, способствующих повышению устойчивости растений к низким неблагоприятным температурам (Trunova, 2007; Kosulina et al., 2011). Поскольку обработка семян как озимой, так и яровой пшеницы протравителем «Бункер» приводила к ингибированию роста побегов (рис. 1), а также индуцировала синтез ряда дегидринов (рис. 3), то возможно, что обработка препаратом «Бункер» будет влиять и на морозоустойчивость этих зерновых культур.
Чтобы выяснить данное предположение, проанализировали выживаемость холодозакалённых проростков озимой и яровой пшеницы, выращенных из необработанных и обработанных препаратом «Бункер» семян, после их промораживания при -7 °С в течение 24 ч. Оказалось, что выживаемость проростков из необработанных семян при данной температуре составляет 30% для яровой пшеницы и 70% для озимой пшеницы (рис. 4). В то же время выживаемость проростков, выращенных из семян, обработанных препаратом «Бункер» в концентрации 1,5 л/т, значительно выше и составляет 84,5% для яровой пшеницы и 95% для озимой пшеницы (рис. 4).
Концентрация препарата “Бункер”, л/т
Figure 1. Ингибирование длины колеоптилей, вызванное обработкой семян озимой и яровой пшеницы препаратом «Бункер». В качестве контроля использовали колеоптили 5-ти суточных проростков, выращенных из семян, необработанных препаратом «Бункер». n =4. M±S.D.
Концентрация препарата “Бункер”, л/т
Figure 2. Влияние обработки семян препаратом «Бункер» на жизнеспособность клеток колеоптилей озимой и яровой пшеницы
Обозначения : погибшие колеоптили – колеоптили 5-ти суточных проростков злаков, подвергнутых кипячению контроль 5 сут – колеоптили 5-ти суточных проростков злаков, выращенных из необработанных препаратом «Бункер» семян. n =3. M±S.D.
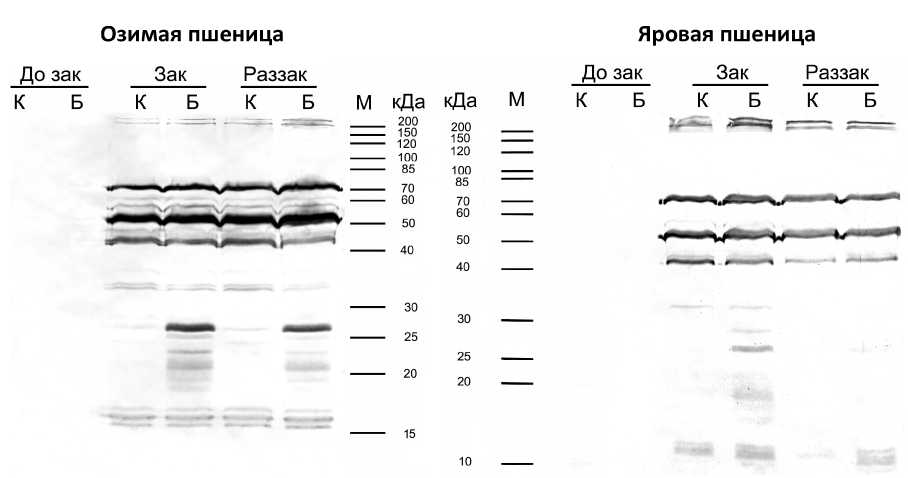
Figure 3. Влияние обработки семян препаратом
Бункер» на синтез дегидринов в побегах
проростков озимой и яровой пшеницы, подвергнутых закаливанию и раззакаливанию
Обозначения : М – белковые маркеры (кДа); К – проростки, выращенные из необработанных семян (контрольные проростки); Б – проростки, выращенные из семян, обработанных препаратом «Бункер» (1,5 л/т); До зак – проростки до закаливания (24 ºС, 3 суток); Зак – 3-х суточные проростки, подвергнутые закаливанию (2 °С, 7 суток); Раззак – закалённые проростки, подвергнутые ступенчатому промораживанию при –2, –4, –6, –8, –10 °С и раззакаливанию при –8, –6, –4, 0, 4 °С (продолжительность воздействия представлена в методике). n =3.
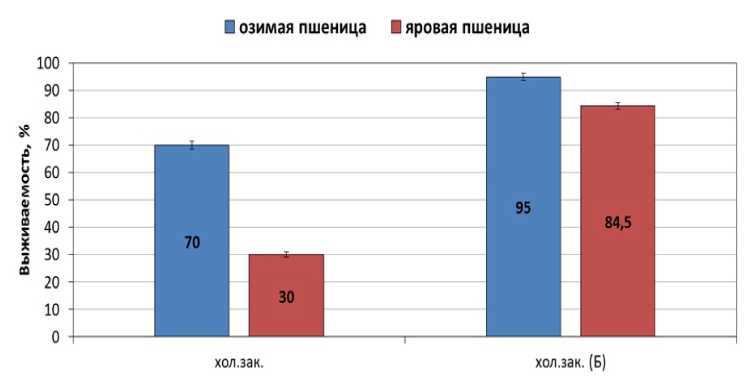
Figure 4. Влияние обработки семян препаратом «Бункер» на выживаемость проростков озимой и яровой пшеницы после действия отрицательной температуры -7 °С (24 ч)
Обозначения : хол.зак. – холодозакалённые проростки, выращенные из необработанных семян, хол.зак. (Б) – холодозакалённые проростки, выращенные из семян, обработанных препаратом «Бункер» (1,5 л/т). n=3. M±S.D.
Таким образом, обработка семян озимой и яровой пшеницы препаратом «Бункер» – фунгицидом триазольной природы, содержащим в качестве действующего вещества тебуконазол, приводит к ингибированию роста побегов, к синтезу в побегах специфических дегидринов и к повышению морозоустойчивости проростков. Можно полагать, что наблюдаемые в работе эффекты от обработки семян озимой и яровой пшеницы препаратом триазольной природы обусловлены влиянием производных триазола на содержание в клетках АБК (Prusakova and Chizhova, 1998). Вероятно, что действие производных триазола на растительные клетки носит комплексный характер и не ограничивается их влиянием только на изученные параметры, что требует дальнейшего изучения.
Исходя из полученных данных, можно заключить, что тебуконазол-содержащий препарат «Бункер» повышает устойчивость растений к низкой температуре, влияя на ростовые процессы и синтез стрессовых белков.
Список литературы Защитный материал на основе тебуконазола семян «бункер» вызывает синтез дегидринов во время холодного отверждения и повышает морозостойкость посевов пшеницы
- Bubjakina V.V., Tatarinova T.D., Ponomarev A.G., Perk A.A. and Solomonov N.G. (2011) Osobennosti sezonnoj dinamiki degidrinov Betula platyphylla Sukacz., associirovannye s formirovaniem morozoustojchivosti v uslovijah kriolitozony. Doklady Akademii nauk , 439, 844-877
- Chinnusamy V., Zhu J. and Zhu J.-K. (2006) Gene regulation during cold acclimation in plants. Physiol. Plant., 126, 52-61
- Enikeev A.G., Gamburg K.Z., Vysockaja E.F. and Leonova L.A. (1995) Ob ispol'zovanii 2,3,5-trifeniltetrazolij hlorida dlja ocenki zhiznesposobnosti kul'tur rastitel'nyh kletok. Fiziologija rastenij , 42, 423-426
- Goyal K., Walton L.J. and Tunnacliffe A. (2005) LEA proteins prevent protein aggregation due to water stress. Biochem. J., 388, 151-157
- Hanin M., Brini F., Ebel C., Toda Y., Takeda S. and Masmoudi K. (2011) Plant dehydrins and stress tolerance. Versatile proteins for complex mechanisms. Plant Signal. Behav., 6, 1503-1509
- Hara M. (2010) The multifunctionality of dehydrins. Plant Signal. Behav., 5, 1-6
- Ivanov V.B. (1974) Kletochnye osnovy rosta rasteniy. M.: Nauka , 223 s
- Korsukova A.V, Grabel'nyh O.I., Ljubushkina I.V., Pobezhimova T.P., Koroleva N.A., Pavlovskaja N.S., Fedoseeva I.V., Voinikov V.K. (2013a) Rol' aktivnyh form kisloroda i uchastie mitohondrij v razvitii programmiruemoj kletochnoj gibeli v koleoptiljah ozimoj pshenicy. Izvestija Irkutskogo gosudarstvennogo universiteta. Serija "Biologija. Ekologija" , 6, 10-18
- Korsukova A.V., Grabelnych O.I., Pobezhimova T.P., Koroleva N.A., Fedoseeva I.V., Pavlovskaya N.S., Lyubushkina I.V., Borovik O.A., Fedyaeva A.V., Voznenko S.A., Ilyushneva E.M., Voinikov V.K. (2013b) Cold hardening prevents H2O2-induced programmed cell death in maize coleoptiles. J. Stress Physiol. & Biochem., 9, 246-257
- Kosulina L.G., Lucenko Je.K. and Aksenova V.A. (2011) Fiziologija ustojchivosti rastenij k neblagoprijatnym faktoram sredy: Uchebnoe posobie. Rostov n/D: Izd-vo Rost. un-ta , 236 s
- Mel'nikov N.N., Novozhilov K.V. and Belan S.R. (1995) Pesticidy i reguljatory rosta rastenij: Spravochnik. M.: Himija , 575 s
- Monroy A.F., Dryanova A., Malette B., Oren D.H., Farajalla M.R., Liu W., Danyluk J., Ubayasena L.W.C., Kane K., Scoles G.J., Sarhan F. and Gulick P.J. (2007) Regulatory gene candidates and gene expression analysis of cold acclimation in winter and spring wheat. Plant Mol. Biol., 64, 409-423
- Petrov K.A., Sofronova V.E., Bubjakina V.V., Perk A.A., Tatarinova T.D., Ponomarev A.G., Chepalov V.A., Ohlopkova Zh.M., Vasil'eva I.V. and Maksimov T.H. (2011) Drevesnye rastenija Jakutii i nizkotemperaturnyj stress. Fiziologija rastenij , 58, 866-874
- Pobezhimova T.P., Kolesnichenko A.V. and Grabel'nych O.I. (2004) Metody izuchenija mitohondrij rastenij. Poljarografija i elektroforez. M.: OOO «NPK Promjekspobezopasnost'» , 98 s
- Ponomarev A.G., Tatarinova T.D., Perk A.A., Vasil'eva I.V. and Bubjakina V.V. (2014) Degidriny, associirovannye s formirovaniem morozoustojchivosti berezy ploskolistnoj. Fiziologija rastenij , 61, 144-120
- Popov S.Ja., Dorozhkina L.A. and Kalinin V.A. (2003) Osnovy himicheskoj zashhity rastenij: Uchebnoe posobie. Pod red. professora S.Ja. Popova. M.: Art-Lion , 208 s
- Prusakova L.D. and Chizhova S.I. (1998) Primenenie proizvodnyh triazola v rastenievodstve (obzor). Agrohimija , 37-44
- Skriver K. and Mundy J. (1990) Gene expression in response to abscisic acid and osmotic stress. Plant Cell, 2, 503-512
- Theocharis A., Clément C. and Barka E.A. (2012) Physiological and molecular changes in plants grown at low temperatures. Planta, 235, 1091-1105
- Titov A.F., Akimova T.V., Talanova V.V. and Topchieva L.V. (2006) Ustojchivost' rastenij v nachal'nyj period dejstvija neblagoprijatnyh temperatur. Otv. red. N.N. Nemova. M.: Nauka , 143 s
- Trunova T.I. (2007) Rastenie i nizkotemperaturnyj stress. M.: Nauka , 54 s


