Зависимость аккумуляции растениями никеля и кадмия от их концентрации
Автор: Елизарьева Е.Н., Янбаев Ю.А., Кулагин А.Ю., Усманов И.Ю.
Журнал: Вестник Нижневартовского государственного университета @vestnik-nvsu
Рубрика: Экология и природопользование
Статья в выпуске: 1, 2017 года.
Бесплатный доступ
Одной из наиболее острых экологических проблем последних десятилетий является возрастающее техногенное загрязнение окружающей среды тяжелыми металлами. Они представляют собой серьезную угрозу для живых организмов, прежде всего, из-за их высокой токсичности. Хотя многие тяжелые металлы и не являются необходимыми для нормальной жизнедеятельности растений химическими элементами, тем не менее могут ими активно поглощаться и долго сохранять токсические свойства, оказывая тем самым длительное негативное действие и последействие на организм. Целью данной работы является установление зависимости аккумуляции растениями никеля и кадмия от их концентрации. В ходе работы были проведены эксперименты по выращиванию разных сортов редиса Raphanus sativus L. и кукурузы Zea mays L. в условиях гидропоники в растворах, содержащих разные концентрации кадмия и никеля. Анализировали внешние проявления действия тяжелых металлов, а также изменение массы растений. Содержание тяжелых металлов в корнях и надземных частях растений измеряли с помощью метода пламенной атомно-абсорбционной спектрометрии...
Тяжелые металлы, токсичность, аккумуляция, биомасса, индекс толерантности, ризофильтрация, предельно-допустимая концентрация
Короткий адрес: https://sciup.org/14116969
IDR: 14116969 | УДК: 57.044
Текст научной статьи Зависимость аккумуляции растениями никеля и кадмия от их концентрации
Кадмий хорошо известен как элемент, токсичный для живых организмов уже при низких концентрациях (Azizian et al. 2011). Токсичность кадмия для растений проявляется в нарушении активности ферментов, торможении фотосинтеза, нарушении транспирации, а также ингибировании восстановления NOt до NO (Khadijeh et al. 2011). Кроме того, в метаболизме растений он является антагонистом ряда элементов питания (Zn, Си, Мп, Ni, Se, Са, Mg, Р) (Sharma, Dhiman 2013). При токсичном воздействии металла у растений наблюдаются задержка роста, повреждение корневой системы и хлороз листьев. Кадмий достаточно легко поступает из почвы и атмосферы в растения. По фитотоксичности и способности накапливаться в растениях в ряду тяжелых металлов он занимает первое место (Swain et al. 2014).
Биологическая роль никеля заключается в участии в структурной организации и функционировании основных клеточных компонентов - ДНК, РНК и белка. Наряду с этим он присутствует и в гормональной регуляции организма. По своим биохимическим свойствам никель весьма схож с железом и кобальтом. До настоящего времени в литературе не встреча- ются данные о дефиците никеля для растений, однако в ряде экспериментов установлено положительное влияние внесения никеля в почвы на урожайность сельскохозяйственных культур, которое, возможно, связано с тем, что он стимулирует микробиологические процессы нитрификации и минерализации соединений азота в почвах (Di Salvatore 2012). Токсичность никеля для растений проявляется в подавлении процессов фотосинтеза и транспирации, появлении признаков хлороза листьев (Syama et al. 2016).
Целью данной работы является установление зависимости аккумуляции растениями никеля и кадмия от их концентрации. В процессе исследования семена растений, названия которых приведены в таблице 1, проращивались в чашках Петри на песке в течение 4-7 дней.
Затем пророщенные семена перемещались на сетку, укрепленную на горловине сосуда объемом 1 л. Сосуд заполнялся раствором Хоагланда (Watson et al. 2003), в состав которого входят соли Ca(NO3)2e4H2O, KNO3, Fe-EDTA, MgSO4*7H2O, KH2PO4 Для данной серии экспериментов использовался раствор, разбавленный в 4 раза по сравнению с оригинальной рецептурой (1/4-strength modified).
Через 2 недели в раствор Хоагланда вводились добавки разных концентраций никеля и кадмия (см. табл. 2). Там же показано отношение концентрации металла в растворе к значению предельно допустимой концентрации (ПДК) для водоемов хозяйственно-питьевого (ПДКх.п.в.) и рыбохозяйственного (ПДКрх.) назначения.
Перечень семян, исполь
Таблица 1 данных в исследованиях
|
Растение |
Видовое название (Николаева, Паутова 2002) ' |
Сорта |
Условное обозначение |
|
Редис |
Raphanus sativus L. |
French breakfast |
FB |
|
Cherry belle |
CB |
||
|
Long white icicle |
LWI |
||
|
Mixed |
M |
||
|
Кукуруза |
Zea maysV. |
Fl Sweet nugget |
SN |
|
Fl Kelvedon glory |
KG |
Таблица 2
Характеристика растворов никеля и кадмия
|
c ^p-p’ цМ |
Никель |
Кадмий |
||||
|
с ^p-p’ мг/л |
с р-р пдкх.п.в. |
с р-р ПДКрх. |
с ^р-р’ мг/л |
с р-р пдкхп,. |
с р-р пдкрх |
|
|
1 |
0,06 |
0,6 |
6 |
0,11 |
110 |
22 |
|
2 |
0,12 |
1,2 |
12 |
0,23 |
230 |
46 |
|
5 |
0,29 |
3 |
29 |
0,56 |
560 |
112 |
|
10 |
0,59 |
6 |
59 |
1,12 |
1120 |
224 |
|
20 |
1,17 |
12 |
117 |
2,25 |
2250 |
450 |
Растения выращивались в теплице при температуре 25-27 °C, которая соответствует среднемноголетней температуре летнего сезона на территории Башкортостана (Afanasev et al. 2014). Через 3 недели растения удалялись из раствора. Корни отделялись от зеленой массы, промывались и сушились в сушильной печи в течение суток при температуре 70 °C, затем взвешивались. По результатам взвешивания рассчитывался индекс толерантности для побегов (ИТП), корней (ИТК) и всей биомассы исследуемых растений (ИТБ) (табл. 3, 4).
Таблица 3
Порядок расчета индекса толерантности растения к воздействию тяжелых металлов (Ismail 2013)
|
Формула |
Градация |
|
Индекс толерантности: ит = Мм^х1оо%, мк где ММе - вес сухой биомассы растения, выращенного с добавлением металлов, г; Мк - вес сухой биомассы контрольного растения, выращенного в растворе Хоагланда, г. Индекс толерантности рассчитывается для побегов (ИТП), корней (ИТК) и всей биомассы в целом (ИТБ). |
ИТ>100% - стимулирующее воздействие; ИТ = 100% - отсутствие влияния; ИТ<100% - угнетающее влияние анализируемых концентраций тяжелых металлов на рост растения; ИТ = 50% — минимальный желательный объем биомассы при произрастании на загрязненной среде. |
Затем высушенные растения измельчалась в настольной мельнице (Glen Creston hammer cutter mill, England) c 1,5 мм сеткой. Измельченная биомасса растений подвергалась кислотной минерализации. Навеска биомассы 0,2-0,5 г минерализовалась в 10 мл 69% азотной кислоты и после выдерживания при комнатной температуре в течение 12 часов помещалась в блок разложения на 3 часа при температуре 120 °C (до прекращения выделения оксидов азота). После окончания процесса минерализации и охлаждения пробирок в них добавлялось 10 мл дистиллированной воды, после чего содержимое отфильтровывалось через фильтровальную бумагу № 541 (соответствует отечественной фильтровальной бумаге с синей лентой) в мерные колбы, осадок на фильтре промывался дистиллированной водой, и объем раствора доводился до 50 мл. Полученные пробы переливались в 60-мл пластиковые бутылки.
Содержание металлов определялось с помощью метода пламенной атомно-абсорбционной спектрометрии (ААС).
Сравнение полученных значений индекса толерантности (табл. 4) с внешним видом растений (рис. 1, 2) показало, что значение ИТБ>100% не свидетельствует о стимулирующем действии металлов на рост растений. Об этом свидетельствуют их угнетенный вид и на личие хлорозных и некрозных пятен на листьях. Часть биомассы представляла собой растительную массу с нарушением нормальной деятельности метаболических центров и течения метаболических процессов.
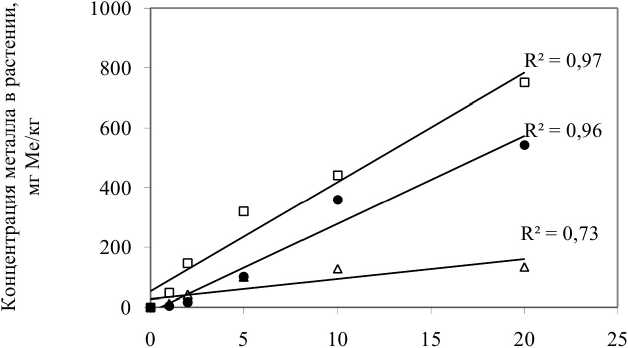
Был проведен корреляционный анализ для установления тесноты связи между концентрацией металлов в растворе и в различных частях растений (рис. 3, табл. 5). Величина коэффициента корреляции варьировалась от 0,73 до 0,99, что соответствует тесной (0,71^0,9) и очень тесной линейной связи (0,91 и выше) (Трухачева 2012). Анализ зависимости концентраций металлов в растениях и в растворе показал, что для аккумуляции как никеля, так и кадмия редисом FB и кукурузой SN (аккумуляция никеля - только корнями) характерна линейная зависимость. Установлено, что кукуруза SN вообще не накапливает никель в надземных частях растения во всем исследованном диапазоне концентраций.
Анализ корреляции между концентрациями металлов в растворе и индексом толерантности растений показал, что тесной корреляционной зависимостью характеризуется только ИТБ редиса от концентрации никеля в растворе (г=0,92), в остальных случаях зависимость была слабой и имела обратный характер.
Таблица 4
|
Концентрация металла в растворе |
Кукуруза SN |
Редис FB |
||||||||||||
|
Ni |
Cd |
Ni |
Cd |
|||||||||||
|
ИТ п |
ИТ К |
ИТ Б |
ИТ и |
ИТ К |
ИТ Б |
ИТ И |
ИТ К |
итп л |
ИТ Б |
ИТ И |
ИТ к |
ИТП л |
ИТ Б |
|
|
1 цМ |
181 |
145 |
172 |
148 |
155 |
149 |
88 |
88 |
143 |
117 |
85 |
88 |
117 |
102 |
|
2 цМ |
118 |
123 |
119 |
109 |
98 |
106 |
85 |
63 |
161 |
124 |
112 |
100 |
184 |
150 |
|
5 цМ |
84 |
68 |
80 |
74 |
70 |
73 |
97 |
88 |
140 |
119 |
144 |
63 |
217 |
178 |
|
10 цМ |
90 |
70 |
85 |
73 |
68 |
72 |
122 |
100 |
160 |
141 |
108 |
75 |
173 |
141 |
|
20 цМ |
84 |
68 |
80 |
58 |
58 |
58 |
119 |
88 |
179 |
149 |
63 |
88 |
129 |
99 |
Таблица 5
|
Концентрация металла в растворе |
Кукуруза SN |
Редис FB |
||||||||
|
Ni |
Cd |
Ni |
Cd |
|||||||
|
Побеги |
Корни |
Побеги |
Корни |
Побеги |
Плоды |
Корни |
Побеги |
Плоды |
Корни |
|
|
1 цМ |
НПО |
4,9 |
12,0 |
47,3 |
3,23 |
9,97 |
- |
6,1 |
НПО |
70,72 |
|
2 цМ |
НПО |
16,3 |
41,3 |
146,1 |
14,05 |
23,7 |
- |
31,8 |
17,78 |
171,6 |
|
5 цМ |
НПО |
100,7 |
100,1 |
319,9 |
21,3 |
34,8 |
78,61 |
40,1 |
30,92 |
569,43 |
|
10 цМ |
НПО |
359,9 |
128,1 |
441,4 |
84,9 |
95,1 |
146,53 |
219,2 |
112,10 |
792,93 |
|
20 цМ |
НПО |
544,1 |
133,8 |
752,1 |
209,8 |
387,6 |
1000 |
504,4 |
231,12 |
2073,55 |
Индекс толерантности,%
Концентрация металлов в сладкой кукурузе SN, мг Me/кг сухой массы
Полученные результаты подтверждают данные о возможности извлечения кадмия и никеля из сточных вод с помощью ризофильт-рации путем пропускания сточных вод через установки с высшими наземными растениями, выращиваемыми гидропонным методом, т.к. их длинная, волокнистая и густая, покрытая волосками, корневая система способна абсорбировать, концентрировать или осаждать тяжелые металлы (Januarya et al. 2008).
Анализ результатов проверки соответствия концентраций в исследуемых растениях критерию безопасности (Елизарьев и др. 2015) показал, что кукуруза SN может быть использована для ризофильтрации сточных вод, содержащих никель в пределах 1-^20 цМ с последующим применением биомассы как на корм скоту, так и в пищу человеку (табл. 6). В случае с кадмием, биомасса кукурузы SN не пригодна для этих целей. Редис FB накапливает тяжелые металлы в количествах, не превышающих допустимых норм, лишь при минимальных концентрациях кадмия (1цМ) и никеля (1-^2цМ).
Таблица 6
Соотношение концентраций никеля и кадмия в сырой биомассе с МДУ их содержания в корме скота (Починова 2014) и с ПДК в пище человека (СанПиН 2.1.7.573-96)
|
Концентрация металла в растворе |
Кукуруза SN |
Редис FB |
||||||
|
Ni |
Cd |
Ni |
Cd |
|||||
|
МДУ |
ПДКпп. |
МДУ |
ПДКпп. |
МДУ |
ПДКпп. |
МДУ |
ПДКпп, |
|
|
1 цМ |
0,12* |
0,02* |
5 |
47 |
0,2 |
1 |
1,2* |
1,2* |
|
2 цМ |
0,12* |
0,02* |
16 |
162 |
0,6 |
3 |
42 |
42 |
|
5 цМ |
0,12* |
0,02* |
39 |
393 |
0,8 |
5 |
74 |
74 |
|
10 цМ |
0,12* |
0,02* |
50 |
502 |
2 |
14 |
267 |
267 |
|
20 цМ |
0,12* |
0,02* |
52 |
525 |
9 |
55 |
550 |
550 |
Примечание. * — рассчитаны но значению предела обнаружения (0,5 mi- / кг сухой массы).
Таким образом, согласно полученным данным кадмий является высокотоксичным элементом даже при невысоком его содержании и характеризуется интенсивным перемещением внутри растения. Токсичность никеля и его транслокация сильно зависят от вида растения.
Выявленные тенденции накопления ионов кадмия и никеля в различных частях растений можно использовать для доочистки сточных вод ризофильтрацией с последующим применением выращенной биомассы как на корм скоту, так и в пищу человеку в зависимости от вида растения и концентрации тяжелых металлов в сточных водах.

Рис. 1. Кукуруза SN, выращенная в растворе, содержащем разные концентрации Cd и Ni

Рис. 2. Редис СВ, выращенный в растворе, содержащем разные концентрации Cd и Ni
Концентрация металла в растворе, л/М
△ Кукуруза побеги Cd □ Кукуруза корни Cd • Кукуруза корни Ni
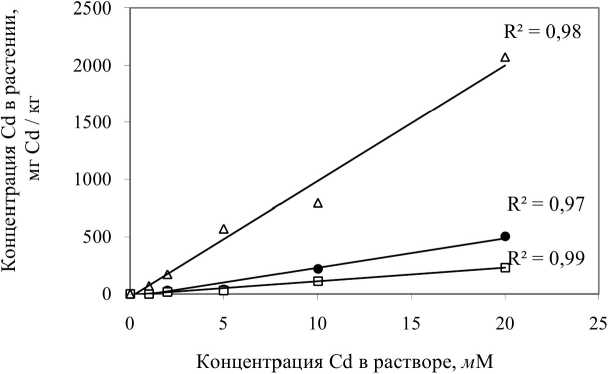
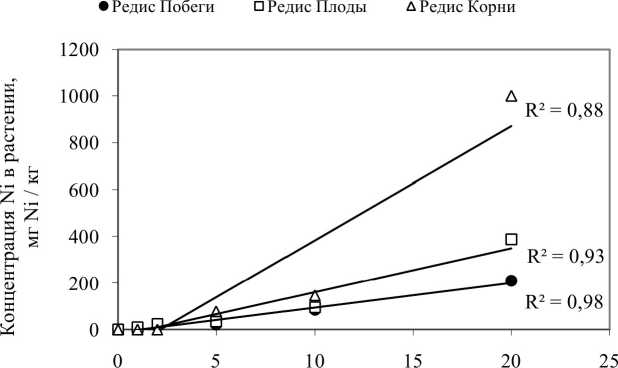
Концентрация Ni в растворе, л/М
-
• Редис Побеги
-
□ Редис Плоды
А Редис Корни
Рис. 3. Зависимость концентрации металлов в растениях от их концентрации в растворе
Список литературы Зависимость аккумуляции растениями никеля и кадмия от их концентрации
- Гигиенические требования к использованию сточных вод и их осадков для орошения и удобрения. 1997. Санитарные правила и нормы. СанПиН 2.1.7.573-96. М.: ИИЦ Минздрава России.
- Елизарьев А. Н., Насыров А. Н., Насырова Э. С. 2015. Комплексная оценка экологического состояния водоемов урбанизированных территорий (на примере г. Уфа)//Вода: химия и экология. 9, 3-11.
- Николаева М. Г., Паутова И. А. 2002. Краткий словарь русских названий растений. СПб.: Издательство ООО «Росток».
- Починова Т. В., Захаров Н. Г. Влияние норм внесения осадков сточных вод на качество зеленой массы кукурузы //Вестник Ульяновской государственной сельскохозяйственной академии. 2014. -№4 (28). -30-35.
- Трухачева Н. В. 2012. Математическая статистика в медико-биологических исследованиях с применением пакета Statistica. М.: «ГЭОТАР-Медиа».
- Afanasev I., Volkova T., Elizaryev A., Longobardi A. 2014. Analysis of interpolation methods to map the long-term annual precipitation spatial variability for the Republic of Bashkortostan, Russian Federation//WSEAS Transactions on Environment and Development. 10 (1), 405-416.
- Azizian A., Amin S., Noshadi M., Maftou N. M., Emam Y. 2011. Phytoremediation Potential of Corn and Oat for Increased Levels of Soil Cadmium under Different Irrigation Intervals//Iran Agricultural Research. 30 (1.2), 47-60.
- Di Salvatore M., Carafa A. M., Mingo A., Carratù G. 2012. Evaluation of Heavy Metal Toxicity on Radish: Comparison between Soil and Floating Hydroponics Systems//American Journal of Experimental Agriculture. 2 (2), 174-185.
- Ismail S., Khan F., Iqbal Z. M. 2013. Phytoremediation: assessing tolerance of tree species against heavy metal (Pb and Cd) toxicity//Pakistan Journal of Botany. 45(6), 2181-2186.
- Khadijeh B., Kholderarin B., Moladshohi A. 2011. Effect of Cd on growth, protein content and peroxidase activity in Pea plants//Pakistan Journal of Botany. 43(3), 1467-1470.
- Sharma A., Dhiman A. 2013. Nickel and Cadmium toxicity in plants//Journal of Pharmaceutical and Scientific Innovation. 2 (2), 20-24.
- Swain G., Adhikari S., Mohanty P. 2014. Phytoremediation of Copper and Cadmium from Water Using Water Hyacinth, Eichhornia Crassipes//International Journal of Agricultural Science and Technology. 2 (1), 1-7.
- Syama N., Wardiyatib T., Maghfoerb M. D., Handayantoc E., Ibrahima B., Muchdara A. 2016. Effect of Accumulator Plants on Growth and Nickel Accumulation of Soybean on Metal-contaminated Soil//Agriculture and Agricultural Science Procedia. 9, 13-19.
- Januarya M. С., Cutrighta T. J., Van Keulenb H., Weic R. 2008. Hydroponic phytoremediation of Cd, Cr, Ni, As, and Fe: Can Helianthus annuus hyperaccumulate multiple heavy metals?//Chemosphere. 70 (3), 531-537.
- Watson C., Pulford I. D., Riddell-Black D. 2003. Development of a hydroponic screening technique to access heavy metal resistance in willow (Salix)//International journal of phytoremediation. 5 (4), 333-349.


