Зависимость формирования холодоустойчивости у растений in vitro от концентрации сахарозы в среде выращивания
Автор: Дерябин Александр Николаевич, Сабельникова Е.П., Бураханова Елена Александровна
Журнал: Инженерные технологии и системы @vestnik-mrsu
Рубрика: Физиология растений и животных
Статья в выпуске: 4, 2011 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/14719813
IDR: 14719813
Текст статьи Зависимость формирования холодоустойчивости у растений in vitro от концентрации сахарозы в среде выращивания
На примере двух генотипов картофеля (Solanum tuberosum L.), различающихся по углеводному метаболизму, показана возможность повышения холодоустойчивости растений посредством увеличения концентрации сахарозы в среде выращивания. Выявлена зависимость активности различных форм инвертазы и содержания растворимых сахаров (преимущественно глюкозы и сахарозы) в листьях от концентрации (2, 4 и 6 %) сахарозы в среде выращивания и экспрессии гена инвертазы дрожжей, встроенного в геном трансформантов. Показано, что повышенное содержание сахаров в листьях за счет выращивания обоих генотипов на МС-среде с 4 % сахарозы способствует снижению интенсивности свободнорадикальных процессов и повышению устойчивости растений к низкой температуре. Конститутивная экспрессия гена инвертазы дрожжей в листьях картофеля способствует большему, по сравнению с контрольными растениями, накоплению сахаров и повышенной холодоустойчивости.
В ходе эволюции растения выработали действию абиотических стрессоров, в том определенные адаптационные механизмы к числе низкой температуры, представляющие
собой комплекс морфофизиологических и биохимических приспособлений. Одним из обязательных условий развития максимальной морозо- и холодоустойчивости является накопление в тканях растений сахаров [7 — 8; 12]. В условиях низкотемпературного стресса в защите мембран принимают участие как внутриклеточные, так и внеклеточные (находящиеся в апопластс) сахара. Например, количество сахаров, накапливаемых при холодовом закаливании злаков, может достигать 60 % от массы сухого вещества клеток [6]. Общепризнаны основные функции сахаров, накапливаемых в тканях растений при адаптации к низкой температуре: осморегу-ляторная, энергетическая, пластическая, протекторная и антифризная. Растворимые сахара способны снижать температуру раствора, при которой происходит нуклеация льда [10], стабилизировать фосфолипидный бислой плазмалеммы, взаимодействуя с полярными головками фосфолипидов и сохраняя (при дегидратации) жидко-кристаллическое состояние липидов [20].
Растения, выращиваемые in vitro, в отличие от растений in vivo, являются удачной моделью для изучения влияния экзогенных растворимых сахаров на процесс формирования холодоустойчивости. У растений, выращиваемых in vitro в пробирочной культуре на искусственной питательной среде, лимитирован процесс фотосинтеза из-за недостатка углекислого газа [2], в связи с чем они вынуждены усиленно потреблять сахара из культуральной среды, являясь, таким образом, преимущественно гетеротрофной культурой. Кроме того, поддерживаемые в культуре in vitro растения находятся в условиях, строго контролируемых по освещенности, фотопериоду, температуре, влажности воздуха и другим параметрам. Новые возможности для изучения роли отдельных соединений в стрессоустойчивости открывают генно-инженерные подходы, в частности, использование в научных исследованиях линий трансформированных растений, экспрессирующих гены гетерологичных организмов. Растения картофеля, метаболизм углеводов которых изменен вследствие экспрессии введенного гена инвертазы дрожжей [15], отлично подходят для решения поставленных вопросов. Ранее нами было показано, что эти трансформанты имели более высокую холодоустойчивость по сравнению с нетрансформирован-ными растениями вследствие повышенной концентрации сахаров в листьях [1; 16]. Цель настоящей работы состояла в изучении зависимости формирования холодоустойчивости от концентрации сахарозы в среде вы ращивания у генотипов картофеля, различающихся по углеводному метаболизму. Для достижения поставленной цели было необходимо: 1) выявить конститутивные изменения в активности основного фермента углеводного метаболизма — инвертазы — ив содержании растворимых сахаров у исследуемых генотипов при модификации углеводного состава среды выращивания; 2) определить устойчивость к низкой температуре растений, выращенных на средах с различной концентрацией сахарозы.
Объектом исследования служили растения картофеля (Solarium tuberosum L., cv. Desiree), экспрессирующие ген инвертазы дрожжей (inuX находящийся под контролем клубнеспецифичного пататинового промотора ВЗЗ класса I и содержащий последовательность лидерного пептида ингибитора протеиназы II для обеспечения апопластной локализации фермента (далее по тексту — ВЗЗ-inv растения). Контролем служили растения картофеля (5. tuberosum L.) сорта Дезире, у которых встроенный репортерный ген GUS, кодирующий p-глюкуронидазу, не несущую функциональной нагрузки в организме высших растений, экспрессировался под контролем сильного конститутивного промотора 35S вируса мозаики цветной капусты (CaMV). Все трансформанты содержали маркерный ген nptH, обеспечивающий устойчивость к антибиотику канамицину. Растения отобраны из коллекции клонов, полученных в результате совместной работы сотрудников Лаборатории сигнальных систем контроля онтогенеза имени академика М. X. Чай-лахяна Института физиологии растений Российской академии наук (ИФР РАН) и Института молекулярной физиологии растений им. Макса Планка (г. Гольм, Германия).
Растения размножали микрочеренкованием и выращивали в фитотроне ИФР РАН при 22 ± 1 °C и 16 ч освещении люминесцентными лампами белого света (освещенность 100 цмоль/м2 • с) в течение 5 недель в пробирочной культуре на агаризованной питательной среде Мурасиге и Скуга (МС-сре-да), содержавшей 2, 4 и 6 % сахарозы. Для изучения влияния низкой температуры растения извлекали из пробирок и помещали на 15 мин в климатическую камеру MIR-153 (SANYO, Япония) с температурой 2 °C.
Для определения активности различных форм инвертазы навеску (1,0 г) листьев на холоде (4 °C) растирали в фарфоровой ступке с фосфатно-цитратным буфером (pH 7,0) и полученную массу диализовали 20 ч против разбавленного в 10 раз этого же буфера для удаления сахаров, содержащихся в тка- ни. После диализа гомогенат центрифугировали 20 мин при 18 000 g. Супернатант, содержащий растворимую фракцию клеток с примесью микросом, нс обладающих инвертазной активностью, использовали для определения активностей растворимых кислой и щелочной форм инвертазы. Осадок трижды промывали разбавленным фосфатно-цитрат-ным буфером, отделяя его на центрифуге при 200 g в течение 10 мин, и полученную фракцию использовали для определения активности кислой нерастворимой формы инвертазы.
Инкубационная смесь общим объемом 0,5 мл содержала 0,2 мл фракции фермента, 0,3 мл буфера с сахарозой (конечная концентрация сахарозы в смеси составляла 150 мМ) и одну каплю толуола. Для определения активности кислых форм инвертазы использовали 1М ацетатный буфер (pH 4,7), для щелочной — фосфатно-цитратную буферную смесь (pH 7,5). В контрольных образцах перед инкубацией инвертазу инактивировали кипячением в течение 2 мин. Время инкубации составляло 1 ч при 30 °C. Об активности различных форм инвертазы судили по количеству образовавшейся глюкозы в инкубационной среде (мкмоль/г сырой массы в час), которую определяли глюкозооксидаз-ным методом. В работе использовали набор биохимических реагентов «Ольвекс диагнос-тикум». Содержание сахарозы и фруктозы в листьях определяли по методу Рое [9].
Об устойчивости растений картофеля к низкой температуре судили по интенсивности перекисного окисления липидов (ПОЛ), определенного по накоплению в листьях одного из конечных продуктов процесса — малонового диальдегида (МДА), по цветной реакции с тиобарбитуровой кислотой [3]. Измерение оптической плотности растворов проводили на спектрофотометре СФ-46 (ЛОМО, Россия) при длине волны 532 нм, используя кювету с длиной хода луча 1 см. Расчет концентрации МДА проводили по изменению молярной экстинкции согласно формуле С = D/г^ где С — концентрация МДА, мкмоль, е — молярный коэффициент экстинкции, равный 1,56 105 см-1 М-1), D — оптическая плотность, / — толщина слоя раствора в кювете, см. Количество МДА рассчитывали в мкмоль/г сырой массы листьев [5].
Статистическую обработку данных проводили с использованием программы t-test (применяли критерий Стьюдента, Р == 0,05) и графопостроителя Origin. В работе обсуждаются различия, достоверные при 95 %-м уровне значимости. Представлены средние значе- ния типичного опыта, состоящего из трех биологических повторностей, представленных образцами листьев, взятых из средней части 3 — 5 растений.
Выращивание растений на питательных средах с различной концентрацией сахарозы (2, 4 и 6 %) выявило рост ингибирующий эффект сахаров. Рост растений тормозился с возрастанием концентрации сахарозы в среде выращивания (данные не представлены). Основываясь на литературных данных об участии сахаров в изменении гормонального баланса растений за счет формирования конъюгатов с фитогормонами — активаторами роста, например с ауксинами [4], есть повод считать, что этим объясняется рост ингибирующий эффект повышенной (4 и 6 %) концентрации сахаров в МС-среде. Наилучший рост растений наблюдали при использовании МС-среды, содержавшей 2 % сахарозы.
Известно, что ключевую роль в изменении состава и соотношения различных фракций растворимых углеводов у растений играет фермент из класса гидролаз — инвертаза (КФ 3.2.1.26) [21]. Щелочная форма инвертазы представлена в клетке растворимыми цитоплазматическими белками. Кислые формы инвертазы находятся во внеклеточном пространстве — апопласте — и ионно связаны с клеточной стенкой, а также содержатся в виде растворимых белков в вакуоли [13]. Мы провели анализ активности различных форм инвертазы в листьях исследуемых генотипов картофеля при выращивании растений на модифицированных по углеводному составу питательных средах. Согласно полученным данным концентрация сахарозы в среде выращивания оказывала существенное влияние на активность фермента (рис. 1). В листьях обоих генотипов с увеличением концентрации сахарозы в МС-среде активность щелочной инвертазы возрастала в 2—3 раза, при этом в контрольных растениях активность других форм фермента изменялась несущественно. При выращивании ВЗЗ-гии растений на МС-среде с 2 % сахарозы выявлено, что экспрессия гена инвертазы дрожжей привела к увеличению активности кислой нерастворимой формы инвертазы в 1,5, а кислой растворимой — в 2,0 раза по сравнению с контролем. Необходимо отметить, что наблюдаемое нами у ВЗЗ-inu растений 1,5-кратное увеличение активности инвертазы клеточных стенок по сравнению с контрольными растениями, видимо, связано с частичной адсорбцией на клеточной стенке секретируемой чужеродной инвертазы. Наши данные согласуются с результатами, полученными S. J. Carlson и Р. S. Chou- rey [И], которые выявили присутствие в растворимой фракции кислой нерастворимой инвертазы и высказали предположение об ее слабом ионнохМ взаимодействии с клеточной стенкой. Авторы заключили, что основная масса кислой нерастворимой инвертазы при проведении биохимического анализа переходит в растворимую фракцию.
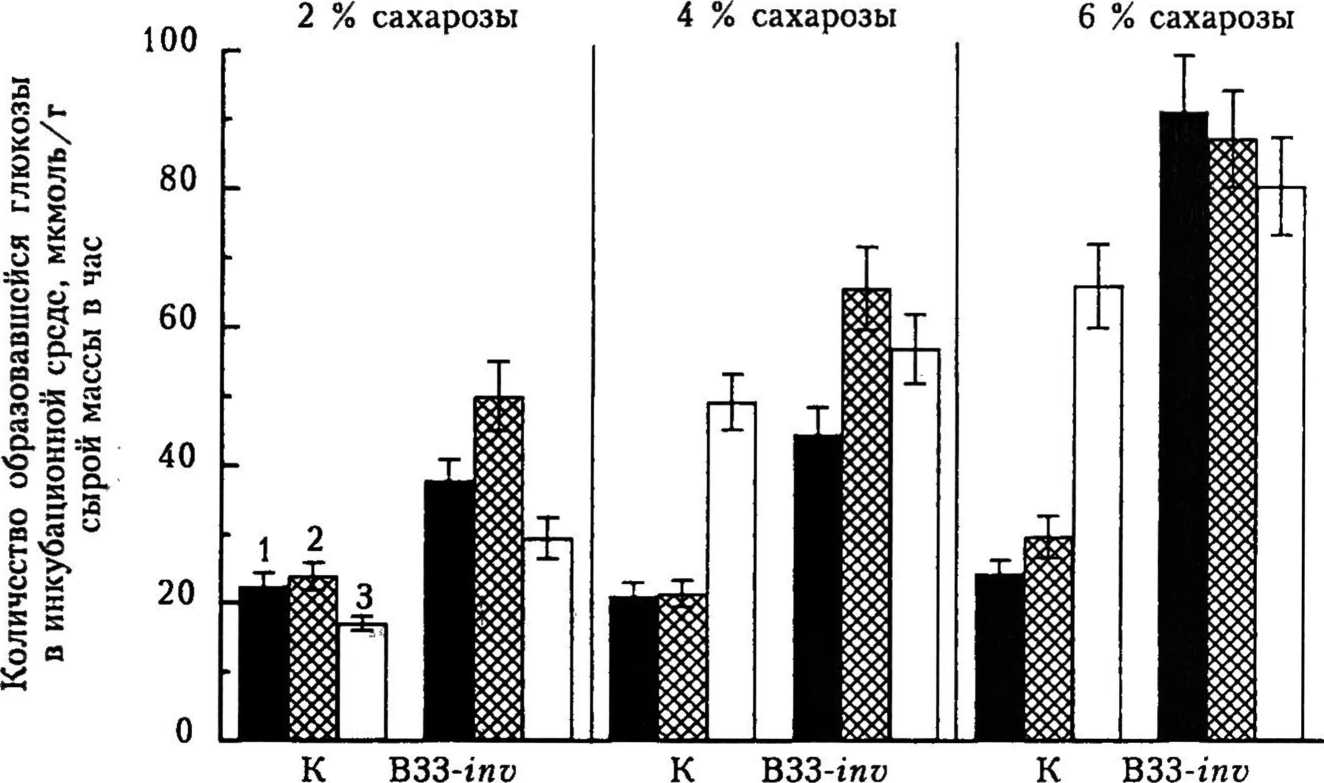
Рис. 1. Активность кислой нерастворимой (1), кислой растворимой (2) и щелочной (3) инвертазы в листьях контрольных (К) и ВЗЗ-гиу растений картофеля при выращивании на МС-средс с 2, 4 и 6 % сахарозы * -
Полученные данные позволяют сделать вывод, что активность кислых форм инвертазы в листьях ВЗЗ-гпа растений возрастала с увеличением концентрации сахарозы в среде выращивания (см. рис. 1). Наибольшую активность всех форм инвертазы наблюдали при использовании МС-среды с 6 % сахарозы: по сравнению с МС-средой с 2 % сахарозы активность фермента возросла более чем в 2 раза. Таким образом, выращивание растений картофеля на МС-среде с 4 и 6 % сахарозы по сравнению с МС-средой с 2 % сахарозы привело к возрастанию активности щелочной инвертазы, а у ВЗЗ-iny растений в отличие от контроля — также к увеличению активности кислых форм фермента (за счет экспрессии гена инвертазы дрожжей). Необходимо отметить, что щелочная форма инвертазы рассматривается в качестве «поддерживающего» фермента, включенного в деградацию сахарозы, когда активность кислых форм инвертазы низка. Данный факт согласуется с результатами наших исследований, свидетельствующими о возрастании активности щелочной формы инвертазы в листьях контрольных растений при выращивании на МС-среде с 4 и 6 % сахарозы по сравнению с МС-средой, содержавшей 2 % сахарозы.
Увеличение концентрации сахарозы в среде выращивания отразилось не только на возрастании активности инвертазы, но и на содержании сахаров в листьях растений. Из рис. 2 видно, что в листьях обоих генотипов картофеля из исследуемых основных форм растворимых сахаров (глюкозы, фруктозы и сахарозы) содержание фруктозы было минимальным и почти не изменялось при модификации концентрации сахарозы в МС-среде. Можно предположить о быстром фосфорилировании фруктозы фруктокиназами и ее вовлечении в метаболизм клетки. Содержание глюкозы и сахарозы в листьях обоих генотипов с увеличением концентрации сахарозы в среде выращивания возросло в 1,5 — 2,0 раза, при этом у ВЗЗ-гиу растений — в большей степени. Анализ изменения конститутивной активности инвертаз и содержания сахаров в листьях растений картофеля при выращивании на МС-среде с различной концентрацией сахарозы позволяет допустить возможность индуцирования этих процессов сахарозой, поступающей из культуральной среды и способствующей значительному накоплению сахаров в листьях, главным образом в форме глюкозы и сахарозы (см. рис, 2). При этом у ВЗЗ-inv растений, обладающих более высокой активностью кислой нерастворимой инвертазы за счет экспрессии гена инвертазы дрожжей, эти процессы протекали более интенсивно.
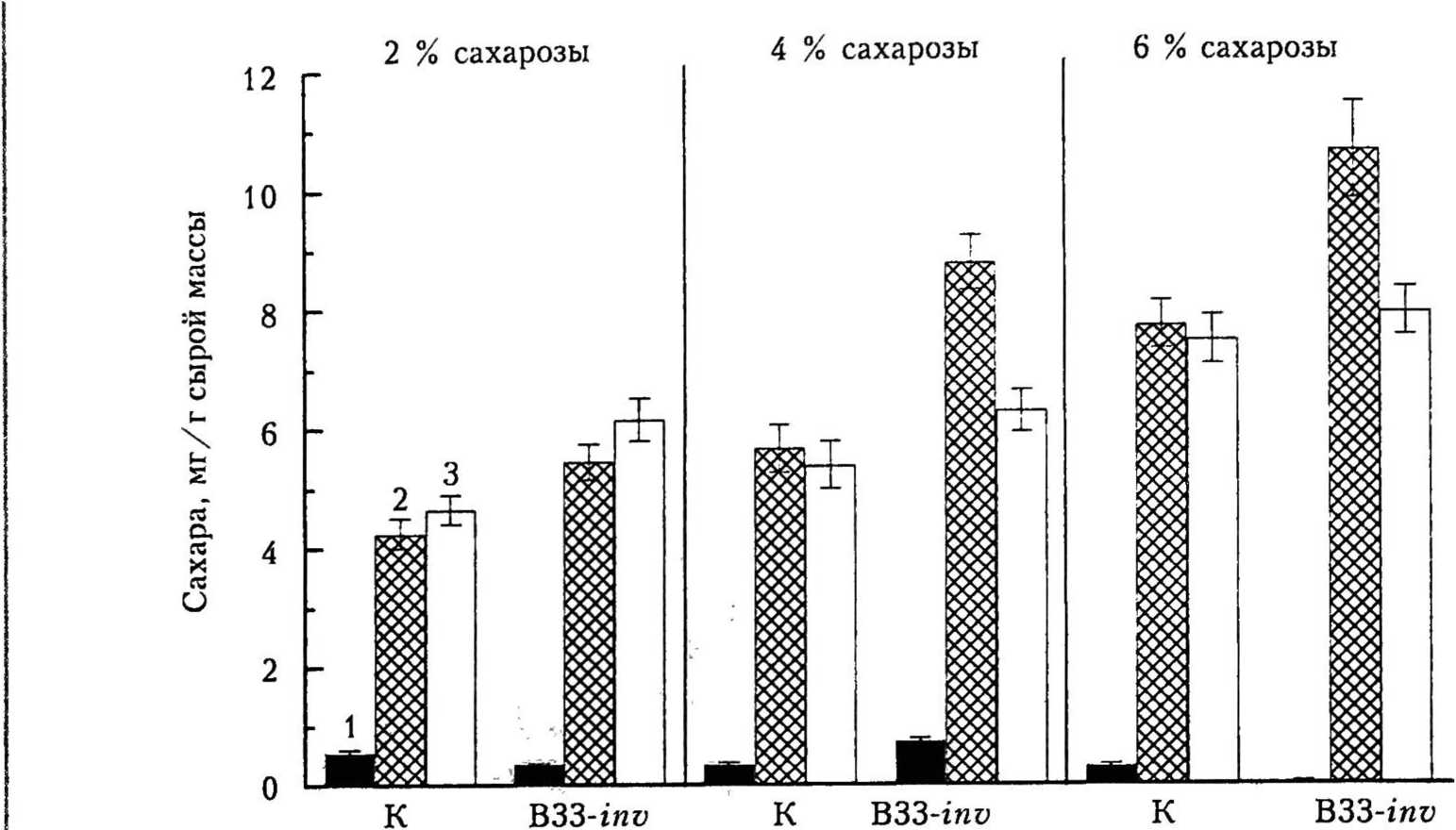
Рис. 2. Содержание фруктозы (1), глюкозы (2) и сахарозы (3) в листьях контрольных (К) и ВЗЗ-шу растений картофеля при выращивании на МС-средс с 2, 4 и 6 % сахарозы
Важно отметить, что концентрация сахаров в клетках растений является одним из факторов, влияющих на экспрессию генома [17]. Избыток, равно как и недостаток сахаров, может усилить или подавить экспрессию определенных генов. Сахара выполняют роль сигнальных молекул, регулирующих экспрессию генов и контролирующих многие морфофизиологические процессы [14]. Участие сахаров в сигналлинге проявляется как на уровне клетки — при взаимоотношении между органеллами, так и на уровне целого организма — между фотосинтезирующими (донор) и запасающими (акцептор) органами. Установлено, что центральными компонентами внутриклеточной сигнальной системы сахаров являются ферменты гексо-киназы [18] и фруктокиназы [19]. Влияя на экспрессию генов, сахара избирательно усиливают либо ослабляют пути биосинтеза белков, липидов, органических кислот и других метаболитов, что сказывается на проявлении такого признака, как устойчивость растения к низкой температуре.
В нашей работе устойчивость растений к низкой температуре оценивали по степени накопления в листьях одного из конечных продуктов ПОЛ — малонового диальдегида. Как свидетельствуют полученные данные (рис. 3), независимо от концентрации саха розы в среде выращивания после охлаждения листья ВЗЗ-гии растений по сравнению с контролем накапливали меньше МДА. При выращивании на МС-среде с 4 % сахарозы оба генотипа формировали более высокую холодоустойчивость, при этом у ВЗЗ-гпу растений она была выше (содержание МДА меньше). Однако на МС-среде, содержавшей 6 % сахарозы, после охлаждения в листьях исследуемых генотипов наблюдали некоторое увеличение интенсивности ПОЛ, что можно объяснить осмострессом, оказываемым на растения повышенной концентрацией сахарозы в среде выращивания (в дополнение к низкотемпературному стрессу).
Полученные результаты позволили заключить, что: 1) процесс формирования холодоустойчивости у растений модифицируется посредством варьирования углеводного состава питательной среды in vitro; 2) сахара, накапливающиеся в листьях при действии низкой температуры, снижают интенсивность свободнорадикальных реакций (ПОЛ), что способствует повышению холодоустойчивости растений; 3) конститутивная экспрессия гена инвертазы дрожжей в ВЗЗ-mu растениях картофеля способствует большему по сравнению с контролем накоплению сахаров в форме глюкозы и фруктозы в листьях и повышенной холодоустойчивости.
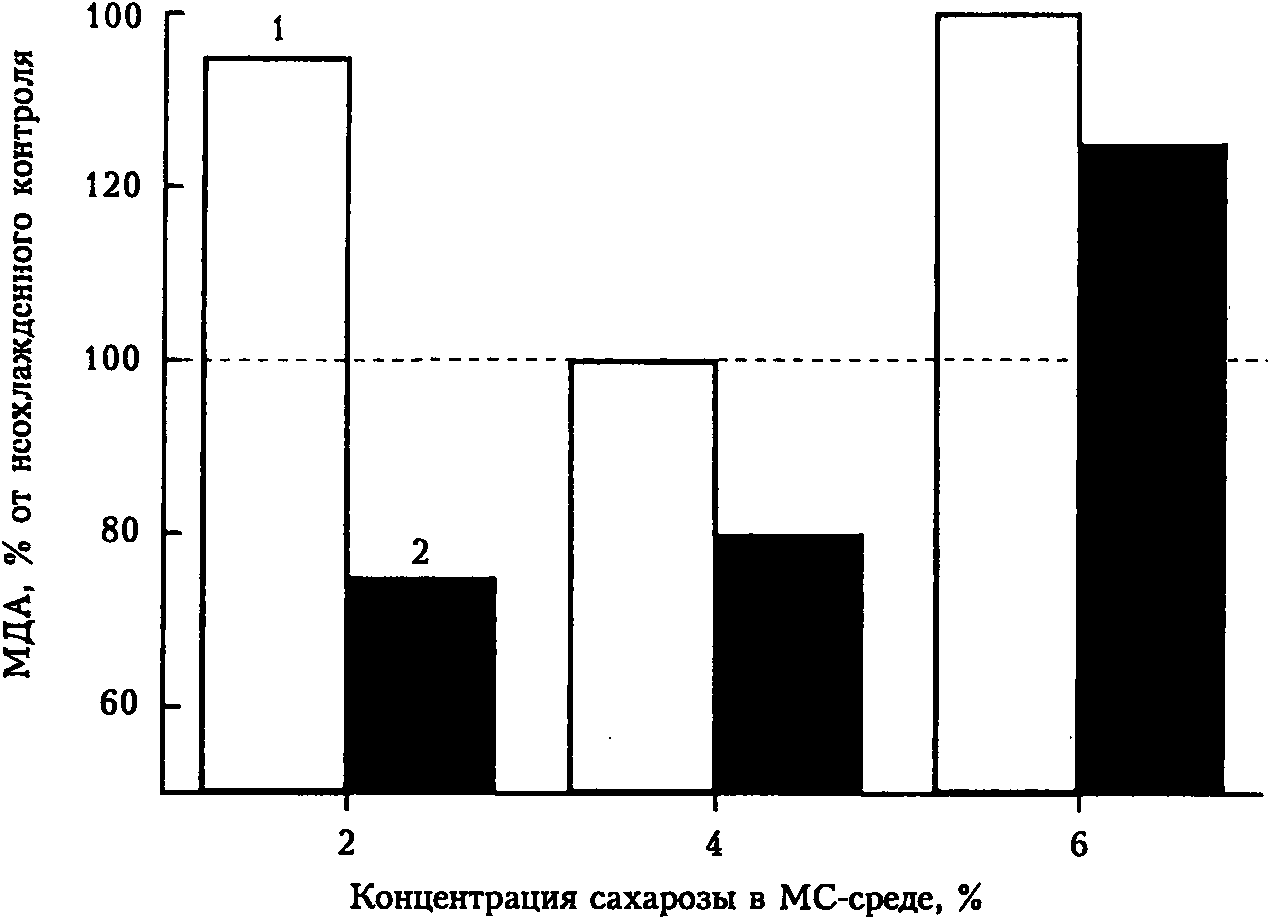
Рис. 3. Влияние низкой температуры (-2 °C; 15 мин) на интенсивность перекисного окисления липидов в листьях контрольных (1) и ВЗЗ-inu (2) растений картофеля, выращенных на МС-средах с различной конценрацией сахарозы


