Зависимость глубины радиочастотного повреждения миокарда от исходного сопротивления тканей в различных температурных условиях
Автор: Евтушенко А.В., Евтушенко В.В., Смышляев К.А., Быков А.Н., Кистенев Ю.В., Анфиногенова Я.Д., Павлюкова Е.Н., Курлов И.О., Попов С.В.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Анестезиология и реаниматология
Статья в выпуске: 1 т.20, 2016 года.
Бесплатный доступ
Цель. Анализ эффективности радиочастотной деструкции миокарда при различных температурных условиях рабочего поля. Материал и методы. Провели исследования на 20 изолированных сердцах, воздействие выполняли на миокарде левого желудочка. Для оценки эффективности радиочастотного воздействия применили две температурные среды: нормотермию (36,6 °C) и гипотермию (20 °C) миокарда. Помещали сердца в электрофизический стенд, оценивали глубину деструкции, температуру эпи-, эндо- и миокарда в точках воздействия. До и после воздействия измеряли сопротивление тканей. Радиочастотное воздействие выполняли орошаемым шаровидным электродом по монополярной схеме с мощностью 40 Вт в течение 7 секунд. Результаты. При гипотермии миокард имеет низкое сопротивление, что препятствует адекватному нагреву его глубоких слоев. В связи с этим высок риск восстановления потенциалов мембран кардиомиоцитов с сохранением их функции. Таким образом, радиочастотное воздействие при низких температурах рабочего поля вызывает меньшую глубину повреждения при равном времени воздействия с нормотермическими условиями.
Проводимость, сопротивление, температура, радиочастотная энергия, миокард
Короткий адрес: https://sciup.org/142140726
IDR: 142140726
Текст научной статьи Зависимость глубины радиочастотного повреждения миокарда от исходного сопротивления тканей в различных температурных условиях
Citation: Evtushenko AV, Evtushenko VV, Smyshlyaev KA, Bykov AN, Kistenev YuV, Anfinogenova YaD, Pavlyukova EN, Kurlov IO, Popov SV. Relationship between depth of RF destruction of myocardium and initial tissue resistance under various temperature conditions. Patologiya krovoobrashcheniya i kardiokhirurgiya [Circulation Pathology and Cardiac Surgery]. 2016;20(1):35-39. (In Russ.).
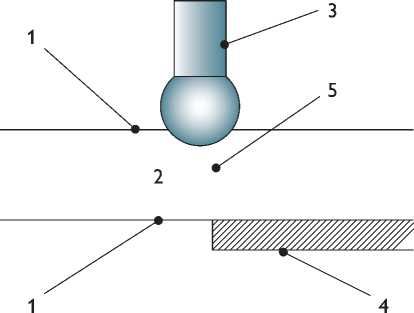
Рис. 1. Схема эксперимента: 1 – электроды для измерения температуры и сопротивления тканей; 2 – миокард; 3 – активный монополярный электрод; 4 – пассивный электрод; 5 – температурный датчик в толще миокарда посередине между эпи- и эндокардом
обе бранши электрода располагаются в зоне воздействия: одна на эпикарде, вторая на эндокарде [2]. Тем не менее открыт вопрос, при каких характеристиках внешней среды воздействие максимально эффективно.
Цель исследования – анализ эффективности радиочастотной деструкции миокарда при различных температурных условиях рабочего поля.
Материал и методы
Изучали сопротивление миокарда при различных температурах. Для этого использовали трупные сердца, на которых проводили радиочастотное воздействие при нормальной температуре тела человека (36,6 °С) и гипотермии (20 °С). Выполняли исследование на электрофизическом стенде с измерением температуры тканей и сопротивления. В ходе эксперимента разделили серии наблюдений на две группы. Первую группу наблюдений исполняли в следующих условиях: в электрофизический стенд помещали сердца, нагретые до 36,6 °С, измеряли сопротивление между эпи- и эндокардом, затем осуществляли радиочастотное воздействие на стенку сердца в течение 7 секунд по монополярной методике. Пассивный электрод располагался под сердцем, а активный на поверхности эпикарда с противоположной стороны, после чего повторно измеряли сопротивление и температуру на поверхности эпикарда в точке воздействия, в глубине очага воздействия (на середине расстояния между эпикардом и эндокардом) и на поверхности эндокарда. Для второй группы наблюдений сердца охлаж- дали до 20 °С, вновь измеряли сопротивление между эпикардом и эндокардом и на интактном участке снова применяли радиочастотное воздействие по монополяр-ной схеме в течение 7 секунд с последующим измерением температуры и сопротивления по вышеописанной схеме (рис. 1). В каждой группе наблюдений коронарное русло в процессе эксперимента перфузировали раствором Рингера заданной температуры. После окончания эксперимента совершали поперечный разрез сердечной мышцы через центры точек воздействия и измеряли макроскопически видимую глубину радиочастотного повреждения. Всего произвели 20 серий исследований. Все сердца не имели видимой патологии и рубцовых изменений стенок. Средняя толщина стенок левого желудочка составила 9,8±1,2 мм.
Статистический анализ
Статистическую обработку проводили с применением пакета программ Statistica 10.0 for Windows (StatSoft, Inc., США). Проверку нормальности распределения осуществляли критерием Шапиро – Уилка. Описывали данные с помощью среднего и стандартного отклонения – M±SD либо медианы с определением верхнего и нижнего квартилей и межквартильного размаха. Для корреляционного анализа использовали корреляционный коэффициент Спирмена. Для оценки достоверности межгрупповых различий применяли критерий Манна – Уитни. Принимали уровень значимости р = 0,05, доверительная вероятность 0,95.
Показатели сопротивления, температуры различных слоев миокарда и глубины повреждения по группам
Первая группа, n = 10 Вторая группа, n = 10
|
Показатель |
Me (Q25; Q75) |
Межквартильный размах |
Me (Q25; Q75) |
Межквартильный размах |
|
Сопротивление миокарда до воздействия, МΩ |
3,75 (3,60; 3,80) |
0,30 |
0,70 (0,60; 0,90) |
0,30 |
|
Сопротивление миокарда после воздействия, МΩ |
4,80 (4,70; 4,90) |
0,20 |
0,95 (0,90; 1,20) |
0,30 |
|
Температура эпикарда, °С |
98,50 (97,00; 99,00) |
2,00 |
97,00 (96,00; 98,00) |
2,00 |
|
Температура средних слоев миокарда, °С |
67,00 (65,00; 67,00) |
2,00 |
59,50 (58,00; 61,00) |
3,00 |
|
Температура эндокарда, °С |
40,00 (39,00; 41,00) |
2,00 |
38,50 (38,00; 39,00) |
1,00 |
|
Глубина повреждения, мм |
5,80 (5,50; 6,00) |
0,50 |
4,70 (4,50; 4,90) |
0,40 |
Результаты
Медиана сопротивления миокарда при температуре 36,6 °С составила 3,75 М Ω до и 4,8 М Ω после воздействия, что, очевидно, связано с нагревом миокарда в данной точке. При этом медиана температуры эпикарда в точке воздействия составила 98,5 °С, в глубине очага воздействия – 67,0 °С, на эндокарде – 40,0 °С. Медиана макроскопически видимой глубины повреждения составила 5,8 мм. При охлаждении сердца до 20 °С сопротивление миокарда резко снижалось и до воздействия его медиана была 0,7 М Ω . После воздействия в перифокальной зоне сопротивление возрастало до 0,95 М Ω . Медиана температуры эпикарда в точке воздействия – 97 °С, в глубине очага воздействия – 59 °С, на эндокарде – 38,5 °С. Медиана глубины радиочастотного повреждения в данной серии наблюдений составила 4,7 мм ( таблица ).
Различие сопротивления тканей внутри каждого температурного значения, при котором проводили эксперимент, до и после воздействия было статистически
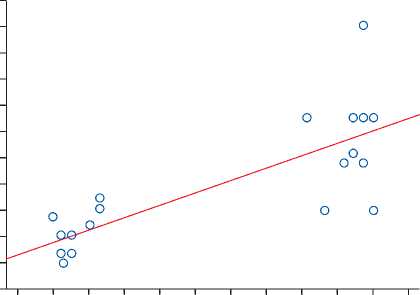
Рис. 2. Зависимость глубины радиочастотного повреждения от исходного сопротивления миокарда значимым, p<0,05. Межгрупповые значения сопротивления, температуры до и после воздействия, а также глубина радиочастотного повреждения статистически значимо различались, p<0,01. Выявили сильную корреляционную связь с коэффициентом 0,804 между исходным сопротивлением миокарда и глубиной радиочастотного повреждения (рис. 2).
Обсуждение
Эффективность радиочастотного воздействия на сердечную мышцу зависит от температуры окружающих тканей. Исходно низкая температура тканей приводит к медленному повышению температуры в зоне воздействия, что препятствует быстрому росту электрического сопротивления и эффективному нагреву глубоких слоев миокарда, а также достижению эффективной деструкции за то же время экспозиции, что и при более высокой температуре миокарда.
Проблема повышения эффективности воздействия радиочастотных систем актуальна в течение долгого времени. Nath S. в работах (1993, 1995) показал, что потенциалы мембран кардиомиоцитов зависят от температуры. Согласно данным, нагрев кардиомиоцитов до 48 °С приводит к обратимым изменениям в них. Это препятствует достижению трансмуральной деструкции. Таким образом, недостаточный нагрев в глубине воздействия может приводить к восстановлению потенциалов мембран и, как следствие, неэффективности радиочастотной аблации [8, 9]. Также в данных работах показано, что при использовании орошаемых электродов точка максимального импеданса и нагрева смещается вглубь сердечной мышцы, вызывая более распространенное повреждение, в отличие от неорошаемых радиочастотных систем, где точка максимального нагрева находится непосредственно в зоне контакта электрода с тканью. Это вызывает коагуляцию поверхностных слоев и резкое повышение сопротивления, препятствующее распространению радиочастотной энергии вглубь тканей [7].
Полученные данные позволяют утверждать, что эффективность радиочастотной деструкции в условиях нормотермии выше, чем при локальной или общей гипотермии. В ряде работ показано, что оптимальная для деструкции температура составляет 50–70 °С [1, 8], так как именно в данных условиях наступает необратимая гибель клетки. Исходно более высокое сопротивление тканей приводит к усиленному нагреву миокарда, что способствует нагреву глубоких слоев миокарда в большей степени, нежели радиочастотное воздействие в условиях гипотермии тканей. Следствием гипотермии является недостаточный прогрев субэндокардиальных слоев и отсутствие радиочастотного повреждения на всю толщину стенки сердца, что ведет к неэффективности процедуры, особенно в участках, имеющих большую или неравномерную толщину миокарда (зоны фиброзных колец атриовентрикулярных клапанов, участки миокарда с повышенной трабекулярностью).
Радиочастотная деструкция при нормотермии позволяет достичь достаточной для необратимых клеточных изменений температуры на заданной глубине поражения, однако в ряде случаев, таких как поддержание гипотермии миокарда в условиях кардиоплегии, это не всегда возможно. Следовательно, время воздействия должно меняться в зависимости от исходной температуры тканей, чтобы обеспечить достаточный для необратимой гибели клеток прогрев миокарда [6].
Альтернатива радиочастотному воздействию при глубокой гипотермии – новые принципы проведения радиочастотной энергии вглубь миокарда. Эти методы должны обеспечивать нагрев всех слоев миокарда с одинаковой температурой 50–70 °С при минимизации времени и площади воздействия.
Заключение
Эффективность радиочастотного воздействия на миокард зависит от температуры тканей. Чем выше температура, тем больше сопротивление, которое усиливает нагрев слоев миокарда и приводит к его более глубокому повреждению. Гипотермия миокарда, напротив, способствует резкому уменьшению сопротивления тканей, что не позволяет нагреть глубокие слои миокарда до значений, приводящих к необратимой гибели кардиомиоцитов, снижая эффективность процедуры. Разработка и внедрение новых принципов ра- диочастотного воздействия позволит повысить эффективность радиочастотной деструкции.
Список литературы Зависимость глубины радиочастотного повреждения миокарда от исходного сопротивления тканей в различных температурных условиях
- Swanson D.K., Smith W.J., Ibrahim T., Wechsler A.S. Tissue temperature control and power the key to successful ablation//Innovations. 2011. Vol. 6 (4). P. 276-282. doi: 10.1097/IMI.0b013e31822b4d22.
- La Meir M., Gelsomino S., Luca F., Lorusso R., Gensini G.F., Pison L., Wellens F., Maessen J. Minimally invasive thoracoscopic hybrid treatment of lone atrial fibrillation: early results of monopolar versus bipolar radiofrequency source//Interact. Cardiovasc. Thorac. Surg. 2012. Vol. 14 (4). P. 445-50 DOI: 10.1093/icvts/ivr142
- Chang D., Zhang S., Yang D., Gao L., Lin Y., Chu Z., Jiang X., Yin X., Zheng Z., Wei X., You D., Xiao X., Cong P., Bian X., Xia Y., Yang Y. Effect of epicardial fat pad ablation on acute atrial electrical remodeling and inducibility of atrial fibrillation//Circ. J. 2010. Vol. 74 (5). P. 885-894.
- Saliba W., Wazni O.M. Sinus rhythm restoration and treatment success: insight from recent clinical trials//Clin. Cardiol. 2011. Vol. 34 (1). P. 12-22 DOI: 10.1002/clc.20826
- Wenning C., Lange P.S., Schülke C., Vrachimis A., Mönnig G., Schober O., Eckardt L., Schäfers M. Pulmonary vein isolation in patients with paroxysmal atrial fibrillation is associated with regional cardiac sympathetic denervation//EJNMMI Res. 2013. Vol. 3 (1). P. 81 DOI: 10.1186/2191-219X-3-81
- Nasso G., Bonifazi R., Del Prete A., Del Prete G., Lopriore V., Bartolomucci F., Calafiore A.M., Speziale G. Long-term results of ablation for isolated atrial fibrillation through a right minithoracotomy: Toward a rational revision of treatment protocols//J. Thorac. Cardiovasc. Surg. 2011. Vol. 142 (2). P. e41-46 DOI: 10.1016/j.jtcvs.2011.04.009
- Nath S., Haines D.E. Biophysics and pathology of catheter energy delivery systems//Prog. Cardiovasc. Dis. 1995. Vol. 37 (4). P. 185-204.
- Nath S., Lynch C. 3rd, Whayne J.G., Haines D.E. Cellular electrophysiological effects of hyperthermia on isolated guinea pig papillary muscle. Implications for catheter ablation//Circulation. 1993. Vol. 88 (4 Pt 1). P. 1826-1831.
- Nath S., Whayne J.G., Kaul S., Goodman N.C., Jayaweera A.R., Haines D.E. Effects of radiofrequency catheter ablation on regional myocardial blood flow. Possible mechanism for late electrophysiological outcome//Circulation. 1994. Vol. 89 (6). P. 2667-2672.


