Зависимость микробиоты почвоподобного субстрата от способа обработки соломы пшеницы
Автор: Сысоева О.В., Тирранен Л.С., Ушакова С.А., Калачева Г.С.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Экология
Статья в выпуске: 3, 2013 года.
Бесплатный доступ
Представлены результаты оценки воздействия обработанной различными способами пшеничной соломы на индикаторные группы микроорганизмов в почвоподобном субстрате для выращивания высших растений. Установлено достоверное изменение в почвоподобном субстрате численности всех групп микроорганизмов в различных вариантах опыта.
Солома пшеницы, микробиота почвоподобного субстрата, индикаторные группы микроорганизмов, минерализация
Короткий адрес: https://sciup.org/14082966
IDR: 14082966 | УДК: 574.34+579.64
Текст научной статьи Зависимость микробиоты почвоподобного субстрата от способа обработки соломы пшеницы
Введение. Работы по созданию биолого-технических систем жизнеобеспечения (БТСЖО) человека начались в нашей стране в середине XX в. [2, 5]. Ранее несъедобные растительные отходы выносились из системы. Увеличение замкнутости БТСЖО по массообмену возможно за счет включения отходов растений в круговорот веществ в системе [10; 12; 13].
N.S. Manukovsky и другими [11] предложена переработка растительных отходов в почвоподобный субстрат (ППС) с достаточно высоким плодородием, позволяющим культивировать на нем растения в искусственных условиях.
Ю.А. Куденко и Р.А. Павленко [3] разработали метод окисления отходов растений и человека перекисью водорода в электромагнитном поле, позволяющим получить питательные растворы для выращивания высших растений.
Оценка воздействия обработанной различными способами пшеничной соломы на индикаторные группы микроорганизмов в почвоподобном субстрате для выращивания высших растений являлась целью нашей работы .
Материалы и методы . При изучении влияния способа обработки соломы на индикаторные группы микроорганизмов объектом исследований являлась микробиота почвоподобного субстрата, на котором выращивали культуру редиса RaphanussativusL . Растения редиса (сорт Вировский белый) культивировали в вегетационной камере при нормальной концентрации СО 2 , круглосуточном освещении и температуре воздуха, равной 240С. Для освещения использовали лампы ДМ-3. Растения выращивали в вегетационных сосудах из нержавеющей стали объемом 5 л и поверхностью 0,032 м2, в каждом – 700 г ППС (в расчете на сухую массу, 21,88 кг/м2). Редис убирали в 30-суточном возрасте, так как он отличается быстрыми темпами роста. Фоном служила проба ППС без растений редиса и обработанной пшеничной соломы.
В период проведения эксперимента перед посевом семян редиса в каждый вегетационный сосуд с почвоподобным субстратом вносили несъедобную биомассу – 40 г соломы пшеницы, обработанной одним из следующих способов:
-
1. Солому пшеницы минерализовали физико-химическим способом по методу Ю.А. Куденко и Р.А. Павленко [3]. Полученный раствор в течение всего периода вегетации равномерно добавляли в ирригационный раствор для полива растений.
-
2. Вносили в ППС сухую пшеничную солому, не подвергавшуюся какой-либо обработке.
-
3. Солому предварительно замачивали, выдерживали в термостате при температуре 50 ° С, отжимали и отжим равномерно добавляли в ирригационный раствор для полива в процессе вегетации редиса.
В работе использованы общепринятые методы посева, выделения и учета микроорганизмов [7, 8]. Для получения более полного представления о качественном и количественном составе микробиоты ППС пробы брали из среднего слоя субстрата (с глубины 5–10 см) из нескольких точек в стерильную чашку Петри, затем перемешивали и стерильно отбирали среднюю пробу для разведений.
Статистическая обработка данных проведена по Г.Ф. Лакину [4] с помощью программы Microsoft Excel. Влияние различных методов обработки вносимой соломы пшеницы оценивали по критерию достоверности различий между численностью микроорганизмов в исследуемых пробах. Критерием оценки служила стандартная величина нормированного отклонения (t Стьюдента ), с которой сравнивалось фактическое значение этого критерия (t эксп ) для р<0,05, р<0,01, р<0,001.
Результаты исследований и их обсуждение. Для определения возможных причин угнетения или усиления роста микроорганизмов в почвоподобном субстрате была сделана водная вытяжка соломы и в ней с помощью масс-спектрометра были идентифицированы органические вещества, растворимые в хлороформе (табл. 1).
Органические соединения, входящие в состав водной вытяжки соломы
Таблица 1
|
Соединение |
Содержание в 500 мл отжима*, мг |
|
Фенольные соединения, всего |
40,453 |
|
Углеводороды |
10,186 |
|
4-метифениловый эфир уксусной кислоты |
8,022 |
|
Фталаты |
7,711 |
|
3, 5, 5-триметил-4 (3-оксибутил)-2-циклогексен-1-он |
4,587 |
|
Прочие органические соединения |
34,246 |
|
Всего |
105, 205 |
Примечание: * или 100 г соломы.
В таблице 1 представлено содержание в вытяжке ряда соединений фенольной природы, количество которых в почвоподобном субстрате может существенно возрастать при микробиологическом разложении лигнина, содержащегося в соломе.
Действие фенолов неспецифично и обусловливается их содержанием в среде. В низких концентрациях они могут стимулировать эти процессы, а в высоких – тормозить и полностью подавлять [1,6].
В таблице 2 показано изменение численности индикаторных групп микроорганизмов в ППС, выделенных на плотных питательных средах.
Численность микроорганизмов в почвоподобном субстрате в зависимости от способа обработки соломы
Таблица 2
|
Группа микроорганизмов |
Вариант опыта* |
|||
|
Фон |
1-й |
2-й |
3-й |
|
|
Бактерии, усваивающие органический азот, 1×106 |
0,55 ± 0,07 |
4,88 ± 0,71 |
4,51 ± 0,41 |
4,37 ± 0,41 |
|
Бактерии группы кишечной палочки, 1×103 |
8,93 ± 0,91 |
13,56 ± 1,31 |
4,32 ± 0,48 |
7,94 ± 1,08 |
|
Фитопатогенные бактерии, 1×103 |
8,93 ± 0,65 |
6,09 ± 0,58 |
18,79 ± 0,29 |
13,89 ± 0,25 |
|
Бактерии-анаэробы, 1×104 |
1,15 ± 0,10 |
1,58 ± 0,12 |
1,65 ± 0,17 |
2,44 ± 0,18 |
|
Микроскопические грибы, 1×103 |
3,57 ± 1 |
9,14 ± 1,85 |
12,51± 0,88 |
18,55 ± 0,33 |
|
Бактерии, усваивающие минеральный азот, 1×105 |
4,47 ± 0,25 |
7,62 ± 0,25 |
1,88 ± 0,25 |
1,98 ± 0,25 |
* 1 – солома, минерализованная физико-химическим методом; 2 – сухая солома; 3 – предварительно замоченная солома.
Полученные данные свидетельствуют о зависимости численности исследованных групп микроорганизмов в ППС от способа обработки пшеничной соломы. Наименьшее количество микроорганизмов выявлено в фоне (см. табл. 2), что, видимо, вызвано отсутствием питательных веществ, поступающих с корневыми выделениями растений редиса.
По сравнению с фоном внесение в почвоподобный субстрат соломы пшеницы, обработанной любым из трех способов, увеличило количество бактерий, усваивающих органический азот (см. табл. 2).
Высокая численность бактерий группы кишечной палочки (БГКП) в варианте с минерализованной физико-химическим методом соломой пшеницы является результатом присутствия в растворе легкодоступных для бактерий форм азота [3]. Снижение численности БГКП в варианте с высушенной соломой может свидетельствовать об отсутствии необходимых питательных веществ для роста бактерий.
По сравнению с фоном внесение высушенной соломы в почвоподобный субстрат привело к росту численности фитопатогенных бактерий и микроскопических грибов (см. табл. 2).
Замачивание соломы перед внесением в ППС способствовало значимому увеличению численности фитопатогенных бактерий, бактерий-анаэробов и микроскопических грибов.
Достоверность изменений численности исследованных групп микроорганизмов приведена в таблице 3.
Таблица 3
Критерий достоверности различий (tэксп*) между численностью микроорганизмов в фоне и разных вариантах опыта
|
Группа микроорганизмов |
Вариант опыта |
||
|
1-й |
2-й |
3-й |
|
|
Бактерии, усваивающие органический азот |
4,19 |
4,63 |
4,75 |
|
Бактерии группы кишечной палочки |
2,90 |
4,48 |
0,70 |
|
Фитопатогеные бактерии |
3,26 |
13,85 |
7,12 |
|
Бактерии-анаэробы |
2,75 |
2,54 |
6,26 |
|
Микроскопические грибы |
2,65 |
6,95 |
14,23 |
|
Бактерии, усваивающие минеральный азот |
8,91 |
7,33 |
7,04 |
* t эксп – критерий разности достоверен при t эксп ≥ t St ( t St = 2,78 для р = 0,05; t St = 4,60 для р = 0,01; t St = 8,61 для р = 0,001). Варианты опыта: см. табл.2.
На рисунке 1 показано соотношение общего количества бактерий, усваивающих органический азот, и спорообразующих бактерий в стадии спор.
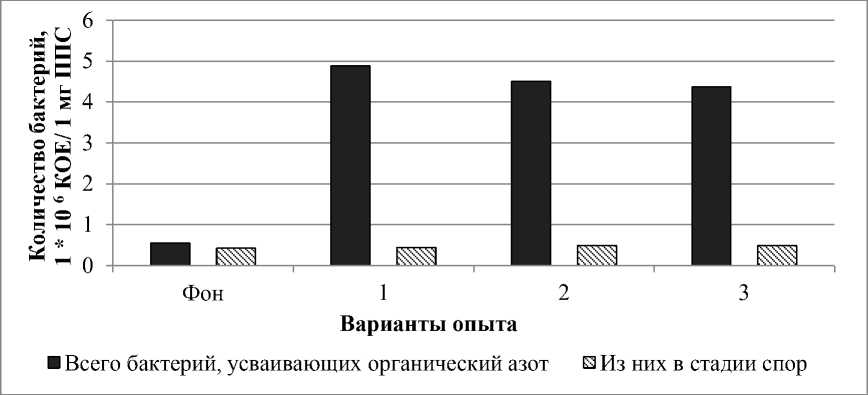
Рис. 1. Численность бактерий в зависимости от способа обработки соломы пшеницы: 1 – солома, минерализованная физико-химическим методом; 2 – сухая солома; 3 – предварительно замоченная солома. КОЕ – колониеобразующие единицы
Количество споровых бактерий в стадии спор между вариантами опыта и фоном достоверно не отличалось (см. рис. 1). В фоне на момент отбора проб основную массу бактерий, усваивающих органический азот, составляли бактерии в стадии спор (до 76 %), тогда как в вариантах опыта с добавлением соломы пшеницы их в среднем было 10 %.
Полагаем, что внесение переработанной соломы пшеницы любым из использовавшихся способов
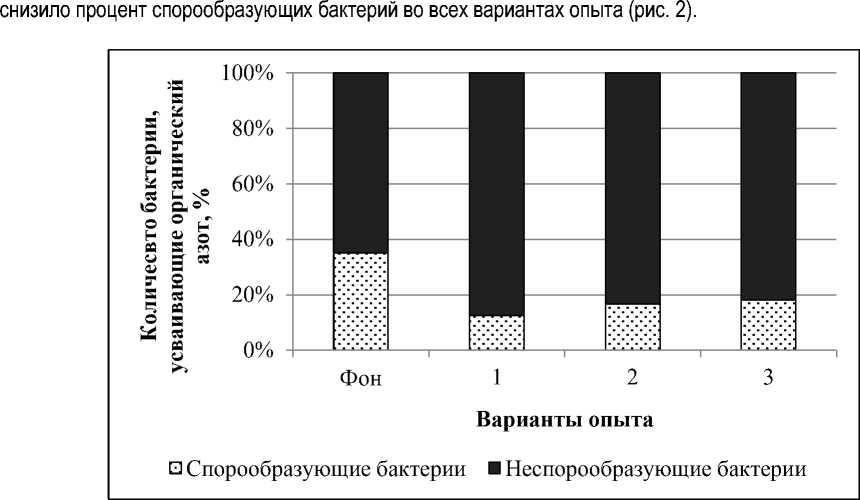
Рис. 2. Численность бактерий, усваивающих органический азот, в зависимости от способа обработки соломы пшеницы: обозначения см. рис. 1
Предполагаем, что высокий процент спорообразующих бактерий в фоне (см. рис. 2) указывает на присутствие большего количества трудноокисляемых органических веществ, чем в других вариантах опыта.
В таблице 4 представлены данные об изменении численности физиологических групп микроорганизмов, выделенных на жидких питательных средах.
Таблица 4
Численность микроорганизмов в почвоподобном субстрате на жидких питательных средах в зависимости от способа обработки соломы
|
Вариант опыта |
Микроорганизмы |
|||
|
Аммонифицирующие, 1×105 |
Денитрифицирующие |
Целлюлозоразрушающие, 1×103 |
||
|
косвенные, 1×103 |
истинные, 1×103 |
|||
|
Фон |
13,40 |
44,70 |
2,23 |
2,23 |
|
1 |
7,62 |
7,62 |
0,08 |
3,77 |
|
2 |
93,90 |
35,70 |
0,28 |
28,18 |
|
3 |
179,00 |
9,93 |
3,77 |
9,14 |


