Зависимость спина основного состояния активного центра Fe 2S 2 ферредоксина от ориентации лигандов
Автор: Лыхин А.О., Кузубов А.А., Варганов С.А., Сержантова М.В., Елисеева Н.С.
Журнал: Сибирский аэрокосмический журнал @vestnik-sibsau
Рубрика: Математика, механика, информатика
Статья в выпуске: 4 (44), 2012 года.
Бесплатный доступ
В рамках теории функционала плотности рассмотрено строение окисленной формы кластера [2Fe-2S-4(SCH 3)] 2-, являющегося аналогом активного центра белка ферредоксина. Показана возможность неадиабатических спин-запрещенных переходов между конформерами кластера, находящимися в синглетном и триплетном спиновых состояниях. Полученные переходные структуры могут быть использованы при изучении механизма реакций кластера с участием вырожденных спиновых состояний.
Ферредоксин, неадиабатические процессы, теория функционала плотности
Короткий адрес: https://sciup.org/148176913
IDR: 148176913
Текст научной статьи Зависимость спина основного состояния активного центра Fe 2S 2 ферредоксина от ориентации лигандов
Широко используемое в квантовой химии адиабатическое приближение предполагает расчет энергии структуры при фиксированных положениях ядер атомов и нахождении системы в основном электронном состоянии. Однако в ряде случаев разница между основным и возбужденным состоянием может быть достаточно мала, в результате чего становится возможным переход на поверхность потенциальной энергии возбужденного состояния. Изучение таких неадиабатических процессов является одной из наиболее актуальных задач в области динамики химических реакций [1; 2].
Описание спинового состояния системы играет особую роль в элементоорганической и бионеоргани-ческой химии [3]. В частности, давно известно, что изменение спинового состояния напрямую связано с протеканием реакций, в которых участвуют гемопротеины [4]. Все большее значение приобретает контроль спинового состояния в каталитических процессах, например с участием железа [5]. Реализация неадиабатических эффектов в системах с переходными металлами напрямую связана со спин-орбитальным взаимодействиям между электронными состояниями с разными спинами. В этой связи особое внимание уделяется рассмотрению железосодержащих белков, например ферредоксина. В качестве активного центра этого белка чаще всего выступает биядерный кластер [2Fe–2S], который связан с четырьмя цистеиновыми остатками, формирующими близкое к тетраэдрическому окружение для каждого атома Fe. Такая модель активного центра характеризуется заменой цистеиновых остатков на тиометильные группы.
Применение теории функционала плотности в моделировании структуры активного центра ферредоксина показало возможность существования окисленной формы кластера [2Fe–2S–4(SCH3)]2– в виде одной из 17 равновесных конформаций, отличающихся величиной двугранного угла, образуемого атомами Fe– Fe–S–C [6]. Однако кристаллографические данные строения белков свидетельствуют об отклонениях рассчитанных значений углов в газовой фазе от экспериментальных, что, по мнению авторов, связано с аминокислотным окружением активного центра ферредоксина. Вместе с тем геометрические параметры системы оказывают определяющее влияние на спиновое состояние кластера, его нахождение в устойчивом, возбужденном или переходном состоянии. Установление возможности существования системы в вырожденном спиновом состоянии является важнейшим этапом на пути исследования механизма реакций, протекающих по неадиабатическому спин-запре-щенному механизму [7].
На основании квантово-химических расчетов, приведенных в [6], были рассмотрены пять наиболее энергетически выгодных структур окисленной формы кластера [2Fe–2S–4(SCH 3 )] 2– , отличающихся величинами двугранных углов Fe–Fe–S(Cys)–C, где S(Cys) – терминальные атомы серы. Моделирование отобранных конформеров выполнялось в рамках теории функционала плотности в квантово-химическом пакете GAMESS [8]. При расчетах использовался обменно-корреляционный функционал PBE [9] в базисном наборе def2-TZVP [10]. Выбор этого базисного набора был обусловлен высокой точностью приближения, характеризующегося стандартным отклонением в энергии атомизации на атом, равным 0,022 эВ при средней ошибке в длине связи менее 1 пм, и отклонением в величине угла менее 1º.
Оптимизация конформеров проводилась без наложения ограничений по симметрии до достижения стандартного критерия сходимости. Были рассмотрены конформеры в антиферромагнитном состоянии (S = 0) и триплетном спиновом состоянии. Для наиболее энергетически выгодных конформеров также рассчитывались состояния с более высокой мультиплет-ностью.
Геометрические параметры полученных конформеров представлены в табл. 1.
Атомы железа и связанные с ними мостиковые атомы серы S3 и S4 расположены практически в одной плоскости. Выход атома серы из плоскости трех атомов не превышает 4º (рис. 1). Для описания двугранных углов введен фиктивный атом X, такой, что прямая, проходящая через атомы X и Fe2, перпендикулярна прямым Fe1–Fe2 и S3–Fe2. Таким образом, два атома железа и фиктивный атом X вместе образуют плоскость σ, перпендикулярную к плоскости Fe1–Fe2–S3.
Таблица 1
|
№ конформера |
Атом |
φ1 |
Abs |
Атом |
φ2 |
Abs |
φ3 |
|
Синглетное спиновое состояние |
|||||||
|
A1 |
S5 |
23 |
23 |
C9 |
176 |
4 |
0,04 |
|
S6 |
–157 |
23 |
C10 |
–3 |
3 |
||
|
S7 |
23 |
23 |
C11 |
–174 |
6 |
||
|
S8 |
–157 |
23 |
C12 |
3 |
3 |
||
|
B1 |
S5 |
–24 |
24 |
C9 |
176 |
4 |
0,2 |
|
S6 |
158 |
22 |
C10 |
0 |
0 |
||
|
S7 |
22 |
22 |
C11 |
177 |
3 |
||
|
S8 |
–156 |
24 |
C12 |
–2 |
2 |
||
|
C1 |
S5 |
–27 |
27 |
C9 |
154 |
26 |
2,1 |
|
S6 |
142 |
38 |
C10 |
118 |
62 |
||
|
S7 |
21 |
21 |
C11 |
–5 |
5 |
||
|
S8 |
–157 |
23 |
C12 |
–3 |
3 |
||
|
D1 |
S5 |
–2 |
2 |
C9 |
–112 |
68 |
0,3 |
|
S6 |
176 |
4 |
C10 |
19 |
19 |
||
|
S7 |
–5 |
5 |
C11 |
120 |
60 |
||
|
S8 |
177 |
3 |
C12 |
120 |
60 |
||
|
E1 |
S5 |
3 |
3 |
C9 |
112 |
68 |
1,0 |
|
S6 |
–175 |
5 |
C10 |
–18 |
18 |
||
|
S7 |
–3 |
3 |
C11 |
124 |
56 |
||
|
S8 |
176 |
4 |
C12 |
118 |
62 |
||
|
X1 |
S5 |
4 |
4 |
C9 |
117 |
63 |
1,7 |
|
S6 |
–174 |
6 |
C10 |
125 |
55 |
||
|
S7 |
5 |
5 |
C11 |
25 |
25 |
||
|
S8 |
–174 |
6 |
C12 |
30 |
30 |
||
|
A3 |
S5 |
Три 0 |
плетное спиново 0 |
е состояние C9 |
–109 |
71 |
3,5 |
|
S6 |
177 |
3 |
C10 |
23 |
23 |
||
|
S7 |
–11 |
11 |
C11 |
173 |
7 |
||
|
S8 |
165 |
15 |
C12 |
–3 |
3 |
||
|
B3 |
S5 |
5 |
5 |
C9 |
108 |
72 |
3,4 |
|
S6 |
–173 |
7 |
C10 |
–19 |
19 |
||
|
S7 |
17 |
17 |
C11 |
–176 |
4 |
||
|
S8 |
–159 |
21 |
C12 |
4 |
4 |
||
|
C3 |
S5 |
5 |
5 |
C9 |
118 |
62 |
1,3 |
|
S6 |
–174 |
6 |
C10 |
125 |
55 |
||
|
S7 |
18 |
18 |
C11 |
6 |
6 |
||
|
S8 |
–162 |
18 |
C12 |
7 |
7 |
||
|
D3 |
S5 |
–4 |
4 |
C9 |
–116 |
64 |
0,7 |
|
S6 |
175 |
5 |
C10 |
26 |
26 |
||
|
S7 |
–16 |
16 |
C11 |
133 |
47 |
||
|
S8 |
165 |
15 |
C12 |
134 |
46 |
||
|
E3 |
S5 |
3 |
3 |
C9 |
116 |
64 |
0,3 |
|
S6 |
–176 |
4 |
C10 |
103 |
77 |
||
|
S7 |
16 |
16 |
C11 |
135 |
45 |
||
|
S8 |
–165 |
15 |
C12 |
131 |
49 |
||
Окончание табл. 1
|
№ конформера |
Атом |
φ1 |
Abs |
Атом |
φ2 |
Abs |
φ3 |
|
Переходное спиновое состояние |
|||||||
|
I |
S5 |
5 |
5 |
C9 |
118 |
62 |
1,5 |
|
S6 |
–174 |
6 |
C10 |
125 |
55 |
||
|
S7 |
14 |
14 |
C11 |
12 |
12 |
||
|
S8 |
–166 |
14 |
C12 |
14 |
14 |
||
|
II |
S5 |
5 |
5 |
C9 |
119 |
61 |
1,4 |
|
S6 |
–173 |
7 |
C10 |
125 |
55 |
||
|
S7 |
15 |
15 |
C11 |
20 |
20 |
||
|
S8 |
–166 |
14 |
C12 |
11 |
11 |
||
Примечание. В таблице приняты следующие обозначения: φ 1 – двугранный угол X–Fe1–Fe2–S(Cys); φ 2 – двугранный угол Fe–Fe–S(Cys)–C; φ 3 – двугранный угол Fe–Fe–S3–S4; Abs – абсолютное значение углов; все величины приведены в градусах.
Таблица 2
Относительные энергии оптимизированных структур
|
Структура |
E , ккал/моль |
Атомная спиновая плотность |
Спин S Z |
S 2 |
|
|
Fe1 |
Fe2 |
||||
|
A1 |
11,4 |
–0,367 |
0,365 |
0 |
2,266 |
|
A3 |
5,5 |
–0,343 |
0,498 |
1 |
4,051 |
|
B1 |
11,0 |
–0,369 |
0,360 |
0 |
2,207 |
|
B3 |
5,5 |
–0,347 |
0,499 |
1 |
4,076 |
|
C1 |
1 865,9 |
–0,721 |
0,348 |
0 |
2,165 |
|
C3 |
3,8 |
–0,349 |
0,504 |
1 |
4,042 |
|
D1 |
0 |
–0,504 |
0,503 |
0 |
4,000 |
|
D3 |
9,0 |
–0,320 |
0,490 |
1 |
4,065 |
|
E1 |
0,1 |
–0,504 |
0,503 |
0 |
4,001 |
|
E3 |
9,4 |
–0,324 |
0,492 |
1 |
4,029 |
|
X1 |
0,9 |
–0,505 |
0,504 |
0 |
4,007 |
Двугранные углы φ 1 показывают отклонение плоскости Fe1–Fe2–S(Cys) от σ, в свою очередь двугранные углы φ 2 Fe–Fe–S(Cys)–C характеризуют выход углерода из плоскости, формируемой атомами железа и терминальным атомом серы, с которым углерод непосредственно связан. При определении углов φ 2 первый атом железа выбран как наиболее удаленный от атома углерода. В соответствии с нумерацией атомов в соединении к терминальным атомам серы S(Cys) относятся атомы S5 и S6, связанные с Fe1, а также S7 и S8, связанные с Fe2.
Согласно значениям, представленным в табл. 2, наиболее энергетически выгодную конфигурацию в синглетном спиновом состоянии имеют два конформера: D1 и E1, в триплетном состоянии – конформер C3.
В случае конформеров в синглетном состоянии распределение спиновой плотности на атомах железа свидетельствует об антиферромагнитном упорядочении спинов, при котором неспаренные электроны с одинаковыми спинами локализованы на разных атомах Fe. Рассчитанные спиновые плотности для Fe1 и Fe2 равны по абсолютным значениям и противоположны по знаку. Отклонение, наблюдаемое в случае конформера C1, обусловливает его высокую неустойчивость по сравнению с другими структурами.
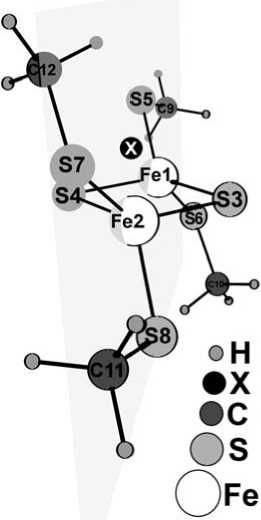
Рис. 1. Строение конформера A1 кластера [2Fe–2S–4(SCH 3 )]2–
Двугранные углы оптимизированных структур кластера [2Fe–2S–4(SCH3)]2–
Вместе с тем для конформеров в синглетном спиновом состоянии характерны исчезающе малые величины спиновой плотности на мостиковых атомах S – около 1 · 10 –4 электрон/атом, которые возрастают в среднем на два порядка при переходе системы в триплетное состояние. Значительная делокализация спиновой плотности проявляется лишь на мостиковых атомах S, в то время как у терминальных атомов S подобного эффекта не наблюдается. Используя значения квадратов длины вектора спинового момента, можно определить величину суммарного спинового числа, которая для значений S 2 , равных 4 и 2, округленно составит 3/2 и 1. Поскольку заряды атомов железа равны, то в случае S 2 ≈ 2 каждый из электронов локализуется на одном из атомов железа. При этом проекции спина у электронов направлены в противоположные стороны, что дает суммарную проекцию спина, равную 0. В случае S 2 ≈ 4 электронное облако третьего электрона делокализовано между атомами железа и мостиковыми атомами серы.
В соответствии с данными об относительной энергии состояний с различной мультиплетностью для структур фиксированной геометрии C3 и E1, пред-ставлеными на рис. 2, устойчивость состояний иной мультиплетности в сравнении со спиновым состоянием оптимизированной структуры ниже, что свидетельствует о том, что для конформеров C3 и E1 основными являются соответственно триплетное и синглетное спиновые состояния.

Рис. 2. Относительные энергии основных и высокоспиновых состояний конформеров C3 и E1 в сравнении с синглетным спиновым состоянием C3:
темные столбцы – исходный конформер E1; светлые столбцы – исходный конформер C3
Оптимизация геометрии конформеров C3 и E1 в состояниях с различной мультиплетностью приводит к понижению энергии высокоспиновых состояний. Однако в целом они остаются менее энергетически выгодными по сравнению с состояниями С3 и Е1 (рис. 3). При этом в случае оптимизации синглетного состояния структуры C3 получен конформер X1, близкий по энергии к конформерам D1 и E1 и вместе с тем имеющий геометрию, наиболее сходную со структурой C3 (см. табл. 1).
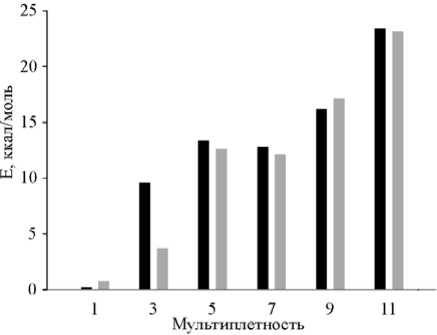
Рис. 3. Относительные энергии оптимизированных структур в сравнении с конформером E1 в синглетном состоянии: темные столбцы – исходный конформер E1; светлые столбцы – исходный конформер C3
Геометрические различия между конформерами C3 (S = 1) и X1 (S = 0) состоят в том, что внешние атомы серы одного из атомов железа выходят из плоскости σ при сохранении положения метильных групп (рис. 4). Таким образом, триплет-синглетный переход с изменением геометрии осуществляется за счет смещения внешних атомов серы, связанных с одним центром. С другой стороны, переходы между конформерами D1 или E1 и C3 зависят от перемещений как атомов S, так и связанных с ними CH 3 -групп.
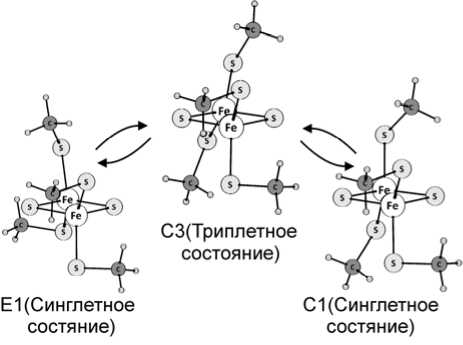
Рис. 4. Основные и высокоспиновые состояния конформеров C3 и E1 [2Fe–2S–4(SCH 3 )] 2– кластера
Переход между конформерами был разделен на 10 промежуточных геометрий. Плавное изменение положений атомов при переходе от одной структуры к другой достигалось путем интерполяции геометрических параметров системы во внутренних координатах [11] (рис. 5, 6).
Перегибы, наблюдаемые в случае C3–E1-перехода (см. рис. 6), связаны с вращением метильных групп. Геометрия, соответствующая пересечению кривых, использовалась в качестве исходной при поиске минимума энергии на пересечении синглетной и триплетной поверхностей потенциальной энергии. Поиск минимума проводился при помощи процедуры MEX пакета GAMESS по стандартным критериям. Полученные переходные состояния близки по геометрическим параметрам и отличаются лишь расположением одной метильной группы.
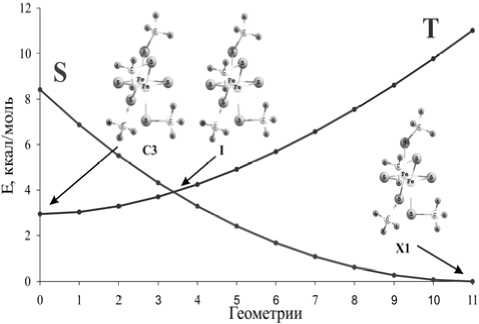
Рис. 5. Относительные энергии структур, характеризующие триплет-синглетный переход I:
геометрия 0 – конформер C3; геометрия 11 – конформер X1
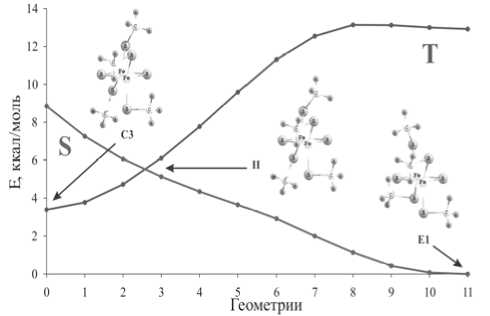
Рис. 6. Относительные энергии структур при триплет-синглетном переходе II:
геометрия 0 – конформер C3; геометрия 11 – конформер E1
В случае перехода II геометрия, отвечающая минимуму энергии на пересечении синглетной и триплетной поверхностей потенциальной энергии, оказалась ниже точки пресечения кривой на рис. 6 на 2,8 ккал/моль.
В результате разница между энергией конформера C3 в триплетном спиновом состоянии и энергией переходного состояния при переходах I и II равна 0,95 и 0,91 ккал/моль соответственно.
Таким образом, незначительные энергетические различия в полученных структурах обусловливают высокую вероятность переходов между устойчивой конформацией С3 в триплетном спиновом состоянии и конформерами E1 и X1 с одновременным понижением мультиплетности системы до синглетного состояния. Подобные переходы являются очень важными в процессах спин-орбитального взаимодействия. При воздействии на геометрические параметры модельного кластера активного центра ферредоксина [2Fe–2S–4(SCH 3 )] 2– , в частности положения лигандов, можно достичь изменения мультиплетности системы. С одной стороны, такие переходы обусловливают возможность существования кластера в различных спиновых состояниях, с другой – открывают широкие возможности по их применению в спин-запрещенном неадиабатическом катализе.


