Зависимость уровня белка-транслокатора TSPO и цитохрома Р450scc от гистотипа опухоли у больных почечно-клеточным раком
Автор: Зуков Р.А., Рукша Т.Г., Дыхно Ю.А., Семенов Э.В., Боякова Н.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 (57), 2013 года.
Бесплатный доступ
Описаны особенности экспрессии белка-транслокатора (TSPO) и цитохрома P450scc (CYP 450scc) у больных почечно-клеточным раком (ПКР). Установлена зависимость уровня экспрессии TSPO от стадии и гистологического варианта рака почки. Изменение уровня экспрессии CYP 450scc в клетках опухоли свидетельствует об изменении выраженности стероидогенеза при различных гистотипах ПКР. Полученные данные важны для понимания патогенеза рака почки, а также могут иметь прогностическое значение.
Почечно-клеточный рак, цитохром p450scc, стероидогенез
Короткий адрес: https://sciup.org/14056332
IDR: 14056332 | УДК: 616-006-092.18:547.96
Текст научной статьи Зависимость уровня белка-транслокатора TSPO и цитохрома Р450scc от гистотипа опухоли у больных почечно-клеточным раком
Translocator protein (TSPO) с молекулярной массой 18 кДа – внутриклеточный белок, участвующий в большинстве основных процессов жизнедеятельности клетки: стероидогенезе, иммунном ответе, стресс-адаптации, клеточной пролиферации и апоптозе [1, 7, 9, 18]. Наиболее изученной функцией TSPO является его участие в транспорте низкомолекулярных клеточных метаболитов, в том числе холестерина, через внешнюю митохондриальную мембрану. Транспорт холестерина является ключевым звеном в синтезе стероидных гормонов [8]. После перемещения к внутренней митохондриальной мембране холестерин преобразуется в прегненолон под действием фермента цитохром Р450scc (СYP450scc) и вспомогательных электрон-транспортирующих белков, локализующихся на матричной поверхности внутренней митохондриальной мембраны. Синтезированный прегненолон транспортируется из митохондрий в эндоплазматический ретикулум клетки, где подвергается ферментативному воздействию, что является окончательным этапом синтеза стероидных гормонов [17].
Уровень TSPO повышается при многих злокачественных новообразованиях, что объясняют усиленным метаболизмом холестерина для пластических нужд трансформированных клеток с высоким пролиферативным потенциалом [15]. В этой связи в нашей работе исследованы особенности экспрессии TSPO и фермента, метаболизирующего холестерин на начальном этапе стероидогенеза у больных почечно-клеточным раком (ПКР) с целью изучения регуляторных механизмов развития, прогрессирования и метастазирования опухоли, а также для определения возможности использования данных белков в качестве молекулярных мишеней для прогнозирования и лечения данного заболевания.
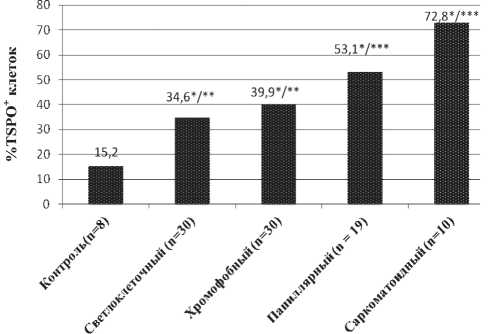
Рис. 1. Уровень экспрессии TSPO при различных гистологических вариантах ПКР. Примечание: * – статистически значимые различия по сравнению с контролем (α <0,05); ** – статистически значимые различия по сравнению с саркоматоидным и папиллярным вариантами ПКР (α <0,05); *** – статистически значимые различия по сравнению с другими гистологическими вариантами
ПКР (α <0,05)
Материал и методы
Под наблюдением находились 89 больных ПКР, оперированных в объеме радикальной нефрэктомии (n=79) или резекции почки (n=10). Полученная во время операции ткань почки фиксировалась в 10 % растворе формалина, заливалась в парафин, после чего изготавливались срезы для иммуногистохимического окрашивания. В качестве контроля использовалась ткань здоровой почки (n=8). Образцы подвергались морфологическому исследованию для определения стадии заболевания и гистологического варианта ПКР. Параллельно срезы толщиной до 5 мкн окрашивались по стандартной методике с моноклональными антителами к TSPO (Trevigen, разведение 1:400) и CYP450scc (Corgen Inc., разведение 1:500). Для выполнения иммуногистохимического протокола использова- лась система NovoLink Polymer Detection System (Leica Microsystems, Newcastle, United Kingdom). На последнем этапе препараты докрашивались гематоксилином. Подсчет положительно окрашенных клеток производился при ×400. При ПКР оценивалось количество положительно окрашенных клеток на 100 опухолевых клеток, в контроле – на 100 клеток нормальной почечной ткани.
Статистическая обработка осуществлялась с помощью критерия Н-Крускала–Уоллеса.
Результаты и обсуждение
Среди наблюдаемых больных ПКР были 42 (47,2 %) женщины и 47 (52,8 %) мужчин. Возраст пациентов составил 42–82 года. При морфологическом исследовании I стадия заболевания выявлена у 12,4 % больных, III стадия – у 70,8 % и IV стадия – у 16,8 %. Гистологически определялись следующие варианты ПКР: светлоклеточный (n=30), хромофобный (n=30), папиллярный (n=19), саркоматоидный (n=10). Достоверных различий в уровне экспрессии TSPO и цитохрома Р450scc в зависимости от пола и возраста выявлено не было. Распределение уровня экспрессии TSPO и цитохрома Р450scc в нормальной почечной ткани и опухолевых очагах в зависимости от стадии ПКР представлено в таблице.
Уровень экспрессии TSPO в зависимости от гистотипа ПКР распределился следующим образом: в контрольной группе – 15,2 %; при светлоклеточном ПКР – 34,6 %, при хромофобном ПКР – 39,9 %, при папиллярном ПКР – 53,1 %, при саркоматоидном ПКР – 72,8 %. Различия между уровнем TSPO+ клеток при всех вариантах ПКР и в контроле, а также между светлоклеточным, хромофобным, папиллярным и саркоматоидным вариантами были статистически значимы ( α <0,05). Не выявлено достоверных различий между светлоклеточным и хромофобным вариантами ПКР (рис. 1).
Таблица
Уровень экспрессии TSpO и цитохрома р450scc у больных ПКр в зависимости от стадии заболевания
|
Группы больных |
TsPO+ |
Цитохром Р450scc+ |
|
Контрольная группа (n=8) |
15,2 % |
98,6 % |
|
ПКР I стадии (n=11) |
47,3 %* |
74,2 %* |
|
ПКР III стадии (n=63) |
40,5 %* |
67,9 %* |
|
ПКР IV стадии (n=15) |
60,3 %* ** |
66,7 %* |
Примечание: * – статистически значимые различия по сравнению с контрольной группой ( α <0,05); ** – статистически значимые различия по сравнению с другими стадиями ПКР ( α <0,05).
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2013. № 3 (57)
Известно, что повышение экспрессии TSPO характерно для злокачественных новообразований молочной железы, простаты, толстой кишки, эндометрия, яичников, центральной нервной системы [2, 7, 9]. Повышение экспрессии TSPO наиболее выражено в опухолях и линиях раковых клеток, обладающих высоким злокачественным потенциалом [8, 9]. Так, уровень экспрессии TSPO значительно повышен при простатической интраэпителиальной неоплазии, первичном раке простаты и метастазах по сравнению с нормальной тканью простаты и доброкачественной гиперплазией предстательной железы. Кроме того, уровень TSPO коррелирует с частотой прогрессирования рака простаты, поскольку уровень белка прямо пропорционально повышается с ростом баллов по шкале Gleason и распространенностью опухоли [7, 9, 12].
Внутриклеточная локализация TSPO связана преимущественно с митохондриями, но при этом данный белок также выявлен в аппарате Гольджи, лизосомах, пероксисомах, ядре и плазматической мембране [18]. Немаловажным для оценки результатов нашего исследования является тот факт, что TSPO, меченные с помощью антител и флуоресцентных лигандов, локализуются в агрессивных опухолях в основном в ядре или вокруг него, а в нормальных клетках и слабоагрессивных опухолях преобладает цитоплазматическая локализация [10]. Учитывая биологические особенности ПКР, а также его высокую метастатическую активность, мы также наблюдали TSPO+ клетки в опухолевых очагах и нормальной почечной ткани с преимущественно ядерной локализацией.
Нами установлено повышение уровня экспрессии TSPO у больных ПКР в сравнении с экспрессией данного белка в нормальной почечной ткани, что свидетельствует о нарушении его функционирования в опухолевых очагах. Кроме того, интересные данные получены при сопоставлении уровня экспрессии TSPO при различных стадиях и гистологических вариантах ПКР. Так, установлена зависимость уровня экспрессии TSPO от стадии опухолевого процесса: у больных с IV стадией ПКР отмечаются более высокие показатели экспрессии белка, чем при I и III стадиях заболевания (таблица). Зависимость уровня экспрессии TSPO от распространенности опухолевого процесса продемонстрирована у больных раком молочной железы: помимо значительного повышения экспрессии TSPO в опухолевых клетках по сравнению с нормальной тканью молочной железы, показана отрицательная корреляция между уровнем TSPO и безрецидивной выживаемостью у пациенток без метастазов в лимфоузлы [8]. У больных колоректальным раком доказано прогностическое значение гиперэкспрессии TSPO при III стадии заболевания, в то же время при IV стадии такой корреляции не выявлено [13].
Различия между уровнем TSPO+ клеток установлены нами при различных гистологических вариантах ПКР. Самый высокий уровень TSPO+ клеток определен при саркоматоидном варианте (72,7 %), промежуточное значение имеет папиллярный рак (53,1 %), наиболее низкий уровень экспрессии TSPO установлен при светлоклеточном (34,6 %) и хромофобном (39,9 %) вариантах рака почки. Полученные данные об уровне экспрессии TSPO сопоставимы с прогностической значимостью гистотипов ПКР. Одни авторы отмечают наиболее благоприятный прогноз у пациентов с хромофобным ПКР по сравнению с папиллярным и светлоклеточным вариантами [16], другие исследователи описывают менее благоприятный прогноз у больных со светлоклеточным вариантом по сравнению с папиллярным и хромофобным [5]. Наличие саркоматоидного характера опухоли во всех доступных исследованиях ассоциировано с крайне неблагоприятным прогнозом [5, 14].
Уровень экспрессии цитохрома Р450scc при всех гистологических вариантах ПКР отличался от уровня экспрессии данного фермента в нормальной почечной ткани. Кроме того, статистически значимо ( α <0,05) отличалось распределение уровня цитохром Р450scc+ клеток при хромофобном раке почки в сравнении с другими вариантами, а также между папиллярным и саркоматоидным типами ПКР (рис. 2).
Повышение уровня экспрессии цитохрома Р450scc (98,6 %) на фоне низкого уровня TSPO+ клеток (15,2 %) в нормальной почечной ткани может являться свидетельством того, что большая часть холестерина, транспортируемого в клетки почечного эпителия в норме, метаболизируется в прегненолон. Действительно, было показано, что в нормальной почечной ткани возможен синтез стероидных гормонов, хотя биологический смысл данного факта является неизученным [6].
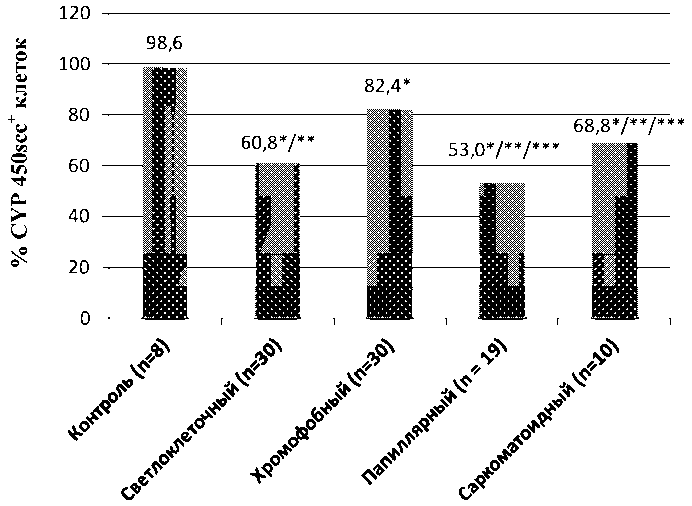
Рис. 2. Уровень экспрессии цитохрома Р450scc при различных гистологических вариантах ПКР. Примечание: * – статистически значимые различия по сравнению с контролем (α<0,05);
** – статистически значимые различия между хромофобным и другими гистологическими вариантами ПКР (α<0,05);
*** – статистически значимые различия между папиллярным и саркоматоидным вариантами ПКР (α<0,05)
Снижение уровня экспрессии цитохрома Р450scc в клетках почечно-клеточного рака, вероятнее всего, говорит о подавлении стероидогенеза в опухолевых очагах. Причем уровень его не зависит от стадии ПКР, однако отмечается влияние гистологического варианта на распределение цитохром Р450scc+ клеток. Наиболее высокий уровень экспрессии цитохрома Р450scc определяется при хромофобном варианте (82,4 %), промежуточное значение имеет светлоклеточный рак (60,8 %), наиболее низкий уровень экспрессии фермента установлен при папиллярном варианте рака почки (53 %). Однозначно интерпретировать данные при саркоматоидном варианте ПКР невозможно, поскольку он не является самостоятельным гистологическим подтипом и в той или иной степени может встречаться при любых гистологических формах ПКР, одновременно указывая на неблагоприятный прогноз [5, 14].
Несмотря на наличие достаточного количества убедительных данных об изменении уровней экспрессии TSPO при многих видах злокачественных новообразований, роль TSPO в канцерогенезе остается невыясненной. Предполагается, что TSPO может служить транспортером холестерина в опухолевые клетки, которые, как известно, обладают высокой способностью к аккумуляции и метаболизму последнего, что может быть обусловлено как по- вышением пластических процессов в опухолевых клетках, так и изменениями механизмов передачи сигнала в клетку через биологические мембраны [4]. С другой стороны, показано, что уровень TSPO модулируется митоген-активируемыми протеинки-назами, МАРК сигнальным механизмом, активация которого происходит при развитии ряда онкологических заболеваний [3]. Известно, что стероидные гормоны могут изменять уровень клеточной пролиферации, регулировать выраженность апоптоза, а также прогрессию и метастазирование опухолевых клеток и, таким образом, патологическая гиперактивация МАРК может приводить к повышению синтеза стероидных гормонов, в свою очередь, выступающих в качестве регуляторов вышеуказанных патологических процессов [11].
Таким образом, у больных ПКР нарушено функционирование TSPO и функционально связанного с ним белка-фермента, играющего важную роль в стероидогенезе, – цитохрома Р450scc. Выявленная зависимость уровня экспрессии TSPO от стадии и гистологического варианта в соотношении с клиническими данными позволяют предположить возможное использование TSPO в качестве молекулярной мишени для прогнозирования течения заболевания. Установленные особенности экспрессии цитохрома Р450scc в клетках опухоли свидетельствуют об изменении выраженности стероидогенеза при ПКР и возможном функциональном перераспределении внутриклеточного холестерина на обеспечение пролиферативных процессов. Дальнейшие исследования механизмов внутриклеточного транспорта холестерина с участием TSPO помогут пролить свет на патогенетические аспекты развития данного заболевания, особенности регуляции процессов пролиферации опухолевых клеток, а также понять механизмы прогрессирования и метастазирования почечноклеточного рака.


