Заживление тканей эвертированного анастомоза
Автор: Власов А.П., Власов П.А., Зайцев П.П.
Журнал: Хирургическая практика @spractice
Рубрика: Оригинальные исследования
Статья в выпуске: 4, 2017 года.
Бесплатный доступ
В эксперименте на 44 взрослых собаках оценен процесс заживления тканей по линии соустья, формированного различными швами: двухрядным инвер- тированным Ламберта-Альберта (n=12), однорядным инвертированным швом Пирогова-Матешука (n=12), однорядным оригинальным эвертированным швом (n=20). В клинике эвертированный шов применен при резекции желудка (n=35) и тонкой кишки (n=24). Установлено, что эвертированное соустье имеет достаточную прочность, оно надежно, при нем минимальны явления анастомозита, в техническом исполнении достаточно просто, не нуждаются в микрохирургической технике. Его применение позволяет адаптировать анастомозируемые отделы разных диаметров. При использовании однорядного эвертированного шва представляется возможным шире производить резекции желудка по Бильрот-I, так как этот способ анастомозирования не нужда- ется в объемной мобилизации двенадцатиперстной кишки, которую выполнить технически не всегда представляется возможным.
Резекция желудка, эвертированный анастомоз, эвертированный шов
Короткий адрес: https://sciup.org/142221821
IDR: 142221821 | УДК: 616.34
Текст научной статьи Заживление тканей эвертированного анастомоза
Материал и методы исследования
В основу работы положены результаты экспериментальных исследований и клинических наблюдений.
На 44 взрослых беспородных собаках под тиопентал-на-триевым наркозом (0,04 г/кг массы) выполнены исследования, в которых изучалось заживления гастродуоденального и межкишечного анастомоза, сформированного двухрядным швом Ламберта-Альберта (n=12), однорядным швом Пирогова-Мате-шука (n=12), эвертированного однорядного анастомоза (n=20).
Применялись следующие методики: макроскопия на аутопсии, световая микроскопия при окраске препаратов гема-токсилин-эозином, определение в тканевых структурах шовного валика окислительно-восстановительного потенциала (редокс-потенциала) для изучения электрогенеза, определение кровенаполнения тканей по линии швов соустья, определение физической герметичности швов (пневмопрессия) и индекса стенозирования (степень сужения) анастомоза.
Результаты исследования и их обсуждение
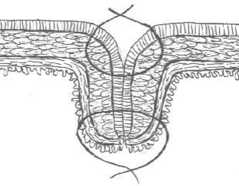
Рис. 1. Схема двухрядного кишечного анастомоза по Ламберу-Альберту
Установлено, что в раннем послеоперационном периоде в тканях соустья по ходу шовного валика имелись существенные нарушения структурных и функциональных параметров.
Через сутки после операции окислительно-восстановительный потенциал, являющийся интегральным показателем электрогенеза тканей, снижался до -70,1 ± 1,47 мВ (р<0,05). Изменялось и кровенаполнение тканей соустья, свидетельствующее о застое крови вследствие нарушенного оттока и развития выраженного воспаления. На вершине анастомоза объем крови достигал 1933,7 ± 62,17 мкл/г (р<0,05). В области соустья отмечалось резкое сужение.
Морфофункциональные изменения тканей внутреннего ряда швов в большинстве наблюдений носили необратимый характер, что проявлялось ишемическим краевым некрозом. Следствием выраженных патоморфологических явлений был анастомозит, который определялся микро- и макроскопически, а в ряде наблюдений и клинически. Эпителизация раневого дефекта замедлялась. В большинстве случаев заживление соустья протекало по типу вторичного натяжения. В целом в инвертированном двухрядном гастродуоденальном анастомозе наблюдалась вначале серозация раны и лишь затем ее эпители-зация. Такое несоответствие приводило к увеличению времени воздействия на ткани области соустья факторов агрессии желудочного сока, что создавало реальные предпосылки для возникновения анастомозита и несостоятельности швов.
В следующей опытной группе был апробирован шов Пиро-гова-Матешука. В формировании узлового серозно-мышечноподслизистого шва использовали викриловую нить (3/0 - 4/0).
Установлено, что аналогично двухрядному анастомозу в шовном валике определялись изменения морфологических и функциональных параметров. Однако следует подчеркнуть, что изменения в регистрированных показателях не были столь выраженными. Так, редокс-потенциал через сутки после оперативного вмешательства на вершине тканевого валика равнялся -51,9 ± 3,21 мВ (р<0,05). Через 3-5 суток после операции окислительно-восстановительный процесс тканей области анастомоза нормализовывался.
Менее выраженная воспалительная реакция по ходу шовного валика инвертированного однорядного соустья подтверждалась и исследованиями кровенаполнения тканей. В первые сутки после операции объем крови в тканях возрастал до 1437,2±61,89 мкл/г (р<0,05), а к 3-5 суткам после операции этот показатель приближался к исходным данным. Отсутствие массивного краевого некроза тканей по линии шва и быстрая смена воспалительно-дистрофической фазы регенерации в репаративную свидетельствовали об относительно благоприятном течении восстановительного процесса. Эпителизация раны, как и в случае с двухрядным инвертированным анастомозом, затягивалась. Однако следует отметить, что некротические процессы на вершине шовного валика были не столь выраженными. Поэтому в отличие от двухрядного анастомоза эпителизация раневого дефекта протекала быстрее.
Таким образом, экспериментальные исследования показали, что однорядный гастродуоденальный шов выглядит предпочтительней многорядного. Он обладает достаточной механической прочностью, не вызывает значительного сужения просвета пищеварительного тракта. Индекс стенозирования не превышал 48,07±5,78 %.
В следующей группе апробирован оригинальный однорядный эвертированный шов с широкой адаптацией подслизистой основы по А.П. Власову [2]. В формировании анастомоза также использовали викриловую нить (3/0 - 4/0). Перед наложением соустья по периметру анастомозируемых отделах скальпелем на глубину4-5 мм удаляется слизистая оболочка с сохранением подслизистой основы. Эта область и является основным адаптационным субстратом по линии швов (рис. 2).
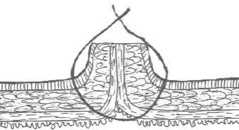
Рис. 2. Схема однорядного эвертированного кишечного анастомоза по А.П. Власову
Исследованиями установлены лучшие параметры репаративного процесса такого рода гастродуоденального соустья. Это обусловлено тем, что при таком варианте анастомозирования, как и при шве Пирогова-Матешука, морфофункциональные изменения тканей по линии раны были выражены незначительно. Так, через сутки после операции кровенаполнение тканей составило 1601,3±72,16 мкл/г (р<0,05). Окислительно-восстановительный потенциал уменьшался только до -47,7±1,32 мВ (р<0,05). К 3-5 суткам регистрированные показатели нормализовывались. В тканях соустья возникали незначительные по выраженности и продолжительности структурные изменения. Вследствие быстрой их регрессии заживление анастомоза протекало первичным натяжением. Причем по ранее выявленной закономерности: вначале восстановление структур стенки анастомозированных органов происходило на основании, а затем на вершине шовного валика соустья. Благодаря тому, что основание шовного валика эвертированного анастомоза приходится на слизистую оболочку, происходило быстрое восстановление ее тканевых структур. Уже к 3-5 суткам наблюдалась почти полная эпителизация раневого дефекта. В результате предотвращалось действие факторов агрессии желудочного сока на регенерирующие структуры соустья, что создавало оптимальные условия для заживления раны. Следовательно, восстановление защитных структур стенки пищеварительного тракта со стороны просвета органа обеспечивало ускоренное течение репаративных процессов и снижало вероятность возникновения гнойных послеоперационных осложнений.
Во многом аналогичные результаты получены при экспериментальной апробации исследованных способов анастомозирования в хирургии тонкой кишки.
Немаловажное преимущество эвертированной методики заключено и в том, что возможен качественный контроль гемостаза по линии швов, так как шовный валик доступен полному осмотру. Ориентация тканевого шовного валика в брюшную полость позволяет адаптировать анастомозируемые отделы разных диаметров. Положительным является и то, что эти оперативные вмешательства не нуждаются в микрохирургической технике, а успех операции в меньшей степени зависит от опыта и квалификации хирурга.
Способ применен и в хирургии тонкой кишки у 24 больных острой тонкокишечной непроходимостью, которым потребовалась резекция кишки. Также получены положительные результаты.
Выводы
Список литературы Заживление тканей эвертированного анастомоза
- Белоконев В.И. Определение показаний к наложению анастомозов и выведению кишечных стом у больных с перитонитом и острой кишечной непроходимостью / В.И. Белоконев, А.И. Федорин // Вестник Авиценны. - 2012. - № 3 (52). - С. 30-33
- Власов А.П. Кишечный шов в условиях нарушенного кровоснабжения (экспериментально-клиническое исследование)/А.П. Власов// Автореф. дисс …докт. мед. наук. - Самара, 1991. - 32 с
- Горский В.А. Проблема состоятельности кишечного шва/ В.А. Горский, М.А. Агапов, А.Е. Климов (и др.)// Практическая меди- цина. - Хирургия, 2015. - № 5 (81). - С. 35-40
- Курмашев А.Р. Экспериментально-морфологическое обоснование микрохирургических межкишечных анастомозов при острой обтурационной толстокишечной непроходимости / А.Р. Курмашев // Автореф. дисс… канд. мед. наук. - Оренбург, 2011. - 26 с.
- Маскин С. С. Диагностика, тактика и хирургическое лечение опухолевой обтурационной толстокишечной непроходимости: современное состояние проблемы/ С.С. Маскин, Я.В. Надельнюк, А.М. Карсанов //Вестник Волгоградского государственного медицинского университета. - 2008.-№ 3 (27). -С. 15-21
- Anderson S.L. Clinical evaluation of a closed, one-stage, stapled, functional, end-to-end jejuno-ileal anastomosis in 5 horses / S.L. Anderson, J.T. Blackford, S.G. Kelmer // Can Vet J. - 2012. - Sep. - Vol. 53. - Iss. 9. - P. 987-991
- Boscarelli A. Intestinal anastomosis in children: it's time for a general consensus / A. Boscarelli // Transl Pediatr. - 2017. - Jan. - Vol. 6. - Iss. 1. - P. 76-77
- Holzner P. Double 90 Degrees Counterrotated End-to-End- Anastomosis: An Experimental Study of an Intestinal Anastomosis Technique / P. Holzner, B. Kulemann, G. Seifert et al. // Eur J Pediatr Surg. - 2015. - Jun. - Vol. 25. - Iss. 3. - P. 269-276
- Груба Л.Н., Магомедов М.С., Василенко К.В., Лебедев И.С., Егиев В.Н. Опыт применения интраоперационной эндоскопии с целью раннего выявления и предотвращения осложнений анастомозов желудочно-кишечного тракта // Московский хирургический журнал. 2016. № 2 (48). С. 9-14
- Шабунин А.В., Тавобилов М.М., Карпов А.А. Сравнительный анализ результатов формирования панкреатодигестивных анастомозов // Московский хирургический журнал. 2016. № 1 (47). С. 5-10


