Здоровая микробиота и натуральное функциональное питание: гуморальный и клеточный иммунитет
Автор: Романчук Наталья Петровна
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 9 т.6, 2020 года.
Бесплатный доступ
Иммунная система человека и микробиота совместно эволюционируют, и их сбалансированное системное взаимодействие происходит в течение всей жизни. Эта тесная ассоциация и общий состав, и богатство микробиоты играют важную роль в модуляции иммунитета хозяина и могут влиять на иммунный ответ при вакцинации. Наличие инновационных технологий, таких как секвенирование следующего поколения и коррелированные инструменты биоинформатики, позволяют глубже исследовать перекрестные нейросетевые взаимосвязи между микробиотой и иммунными реакциями человека. Новая управляемая здоровая биомикробиота и персонализированное функциональное и сбалансированное питание «мозга и микробиоты» - это долговременная медицинская программа пациента, которая позволяет комбинированному применению питательной эпигенетики и фармэпигенетики, а главное проведению профилактики полипрагмазии. Функциональный продукт питания с помощью биомаркеров и технологий искусственного интеллекта является целевой питательной средой как для организма в целом, так и для биомикробиоты в частности. Факторы образа жизни и воздействия окружающей среды оставляют эпигенетические следы на нашей ДНК, которые влияют на экспрессию генов, некоторые из них оказывают защитное действие, а другие - вредное. Генетические и эпигенетические факторы обеспечивающие долголетие и сверхдолголетие, требуют от человека разумного нового взаимодействия с природой и обществом, и ответственности за будущие здоровые поколения. В исследованиях П. И. Романчук показано, что увеличение средней продолжительности жизни человека и нейроэндокринные изменения при физиологическом и патологическом старении, с одной стороны, эпигенетические факторы и электромагнитная информационная нагрузка/перегрузка, с другой стороны, внесли существенный вклад в циркадианную природу нейросетевого взаимодействия головного мозга человека с искусственным интеллектом. Микробиота представляет собой ключевой элемент, потенциально способный влиять на функции антигена вызывать защитный иммунный ответ и на способность иммунной системы адекватно реагировать на антигенную стимуляцию (эффективность вакцины), действуя в качестве иммунологического модулятора, а также природного адъюванта вакцины. Механизмы, лежащие в основе перекрестных помех между микробиотой кишечника и иммунной системой, играют решающее значение, особенно в раннем возрасте (ранняя микробиота кишечника формирует иммунологические функции). Новые взаимодействия, наряду с другими генетическими и экологическими факторами, приводят к определенному составу и богатству микробиоты, которые могут разнообразить индивидуальный ответ на прививки. Вариации в микробных сообществах могут отчасти объяснить географическую неоднородность успеха вакцинации, а глубокое понимание этой динамики может стать инструментом для совершенствования стратегий иммунизации.
Воспаление, клеточное старение, микробиота кишечника, микробиом, вакцины, иммунная система, иммунные ответы, секвенирование следующего поколения, функциональное питание, эпигенетическая и диетическая защита, долголетие
Короткий адрес: https://sciup.org/14117873
IDR: 14117873 | УДК: 616.83/.85:616.89+573.7.017.6+612.67/.68+575 | DOI: 10.33619/2414-2948/58/14
Текст обзорной статьи Здоровая микробиота и натуральное функциональное питание: гуморальный и клеточный иммунитет
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 616.83/.85:616.89+573.7.017.6+612.67/.68+575
Целью исследования является установить эффективность инновационных генетических и эпигенетических технологий, коррелированные инструменты биоинформатики и искусственного интеллекта, для нейросетевого взаимодействия между микробиотой и иммунными реакциями человека.
В настоящем исследовании рассмотрены следующие проблемы:
Новая современная эпигенетическая, микробиотическая и диетическая защита Homo sapiens и мозга H. sapiens , с помощью создания (культивирования) персонифицированной здоровой биомикробиоты.
Эффективность инновационных генетических и эпигенетических технологий, коррелированные инструменты биоинформатики и искусственного интеллекта, для нейросетевого взаимодействия между здоровой микробиотой и иммунными реакциями человека.
Новая управляемая здоровая биомикробиота и персонализированное функциональное и сбалансированное питание «мозга и микробиоты» — это долговременная медицинская программа пациента, которая позволяет комбинированному применению питательной эпигенетики и фармэпигенетики, а главное проведению профилактики полипрагмазии.
Функциональные продукты питания, здоровая биомикробиота, здоровый образ жизни и управляемое защитное воздействия окружающей среды, искусственный интеллект и электромагнитная информационная нагрузка/перегрузка – ответственны за работу иммунной системы и ее способности своевременного иммунного ответа на пандемические атаки.
Совершенствование стратегий иммунизации и географического успеха вакцинации, на биоинформационной платформе моделирования и управления с помощью искусственного интеллекта новыми инструментами и методами иммунной защиты и индивидуального иммунного ответа.
Новая эпигенетика H. sapiens управляет взаимодействием эпигенетических механизмов старения и долголетия с биологией, биофизикой, физиологией и факторами окружающей среды в регуляции транскрипции. Старение — это структурно-функциональная перестройка (перепрограммирование) и постепенное снижение физиологических функций организма, которые приводят к возрастной потере профессиональной пригодности, болезням, и к смерти. Понимание причин здорового старения составляет одно из самых проблемных междисциплинарных направлений [1].
Продолжительность жизни человека в значительной степени определяется эпигенетически. Эпигенетическая информация — обратима, наши исследования дают возможность терапевтического вмешательства при здоровом старении, и связанных с возрастом заболеваниях [1].
Авторские разработки позволяют управлять острым и хроническим стрессом, снижают аллостатическую перегрузку, повышают нейропластичность мозга, включают гибридные и комбинированные инструменты и методики нейрореабилитации и психонейроиммунореабилитации [1].
В исследовании [2] установлены основные современные инструменты и методики эпигенетической защиты здорового старения и долголетия человека разумного.
Функциональные продукты питания различные по составу, оказывают системное воздействие как на гуморальные и гормональные циркадианные колебания, так и на персонифицированное состояние здоровья, и его полиморбидность [3]. Включение в комбинированную схему лечения и профилактики заболеваний — функционального продукта питания обусловлено его сбалансированностью по содержанию микро- и макроэлементов, витаминов и минералов, клетчатки и др., необходимых мужскому и женскому организму человека как для профилактики гормональных нарушений в репродуктивной системе, так и для диетического, профилактического и функционального питания при диссомнии, десинхронозе [4].
Концентрация мелатонина в желудочно–кишечных тканях превосходит его уровень в крови в 10–100 раз, а в желудочно–кишечном тракте, по крайней мере, в 400 раз больше мелатонина, чем в шишковидной железе [5]. Организм человека представляет собой симбиотическое сообщество многочисленных эукариотических, прокариотических клеток, вирусов и архебактерий. Общее число соматических и зародышевых клеток достигает 1 трлн, а микробных клеток — свыше 100 трлн. В системно-интегративной деятельности головного мозга человека насчитывается огромное количество — примерно 10 млрд связанных между собой и постоянно взаимодействующих клеток [3].
В исследованиях [4–5] показано, что оптимизация нейробиологических и хрономедицинских процессов, возможна при циркадианной выработке мелатонина и обеспечении его длительной концентрации в организме человека. Установлено, что системно–локальное и индивидуальное сочетанное (медикаментозное и немедикаментозное) вмешательство в циркадианную ось «микробиота–кишечник–мозг» с помощью ежедневного употребления функциональных продуктов питания, положительно влияет на когнитивное и психическое здоровье человека. Висцеральный и когнитивный мозг регулируя уровни мелатонина изменяют флору кишечника и улучшают антимикробные действия. Функциональное и сбалансированное питание обеспечивают циркадианное функционирование нейрооси «мозг–кишечник» с одновременным питанием «мозга» и «микробиоты». Новая концепция, рассматривающая микрофлору кишечника как ключевой регулятор поведения и функционирования головного мозга, представляет собой смену парадигмы в нейронауке и клинической гериатрии [6].
Внедрение результатов исследования Н. П. Романчук позволяет восстановить функционирование циркадианной системы человека, нормализовать уровень и концентрацию мелатонина в организме, осуществлять регуляцию процессов сна и бодрствования, управлять нейропластичностью, проводить профилактику когнитивных нарушений, активировать собственные циркадианные ритмы и их синхронизацию с окружающей средой, через использование мультимодальной схемы повышения циркадианного уровня гормона мелатонина в крови человека: циркадианные очки, функциональное питание и физическая активность [4–5, 7].
Исследовано, что различия в составе кишечной микробиоты, обусловленные экологическими, социально-экономическими, пищевыми и гигиеническими условиями, влияют на эффективность вакцинопрофилактики. Анализируя механизмы, посредством которого микробиота влияет на иммуногенность вакцин, и причинно-следственные связи между конкретным составом сообщества и реактивностью, показано, что бактериальные виды или их специфические компоненты выступают в качестве мощных модуляторов гуморального или клеточного иммунитета среди субъектов, отвечающих на вакцину. В этом контексте используются различные подходы для проверки потенциального адъювантного эффекта некоторых пробиотических штаммов для усиления иммунного ответа как на пероральные, так и на парентеральные вакцины с противоречивыми результатами [8].
Исследовано [8], влияние микробиоты на иммунный ответ на вакцинацию и новые инструменты для глубокого анализа влияния микробиома на вакцинные реакции.
Различные регуляторные клетки также участвуют в контроле иммунного гомеостаза, чтобы переносить микробную колонизацию на слизистых участках при рождении. Напротив, состояние дисбиоза способствует сильному смещению Th1 и воспалительному состоянию, которые могут быть вовлечены в некоторые заболевания в зрелом возрасте [9]. Основной интерфейс между хозяином и микроорганизмами представлен эпителиоцитами кишечника
(ИЭКс); микробиота связывается с ИЭКс через ассоциированные с микробами молекулярные паттерны (MAMPs) и продукты обмена веществ. С другой стороны, IECs снабжены специализированными поверхностными структурами (микроволнами, ресничками, выработкой слизи и межклеточными соединениями) и набором врожденных иммунных рецепторов, называемых рецепторами распознавания образов (PRRs), которые распознают MAMPs (Рисунок 1) [10], PRRs, классифицированные на toll-подобные рецепторы (TLRs), NOD-подобные рецепторы (NLRs) и ретиноевые кислотоиндуцибельные ген I (RIG-I)-подобные рецепторы (RLRs) [11], распознают микробные структуры, такие как липополисахарид (ЛПС) (TLR4), флагеллин (TLR5 и NLRC4), липотейхоевая кислота, бактериальные липопротеины и пептидогликаны грамположительных бактерий (TLR2, Nod1 и Nod2).
Взаимодействие между микробиотой и клетками хозяина происходит главным образом на поверхности кишечного эпителия, что составляет основные физико-химические барьеры для поддержания иммунного гомеостаза кишечника (Рисунок 1).
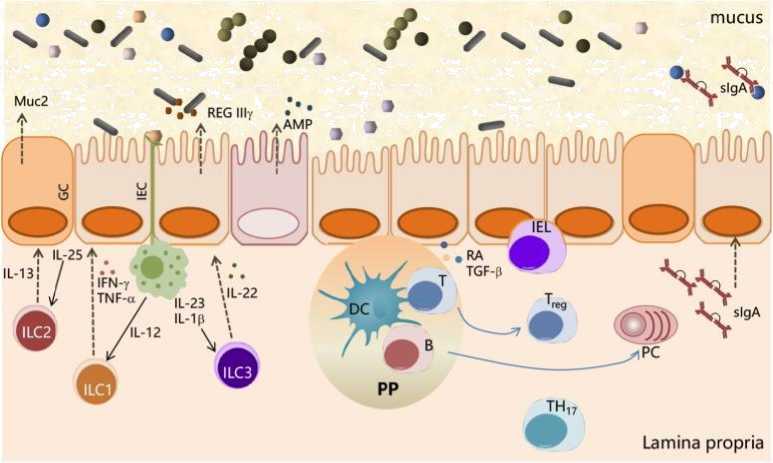
Рисунок 1. Взаимодействие между микробным сообществом
слизистых оболочках [8, 10].
и иммунной системой на
Кишечная микробиота отделяется от кишечного эпителия слоем слизи, выделяемой бокаловидными клетками (ГКС). Микроб-ассоциированные молекулярные картины (MAMPs), выраженные на бактериальной поверхности, узнаны приемными устройствами (PRRs) распознавания по образцу, выраженными кишечными эпителиальными клетками (IECs), и наводят разнообразие влияния для того чтобы преградить бактерии как продукция противомикробных пептидов (AMPs). IEC-released факторы, такие как ретиноевая кислота (RA) и TGF-β, способствуют развитию в пластинке propria tolerogenic DCs которые стимулируют дифференцирование клеток T в Treg. В-клетки дифференцируются в плазматические клетки (ПК), секретирующие IgA, которые транслоцируются через эпителий и высвобождаются в слой слизи, где контролируют адгезию бактерий к тканям хозяина. Макрофаги, стимулированные такими сигналами, как флагеллин, высвобождают IL-23, что в свою очередь способствует продукции IL-22 ILC3. IL-22 стимулирует высвобождение Regiiy, антимикробного пептида, производимого IECs. ILC2 способствует контролю слизи путем секреции IL-13, цитокина, который стимулирует дифференцировку кишечных эпителиальных стволовых клеток в направлении GC, которые, в свою очередь, производят гликопротеины муцина [8, 10].
Иммунная система устанавливает ряд врожденных и адаптивных иммунных механизмов, направленных на усиление сдерживания микробиоты, барьерного иммунитета и восстановления тканей таким образом, чтобы они не были связаны с воспалением. Толерантность к нормальной микробиоте кишечника является важнейшим элементом гомеостаза кишечника, требующим обширной сети регуляторных иммунных клеток, включая Т-регуляторные (Tregs) и толерогенные дендритные клетки (DC). Зондирование комменсальной микробиоты через сигнальный путь TLR-MyD88 является стратегией, применяемой иммунной системой для поддержания гомеостаза хозяина-микроба [10].
Влияние микробиоты кишечника на иммунный ответ на вакцину может быть оценено с помощью комплексного подхода между характеристикой микробиома и иммунным ответом на вакцину через системный биологический подход. Наличие новых инструментов для глубокого анализа микробиома, таких как технологии секвенирования следующего поколения (NGS), и иммунного ответа хозяина открывает путь для выяснения влияния микробиома на модуляцию иммунного ответа вакцины (Рисунок 2) [8].
Microbioma characterization
Host Responses
Serological assays
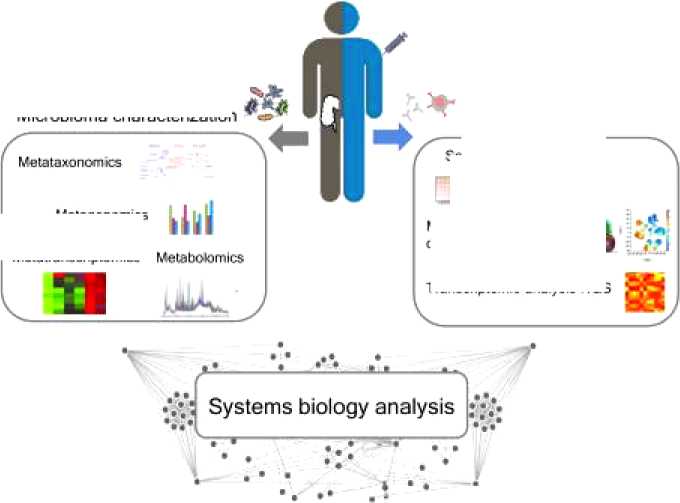
Рисунок 2. Комплексный подход к анализу взаимосвязи между микробиотой и иммунным ответом после вакцинации [8].
Metagenomics
Metatranscnptomics
Mvltiparamelric Flow 0 cytometry
Transcripfomic analysis NGS
Глубокая характеристика микробиома кишечника может быть получена с помощью подходов NGS, включая метатаксономику, метагеномику, метатранскриптомику и метаболомику. Передовые технологии, включающие многопараметрическую проточную цитометрию и транскриптомный анализ, позволяют профилировать как гуморальные, так и клеточные иммунные реакции. Системная биологическая интеграция характеристики микробиома с анализом реакции хозяина при введении вакцины может позволить лучше коррелировать влияние кишечного микробиома на реакцию вакцины [8].
Хорошо известно, что недостаточность питания значительно ухудшает функционирование иммунной системы. Кроме того, все чаще признается, что потребление питательных веществ, превышающее то, что в настоящее время рекомендуется, может благотворно влиять на иммунную функцию, модулировать хронические воспалительные и аутоиммунные состояния и снижать риск инфицирования. Это включает как макронутриенты (липиды, такие как N-3 ПНЖК), так и микронутриенты (цинк, витамин D и витамин Е), В дополнение к фитохимическим веществам и функциональным продуктам питания (пробиотики и зеленый чай). Многие из этих питательных и непитательных пищевых компонентов связаны в своих функциях с поддержанием или улучшением иммунной функции, включая ингибирование провоспалительных медиаторов, стимулирование противовоспалительных функций, модуляцию клеточного иммунитета, изменение функции АПК и связь между врожденными и адаптивными иммунными системами [12].
Neutrophils
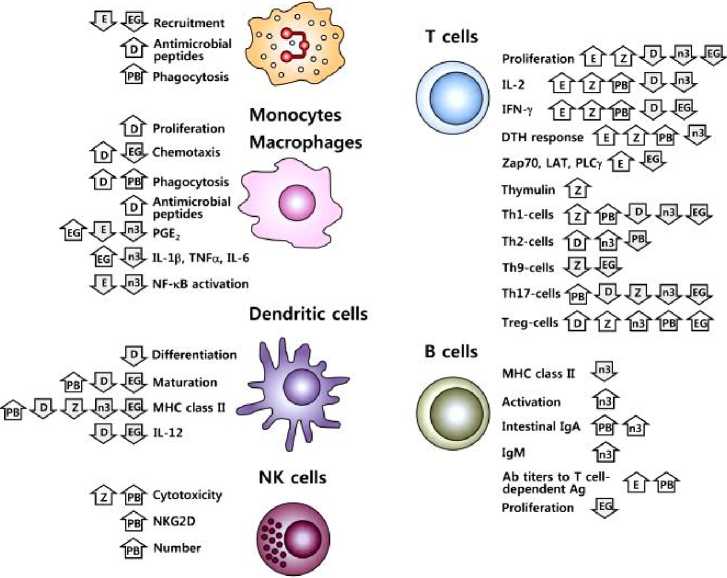
Рисунок 3. На функции иммунных клеток влияют витамины D и E, цинк, N-3 ПНЖК, пробиотики и EGCG. D, Витамин D; E, Витамин Е; Z, цинк; n-3, N-3 ПНЖК; PB, пробиотики; например, EGCG; увеличение; уменьшение. Эффекты пробиотиков, приведенные здесь, относятся к некоторым штаммам; учитывая специфичность штаммов для эффектов пробиотиков, эти результаты не следует обобщать [12].
Свойства питательных веществ, фитохимических веществ и функциональных продуктов питания в модуляции иммунной функции имеют значительные последствия для условий, опосредованных воспалением. Как на животных, так и на людях были получены многообещающие результаты, свидетельствующие о клинической пользе витамина D, N-3 ПНЖК и EGCG при хронических воспалительных состояниях, n-3 ПНЖК и EGCG при аутоиммунных расстройствах, а также витамина D, витамина Е, цинка и пробиотиков в защите от инфекции. Тем не менее, несоответствие результатов многих исследований добавляет сложность и сложность проведения исследований в области пищевой иммунологии; в результате в настоящее время нет четкого консенсуса относительно клинической значимости этих диетических компонентов. В некоторых случаях результаты исследований на людях не всегда согласуются с доклиническими моделями на животных, либо иммуномодулирующие эффекты еще не изучены на людях. Кроме того, существуют большие различия между проектами исследований на людях, используемыми дозами и популяциями исследования, демонстрируя необходимость в более стандартизированных проектах клинических испытаний, лучше охарактеризованных популяциях, большей информации для определения используемой дозы вмешательства и более значимых выбранных измерений результатов. В частности, для цинка, витамина Е, N-3 ПНЖК и пробиотиков, очевидно, необходимо установить оптимальные дозы для получения максимальной клинической пользы, которая, вероятно, может отличаться в зависимости от возраста, генетического фона, а также питания и состояния здоровья населения исследования [12].
В зависимости от функций лимфоцитов, специфический иммунитет принято делить также на гуморальный и клеточный. В-лимфоциты в данном случае ответственны за гуморальный, а Т-лимфоциты — за клеточный иммунитет. Гуморальный иммунитет назван так потому, что его иммуноциты (В-клетки) вырабатывают антитела, способные отделяться от клеточной поверхности. Продвигаясь по кровяному или лимфатическому руслу — гумору, антитела поражают чужеродные тела на любой дистанции от лимфоцита. Клеточным иммунитет именуют потому, что Т-лимфоциты (преимущественно Т-киллеры) вырабатывают рецепторы, жестко фиксированные на клеточной мембране, и служат Т-киллерам эффективным оружием для поражения чужеродных клеток при непосредственном контакте с ними.
Клеточный иммунитет — это такой тип иммунного ответа, в котором не участвуют ни антитела, ни система комплемента. В процессе клеточного иммунитета активируются макрофаги, натуральные киллеры, антиген-специфичные цитотоксические Т-лимфоциты, и в ответ на антиген выделяются цитокины.
Иммунная система исторически описывается состоящей из двух частей: системы гуморального иммунитета и системы клеточного иммунитета. В случае гуморального иммунитета защитные функции выполняют молекулы, находящиеся в плазме крови, а не клеточные элементы. В то время как в случае клеточного иммунитета защитная функция связана именно с клетками иммунной системы. Лимфоциты кластера дифференцировки CD4 или Т-хелперы осуществляют защиту против различных патогенов.
На периферии зрелые Т- и В-клетки располагаются в одних и тех же лимфоидных органах — частично изолированно, частично в смеси. Но что касается Т-лимфоцитов, то их пребывание в органах непродолжительно, т. к. они постоянно в движении. Срок их жизни (месяцы и годы) способствует им в этом. Т-лимфоциты многократно покидают лимфоидные органы, попадая сначала в лимфу, затем в кровь, а из крови снова возвращаются в органы. Без такой способности лимфоцитов были бы невозможны своевременное их развитие, взаимодействие и эффективное участие в иммунном ответе при вторжении чужеродных молекул и клеток.
Полноценное развитие гуморального иммунного ответа требует не двух, а по крайней мере трех типов клеток. Функция каждого клеточного типа в антителопродукции строго предопределена. Макрофаги и другие фагоцитирующие клетки поглощают, перерабатывают и экспрессируют антиген в иммуногенной, доступной для Т- и В-лимфоцитов форме. Т-хелперы после распознавания антигена начинают продукцию цитокинов, обеспечивающих помощь В-клеткам. Эти последние клетки, получив специфический стимул от антигена и неспецифический от Т-клеток, начинают продукцию антител. Гуморальный иммунный ответ обеспечивается антителами, или иммуноглобинами. У человека различают 5 основных классов иммуноглобинов: IgA, IgG, IgM, IgE, IgD. Все они имеют как общие, так и специфические детерминанты.
При формировании клеточного типа иммунного ответа также необходима кооперация различных типов клеток. Клеточный иммунитет зависит от действия гуморальных факторов, выделяемых цитотоксическими лимфоцитами (Т-киллерами). Эти соединения получили наименование перфорины и цитолизины.
Установлено, что каждый Т-эффектор способен лизировать несколько чужеродных клеток-мишеней. Этот процесс осуществляется в три стадии:
-
1) распознавание и контакт с клетками-мишенями;
-
2) летальный удар;
-
3) лизис клетки-мишени.
Последняя стадия не требует присутствия Т-эффектора, так как осуществляется под влиянием перфоринов и цитолизинов. В стадию летального удара перфорины и цитолизины действуют на мембрану клетки-мишени и образуют в ней поры, через которые проникает вода, разрывающая клетки.
Клеточный иммунитет направлен преимущественно против микроорганизмов, которые выживают в фагоцитах и против микроорганизмов, поражающие другие клетки. Система клеточного иммунитета особенно эффективна против клеток, инфицированных вирусами, и принимает участие в защите от грибов, простейших, внутриклеточных бактерий и против клеток опухолей. Также система клеточного иммунитета играет важную роль в отторжении тканей.
Гуморальный иммунный ответ. Активация В-лимфоцитов (В2 CD5-) и их дифференцировка в антителообразующие (АОК) плазматические клетки. Иммуноглобулиновый рецептор В-лимфоцитов (ВСR) распознает антиген и клетка его поглощает. В-клетка представляет образовавшийся комплекс Тх-2 через ТСR и CD4. Активация покоящихся В-лимфоцитов, их пролиферация с участием цитокинов Тх-2. Популяция (В1 CD5+) находится в лимфоидных образованиях слизистых, кожи и синтезирует преимущественно IgM, участвуя в антибактериальном иммунитете .
Клеточный иммунный ответ. Участвуют популяции Тх-1 CD4+ и цитотоксические Т-лимфоциты (CD8+). Антигенпредставляющие клетки, обычно дендритные, после процессинга поглощенного АГ представляют ЦТЛ микробные пептиды в комплексе с МНС1 ЦТЛ через ТСR и CD8 распознают микробный пептид и МНС1 (двойное распознавание). Под действием ИЛ-2 происходит пролиферация ЦТЛ, их активация и уничтожение микробного агента путем выброса из гранул цитотоксических белков (сериновых протеаз) и конечного апоптоза клеток с нарушенной мембраной.
Противобактериальный иммунитет. Направлен против бактерий и их токсинов. Бактерии и токсины нейтрализуются антибактериальными и антитоксическими антителами. Комплексы АГ-АТ активируют комплемент, мембранатакующий комплекс которого разрушает наружную мембрану грамотрицательных бактерий. Пептидогликан клеточной стенки бактерий разрушается лизоцимом. Антитела и комплемент (С3в) обволакивают бактерии для дальнейшего иммунного фагоцитоза. Основной механизм противобактериального иммунитета — фагоцитоз. Противобактериальная защита слизистых оболочек обусловлена секреторным IgA, который препятствует адгезии бактерий на эпителиоцитах.
Противовирусный иммунитет. Основой является клеточный иммунитет. Клетки-мишени (инфицированные вирусом) уничтожаются цитотоксическими лимфоцитами, а также NK-клетками и фагоцитами. Противовирусные антитела способны нейтрализовать только внеклеточно расположенные вирусы, после чего они поглощаются фагоцитами или выводятся с мочой, потом и др. («выделительный иммунитет»). Интерфероны оказывают иммуномодулирующее действие, усиливая в клетках экспрессию антигенов МНС. Противовирусная защита слизистых обусловлена секреторным IgA, препятствующим адгезии вирусов к эпителиоцитам.
Противогрибковый иммунитет. Антитела (IgМ, IgG) при микозах выявляются в низких титрах. Основой противогрибкового иммунитета является клеточный иммунитет. В тканях происходит фагоцитоз, развивается гранулематозная реакция, иногда – тромбоз кровеносных сосудов. Микрозы, особенно оппортунистические, часто развиваются после длительной антибиотикотерапии и при ИДС. Микозы сопровождаются развитием ГЗТ. После респираторной сенсибилизации фрагментами условно-патогенных грибов родов Aspergillus, Penicillium, Mucor, Fusarium и др. возможно развитие аллергических заболеваний.
Более распространенным методом гормональной регуляции является петля отрицательной обратной связи. Отрицательная обратная связь характеризуется торможением дальнейшей секреции гормона в ответ на адекватный уровень этого гормона. Это позволяет регулировать уровень гормона в крови в узком диапазоне. Примером отрицательной обратной связи является высвобождение глюкокортикоидных гормонов из надпочечников, направленное гипоталамусом и гипофизом. По мере повышения концентрации глюкокортикоидов в крови гипоталамус и гипофиз уменьшают свою сигнализацию надпочечникам, чтобы предотвратить дополнительную секрецию глюкокортикоидов.
Высвобождение глюкокортикоидов надпочечников стимулируется высвобождением гормонов из гипоталамуса и гипофиза. Эта сигнализация подавляется, когда уровень глюкокортикоидов повышается, вызывая негативные сигналы в гипофизе и гипоталамусе.
Роль стимулов эндокринных желез. Рефлексы, вызванные как химическими, так и нервными стимулами, управляют эндокринной активностью. Эти рефлексы могут быть простыми, включающими только один гормональный ответ, или они могут быть более сложными и включать много гормонов, как в случае с гипоталамическим контролем различных передних гормонов, контролируемых гипофизом.
Гуморальные стимулы — это изменения в крови уровня негормональных химических веществ, таких как питательные вещества или ионы, которые вызывают высвобождение или ингибирование гормона, чтобы, в свою очередь, поддерживать гомеостаз. Например, осморецепторы в гипоталамусе обнаруживают изменения осмолярности крови (концентрации растворенных веществ в плазме крови). Если осмолярность крови слишком высока, что означает, что кровь недостаточно разбавлена, осморецепторы сигнализируют гипоталамусу о высвобождении АдГ. Гормон заставляет почки поглощать больше воды и уменьшать объем выделяемой мочи. Эта реабсорбция вызывает снижение осмолярности крови, разбавляя ее до соответствующего уровня. Другой пример — регуляция уровня глюкозы в крови. Высокий уровень глюкозы в крови вызывает высвобождение инсулина из поджелудочной железы, что увеличивает поглощение глюкозы клетками и хранение глюкозы печенью в виде гликогена.
Эндокринная железа может также выделять гормон в ответ на присутствие другого гормона, вырабатываемого другой эндокринной железой. Такие гормональные стимулы часто включают гипоталамус, который производит высвобождающие и ингибирующие гормоны, которые контролируют секрецию различных гормонов гипофиза.
Более высокий уровень смертности, вызванный COVID-19 у пожилых людей, особенно с сопутствующими заболеваниями, является проблемой для биомедицинских исследований старения. Обострение воспалительной реакции, в частности опосредованной IL-6, может привести к пагубным последствиям инфекции. Исследования показывают, что другие РНК-вирусы, такие как вирус гриппа, могут демонстрировать повышенную эффективность репликации в стареющих клетках, предполагая, что накопление стареющих клеток со старением и возрастными заболеваниями может играть определенную роль в этих процессах. Продолжающиеся, исследования о реакции на SARS-CoV и SARS-COV-2, происходящей в стареющих клетках [13].
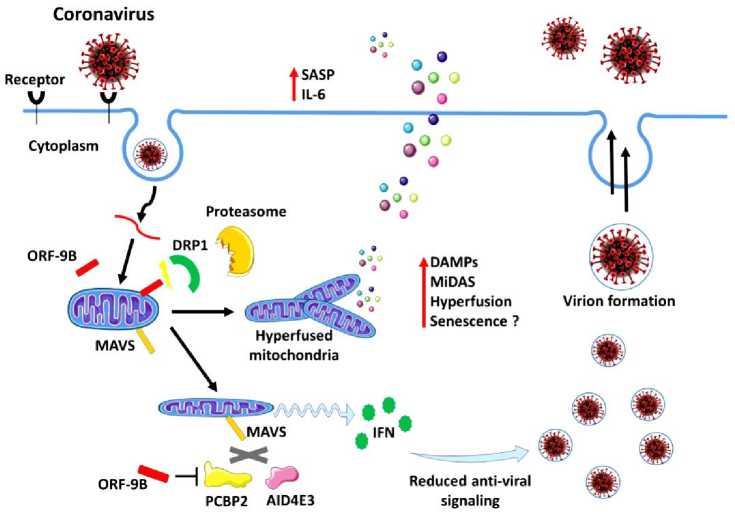
Рисунок 4. Воспаление, и другие механизмы при инфекции КОВИД-19 [14].
Микробиом-иммунный вклад в метаболический синдром. Кишечный микробиом является ключевым регулятором иммунных и метаболических функций хозяина и считается центральным фактором, способствующим воспалению в контексте метаболического синдрома (Рисунки 4–5) [13].
Микробиом взаимодействует с иммунной системой хозяина, регулируя обмен веществ различными механизмами: непосредственным физическим контактом, выработкой метаболитов и сбросом структурных компонентов. Они влияют на метаболический гомеостаз путем местной иммунной модуляции слизистой оболочки и путем отдаленных изменений метаболических органов, таких как жировая ткань, мышцы и печень (Рисунок 5) [13].
Традиционная и новая современная роль иммунной системы в обеспечении противоинфекционной и противоопухолевой защиты, заключается в участии в регуляции системного метаболического гомеостаза. Перекрестная связь между иммунной и метаболической системами играет ключевую роль в поддержании «метаболического здоровья» на протяжении всей жизни организма и играет фундаментальную роль в его адаптации к постоянно меняющимся условиям окружающей среды и доступности питания. Современное понимание взаимодействий иммунитета и метаболизма, между отдельными людьми и между популяциями, указывает на будущие направления исследований, которые, возможно, позволят использовать иммунитет как средство персонализированного лечения общих метаболических нарушений [13].
Актуальность иммуно-метаболического взаимодействия при метаболических нарушениях, заключается в сложных взаимодействиях между иммунной и метаболической системами, и лучше всего проявляется в нескольких определенных состояниях метаболических нарушений, начиная от чрезмерного или недостаточного питания и заканчивая явными проявлениями метаболического синдрома. В большинстве случаев нарушенного метаболизма воспаление является способствующим или регулирующим фактором и включает иммунную сигнализацию либо в истинных гемопоэтических иммунных клетках, либо в тканевых резидентных клетках.
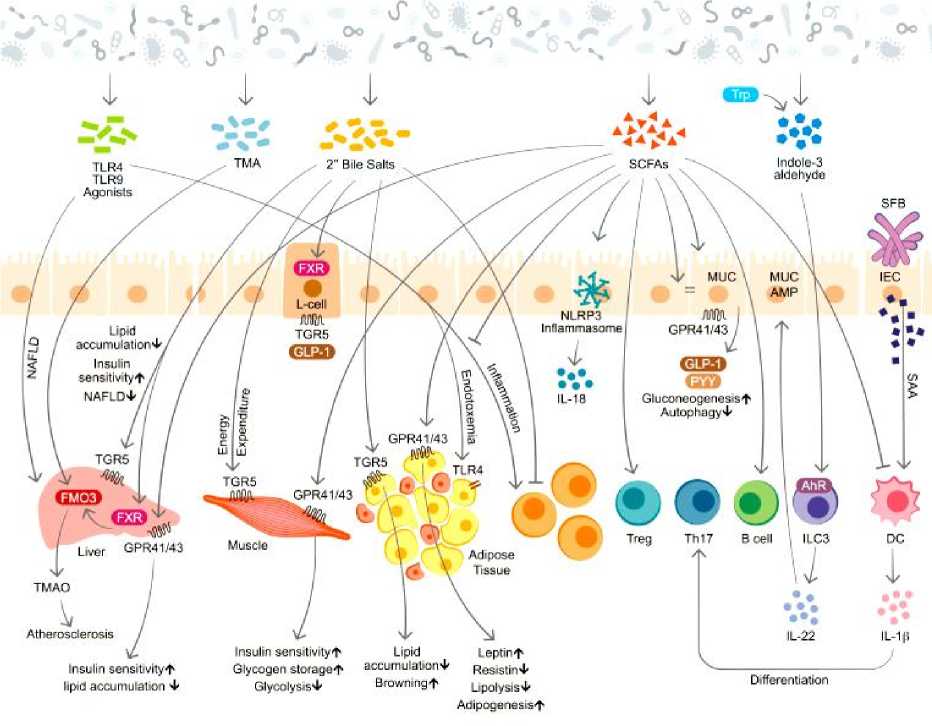
Рисунок 5. Микробиом и иммуно-метаболические взаимодействия [13].
Метаболическое здоровье и вклад иммунитета в метаболические риски, определяемые на различных физиологических этапах жизни и доступности питания, огромное. Несмотря на значительный скачок в нашем понимании связей между иммунной и метаболической системами и выявление ключевых новых алгоритмов и инструментов, которые модифицируют эти взаимодействия, демонстрируют еще более сложные отношения. Будущие перспективы будут сосредоточены на углублении нашего молекулярного понимания иммуно-метаболических перекрестных связей, влияний окружающей среды и микробиома на эти взаимодействия, а также на изучении их значимости для человека в гомеостатических или болезненных условиях.
Использование этих знаний поможет нам во всех аспектах поддержания здоровья и профилактики заболеваний. Детальное профилирование иммунных маркеров, генетики хозяина, эпигенетики и конфигураций микробиома может быть полезно для профилактики и ранней диагностики у лиц, подверженных метаболическим заболеваниям. Аналогичным образом, вмешательства, нацеленные на ключевые центры иммуно-метаболических взаимодействий, могут быть использованы для изменения иммунного вклада в метаболические заболевания. Понимание на молекулярном уровне перекрестных иммуно-метаболических взаимодействий, а также связанных с окружающей средой и микробиомом модификаций этой коммуникационной сети может позволить лучше понять формирующие силы, определяющие иммунный и метаболический гомеостаз и патогенез иммуно-опосредованных или ассоциированных метаболических заболеваний [13].
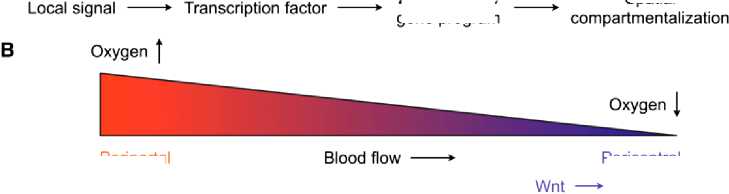
В дополнение к этой пространственной зональности метаболических функций циркадные часы накладывают временной ритм на экспрессию генов гепатоцитов, который синхронизирует метаболизм гепатоцитов с суточными ритмами питания и голодания [15]. Эти два механизма позволяют разделить в пространстве и времени биохимически несовместимые реакции или бесполезные метаболические циклы. Например, глюконеогенез выше во время голодания и локализуется в перипортальной области, тогда как гликолиз преобладает во время кормления и происходит в перицентральной области. Аналогичное разделение между катаболическими (перипортальными) и анаболическими (перицентрическими) реакциями наблюдается для метаболизма холестерина, жирных кислот и глютамина. Если метаболические функции гепатоцитов (клиентских клеток) стробируются зональностью, то из этого следует, что вспомогательные функции вспомогательных клеток, клеток Купфера и звездчатых клеток, также могут демонстрировать сходную картину зональности, образуя функциональную единицу. Хотя доказательств в поддержку этого в настоящее время нет, в литературе есть предположения, что клетки Купфера могут демонстрировать аналогичное зональное распределение, которое функционально выравнивает их с клетками-клиентами.
Будущая основа для изучения тканевого иммунометаболизма, фокусируется на гомеостатических функциях тканевых резидентных иммунных клеток. Эта перспектива основывается на идее, что эволюция метазоанов связана с клеточной специализацией, в результате которой вспомогательные функции были отнесены к вспомогательным клеткам [16]. Эти тканевые вспомогательные клетки, которые включают иммунные и стромальные клетки, продуцируются в процессе развития и поддерживают основные функции паренхиматозных клеток в метаболических органах. Таким образом, основная функциональная единица метаболических органов состоит из паренхиматозных, иммунных и стромальных клеток, которые непрерывно взаимодействуют друг с другом и с окружающей средой. В жировой ткани это координированное восприятие метаболитов опосредуется датчиком жирных кислот PPARy, тогда как в печени оно может быть организовано рецептором оксистерола LXRa. На основную функциональную единицу накладываются нейрональные, гормональные и циркадные входы, которые устанавливают координацию между метаболическими органами, необходимыми для адаптации к вызовам окружающей среды (Рисунок 6) [17].
В перипортальной области воротная вена и печеночная артерия обеспечивают питательные вещества и кислород соответственно, тогда как перицентральная область бедна кислородом. Как правило, энергозатратные катаболические функции локализуются в перипортальной области, тогда как анаболические функции выполняются гепатоцитами в перицентральной области. Перицентральная зональность регулируется путем Wnt-β-катенина/Tcf, в то время как путь HRas контролирует программу зональности вокруг перипортальной области. Ферменты или ферментативная активность которые показывают преимущественную локализацию в перипортальной или перицентральной зонах, перечислены рядом с метаболическими программами, в которых они участвуют [17].
В связи с возникающей пандемией COVID-19, вызванной вирусом SARS-CoV-2, поиск потенциальных защитных и терапевтических противовирусных стратегий представляет особый и неотложный интерес [18]. Цинк, как известно, модулирует противовирусный и антибактериальный иммунитет и регулирует воспалительную реакцию. Несмотря на отсутствие клинических данных, некоторые признаки указывают на то, что модуляция цинкового статуса может быть полезной при COVID-19 [18].
A
Spatial
Zone-specific gene program
Pericentral p-catenin/Tcf
Periportal HRas
Gluconeogenesis (PEPCK, G6PC, FBP1)
Glycolysis (GK)
De novo lipogenesis
(FAS, ACC, ACL)
Fatty acid oxidation (CPT1)
Cholesterol synthesis (HMG-CoA-reductase)
Oxidative energy metabolism (mitochondria)
Xenobiotic detoxification (sulfation)
Ureagenesis (CPS)
Bile acid synthesis
(CYP7A1)
Glycolysis
Xenobiotic biotransformation (P450 enzymes, gluouronidation)
Glutamine synthesis (GS)
Рисунок 6. Метаболическая и иммунная зональность печени: А) модель того, как метаболические и иммунные функции могут быть зонированы в печени; B) метаболическая зональность печени [17].
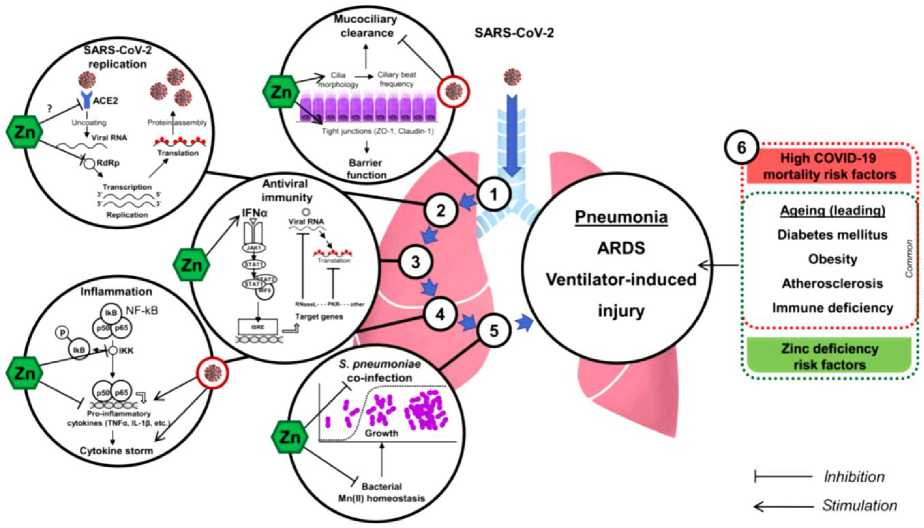
Рисунок 7. Предлагаемые защитные механизмы цинк в КОВИД-19 [18].
cc) 0
-
1. Цинк значительно улучшает морфологию ресничек [19] и увеличивает цилиарный ритм частоты [20] таким образом, улучшается мукоцилиарный клиренс и удаление бактерий и вирусов, содержащих частицы. Путем регулирования вверх плотного соединения белков ZO-1 и Клодин-1 [21] и увеличение антиоксидантной активности респираторного эпителия [22] цинк повышает барьерную функцию. В свою очередь, было показано, что коронавирусная инфекция ухудшает мукоцилиарный клиренс [23] предрасполагая легкие к дальнейшей вирусной и бактериальной агрессии.
-
2. Цинк может также обладать противовирусной активностью за счет ингибирования RdRp и блокирование дальнейшей репликации вирусной РНК, как показано на Рисунке 7 для SARS-CoV [24]. Косвенные данные также указывают на то, что Zn2+ может снижать активность ACE2 [25], как известно, является рецептор для SARS-CoV-2 [26].
-
3. Модуляция противовирусного иммунитета цинком также может ограничить ОРВИ-ков-2 инфекции, по крайней мере, через up-регуляцию продукции IFNa [27] и увеличение его противовирусной активности [28]. Последнее может быть опосредовано через IFNa-индуцированную сигнализацию JAK1/STAT1 и up-регуляцию противовирусных белков (РНК и ПКР), которые разрушают вирусную РНК и ингибируют ее трансляцию [29].
-
4. Чрезмерная воспалительная реакция приводит к перепроизводству провоспалительных цитокинов и известно, что цитокиновый шторм играет значительную роль в COVID-19 патогенезе [30]. Цинк обладает противовоспалительной активностью за счет ингибирования ИКК активности и последующая сигнализация NF-kB, приводящая к пониженной регуляции продукции провоспалительных цитокинов [31–32]. Модуляция регуляторных Т-клеток функции цинком могут также ограничивать чрезмерную воспалительную реакцию [33–34], а также понижающее регулирование продукции провоспалительных цитокинов [35–36].
-
5. Учитывая высокий риск бактериальной инфекции коинфекция при вирусной пневмонии [37], Zn-индуцированное ингибирование S-рост пневмоний через модуляцию бактериального Mn (II) гомеостаза [38] является полезной.
-
6. Цинковый статус — снижает высокую смертность при COVID-19. В частности, старение, иммунодефицит, а также метаболические заболевания, такие как ожирение, диабет и другие — атеросклероз, как известно, является суммирующими факторами риска развития высокой заболеваемости и смертности [39–40] при дефиците цинка [41]. В свою очередь, добавление Zn может оказывают благотворное влияние на модуляцию по крайней мере некоторых из этих рисков факторов: АЦЕ2, ангиотензинпревращающий фермент 2; ИФН, интерферон; IKK, IkB киназа; NF-kB, ядерный фактор-kB; ОРЗ, острые респираторные заболевания дистресс-синдром.
Эксперименты in vitro показывают, что Zn2+ обладает противовирусной активностью за счет ингибирования РНК-полимеразы SARS-CoV. Этот эффект может лежать в основе терапевтической эффективности хлорохина, известного как ионофор цинка. Косвенные данные также указывают на то, что Zn2+ может снижать активность ангиотензинпревращающего фермента 2 (ACE2), который, как известно, является рецептором для SARS-CoV-2. Улучшение противовирусного иммунитета цинком может также происходить за счет усиления регуляции продукции интерферона α и повышения его противовирусной активности. Цинк обладает противовоспалительной активностью, ингибируя сигнализацию NF-kB и модуляцию регуляторных функций Т-клеток, которые могут ограничивать цитокиновый шторм при COVID-19. Улучшение состояния Zn может также снизить риск бактериальной коинфекции за счет улучшения мукоцилиарного клиренса и барьерной функции респираторного эпителия, а также прямого антибактериального действия против S. pneumoniae. Цинковый статус также тесно связан с факторами риска развития тяжелого COVID-19, включая старение, иммунодефицит, ожирение, диабет и атеросклероз, поскольку они являются известными группами риска при дефиците цинка. Таким образом, Zn обладает защитным эффектом в качестве профилактической и адъювантной терапии COVID-19 за счет уменьшения воспаления, улучшения мукоцилиарного клиренса, предотвращения ИВЛ-индуцированного повреждения легких, модуляции противовирусного и антибактериального иммунитета [18].
Новая управляемая здоровая биомикробиота и персонализированное функциональное и сбалансированное питание «мозга и микробиоты» — это долговременная медицинская программа пациента, которая позволяет комбинированному применению питательной эпигенетики и фармэпигенетики, а главное проведению профилактики полипрагмазии.
Функциональные продукты питания, здоровая биомикробиота, здоровый образ жизни и управляемое защитное воздействия окружающей среды, искусственный интеллект и электромагнитная информационная нагрузка/перегрузка — ответственны за работу иммунной системы и ее способности своевременного иммунного ответа на пандемические атаки.
Внедрение изобретения [4] позволило получить пищевой продукт для подавления свободно-радикальной активности, инвазивной детоксикации организма человека, оптимизации нейрогенной регуляции сосудистого тонуса и восстановления репродуктивных функций у лиц мужского и женского пола.
Настоящее изобретение направлено на повышении диетического, функционального и профилактического воздействия функциональных продуктов питания на циркадианную нейроось «микробиота–кишечник–мозг», на работу висцерального и когнитивного мозга. Функциональное и сбалансированное питание обеспечивают циркадианное функционирование нейрооси «мозг–кишечник» с одновременным питанием «мозга» и «микробиоты». Новая концепция, рассматривающая микрофлору кишечника как ключевой регулятор поведения и функционирования головного мозга, представляет собой смену парадигмы в нейронауке и клинической гериатрии.
Оптимизация нейробиологических и хрономедицинских процессов, возможна при циркадианной выработке мелатонина и обеспечении его длительной концентрации в организме человека, посредством работы трех составляющих:
–употребления функционального и сбалансированного питание, содержащее в большом количестве растительные белки [4].
–воздействия света определенной длины светового спектра [7],
–активации проприоцептивной сенсорной системы при физической нагрузке [7].
Длительный, более 15 мин, яркий свет стимулирует нейроны СХЯ гипоталамуса и тормозит выработку мелатонина эпифизом. В исследованиях Н. П. Романчук [4–5, 7], разработана методика воздействие на циркадианные биологические ритмы человека, устройства (очков) состоящего из источника питания, светодиодных излучателей, регуляторов режимов подачи светового потока, выполненного в виде очков, излучателей светового потока, генерирующих пиковую длину волны в области от 480±5 нм до 490±10 нм и смонтированных в виде концентрических кругов, эллипсов или линий на светопрозрачной основе, а в электрическую цепь блока излучателей включено реле-прерыватель светового потока с постоянным временем 400 мс, автоматически управляемое от блока регуляции яркости светового потока. Используемые светодиоды смонтированы в виде горизонтальных, вертикальных или круговых линий, между которыми имеется светопрозрачные промежутки, необходимые для осуществления зрительной функции. Светодиоды имеют диапазон длин волн в синей части видимого спектра величиной от 480±5 нм до 490±10 нм. Источник питания светодиодов смонтирован в оправе очков. После включения питания кнопками управления задаются режим светового потока по показателям яркости частоты пауз светового потока по субъективному предпочтению человека [7].
Указанный технический результат достигается тем, что в продукте функционального, диетического и профилактического питания для больных с хронической ишемией головного мозга, представляющем собой заливаемую при употреблении жидкостью смесь, изготовленную из экологического цельнозернового натурального сырья, произведенного в РФ и не содержащего генно-модифицированных организмов, содержащего высушенное зерно твердой пшеницы, термообработанное методом взрыва, арбузные семена, семена льна, расторопшу, дополнительно введены высушенные зерна ржи, термообработанные методом взрыва, растолченные частицы чечевицы, грецких и кедровых орехов, соя (в виде окары), пчелиная перга, порошок топинамбура, спирулины, ламинарии, женьшеня и каменного масла.
Компоненты находятся в следующем соотношении, г/100 г готового сухого продукта:
-
1) зерно твердой пшеницы 19,5–20,5,
-
2) зерно ржи 19,5–20,5,
-
3) соя 19,5–20,5,
-
4) чечевица 10,5–11,0,
-
5) семена льна 5,0–5,5,
-
6) расторопша 5,0–5,5,
-
7) порошок топинамбура 2,5–2,75,
-
8) арбузные семена 2,5–2,75,
-
9) грецкие орехи 2,5–2,75,
-
10) кедровые орехи 2,5–2,75,
-
11) перга пчелиная 2,5–2,75,
-
12) порошок спирулины 2,5–2,75,
-
13) порошок ламинарии 2,5–2,75,
-
14) порошок женьшеня 0,5–0,75,
-
15) порошок каменного масла 0,5–0,75.
Указанный продукт сбалансирован по содержанию микро- и макроэлементов, витаминов и минералов, клетчатки и др., необходимых организму человека для сохранения интеллектуальных, творческих, производственных способностей и повышения качества жизни, а также для профилактики хронической ишемии головного мозга, с помощью систематического употребления диетического, профилактического и функционального питания заявленного состава.
Указанные признаки являются существенными и взаимосвязаны с образованием устойчивой совокупности существенных признаков, достаточной для получения требуемого технического результата.
Установлено с позиции доказательной медицины, во-первых, что более 33% граждан, страдающих психическими расстройствами личности (депрессия, тревога, немотивированные страхи), испытывают дефицит витаминов «В» в рационе повседневного питания. Во-вторых, быстрая производственная и творческая утомляемость, а также снижение интеллектуальных способностей, свидетельство дефицита железа и недостаточное содержание витаминов В3, В6, В9 (фолиевая кислота) в организме. Фолиевая кислота способствует сохранению и частичному восстановлению краткосрочной и долгосрочной памяти, устойчивости запоминания.
В-третьих, аминокислоты (в т. ч. и незаменимые) и витамины (В3, В6, В9, В12, С и др.), а также ведущие микро- и макроэлементы (магний, цинк, селен и др.) для головного мозга в организме человека не синтезируются, а поступают только с пищей и являются профилактическим базисом по поддержанию функционирования нейрометаболических и интегративных процессов высшей нервной деятельности человека посредством гармонизации биофизических, биохимических и гормональных взаимодействий в циклической системе «хронобиология–хрономедицина».
В настоящем изобретении используются способ получения функционального продукта питания с использованием инновационных технологий (патент РФ RU 2423873 С1 «Способ производства зернового компонента для пищевого продукта быстрого приготовления и способ производства функционального пищевого продукта быстрого приготовления», приоритет от 05.04.2010) [4].
В рамках настоящего изобретения рассматривается новый следующий состав функционального продукта питания для профилактического и диетического питания, содержащий:
–во-первых, рожь 19,5–20,5% в 100 г готового сухого продукта как базовый ФПП, необходимый для восполнения недостающих полезных веществ, так и цельнозерновой продукт — «платформа» для биосинтеза витаминов и биохимических реакций в организме женщины (эндокринной и др. систем);
–во-вторых, чечевица 10,5–11,0% в 100 г готового сухого продукта — важный источник железа и фолиевой кислоты. Она способна обеспечить до 90% суточной нормы этих веществ, необходимых человеку. Чечевица содержит большое количество сложных углеводов и аминокислот, необходимых для быстрого протекания биохимических нейрометаболических процессов в клетках мозга;
–в-третьих, впервые введена цельнозерновая экологическая без ГМО соя 19,5–20,5% в 100 г готового сухого продукта со среднего Поволжья с функциональными характеристиками, решающими поставленную техническую задачу;
–в-четвертых, введен порошок топинамбура, который содержит до 20% сухих веществ, среди которых до 80% содержится полимерного гомолога фруктозы — инулина. Топинамбур аккумулирует кремний из почвы и относится к «кремнефильным» растениям, содержание этого элемента составляет до 8% в расчете на сухое вещество. Кроме того, содержит 8 аминокислот, которые синтезируются только растениями и не синтезируются в организме человека: аргинин, валин, гистидин, изолейцин, лейцин, лизин, метионин, триптофан, фенилаланин;
–в-пятых, добавлен порошок спирулины, имеющий в своем составе полноценный белок, углеводы, жиры, микро- и макроэлементы, витамины, фикоцианин, бета-каротин, линолевую кислоту и другие биологически активные компоненты. Как мощный антиоксидант спирулина предотвращает преждевременное старение в результате окислительных процессов в организме;
–в-шестых, введена ламинария, которая обладает противоопухолевой активностью, антимикробным, антибактериальным и противовирусным действием. Антимутагенным и радиопротекторным действием, а также противовоспалительной и иммуномодулирующей активностью. В ламинарии концентрация магния превышает таковую в морской воде в 9–10

раз, серы — в 17 раз, брома — в 13 раз. В 1 кг ламинарии содержится столько йода, сколько его растворено в 100 000 л морской воды. Содержание полисахаридов фукоидана и ламинарина способствует профилактике и лечению сердечно-сосудистых и цереброваскулярных заболеваний. Эти заболевания во многом зависят от баланса липидов, нарушение которого приводит к повышенной склонности к образованию атеросклеротических бляшек в сосудах. Ламинарин также оказывает гипотензивный эффект и проявляет антикоагулянтную активность, которая составляет 30% от активности гепарина;
–в-седьмых, натуральное экологическое специально переработанное (для лучшей усвояемости) каменное масло, необходимое для организма человека, вместе с другими компонентами, входящими в данный состав, для достижения профилактического базиса по поддержанию функционирования нейрометаболических и интегративных процессов высшей нервной деятельности человека, посредством гармонизации биофизических, биохимических и гормональных взаимодействий в циклической системе «хронобиология–хрономедицина».
Клинические испытания проводились в Федеральном государственном учреждении «Российский научный центр Восстановительной медицины и курортологии (ФГУ «РНЦ ВМ и К») Минздравсоцразвития РФ в период с 20.10.2009 г. по 19.03.2010 г. по договору №1389/09 от 20.10.2009.
Установлены следующие клинические эффекты при употреблении функциональных продуктов питания в рекомендуемых дозах и режимах:
-
1) геропротекторный,
-
2) дезинтоксикационный,
-
3) пребиотический,
-
4) гепатопротекторный,
-
5) пробиотический,
-
6) антиоксидантное действие
-
7) постоянный синтез ферментов и гормонов.
Результаты клинического исследования эффективности функциональных продуктов питания с фитокомпонентами в предложенных дозах эффективно применяются в качестве диетического, пребиотического и функционального питания при ишемии головного мозга.
Данный функциональных продуктов питания содержит антиоксиданты, витамины, минералы, фитопродукты, пищевые волокна, микро- и макроэлементы без наличия ГМО, консервантов и пищевых химических добавок, необходимые для достижения указанного результата.
Помимо влияния диетических привычек на эпигенетическую регуляцию метаболизма существует еще несколько социальных факторов, таких как режим сна, время приема пищи и рабочие смены, которые вызывают циркадное рассогласование.
Даже одна ночь недосыпания приводит к гиперметилированию различных тканеспецифических часовых генов, что приводит к повышению инсулинорезистентности и нарушению толерантности к глюкозе. Кроме того, метаболиты являются субстратами, используемыми для формирования модификаций хроматина и играют фундаментальную роль в деятельности всех биохимических путей. Было показано, что метаболиты, вытекающих из различных пищевых источников могут служить субстратами для транскрипционных факторов и гистонов модификации ферментов, которые потом влияют на уплотнение хроматина. С другой стороны, существует несколько линий доказательств того, что эпигенетика, в свою очередь, может влиять на метаболизм и болезни.
Питание и энергетический обмен являются одними из наиболее важных функций, необходимых для поддержания физической формы и выживания организма, и поэтому являются мощными движущими силами эволюции.
Диетическая модуляция эпигенома. Хорошо известна важная роль эпигенетических механизмов в развитии и функционировании мозга. Однако прогресс в этой области на пути к пониманию механизмов вызванных диетой изменений ограничен в первую очередь из-за недоступности мозга от живых субъектов человека в сочетании со сложностью эпигенетических сигнатур различных типов клеток в головном мозге.
Все больше данных свидетельствует о том, что различные эпигенетические механизмы (метилирование ДНК, модификации гистонов, нкРНК) взаимосвязаны и образуют «эпигенетическую сеть». Наблюдаемый фенотип — включая глобальное здоровье и возрастные процессы — является конечным результатом ряда интегральных сигналов. Факторы образа жизни и воздействия окружающей среды оставляют эпигенетические следы на нашей ДНК, которые влияют на экспрессию генов; некоторые из них оказывают защитное действие, а другие — вредны. Богатые фруктами и овощами диеты могут оказывать сходное воздействие на ДНК с эпигенетическими препаратами. Более глубокое понимание эпигенетических эффектов и сигнальных путей, активируемых биологически активными пищевыми компонентами, помогло бы оценить роль и потенциальную пользу питательных веществ для нашего здоровья [42–43].
Питательная эпигенетика может сочетаться с лекарственными средствами для синергического воздействия в целях лечения или профилактики или быть адаптирована для беременных женщин с целью снижения бремени хронических заболеваний у потомства посредством эпигенетически здоровой диеты. Дальнейшие исследования в области питания и эпигенетики может принести значительную пользу общественному здравоохранению, а персонализированное питание может стать частью медицинской программы пациента.
Мозг регулирует кишечник и его микробиоту посредством нейроанатомических, иммунологических и нейроэндокринных нейросетевых путей, сообщающихся с помощью нейромедиаторов, нейропептидов или продуктов микробного происхождения, влияющих на микробиоту кишечника. Соответственно, микробиота кишечника влияет на мозг. Эти два способа формируют двунаправленную связь и взаимодействие между кишечником и мозгом [44–45].
Дисбактериоз кишечника может быть вызван различными факторами окружающей среды, в том числе, такими как диета, стресс, воздействие антибиотиков, токсинов, лекарств и патогенов.
В исследовании [46], установлено, что микробиом играет ключевую роль в сохранении здоровья и профилактике заболеваний, и существует значительный интерес к терапевтическому таргетированию микробиома, а также к разработке этого богатого ресурса в усилиях по открытию лекарств. Однако все больше данных свидетельствует о том, что микробиота кишечника сама может влиять на действие целого ряда ксенобиотиков, как благотворно, так и потенциально вредно. Традиционно клинические исследования, оценивающие фармакокинетику новых лекарственных средств, в основном игнорируют важное прямое и косвенное влияние микробиома кишечника на метаболизм и эффективность лекарственных средств. Несмотря на некоторые важные наблюдения за метаболизмом ксенобиотиков в целом, существует лишь неполное представление о масштабах влияния микробиома конкретно на метаболизм и абсорбцию лекарственных средств, а также о том, как это может влиять на системные концентрации исходных соединений и токсичных
метаболитов. Значение как микробного метаболизма ксенобиотиков, так и влияния микробиома кишечника на ферментные системы печени хозяина, тем не менее, набирает обороты и представляет собой дополнительную проблему в усилиях по открытию лекарственных средств, имеющих последствия для улучшения результатов лечения или противодействия неблагоприятным лекарственным реакциям. В настоящее время микробные факторы должны учитываться при определении фармакокинетики лекарственных средств и влияния, которое эволюционирующий и динамичный микробиом может оказывать в этом отношении. Интегрировав вклад микробиома кишечника в сохранение здоровья и патогенез болезней к метаболизму ксенобиотиков, сосредоточив внимание на терапевтических вмешательствах, фармакологическом действии лекарственных средств и химических биотрансформациях, которые в совокупности являются стратегическими в доказательной медицине.
Локализация и пространственная организация кишечной микробиоты неоднородны по всему желудочно-кишечному тракту. Эта динамическая экосистема кишечника состоит из многих уникальных особенностей, таких как микрониши, градиенты pH и динамические микробно-тканевые взаимодействия, имеющие отношение к микробной биотрансформации. Самая высокая плотность бактерий присутствует в толстой кишке, причем последние оценки 1013 бактериальных клеток в толстой кишке связаны с микробными генами, кодирующими широкий спектр ферментов, необходимых для биотрансформации ксенобиотиков. Эти бактерии, вероятно, наиболее важны для фармакомикробиомики и обитают в реакционной камере со средним рН 6,4–7,0 и более низким окислительно-восстановительным потенциалом, чем другие желудочно-кишечные ниши. Парциальное давление кислорода по желудочно-кишечному тракту также вносит свой вклад в эти метаболические ниши.
На композиционные характеристики микробиома кишечника оказывает влияние целый ряд факторов, при этом начальный посев и траектория движения к здоровому подобию взрослому разнообразию и стабильности определяются способом доставки (естественный или кесарево сечение) и ранними схемами кормления (грудное вскармливание против искусственного вскармливания). Генетика хозяина также играет определенную роль, как и географическое положение, в то время как стресс на протяжении всей жизни может рассматриваться как угроза для разнообразия микробиома кишечника. Считается также, что «западная» диета нарушает целостность микробиома кишечника, в то время как повышенное потребление клетчатки связано с повышенным разнообразием. Физические упражнения могут также способствовать стабильности микробиома здоровья, хотя процесс старения связан с сужением разнообразия, как и многие болезненные состояния и чрезмерное/ нецелесообразное использование антибиотиков [46].
Исследованы [46], микробные биотрансформации, свидетельствуют, что комплексные различия могут не обязательно приравниваться к функциональным изменениям, индивидуально-специфический генетический состав генома хозяина объясняет некоторые различия в характеристиках микробиома кишечника и может влиять на метаболические результаты. Например, микробные ферменты, такие как β-глюкуронидазы, могут отличаться по селективности субстрата и активности, в зависимости от бактерий, из которых они возникают. Другие известные факторы, влияющие на состав микробиома кишечника, такие как возраст, гормональный статус и пол, также перекрываются с переменной фармакокинетикой препарата и влияют на относительное содержание генов, кодирующих ферменты метаболизма ксенобиотиков. Метаболизм ксенобиотиков хозяина также зависит от циркадианных ритмов, и это может также быть истинно микробной ферментативной
деятельности потому что структура сообщества микробиоты кишечника и метаболически деятельность также отличают биологическими ритмами. Также пока не ясно, сколько переменных, связанных с изменением состава и стабильности микробиома кишечника, в том числе диеты и географии, оставляют свой след на способности к ксенобиотическому метаболизму. Одним из примером модифицируемой природы микробиома кишечника в контексте диеты и географии является передача бактериальных генов, кодирующих порфираназы, агаразы и связанные с ними белки от морских красных водорослей к бактериям, обитающим в желудочно-кишечном тракте японских индивидуумов в результате их потребления морскими водорослями [46].
Многие ксенобиотики также влияют на характеристики микробиома кишечника. Это включает в себя фармацевтические соединения, такие как метформин и метотрексат, и психотропные агенты, такие как Оланзапин. Другие рецептурные препараты связаны с изменениями в разнообразии микробиома кишечника, включая ингибиторы протонной помпы, опиоиды и нестероидные противовоспалительные препараты. Пищевые соединения также оказывают значительное влияние на микробиом кишечника, включая полифенольные фитохимические вещества (ресвератрол, флавоноиды), полиненасыщенные жирные кислоты и сложный эфир растительного стерола. Кроме того, экологические и промышленные химикаты, включая эндокринные разрушающие химикаты, тяжелые металлы, пестициды и загрязнители, оказывают влияние на структуру, состав и функцию микробиома кишечника [46].
Микробиота кишечника экспрессирует более 3,3 миллиона бактериальных генов, в то время как геном человека экспрессирует только 20 тысяч генов. Ген-продукты микроба оказывают решающее влияние на регуляцию переваривания пищи и развитие иммунной системы. Исследования подтверждают [47], что манипуляции с непатогенными бактериальными штаммами в организме хозяина могут стимулировать восстановление иммунного ответа на патогенные бактерии, вызывающие заболевания. Различные подходы, включая использование нутрицевтиков (пребиотиков и пробиотиков), а также фагов, сконструированных с помощью систем CRISPR/Cas, были разработаны в качестве новых методов лечения дисбиоза (изменений в микробном сообществе) и распространенных заболеваний (например, диабета, ожирения и др.).
В исследовании [47], был сделан прогноз на действия и молекулярные подходы, направленные на защиту окружающей среды и микробных экосистем человека. Измерения экологических, филометагеномных и микробных метаболических изменений в микробиомах требуют специализированного и сложного набора знаний. Сотрудничество между университетами, исследовательскими учреждениями, неправительственными организациями и специалистами фармацевтической промышленности имеют ключевое значение для оценки как биологического, так и фармацевтического воздействия на экосистемы и выяснения механизма действия новых соединений в организме хозяина и его микробиомах. Полезность метагеномной функциональной реконструкции для прямой ассоциации функций сообщества с фенотипом среды обитания и хозяина будет иметь решающее значение для надлежащего изучения конструкций и производства более экологичных фармацевтических продуктов для будущей персонализированной медицины.
Современное и своевременное внедрение эпигенетических постулатов питания от «Здоровое питание матери — лучшее начало жизни» до «Здоровое питание человека — обеспеченное здоровое старение» позволит эффективной реализации программ долголетия и сверхдолголетия H. sapiens и мозга H. sapiens .
Эпигенетика предполагает более широкое представление о развитии организма и функционировании генома и рассматривает гены и окружающую среду комплексно, как две неразрывно функционирующие системы, и объясняет такие биологические явления, как пластичность развития и образование множества фенотипов на основе одного генотипа.
Эпигенетические механизмы задействованы от внутриутробного развития ребенка до старения в более позднем возрасте. Функциональные продукты питания и их целевые пищевые компоненты могут вызывать защитные эпигенетические модификации на протяжении всей жизни, причем питание на ранних этапах жизни особенно важно. Помимо генетики, общее состояние здоровья индивидуума можно рассматривать как интеграцию многих экологических сигналов, начинающихся в период беременности и действующих на протяжении жизнедеятельности через эпигенетические модификации.
Микро- и макронутриенты функциональных продуктов питания в сочетании с фруктами и овощами могут оказывать сходное воздействие на ДНК с эпигенетическими препаратами. Более глубокое понимание эпигенетических эффектов и сигнальных путей, активируемых функциональными пищевыми компонентами, оказывает потенциальную пользу питательных веществ, для нашего здоровья и снижения восприимчивости к возраст-ассоциированным заболеваниям. Питательная (функционально-сбалансированная) эпигенетика может сочетаться с лекарственными средствами для синергического воздействия в целях лечения или профилактики и быть адаптирована для беременных женщин с целью снижения бремени хронических заболеваний у потомства посредством «эпигенетически здоровой» диеты. Как в развитых, так и в развивающихся странах оптимизация рациона питания матерей является сложной проблемой общественного здравоохранения. Будущая работа в области питания и эпигенетики может принести значительную пользу общественному здравоохранению, а персонализированное питание может стать частью медицинской программы пациента.
Модификации метаболической экспрессии генов включают краткосрочное метилирование гистонов, ацетилирование, фосфорилирование, убиквитинирование и более долгосрочный сайленсинг ДНК как результат метилирования ДНК.
Современная эпигенетическая защита мозга H. sapiens позволяет с помощью генетических и эпигенетических программ старения управлять здоровым долголетием, посредством мультимодальных инструментов:
–комбинированного и гибридного информационного кластера в диагностике, лечении, профилактике и реабилитации когнитивных нарушений и когнитивных расстройств;
–регуляции эпигенетических часов под контролем искусственного интеллекта для ранней диагностики, лечения и профилактики здорового старения H. sapiens ;
–эпигенетического регулирования сердечно-сосудистого старения для замедления развития сосудистой деменции и болезни Альцгеймера;
–профилактики полипрагмазии через комбинированное применение питательной эпигенетики и фармэпигенетики;
–нутригенетики и нутригеномики — персонализированного функционального питания «мозга и микробиоты» — медицинской программы пациента;
–биочипирования, нейронных и мозговых чипов, технологий секвенирования следующего (нового) поколения для создания информативных биомаркеров;
–новой эпигенетики H. sapiens и мозга H. sapiens [1–2].
Количество видов бактерий пищеварительного тракта человека достигает от 10 тысяч штаммов — до 50 тысяч. Количественное содержание этих бактерий находится в пределах сотен триллионов, а с вирусами — превышает квадриллион. Количество генов в хромосомах человека достигает 25000; микрогеном включает до 5–10 миллионов генов. Восстановление (замена) всех эукариотических клеток у человека требует не менее 20–25 лет, за это время все симбиотические микроорганизмы меняются не менее пяти-шести раз, что свидетельствует о высокой адаптационной способности человеческого надорганизма. Более 80% энергии человека синтезируется в митохондриях, 20% энергетического обеспечения человека приходится на микроорганизмы кишечника. Установлено, что 90% энергии для клеток пищеварительного тракта производится кишечными бактериями. Именно микроорганизмы являются ключевым звеном, стартерами возникновения, а затем эволюции и разнообразия биологической жизни, включая человека, на нашей планете. Молекулярными, клеточными и средовыми основами здоровья и долголетия являются метагеном и эпигеном человека и полноценность их реализации в конкретных условиях его жизнедеятельности.
Нейродегенеративные и возраст-ассоциированные хронические заболевания, при которых имеют место такие патофизиологические проявления как нестабильность генома и эпигенома, окислительный стресс, хроническое воспаление, укорочение теломер, утрата протеостазиса, митохондриальные дисфункции, клеточное старение, истощение стволовых клеток и нарушение межклеточной коммуникации преимущественно инициируются несбалансированным питанием и дисбалансом симбиотической кишечной микробиоты.
С возрастом эффективность работы системы активные радикалы / антиоксидантная защита снижается, что приводит к нарушению работы дыхательной цепи переноса электронов и уменьшению образования АТФ. Увеличение образования активных радикалов кислорода и липидов в митохондриях сопровождается повреждением функций последних и приводит к преждевременной гибели клеточных структур и клеток. Долголетию способствует повышенная активность ряда белков, связанных с антиоксидантной защитой (Mn-SOD; Cu/Zn, SOD; митохондриальная каталаза). Активные радикалы усиливают пролиферативные процессы и выживаемость клеток в ответ на физиологические стрессы и сигналы, активируя компенсаторные гомеостатические ответы.
SOD; митохондриальная каталаза). С другой стороны, в результате пищеварительной деятельности кишечной микробиоты образуется огромное количество разнообразных низкомолекулярных соединений, в том числе и обладающих нейрогормональной активностью.
Понимание механизмов функционирования генома, эпигенома, их взаимоотношений с факторами среды повышает точность диагностики заболеваний, позволяет разрабатывать персонифицированные диеты и выявлять среди известных или вновь созданных лекарственных средств те, которые имеют эпигеномную направленность.
Основное внимание для реализации этого подхода уделяется созданию персонифицированных пищевых рационов для родителей (прежде всего женщин в детородном возрасте) и детей во все периоды их жизни после рождения, а также сохранению и восстановлению кишечной микробной экологии будущих матерей, беременных и кормящих женщин. Большое значение имеет поддержание на нужном уровне всех этапов становления и сукцессии микробиоты кишечника будущего человека. Более широкое применение для оптимизации пищевых рационов населения находят функциональные продукты питания, позволяющие целенаправленно конструировать пищевые рационы с учетом этнической принадлежности потребителей, их возраста, профессии, экологических и географических особенностей регионов их проживания.
Такие продукты, предназначены для систематического (регулярного) употребления в составе обычных пищевых рационов всеми группами здорового населения, сохраняющие и улучшающие состояние их здоровья и снижающие риск алиментарных заболеваний, благодаря наличию в составе подобных продуктов функциональных нутриентов, способных оказывать благоприятный эффект на физиологические функции, метаболические и/или поведенческие реакции организма человека. В категорию функциональных продуктов относят продукты, естественно содержащие требуемые количества функционального ингредиента или группы их; натуральные продукты, дополнительно обогащенные каким-либо функциональным ингредиентом или группой их; натуральные продукты, из которых удален компонент, препятствующий проявлению физиологической активности присутствующих в них функциональных ингредиентов; натуральные продукты, в которых исходные потенциальные функциональные ингредиенты модифицированы таким образом, что они начинают проявлять свою биологически активную физиологическую активность или эта активность усиливается; натуральные пищевые продукты, в которых в результате тех или иных модификаций биоусвояемость входящих в них функциональных ингредиентов увеличивается; натуральные или искусственные продукты, которые в результате применения комбинации вышеуказанных технологических приемов, приобретают способность сохранять и улучшать физическое и психическое здоровье человека и/или снижать риск возникновения заболеваний.
Кишечная микробиота играет жизненно важную роль в различных аспектах здоровья человека. Многочисленные исследования связали изменения в микробиоте кишечника с развитием различных заболеваний. Среди огромного бактериального сообщества кишечника бифидобактерии — это род, который доминирует в кишечнике здоровых грудных детей, тогда как в зрелом возрасте уровни ниже, но относительно стабильны. Наличие различных видов бифидобактерий изменяется с возрастом, от детства до глубокой старости. Bifidobacterium longum, B. breve и B. bifidum как правило, доминируют у новорожденных, тогда как B. catenulatum, B. adolescentis и, а также B. longum они более распространены у взрослых [48].
Убедительные доказательства указывают на наличие окна возможностей в ранней жизни, во время которого изменения в кишечной микробной колонизации могут привести к иммунной дисрегуляции, которая предрасполагает восприимчивых хозяев к заболеванию. Хотя экологические закономерности микробной сукцессии в первый год жизни были частично определены в конкретных человеческих группах, таксономические и функциональные особенности, а также пороги разнообразия, характеризующие эти микробные изменения, по большей части неизвестны. Установлены, наиболее важные связи между временной мозаикой микробной колонизации кишечника и зависящими от возраста иммунными функциями, которые зависят от них. Взаимодействие между сложной экосистемой и иммунной системой хозяина ведет к пониманию важности темпорально структурированных структур разнообразия, ключевых групп и межцарственных микробных взаимодействий для экосистемных функций имеет большой потенциал для разработки биологически обоснованных мероприятий, направленных на поддержание и/или улучшение развития иммунной системы и предупреждение заболеваний.
В конечном счете, выявление критических событий и факторов, влияющих на устойчивость и функционирование микробиома, позволит разработать эффективные мероприятия, направленные на поддержание и/или улучшение развития иммунной системы и профилактику заболеваний. Выполнен огромный объем работы, чтобы понять зависимость иммунной системы от микробиома кишечника ребенка, многое еще предстоит выяснить о конкретных механизмах, ответственных за эту подготовку. Улучшение нашего понимания будет происходить в результате продолжения междисциплинарных совместных усилий иммунологов, микробиологов, клиницистов, биоинформатиков и экологов [49].
Микробиота младенцев и взрослых имеет важное значение для физиологических метаболических процессов (пищеварения) и должна быть способна снабжать хозяина метаболическими предшественниками, биологически активными молекулами, которые не присутствуют в основном в рационе и не производятся самим хозяином. Поглощение питательных веществ происходит на уровне кишечного барьера, обширной поверхности эпителия около 400 м2 поддерживается за счет плотного соединения между ячейками. Здоровая микробиота кишечника может модулировать метаболизм хозяина эпигенетической регулировкой. Следовательно, измененный состав микробиоты будет подавать аберрантный сигнал клеткам-хозяевам, что приведет к нарушению обмена веществ [50].
В настоящее время, мало что известно об отдаленном влиянии этих бактерий на эукариотическую эпигенетическую регуляцию. В последнее время дифференциальное метилирование ДНК и ковалентная модификация гистонов, регулирующих транскрипцию генов, были связаны с питанием. Было показано, что как недостаточное, так и избыточное питание во время беременности и/или лактации индуцируют устойчивые модификации потомства через программирования генетического наследования. Связь между микробиотой и эпигенетическими модификациями должна быть дополнительно исследована. Эпигенетика проявляет унаследованные характеристики (так называемое «эпигенетическое программирование»), именно клеточное микроокружение (бактериальные поверхностные антигены и секретируемые белки, низкомолекулярные соединения из бактерий и биологически активные молекулы, поступающие через диету и обрабатываемые кишечной микробиотой) остается неизменным от одного поколения к другому [50].
«Микробиологическая память» будет доставлять прямые и случайные сигналы в целевую ячейку. После поверхностного взаимодействия клеток (например, растворимое бактериальное соединение, взаимодействующее с рецепторным комплексом клеточной поверхности) внутриклеточные пути активации сигнала будут модулироваться (например, фосфорилирование цитоплазматических белков киназами, ядерная транслокация факторов транскрипции), тем самым влияя на баланс между активацией и генетическим блокированием транскрипции метилированием ДНК и нкРНК. Нуклеосомы состоят из гистонов и двуцепочечной ДНК. Когда динуклеотиды CpG не этилируются в области промотора гена, РНК-полимераза (РНКпол) может связывать и активировать транскрипцию. Метилирование CpG-динуклеотидов (красные символы) метилтрансферазами ДНК рекрутирует гистондиацетилазу (HDAC)/гистоновый комплекс метилтрансферазы (HMT), который в свою очередь удалит ацетильные группы из гистонов и метилирует специфические остатки, общий эффект которых заключается в подавлении транскрипции. Показана также транскрипционная и / или трансляционная интерференция некодирующей РНК (нкРНК) [50].
Исследовано [50], что передача биологической информации от одного поколения к другому основана на ДНК, то наиболее наследуемые фенотипические признаки, такие как хронические метаболические заболевания, не связаны с генетической вариабельностью последовательностей ДНК. Негенетическая наследуемость может иметь несколько причин, включая эпигенетический, родительский эффект, адаптивное социальное обучение и влияние экологической среды. Различение этих причин имеет решающее значение для разрешения основных фенотипических загадок.
Убедительные доказательства указывают на то, что изменения в экспрессии ДНК через различные эпигенетические механизмы, могут быть связаны, со сходством между родителями и потомством с точки зрения чувствительности к метаболическим заболеваниям. Среди негенетических наследуемых признаков функциональное питание объясняет долгосрочное программирование экспрессии генов, ответственных за метаболические заболевания во взрослом возрасте. Питание может формировать неадекватную микробиоту кишечника (дисбиоз), вызывая эпигенетическое дерегулирование транскрипции, которое может наблюдаться при хронических заболеваниях обмена веществ. Дисбиоз может быть основной причиной наследуемых эпигенетических паттернов, обнаруженных в связи с метаболическими заболеваниями. Последние достижения в области микробиома кишечника, подтверждают гипотезу о том, что микробиота кишечника может способствовать молекулярному перекрестному столкновению между бактериями и окружающими клетками-хозяевами, которое контролирует патологическую эпигенетическую сигнатуру.
Микробиологическая память – это основной регулятор эпигенетических сигнатур, тем самым указывая, что различные причины негенетической наследуемости могут взаимодействовать в сложных путях для получения наследования.
Комбинированное основное действие различных эпигенетических факторов на человека из различных источников, присутствующих в окружающей среде. Хотя некоторые из них могут быть полезны для здоровья и поведения, другие могут быть вредными и мешать телу и головному мозгу, создавая дисбаланс, который может проявляться как болезнь или психологическое расстройство. Некоторые из перечисленных благотворных влияний включают физические упражнения, микробиом (полезные кишечные бактерии) и альтернативную медицину, в то время как вредные влияния включают воздействие токсичных химических веществ и наркотиков злоупотребления. Такие факторы, как диета, сезонные изменения, финансовое положение, психологическое состояние, социальные взаимодействия, терапевтические препараты и воздействие болезни, могут оказывать благотворное или вредное воздействие в зависимости от конкретного характера воздействия. Таким образом, окружающая среда дополняет и формирует здоровье человека.
Микробиологическая память будет оставаться стабильной, когда рацион питания и микробиота остаются почти неизменными. Согласно этой модели, в настоящее время известно как эпигенетическое программирование, вероятно, является не более чем негенетической наследуемой сигнатурой, возникающей в результате молекулярного скрещивания между прокариотами кишечника (метаболитом микробиоты) и эукариотическими клетками. Эта перекрестная помеха вызвала бы непрерывную перестройку клеточных генов через активацию сигнальных путей в клетках-хозяевах, тем самым контролируя эпигенетическую сигнатуру. Эпигенетика может быть исследована более или менее простым способом, изучая сигнатуру заболеваний, влияние микробиологической памяти гораздо труднее расшифровать из-за вовлечения многих переменных. Исследования очень необходимы для того, чтобы различать, что является причинным и что является совместным явлением в триаде «диете-микробиоте-эпигенетике» [50].
Оба хозяина клетки и микробы взаимодействуют друг с другом через множество молекул и механизмов, которые зависят от способности обоих типов ячеек адаптироваться к данной среде, то есть кишечнику хозяина; a при лечении, т. е. специальном рационе питания; или при воспалении кишечника. Эти механизмы являются гибкими, поскольку бактерии, особенно патобиоты, используют свой спящий арсенал вирулентности в зависимости от патофизиологического статуса хозяина [51].
В исследовании [52], установлена сильная связь между микробиотой кишечника и многими заболеваниями человека, и понимание динамических перекрестных связей взаимодействия хозяина и микроба в кишечнике стало необходимым для обнаружения, профилактики или терапии заболеваний. Диета, питательные вещества, фармакологические факторы и многие другие стимулы играют доминирующую роль в модуляции микробных композиций кишечника. Факторы, связанные с эпителием, включая врожденные иммунные сенсоры, антимикробные пептиды, слизистый барьер, секреторные IgAs, эпителиальные микроворсинки, эпителиальные плотные соединения, метаболизм эпителия, кислородный барьер и даже микроРНК участвуют в формировании микробиоты. Указанные факторы, клеточного кишечного эпителия селективно «выбирают» микробы и влияют на микробный состав. Полученные результаты, предоставляют возможность для более эффективного контроля многих заболеваний и прогнозирования клинического успеха трансплантации фекальной микробиоты [52].
Важным фактором является понимание того, что соизмеримые микроорганизмы, которые составляют человеческую микробиоту, являются не просто пассажирами в хозяине, но могут фактически управлять определенными функциями [53]. Микробиота и ее микробиома, как установлено, имеют не только ассоциацию, но и ключевую модулирующую роль. Благодаря лучшему пониманию механизмов и вклада микробиоты в эти заболевания, будут разработаны новые терапевтические средства и стратегии для модулирования микробиоты для лечения или профилактики заболеваний. Кроме того, в некоторых случаях это может быть возможность использования микробиомы для выявления заболеваний, связанных с кишечником, до проведения обычной диагностики. В будущем будет проводиться стратификация пациентов более точно для более эффективного лечения. Заболевания печени и микробиота кишечника. Печень получает 70% своего кровоснабжения из кишечника через портальную вену, таким образом, она постоянно подвергается воздействию кишечных факторов, включая бактериальные компоненты. В настоящее время установлено, что микробиота кишечника и хронические заболевания печени тесно связаны между собой. Дисбиоз кишечника, целостность кишечного барьера и механизмы иммунного ответа печени на гуморальные факторы, полученные из кишечника, свидетельствуют о потенциальной актуальности разработки новых методов лечения хронических заболеваний печени [53].
Научные данные, касающиеся микробиоты кишечника, позволяют объяснить связь между питательными веществами и чертами человека. Микробиота кишечника не только непосредственно взаимодействует с соматическими клетками своего хозяина, влияя на особенности человека, как в случае тренировки иммунологических сетей, но и вырабатывает различные химические вещества, которые могут непосредственно модифицировать биохимические пути человека.
Состав микробиоты кишечника колеблется в зависимости от поглощения питательных веществ его хозяином, и состав микробиоты кишечника влияет на различные человеческие черты так же сильно, как и наши гены. Поэтому вполне разумно предположить, что воздействие питательных веществ на человеческие черты будет представлять собой комбинированные результаты как микробиоты кишечника, модифицированной поглощением питательных веществ, так и самих питательных веществ. Исследовано, что микробиота кишечника является недостающим звеном между питательными веществами и модификациями человеческих черт [54].
Влияние микробиоты кишечника на фенотипы человека стало бурно развивающейся областью исследований и представляет собой новую парадигму возможностей для применения в медицине и пищевой промышленности [54].
Многочисленные современные исследования, установили следующие функции кишечной микробиоты:
-
1. Защитная функция (колонизационная резистентность) заключается в предотвращении колонизации желудочно-кишечного тракта условно-патогенными и патогенными микроорганизмами. Микробный антагонизм реализуется посредством конкуренции за питательные вещества и рецепторы адгезии, а также за счет выработки органических кислот, перекиси водорода, антибиотикоподобных веществ — бактерицинов, препятствующих росту патогенных микроорганизмов.
-
2. Пищеварительная функция реализуется за счет, как регуляции функций кишечника, так и непосредственной утилизации питательных субстратов. Облигатная микрофлора толстой кишки в норме обеспечивает конечный гидролиз белков, омыление жиров, сбраживание высокомолекулярных углеводов, которые не абсорбировались в тонкой кишке. Протеолитические микроорганизмы (бактероиды, нормальная кишечная палочка) ферментируют протеины. Некоторые поступающие с пищей вещества могут метаболизироваться только кишечной микрофлорой. Так, сахаролитическая микрофлора расщепляет целлюлозу и гемицеллюлозу до короткоцепочечных жирных кислот.
-
3. Детоксикационная и антиканцерогенная функция. Нормальная микрофлора способна нейтрализовать многие токсические субстраты и метаболиты (нитраты, ксенобиотики, гистамин, мутагенные стероиды), предохраняя энтероциты и отдаленные органы от воздействия повреждающих факторов и канцерогенов.
-
4. Синтетическая функция. Нормальная микрофлора обеспечивает синтез многих макро- и микронутриентов: витаминов группы В, С, К, фолиевой, никотиновой кислоты. Только кишечная палочка синтезирует 9 витаминов. Синтез гормонов и биологически активных веществ лежит в основе регуляторного действия микрофлоры на функции внутренних органов и ЦНС.
-
5. Иммунная функция. Как известно, слизистая оболочка кишечника обладает собственной лимфоидной тканью, известной как GALT (gut-associated lymphoid tissue), которая является одним из значимых компонентов иммунной системы макроорганизма. В слизистой оболочке кишечника локализовано около 80% иммунокомпетентных клеток, 25% слизистой оболочки кишечника состоит из иммунологически активной ткани. Таким образом, кишечник можно рассматривать как самый большой иммунный орган человека. Микрофлора участвует в формировании как местного (активация продукции IgA, фагоцитарной активности), так и системного иммунитета. Само наличие бактерий оказывает постоянное антигенное тренирующее действие.
-
6. Генетическая функция. Микробиота является своего рода «генетическим банком», обмениваясь генетическим материалом с клетками человека путем фагоцитоза. В результате этого микробиота приобретает рецепторы и другие антигены, присущие хозяину и делающие ее «своей» для иммунной системы. Эпителиальные ткани в результате такого обмена приобретают бактериальные антигены. Известно также, что микроорганизмы влияют на экспрессию генов макроорганизма.
-
7. «Суперорганизменная». Кишечная микрофлора — сложнейший «суперорганизм», не уступающий любому другому жизненно важному органу.
Технология производства функциональных продуктов питания. Функционально-макробиотические продукты из мытого, цельного зерна (пшеницы, риса, гречки, овса, ржи, кукурузы, сои, проса, пшена), термообработанного с использованием технологии взрыва (паром), и содержат натуральные не подвергнутые термической обработке растительные добавки: расторопши, льна, амаранта, топинамбура, тыквы, шиповника, кедра, ламинарии, стевии, спирулина, виноградной косточки. Инновационность цикла приготовления готового лечебного продукта питания заключается в использовании современных нанотехнологий с применением импульсного теплового воздействия длительностью 10 сек. Импульс обеспечивает разрыхление зернового продукта из внутри клетки 7–10 сек и измельчение пектиновых связей в растительном сырье, тем самым улучшается биологическая доступность растительной клетки [4].
В исследовании [3–4], под наблюдением находились 41 пациент с различной патологией желудочно-кишечного тракта:
–хроническим панкреатитом — 14,
–эрозивным гастритом — 7,
–гастроэзофагеальной рефлюксной болезнью — 5,
–хроническим гастродуоденитом — 3,
–постхолецистэктомическим синдромом — 6,
–синдромом раздраженного кишечника с преобладанием запоров — 4,
–язвенной болезнью двенадцатиперстной кишки — 2.
Средний возраст больных составил 57,1±1,3 года. У большинства пациентов имело место сочетание 2 или 3 гастроэнтерологических заболеваний. Стеатогепатоз имел место у 5, стеатогепатит — у 3, гипомоторная дискинезия толстой кишки — у 7 пациентов.
Больные были разделены на 2 группы: 31 пациент составил основную группу, 10 — контрольную. Пациенты основной группы получали ФПП «Самарский здоровяк» с фитокомпопентами, по 60 г 2 раза в день (утром и вечером). 31 пациент получал питание «Самарский здоровяк» с фитокомпонентами на фоне комплексной медикаментозной и физиобальнеотерапии.
Контрольная группа (10 пациентов) принимали ФПП «Самарский здоровяк» без какой-либо терапии.
При поступлении в реабилитационный комплекс больные предъявляли жалобы на боли в эпигастрии (46,3%) и в правом подреберье (26,8%), изжогу (44%), дискомфорт в эпигастрии (32%) и в правом подреберье (20%), вздутие и урчание живота (39%), горечь во рту (19,5%), отрыжку (54%), тошноту (10%), запоры (56%), диарею (12,2%).
При оценке синдрома цитолиза учитывали уровни АЛТ и АСТ в крови. Синдром холестаза оценивали по уровню билирубина, щелочной фосфотазы и ГГТП в крови, липидный обмен — по уровню холестерина, холестерина ЛПНП, холестерина ЛПОНП, холестерина ЛПВП и триглицеридов.
Исследование биоценоза кишечника у 41 больного выявило нарушение нормального состава микрофлоры толстой кишки до лечения (у 85,3% пациентов).
У обследованных больных выявлены общие закономерности в характеристике эубиотического состояния толстой кишки: изменено общее количество микроорганизмов с одновременным снижением содержания бифидобактерий, лактобактерий и кишечной палочки; отмечены качественные изменения микрофлоры толстой кишки; выявлен высокий процент высевания условно-патогенных энтеробактерий: гемолитических и лактозонегативных штаммов кишечных палочек, клостридий, грибов рода Кандида.
У 95,0% находившихся под наблюдением больных установлено положительное восстановление биоценоза кишечника [1–2].
Таким образом, понимание механизмов функционирования генома, эпигенома, их взаимоотношений с факторами окружающей среды повышает точность диагностики заболеваний, позволяет разрабатывать персонифицированные функциональные диеты и выявлять среди известных или вновь созданных лекарственных средств те, которые имеют эпигеномную направленность.
Нейроось «микробиота-кишечник-мозг» представляет собой динамическую матрицу тканей и органов, включая желудочно-кишечную микробиоту, иммунные клетки, ткани кишечника, железы, вегетативную нервную систему и головной мозг, которые взаимодействуют сложным разнонаправленным образом через ряд анатомически и физиологически различных систем. Долгосрочные возмущения этой гомеостатической среды могут способствовать прогрессированию ряда нарушений путем изменения физиологических процессов, включая активацию гипоталамо-гипофизарно-надпочечниковой оси, нейромедиаторных систем, иммунной функции и воспалительной реакции [55].
Продолжаются исследования того, что триллионы микробов, населяющих наш кишечник, являются существенным фактором, способствующим психическому здоровью и, в равной степени, прогрессированию нервно-психических расстройств. Экстраординарная сложность экосистемы кишечника и ее взаимодействие с кишечным эпителием для проявления физиологических изменений в головном мозге, влияющих на настроение и поведение. H. sapiens имеет уникальное сообщество микробиоты и здоровой биомикробиоты, которая меняется под воздействием ряда факторов, включая диету, физические упражнения, стресс, состояние здоровья, генетику, «свою полипрагмазию» и т. д.
Современные инструменты и методики эпигенетической, диетической и биомикробиотической защиты здорового старения — это междисциплинарные, межвузовские и межведомственные направления, которые фокусируются на изучении нервной системы и влияния мозга на поведение и мыслительную способность людей [1–2].
Новая эпигенетика H. sapiens управляет взаимодействием эпигенетических механизмов старения и долголетия с биологией, биофизикой, физиологией и факторами окружающей среды в регуляции транскрипции. Старение — это структурно-функциональная перестройка (перепрограммирование) и постепенное снижение физиологических функций организма, которые приводят к возрастной потере профессиональной пригодности, болезням, и к смерти. Понимание причин здорового старения составляет одно из самых проблемных междисциплинарных направлений.
Генетический и эпигенетический вклад в старение и долголетие человека огромен. В то время как факторы окружающей среды и образа жизни важны в более молодом возрасте, вклад генетики проявляется более доминантно в достижении долголетия и здоровой старости. Эпигеномные изменения во время старения глубоко влияют на клеточную функцию и стрессоустойчивость. Дисрегуляция транскрипционных и хроматиновых сетей, вероятно, является важнейшим компонентом старения. В ближайшем будущем искусственный интеллект и крупномасштабная биоинформационная система анализа сможет выявить вовлеченность многочисленных сетей взаимодействия.
Американские и корейские ученые выяснили, что гепарин, входящий в состав морских водорослей блокирует новый коронавирус лучше, чем ремдесивир — главный препарат от
COVID-19, применяемый в США. Хорошо известный антикоагулянт гепарин обладает исключительным сродством связывания со спайковым белком (S-белком) SARS-CoV-2 [56]. S-белок SARS-CoV-2 более плотно связывается с иммобилизованным гепарином (КД= ~10-11M) чем S-белки любого из SARS-CoV (КД= ~10-7М) или БВРС-КоВ (КД= ~10-9М). Однако неизвестно, приводит ли плотное связывание гепарина с S-белком SARS-CoV-2 к мощной противовирусной активности [57].
Выводы
Микробиологическая память будет оставаться стабильной, когда рацион функционального (здорового) диетического питания и здоровая биомикробиота остаются почти неизменными.
Новая управляемая здоровая биомикробиота и персонализированное функциональное и сбалансированное питание «мозга и микробиоты» — это долговременные медицинские программы пациента, которые позволяет проведению профилактики полипрагмазии.
Персонализированные функциональные диеты на основе алгоритмов искусственного интеллекта улучшают гликемические реакции на диетические продукты. Другие персонализированные терапевтические применения диетической-иммуно-метаболической оси включают функциональные пробиотические добавки и/или функциональное диетическое планирование, основанное на профилях микробиома.
Иммунная система человека и микробиота совместно эволюционируют, и их сбалансированное системное взаимодействие происходит в течение всей жизни. Эта тесная ассоциация и общий состав, и богатство микробиоты играют важную роль в модуляции иммунитета хозяина и могут влиять на иммунный ответ при вакцинации.
Наличие инновационных технологий, таких как секвенирование следующего нового поколения и коррелированные инструменты биоинформатики, позволяют глубже исследовать перекрестные нейросетевые взаимосвязи между микробиотой и иммунными реакциями человека.
Микробиота представляет собой ключевой элемент, потенциально способный влиять на функции антигена вызывать защитный иммунный ответ и на способность иммунной системы адекватно реагировать на антигенную стимуляцию (эффективность вакцины), действуя в качестве иммунологического модулятора, а также природного адъюванта вакцины.
Функциональные продукты питания, здоровая биомикробиота, здоровый образ жизни и управляемое защитное воздействия окружающей среды, искусственный интеллект и электромагнитная информационная нагрузка/перегрузка – ответственны за работу иммунной системы и ее способности своевременного иммунного ответа на пандемические атаки.
Совершенствование стратегий иммунизации и географического успеха вакцинации, взаимосвязаны с искусственным интеллектом и инновационными инструментами, моделированием и управлением иммунной защитой и индивидуальным иммунным ответом.
Мультимодальные инструменты, биочипирование, нейронные и мозговые чипы, технологии секвенирования следующего (нового) поколения создают биомаркеры для управления структурой здоровой биомикробиоты и функционального питания, в зависимости от целевых показателей.
Функциональный продукт питания с помощью биомаркеров и технологий искусственного интеллекта является целевой питательной средой как для организма в целом, так и для биомикробиоты в частности.
Список литературы Здоровая микробиота и натуральное функциональное питание: гуморальный и клеточный иммунитет
- Романчук П. И. Возраст и микробиота: эпигенетическая и диетическая защита, эндотелиальная и сосудистая реабилитация, новая управляемая здоровая биомикробиота // Бюллетень науки и практики. 2020. Т. 6. №2. С. 67-110. DOI: 10.33619/2414-2948/51/07
- Романчук П. И., Волобуев А. Н. Современные инструменты и методики эпигенетической защиты здорового старения и долголетия Homo sapiens // Бюллетень науки и практики. 2020. Т. 6. №1. С. 43-70. DOI: 10.33619/2414-2948/50/06
- Малышев В. К., Романчук П. И. Функциональные продукты питания: инновации в диетологии и кардиологии. М.-Самара, 2012. 248 с.
- Романчук Н. П. Способ производства зернового компонента для пищевого продукта быстрого приготовления и способ производства функционального пищевого продукта быстрого приготовления. Патент РФ на изобретение №2423873.
- Романчук Н. П., Пятин В. Ф. Мелатонин: нейрофизиологические и нейроэндокринные аспекты // Бюллетень науки и практики. 2019. Т. 5. №7. С. 71-85. DOI: 10.33619/2414-2948/44/08
- Романчук Н. П., Романчук П. И., Малышев В. К. Продукт диетического, профилактического и функционального питания при хронической ишемии головного мозга // Патент РФ на изобретение №2489038.
- Пятин В. Ф., Романчук Н. П., Романчук П. И., и др. Способ нормализации циркадианных ритмов человека. Патент РФ на изобретение 2533965.
- Ciabattini A., Olivieri R., Lazzeri E., Medaglini D. Role of the Microbiota in the Modulation of Vaccine Immune Responses // Frontiers in microbiology. 2019. №10. P. 1305.
- DOI: 10.3389/fmicb.2019.01305
- Tamburini S., Shen N., Wu H. C., Clemente J. C. (2016). The microbiome in early life: implications for health outcomes // Nat. Med. №22. P. 713-722.
- DOI: 10.1038/nm.4142
- Belkaid Y., Hand T. W. Role of the microbiota in immunity and inflammation // Cell 2014. №157. P. 121-141.
- DOI: 10.1016/j.cell.2014.03.011
- Kamada N., Seo S.-U., Chen G. Y., Núñez G. (2013). Role of the gut microbiota in immunity and inflammatory disease // Nat. Rev. Immunol. №13. P. 321-335.
- DOI: 10.1038/nri3430
- Wu D., Lewis E. D., Pae M., Meydani S. N. Nutritional Modulation of Immune Function: Analysis of Evidence, Mechanisms, and Clinical Relevance // Frontiers in immunology. 2019. №9. P. 3160.
- DOI: 10.3389/fimmu.2018.03160
- Zmora N., Bashiardes S., Levy M., Elinav E. The role of the immune system in metabolic health and disease // Cell Metabolism. 2017. V. 25. №3. P. 506-521.
- DOI: 10.1016/j.cmet.2017.02.006
- Malavolta M., Giacconi R., Brunetti D., Provinciali M., Maggi F. Exploring the relevance of senotherapeutics for the current SARS-CoV-2 emergency and similar future global health threats // Cells. 2020. V. 9. №4. P. 909.
- DOI: 10.3390/cells9040909
- Bass J., Takahashi J. S. Circadian integration of metabolism and energetics // Science. 2010. V. 330. №6009. P. 1349-1354.
- DOI: 10.1126/science.1195027
- Okabe Y., Medzhitov R. Tissue biology perspective on macrophages // Nature immunology. 2016. V. 17. №1. P. 9.
- DOI: 10.1038/ni.3320
- Man K., Kutyavin V. I., Chawla A. Tissue immunometabolism: development, physiology, and pathobiology // Cell metabolism. 2017. V. 25. №1. P. 11-26.
- DOI: 10.1016/j.cmet.2016.08.016
- Skalny A. V., Rink L., Ajsuvakova O. P., Aschner M., Gritsenko V. A., Alekseenko S. I.,.. Tsatsakis A. Zinc and respiratory tract infections: Perspectives for COVID-19 // International Journal of Molecular Medicine. 2020. V. 46. №1. P. 17-26.
- DOI: 10.3892/ijmm.2020.4575
- Pittet L. A., Hall-Stoodley L., Rutkowski M. R., Harmsen A. G. Influenza virus infection decreases tracheal mucociliary velocity and clearance of Streptococcus pneumoniae // American journal of respiratory cell and molecular biology. 2010. V. 42. №4. P. 450-460.
- DOI: 10.1165/rcmb.2007-0417OC
- Darma A., Ranuh R. G., Merbawani W., Setyoningrum R. A., Hidajat B., Hidayati S. N.,.. Sudarmo S. M. Zinc supplementation effect on the bronchial cilia length, the number of cilia, and the number of intact bronchial cell in zinc deficiency rats // The Indonesian Biomedical Journal. 2020. V. 12. №1. P. 78-84.
- DOI: 10.18585/inabj.v12i1.998
- Truong-Tran A. Q., Carter J., Ruffin R., Zalewski P. D. New insights into the role of zinc in the respiratory epithelium // Immunology and cell biology. 2001. V. 79. №2. P. 170-177.
- DOI: 10.1046/j.1440-1711.2001.00986.x
- Woodworth B. A., Zhang S., Tamashiro E., Bhargave G., Palmer J. N., Cohen N. A. Zinc increases ciliary beat frequency in a calcium-dependent manner // American journal of rhinology & allergy. 2010. V. 24. №1. P. 6-10.
- DOI: 10.2500/ajra.2010.24.3379
- Speth R., Carrera E., Jean-Baptiste M., Joachim A., Linares A. Concentration-dependent effects of zinc on angiotensin-converting enzyme-2 activity (1067.4) // The FASEB journal. 2014. V. 28. P. 1067.4.
- Sandstead H. H., Prasad A. S. Zinc intake and resistance to H1N1 influenza // American journal of public health. 2010. V. 100. №6. P. 970.
- DOI: 10.2105/AJPH.2009.187773
- Zhang H., Penninger J. M., Li Y., Zhong N., Slutsky A. S. Angiotensin-converting enzyme 2 (ACE2) as a SARS-CoV-2 receptor: molecular mechanisms and potential therapeutic target // Intensive care medicine. 2020. V. 46. №4. P. 586-590.
- DOI: 10.1007/s00134-020-05985-9
- Xu L., Tong J., Wu Y., Zhao S., Lin B. L. Targeted oxidation strategy (TOS) for potential inhibition of coronaviruses by disulfiram-a 70-year old anti-alcoholism drug. 2020.
- DOI: 10.26434/chemrxiv.11936292.v1
- Korant B. D., Kauer J. C., Butterworth B. E. Zinc ions inhibit replication of rhinoviruses // Nature. 1974. V. 248. №5449. P. 588-590.
- DOI: 10.1038/248588a0
- Cakman I., Kirchner H., Rink L. Zinc supplementation reconstitutes the production of interferon-α by leukocytes from elderly persons // Journal of interferon & cytokine research. 1997. V. 17. №8. P. 469-472.
- DOI: 10.1089/jir.1997.17.469
- Berg K., Bolt G., Andersen H., Owen T. C. Zinc potentiates the antiviral action of human IFN-α tenfold // Journal of Interferon & Cytokine Research. 2001. V. 21. №7. P. 471-474.
- DOI: 10.1089/10799900152434330
- Khera D., Singh S., Purohit P., Sharma P., Singh K. Prevalence of Zinc Deficiency and Effect of Zinc Supplementation on Prevention of Acute Respiratory Infections: A Non Randomized Open Label Study.
- DOI: 10.2139/ssrn.3273670
- Lang C. J., Hansen M., Roscioli E., Jones J., Murgia C., Ackland M. L.,.. Ruffin R. Dietary zinc mediates inflammation and protects against wasting and metabolic derangement caused by sustained cigarette smoke exposure in mice // Biometals. 2011. V. 24. №1. P. 23-39.
- DOI: 10.1007/s10534-010-9370-9
- Wessels I., Haase H., Engelhardt G., Rink L., Uciechowski P. Zinc deficiency induces production of the proinflammatory cytokines IL-1β and TNFα in promyeloid cells via epigenetic and redox-dependent mechanisms // The Journal of nutritional biochemistry. 2013. V. 24. №1. P. 289-297.
- DOI: 10.1016/j.jnutbio.2012.06.007
- Prasad A. S., Bao B., Beck F. W., Sarkar F. H. Zinc-suppressed inflammatory cytokines by induction of A20-mediated inhibition of nuclear factor-κB // Nutrition. 2011. V. 27. №7-8. P. 816-823.
- DOI: 10.1016/j.nut.2010.08.010
- Wellinghausen N., Martin M., Rink L. Zinc inhibits interleukin-1-dependent T cell stimulation // European journal of immunology. 1997. V. 27. №10. P. 2529-2535.
- DOI: 10.1002/eji.1830271010
- Maywald M., Rink L. Zinc supplementation induces CD4+ CD25+ Foxp3+ antigen-specific regulatory T cells and suppresses IFN-γ production by upregulation of Foxp3 and KLF-10 and downregulation of IRF-1 // European journal of nutrition. 2017. Т. 56. №5. С. 1859-1869.
- DOI: 10.1007/s00394-016-1228-7
- Von Bülow V., Dubben S., Engelhardt G., Hebel S., Plümäkers B., Heine H.,.. Haase H. Zinc-dependent suppression of TNF-α production is mediated by protein kinase A-induced inhibition of Raf-1, IκB Kinase β, and NF-κB // The Journal of Immunology. 2007. V. 179. №6. P. 4180-4186.
- DOI: 10.4049/jimmunol.179.6.4180
- Kahmann L., Uciechowski P., Warmuth S., Plümäkers B., Gressner A. M., Malavolta M.,.. Rink L. Zinc supplementation in the elderly reduces spontaneous inflammatory cytokine release and restores T cell functions // Rejuvenation research. 2008. V. 11. №1. P. 227-237.
- DOI: 10.1089/rej.2007.0613
- Osendarp S. J., Prabhakar H., Fuchs G. J., van Raaij J. M., Mahmud H., Tofail F.,.. Black R. E. Immunization with the heptavalent pneumococcal conjugate Vaccine in Bangladeshi infants and effects of zinc supplementation // Vaccine. 2007. V. 25. №17. P. 3347-3354.
- DOI: 10.1016/j.vaccine.2007.01.001
- Tsatsakis A., Tyshko N. V., Docea A. O., Shestakova S. I., Sidorova Y. S., Petrov N. A.,.. Tutelyan V. A. The effect of chronic vitamin deficiency and long term very low dose exposure to 6 pesticides mixture on neurological outcomes - A real-life risk simulation approach // Toxicology letters. 2019. V. 315. P. 96-106.
- DOI: 10.1016/j.toxlet.2019.07.026
- Wu C., Chen X., Cai Y., Zhou X., Xu S., Huang H.,.. & Song J. Risk factors associated with acute respiratory distress syndrome and death in patients with coronavirus disease 2019 pneumonia in Wuhan, China // JAMA internal medicine. 2020.
- DOI: 10.1001/jamainternmed.2020.0994
- Скальный А. Микроэлементы: бодрость, здоровье, долголетие. Litres, 2019.
- Ideraabdullah F. Y., Zeisel S. H. Dietary modulation of the epigenome // Physiological reviews. 2018. V. 98. №2. P. 667-695.
- DOI: 10.1152/physrev.00010.2017
- Tiffon C. The impact of nutrition and environmental epigenetics on human health and disease // International journal of molecular sciences. 2018. V. 19. №11. P. 3425.
- DOI: 10.3390/ijms19113425
- Singh P. B., Newman A. G. Age reprogramming and epigenetic rejuvenation // Epigenetics & Chromatin. 2018. V. 11. №1.
- DOI: 10.1186/s13072-018-0244-7
- Wang H. X., Wang Y. P. Gut microbiota-brain axis // Chinese medical journal. 2016. V. 129. №19. P. 2373.
- DOI: 10.4103/0366-6999.190667
- Clarke G., Sandhu K. V., Griffin B. T., Dinan T. G., Cryan J. F., Hyland N. P. Gut reactions: breaking down xenobiotic-microbiome interactions // Pharmacological reviews. 2019. V. 71. №2. P. 198-224.
- DOI: 10.1124/pr.118.015768
- Belizário J. E., Napolitano M. Human microbiomes and their roles in dysbiosis, common diseases, and novel therapeutic approaches // Frontiers in microbiology. 2015. V. 6. P. 1050.
- DOI: 10.3389/fmicb.2015.01050
- Arboleya S, Watkins C, Stanton C., Ross R. P. Gut Bifidobacteria Populations in Human Health and Aging // Front. Microbiol. 2016. V. 7. P. 1204.
- DOI: 10.3389/fmicb.2016.01204
- Laforest-Lapointe I., Arrieta M. C. Patterns of early-life gut microbial colonization during human immune development: an ecological perspective // Frontiers in immunology. 2017. V. 8. P. 788.
- DOI: 10.3389/fimmu.2017.00788
- Devaux C. A., Raoult D. The microbiological memory, an epigenetic regulator governing the balance between good health and metabolic disorders // Frontiers in microbiology. 2018. V. 9. P. 1379.
- DOI: 10.3389/fmicb.2018.01379
- Serino M. Molecular paths linking metabolic diseases, gut microbiota dysbiosis and enterobacteria infections // Journal of molecular biology. 2018. V. 430. №5. P. 581-590.
- DOI: 10.1016/j.jmb.2018.01.010
- Chang C.-S., Kao C.-Y. Current understanding of the gut microbiota shaping mechanisms // Journal of Biomedical Science. 2019. V. 26. №1.
- DOI: 10.1186/s12929-019-0554-5
- Marchesi J. R., Adams D. H., Fava F., Hermes G. D., Hirschfield G. M., Hold G.,.. Thomas L. V. The Gut microbiota and host health: a new clinical frontier // Gut. 2016. V. 65. №2. P. 330-339.
- DOI: 10.1136/gutjnl-2015-309990
- Chung H. J., Nguyen T. T., Kim H. J., Hong S. T. Gut Microbiota as a missing link between nutrients and traits of human // Frontiers in microbiology. 2018. V. 9. P. 1510.
- DOI: 10.3389/fmicb.2018.01510
- Романчук П. И., Волобуев А. Н., Сиротко И. И., Никитин О. Л. Активное долголетие: биофизика генома, нутригеномика, нутригенетика, ревитализация // Самара: Волга-Бизнес. 2013.
- Kim S. Y., Jin W., Sood A., Montgomery D. W., Grant O. C., Fuster M. M.,.. Linhardt R. J. Characterization of heparin and severe acute respiratory syndrome-related coronavirus 2 (SARS-CoV-2) spike glycoprotein binding interactions // Antiviral research. 2020. P. 104873.
- DOI: 10.1016/j.antiviral.2020.104873
- Kwon P. S., Oh H., Kwon S. J., Jin W., Zhang F., Fraser K.,.. Dordick J. S. Sulfated polysaccharides effectively inhibit SARS-CoV-2 in vitro // Cell discovery. 2020. V. 6. №1. P. 1-4.
- DOI: 10.1038/s41421-020-00192-8


