Железо в неживой и живой природе
Автор: Еланский Геннадий Николаевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Физическая химия и физика металлургических систем
Статья в выпуске: 1 т.17, 2017 года.
Бесплатный доступ
Рассмотрены кристаллическое строение железа и его химические свойства, степени окисления и участие железа в окислительно-восстановительных процессах в неживой и живой природе. Железо, в зависимости от температуры и давления, может иметь пять кристаллических структур: α, β, γ, δ и ε. Приведены рисунки элементарных кристаллических ячеек. Выделены пустоты в кристаллических ячейках, в которых могут размещаться примесные атомы. Железо может иметь степени окисления от нулевой (чистое железо) до +8. Наиболее важными являются степени окисления 0, +2 и +3. Оксид железа +2 (FeO) окрашен в черный цвет, а оксид железа +3 (Fe2O3) окрашен в ярко-красный цвет. Железо является главным участником процесса переноса кислорода в сталеплавильных процессах. Процесс переноса состоит из приобретения железом кислорода за счёт его окисления до FeO (Fe+2) и Fe2O3 (Fe+3) и передачи кислорода в расплавленный металл [O]. Окислительно-восстановительные процессы и процессы переноса кислорода связаны с изменением степени окисления железа. Выражено сомнение о присоединении кислорода к гемоглобину в молекулярной форме и предложена запись реакций в крови с участием гемоглобина на основе окислительно-восстановительных реакций. Предложены реакции переноса кислорода кровью. В лёгких, при высоком парциальном давлении кислорода, часть Fe+2 гемоглобина отдаёт электроны и окисляется до Fe+3, что и приводит к изменению цвета крови: (Hb•4Fe+2) + O2 ↔ (Hb•4Fe+3•2O-2). В капиллярах Fe+3 присоединяет электроны, отдает кислород, который участвует в окислении, и восстанавливается до Fe+2: (Hb•4Fe+3•2O-2) + Cсреды = (Hb•4Fe+2) + CO2. В предложенной записи реакций нет места молекулярному кислороду. Окислительно-восстановительные реакции в лёгких и капиллярах протекают по предложенной электрохимической схеме с большой скоростью с участием и переносом электронов.
Железо, кристаллические структуры, пустоты в кристаллах, степень окисления железа, окисление железа, восстановление железа, перенос кислорода в сталеплавильных процессах, кровь, гемоглобин, перенос кислорода кровью, изменение цвета крови
Короткий адрес: https://sciup.org/147157073
IDR: 147157073 | УДК: 546.72 | DOI: 10.14529/met170101
Текст научной статьи Железо в неживой и живой природе
Среди многих металлов, используемых в народном хозяйстве, железо и его сплавы – сталь и чугун – занимают особое место, они – основа конструкционных материалов, без них невозможна современная цивилизация. Железо – активный участник процессов восстановления-окисления при производстве чугуна и стали.
Под железом понимают химический элемент и металл, содержащий от 99,99 до 99,999 % Fe, остальное – примеси. К свойствам чистого железа приближается сталь типа IF (Interstitial Free), в которой ферритная матрица свободна от атомов внедрения. Сталь содержит 0,0020–0,0035 % С, менее 0,03 % Si, (9–13)·10–5% Н [(1,0–1,5) см3/100 г]
и 0,002–0,003 % N. В мире производят свыше 100 млн т сталей с содержанием углеродом менее 0,01 %.
Железо Fe2655,847 занимает после кислорода, кремния и алюминия четвёртое место по распространённости в земной коре, его доля равна 5,1 %. Плотность железа при нормальных условиях равна 7872 кг/м3, давление пара при 1600 °С равно ≈ 12 Па. Железо расположено в периодической системе элементов Д.И. Менделеева в VIII группе в подгруппе Б (семейство железа). Железо является 3d-пере-ходным металлом с незаполненным 3d-слоем электронов. Строение внешнего электронного слоя изолированного атома железа 3s23p63d64s2. Чистое железо в природе (за исключением метеоритного) не встречается, оно связано с другими элементами в соединения (оксиды, карбонаты, сульфиды и др.) [1].
Железо обладает уникальными кристаллографическими, химическими и биологическими свойствами. Статья ставит своей целью представление краткой информации о кристаллическом строении железа, степенях окис- ления железа и раскрытие с единых позиций процессов передачи кислорода в неживой и живой природе с участием железа.
В твёрдом состоянии железо может находиться в зависимости от температуры и давления в пяти кристаллографических формах: α, β, γ, δ и ε (рис. 1–3) [2, 3].
Модификации α-Fe, β-Fe и δ-Fe являются
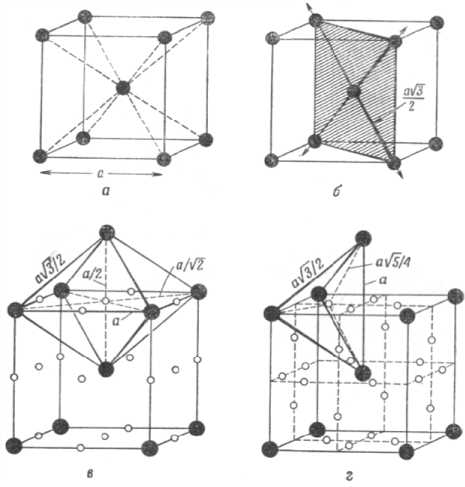
Рис. 1. Объёмноцентрированная кубическая решётка: а – элементарная ячейка; б – плотноупакованные плоскости {110}, в – октаэдрические пустоты ( о ); г – тетраэдрические пустоты ( о ); • – атомы металла
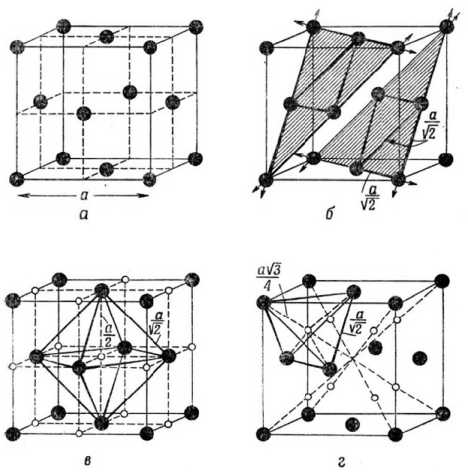
Рис. 2. Гранецентрированная кубическая решётка: а – элементарная ячейка; б – плотноупакованные плоскости {111}, в – октаэдрические пустоты ( о ); г – тетраэдрические пустоты ( о ); • – атомы металла
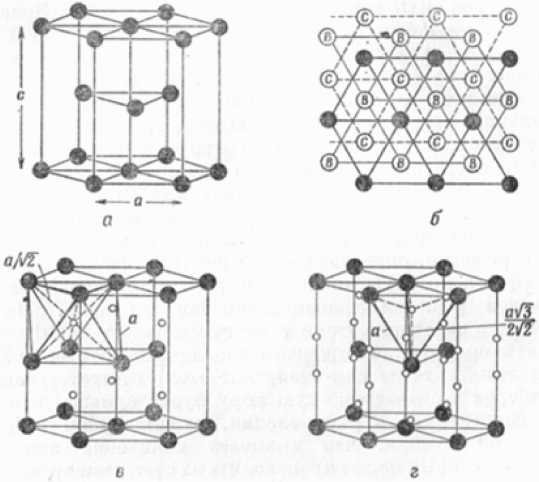
Рис. 3. Гексагональная плотноупакованная решётка: а – элементарная ячейка; б – последовательность чередования плотноупакованные плоскости {001} в структуре ГПУ и {111} в структуре ГЦК, в – октаэдрические пустоты ( о ); г – тетраэдрические пустоты ( о ); • – атомы металла
изоморфными, они обладают объёмно-центрированной кубической (о.ц.к.) кристаллической структурой (рис. 1). О.ц.к. структура характеризуется периодом кристаллической решётки а = 0,286645 нм при 20 °С, числом атомов в элементарной решётке n = 2, координационным числом (числом ближайших соседей) Z = 8, пространственной кристаллической группой Im3m. Низкотемпературная модификация α(β)-Fe имеет наименование феррит.
При 769 °С ( точка Кюри ) магнитное α-Fe переходит в парамагнитное (немагнитное) состояние β-Fe без изменения сингонии и др. свойств, кроме магнитных. Парамагнитное железо β-Fe устойчиво в интервале 769–909 °С. Фазовый переход α ↔ β является фазовым переходом второго рода, он происходит без изменения теплосодержания системы, Δ Н = 0.
Сингония (гр. syn – вместе + gonia – угол) – кристаллографическая система, объединяющая кристаллы с одинаковой совокупностью углов между гранями. Кристаллы каждой сингонии характеризуются одинаковыми углами и относительными величинами рёбер и обладают подобным набором элементов – осями и плоскостями симметрии. По признаку точечной симметрии элементарной ячейки все кристаллы делят на семь сингоний по трём категориям: низшие категории – триклинная, моноклинная, ромбическая; средние категории – тетрагональная, гексагональная, ромбоэдрическая (тригональная), и высшая категория – кубическая. Железо при обычных давлениях относится к высшей кубической сингонии [3].
Модификация γ-Fe (аустенит, рис. 2) существует в интервале температур 909–1388 °С. Она обладает гранецентрированной кубической (г.ц.к.) структурой. Её параметры: период кристаллической решётки а = 0,3656 нм при 950 °С, число атомов в элементарной решётке n = 4, координационное число (число ближайших соседей) Z = 12, пространственная кристаллическая группа Fm3m. Фазовый переход α(β) ↔ γ является фазовым переходом первого рода, он протекаем с изменением теплосодержания системы, Δ Н ≠ 0.
В интервале температур 1388–1539 °С существует парамагнитное δ-Fe с о.ц.к. кристаллической решёткой (при 1425 °С а = 0,293 нм, число атомов в элементарной решётке n = 2, координационное число (число ближайших соседей) Z = 8, пространственная кристаллическая группа Im3m). Переход γ ↔ δ является фазовым переходом первого рода, Δ Н ≠ 0.
Модификация ε-Fe (рис. 3) существует при высоких давлениях 13 ГПа (128,3·103 атм), ей свойственна гексагональная плотноупакован-ная (г.п.у.) решётка. Число атомов в элементарной г.п.у.-решётке n = 8, координационное число (число ближайших соседей) Z = 12. Модификация ε-Fe образуется и при нормальном давлении при легировании железа рядом элементов.
При температуре 1539 °С (1812 К) происходит плавление железа. Имеются сведения о температуре плавления железа в 1540 °С. Фазовое превращение δ-Fe ↔ Feж является фазовым переходом первого рода, оно сопровождается изменением энтальпии и энтропии системы: Δ H о пл = 15 кДж/моль, Δ S о пл = 8,4 Дж/(моль·К). Температура кипения чистого железа равна 2880 °С (3153 К) при давлении 1,013·105 Па (1 атм). Температура плавления железа в соответствии с уравнением Клапейрона – Клаузиуса dp/dT = Δ H пл /(T Δ V пл ), где Δ V пл – изменение объёма металла при плавлении, зависит от давления. М.А. Подурец определил, что при статическом повышении давления до 200 ГПа температура плавления достигает 3700 К. Динамическое повышение давления (взрыв) до 235 ГПа приводит к повышению температуры плавления железа до 6300 К (рис. 4).
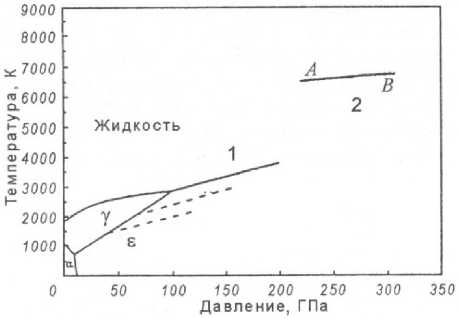
Рис. 4. Зависимость температуры плавления железа от давления (М.А. Подурец)
Кристаллическое строение твёрдых тел можно представить набором частиц-шаров, ориентированных в пространстве в соответствии со своей сингонией. Между шарами есть всегда пустоты. В плотнейших упаковках, свойственных металлам, возникают пустоты двух типов. Одни окружены четырьмя шарами и имеют, соответственно, координационное число 4. Центры четырёх шаров, между которыми образуется пустота первого типа, располагаются по вершинам тетраэдра, поэтому пустоты между ними называют тетраэдрическими пустотами, их радиус rт.п = 0,22r, где r – радиус шара плотнейшей упаковки. Другие пустоты располагаются между шестью шарами, т. е. имеют координационное число 6. Центры шести шаров, замыкающие пустоту второго типа, расположены по вершинам октаэдра, поэтому пустоты называют октаэдрическими. Их радиус равен rо.п = 0,41r (см. рис. 1–3).
Пустоты представляют собой места, в которых могут размещаться примеси металла, в данном случае железа. При размещении примесного элемента (C, H, N) в тетраэдрических или октаэдрических пустотах образуется твёрдый раствор внедрения, а примеси называют примесями внедрения. В автомобилестроении широко применяют стали типа IF (Interstitial Free), в которых ферритная матрица свободна от атомов внедрения (C, H, N). Элемент, имеющий атомный диаметр примерно равный атомному диаметру железа (Mn, Ni, Co, Cr), замещает железо в узле кристаллической решётки железа. В этом случае образуется твёрдый раствор замещения.
Под влиянием примесей железо (сталь) изменяет свою кристаллическую структуру. Изменением состава стали и температуры термической обработки достигают желаемую структуру готового стального изделия с обеспечением высокого качества и необходимых служебных свойств.
Полиморфные превращения железа и стали при нагревании и охлаждении открыл в 1868 г. Д.К. Чернов.
Железо обладает многими химическими свойствами. Остановимся только на одном, а именно на степени окисления (в старой терминологии – валентности). Это связано с тем, что в процессе технологических переделов степень окисления железа подвержена изменениям.
В химической и металлургической литературе приводится информация о том, что железо может иметь степени окисления 0, +1, +2, +3, +4, +5, +6, +7, +8 [1, 4–6].
Степень окисления 0 имеет чистое железо, а также соединения карбонилов Fe3(CO)12, Fe5(CO)15 и др. Железо имеет степень окисления +1 в нитрозных комплексах, в частности, в красной соли состава K[Fe(NO)2S] и K[Fe(NO)2S2O3]. Железо имеет степень окисления +2 в оксиде FeO, в гидроксиде Fe(OH)2, солях FeF2, FeCl2 и других, в сложных комплексах. Степень окисления железа +3 соответствует оксиду Fe2O3, гидроксиду Fe(OH)3, солям FeF3, FeBr3 и другим, комплексам K3[Fe(C2O4)3]·3H2O и другим. Железо со степенью окисления +4 образует ферраты IV K2FeO3, Ba3FeO5. ИК спектр газообразного FeO2 наблюдали в матрице из аргона. Степень окисления железа +5 свойственна феррату V K3FeO4. Известен феррат железа VI Cs2FeO4. Зафиксировано появление Fe+7 и Fe+6 в матрице смешанновалентном (+6, +7) оксорутенате Cs3(Ru(VI)1/2Ru(VII)1/2O4). В отношении Fe+7 можно было ожидать, что это состояние достижимо, так как нельзя исключить его наличия в механизме получения FeO4 на стадии диспропорционирования ионов в щелочных средах: 2Fe(VI) → Fe(VIII) + Fe(IV). Для дальнейшего рассмотрения наиболее значимыми являются степени окисления 0, +2 и +3.
Степени окисления железа ν Fe +3 соответствует оксид Fe2O3. Чистый оксид Fe2O3 имеет ярко-красную окраску. Информация о цвете оксида понадобится далее. Оксид Fe 2 O 3 является основой железной руды под названием гематит (корень «гем»), или красный железняк.
Степени окисления железа ν Fе +2 соответствует оксид FeO. Оксид FeO образует редко встречающийся минерал вюстит [7, 8], имеющий цвет от коричневого до чёрного. Оксид FeO, более известный как твёрдый раствор кислорода в железе FeO n нестехиометрического состава под названием вюстит при n > 1, занимает на диаграмме состояния Fe–O при температурах от 570 до ≈1400 °С большую область гомогенности (рис. 5) [1, 9]. Минерал и твёрдый раствор кислорода в железе получили свое название вюстит по имени немецкого исследователя Фритца Вюста (Fritz Wüst) [10], основателя исследовательского института кайзера Вильгельма, ныне исследовательский институт имени Макса Планка. Из рис. 5 видно, что повышение как температуры, так и парциального давления кислорода (на рисунке нанесены изобарические линии давления кислорода, выраженного в атмосферах) приводит к расширению области гомогенности. Правая восходящая ветвь вюстита (левая почти вертикальная) указывает на то, что повышение температуры и давления кислорода приводит к возрастанию концентрации кислорода в вюстите, коэффициента n в формуле FeO n . Значение величины n > 1 и её возрастание при повышении давления кислорода сви-
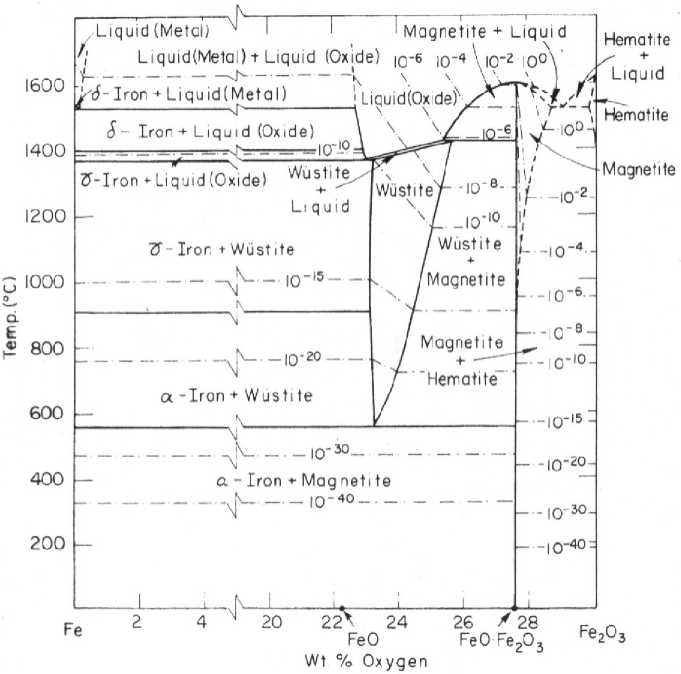
Рис. 5. Диаграмма состояния железо–кислород [9]
детельствует о том, что в гомогенном твёрдом растворе вюстита помимо оксида FeO возникают зародыши оксида Fe 2 O 3 . Это можно трактовать как увеличение средней степени окисления железа ν Fe . Она равна, согласно нашему расчёту, при 570 °С (точка сходящихся ветвей вюстита) 2,1, при 1000 °С ν Fe = 2,30, а при 1200 °С ν Fe = 2,36. Следовательно, вюс-тит – твёрдый смешанновалентный раствор кислорода в железе с дробной осреднённой степенью окисления более +2, но менее +3.
Оксид FeO входит в состав железной руды под названием магнетит. Химическая формула магнетита Fe 3 O 4 или, как свойственно шпинели, FeO·Fe 2 O 3 , то есть часть железа в магнетите имеет степень окисления +2, а другая часть +3. Расчёт по вкладу катионов Fe+2 и Fe+3 даёт среднюю степень окисления железа в магнетите +2,67. Магнетит Fe 3 O 4 за счёт присутствия оксида железа +2 окрашен в чёрный цвет.
В сталеплавильных шлаках окислительных процессов – кислородно-конвертерный, электросталеплавильный в высокомощных дуговых печах – всегда содержатся оксиды железа. Состав конечного шлака конвертер- ного процесса следующий [11], % по массе: 8–25 FeO, 2–6 Fe2O3, 3–12 MnO, 43–52 CaO, 14–22 SiO2, 3–7 Al2O3, 1,5–4 MgO, 0,5–4 P2O5, < 1 CaS, < 3 CaF2. Для расчёта средней степени окисления железа в шлаке приняли его состав, %: 20 FeO, 5 Fe2O3 и 10 MnO (оксид марганца приравняли эквивалентным оксиду железа FeO). Расчёт на 100 г шлака вели с учётом массы m железа Fe+2, Fe+3 и Mn+2 в шлаке и количества их молей n. Массы железа и марганца равны: mFe+2 = 15,55 г, mFe+3 = 3,50 г, mMn+2 = 7,75 г; количество их молей равны: nFe+2 = 0,28, nFe+3 = 0,06, nMn+2 = 0,14, сумма молей 0,48. Средняя степень окисления железа в шлаке оказалась дробной и равной 2,13.
Л.Я. Левков [12] провёл тщательное исследование процесса электрошлакового переплава с непрерывным введением в расплавленный шлак раскислителей и замером парциального давления кислорода Po2 над расплавленным шлаком кислородными зондами. Расчётом установлено, что в зависимости от температуры шлака в пределах от 1525 до 1873 К и парциального давления кислорода Po2 в пределах от 105 до 10–10 Па средняя степень окисления железа νFe в оксидах в шлаке изменяется в пределах от +3 до +1 и является дробной. Л.Я. Левков трактует среднюю степень окисления элемента νi как разность между общим числом электронов в атоме (порядковым номером в Периодической системе элементов Д.И. Менделеева) и средним их числом на энергетических уровнях атомов элемента i в шлаковой фазе.
Проф. В.Е. Рощин [13] считает, что дробным заряд металлических ионов (катионов), например, железа, может быть не только потому, что отдельные катионы имеют разный заряд, но дробным может быть заряд и одного катиона. Это возможно потому, что в сложных системах, в частности в оксидных, не существует чисто ионной связи, а есть преимущественное распределение электронов вблизи аниона, например, кислорода. Ведь природа любой химической связи одна и та же – перемещение электронов к тому или иному иону.
Железо является главным (практически единственным) участником процесса переноса кислорода в сталеплавильных процессах. Процесс переноса состоит из этапов (здесь и далее квадратные скобки означают металлическую фазу, круглые скобки – шлаковую фазу, фигурные скобки – газовую фазу):
-
1. Приобретение железом кислорода за счёт его окисления до (FeO) и (Fe2O3):
-
2. Передача кислорода в расплавленный металл:
2[Fe] + {O2} = 2(FeO);(1)
2(FeO) + ½{O2} = (Fe2O3).(2)
(Fe2O3) = 2 (FeO) + [O];(3)
(FeO) = [Fe] + [O].(4)
Эти реакции в электронной форме записываются следующим образом ( е – электрон):
[Fe] = (Fe+2) + 2e;(5)
(Fe+2) = (Fe+3) + e;(6)
(Fe+3) + e =(Fe+2);(7)
{O2} + 4e = 2(O–2);(8)
2(O–2) = 2[O] + 4e.(9)
Процессы окисления и восстановления оксидов металлов (на примере железа, поскольку оно обладает разной степенью окисления) можно рассматривать по крайней мере с четырёх равнозначных позиций) [1]:
-
1. Окисление – это присоединение к атому железа кислорода:
-
2. Восстановление может также протекать при диссоциации оксидов, то есть без участия восстановителя. Для оксидов железа возможна только реакция:
-
3. Окисление – это повышение степени окисления железа от нулевой (чистое железо) до максимальной +3, реально реализуемой в металлургических процессах:
-
4. Окисление – это потеря атомами железа электронов с образованием катионов:
[Fe] + n {O 2 } = (FeO) или (Fe 3 O 4 ) или (Fe 2 O 3 ), Δ G 1 < 0.
Восстановление – это отъём у оксида железа кислорода веществом-восстановителем B, обладающим более высоким сродством к кислороду, чем железо:
(FeO), (Fe 3 O 4 ), (Fe 2 O 3 ) + nB = n [Fe] + n ( B O), Δ G 2 < 0.
3(Fe 2 O 3 ) → 2(Fe 3 O 4 ) + ½{O 2 }.
[Fe0] → (Fe+2) → (Fe+3).
Восстановление – это понижение степени окисления от максимальной +3 до нулевой (чистое железо): (Fe+3) → (Fe+2) → [Fe0].
[Fe0] – 2 e → (Fe+2) – e → (Fe+3).
Восстановление – это присоединение катионами железа электронов:
(Fe+3) + е → (Fe+2) + е → [Fe0].
В качестве восстановителей В оксидов железа +3 и +2 выступают газы водород Н 2 и оксид углерода СО, а также углерод С. Восстановление оксидов железа газами называют косвенным, а углеродом – прямым. В качестве восстановителей оксидов железа могут выступать металлы кремний и алюминий (металлотермия), обладающие более высоким сродством к кислороду, чем железо.
Согласно принципу превращений А.А. Байкова, переход высшего оксида в низший (и в конечном итоге в металл) происходит через последовательное образование всех устойчивых в данных условиях промежуточных оксидов. Восстановление оксидов железа при температуре более 570 °С происходит через следующие стадии:
(Fe 2 O 3 ) → (Fe 3 O 4 ) → (FeO) → [Fe].
При температуре менее 570 °С оксид железа (FeO) не образуется, поэтому реализуется следующая последовательность:
(Fe 2 O 3 ) → (Fe 3 O 4 ) → [Fe].
Марганец образует четыре оксида. Восстановление оксидов марганца происходит через следующие стадии:
(MnO4) → (Mn2O3) → (Mn3O4) →
→ (MnO) → [Mn].
В основе физической концепции твёрдофазного восстановления металлов В.Е. Рощина [13] лежит представление о механизме восстановления как о процессе обмена электро- нами между восстановителем и катионами металлов оксидов. Суть восстановления заключается в превращении ионной связи в кристаллической решётке оксида в металлическую связь с образованием ионной же решётки металла. Превращение оксида в металл не требует образования промежуточных оксидных фаз. Изъятие кислорода всегда происходит на поверхности оксида, а выделение металлического зародыша может происходить как на поверхности, так и в местах стока вакансий в объёме оксида. Образующийся металлический зародыш устойчив при любых размерах.
Термодинамически наиболее трудно во с станавливать низший оксид, в данном случае это (FeO) и (MnO). Восстано вление этих о к сидов в доменном и ферросплавном проце с сах идёт в зоне высоких температур по пр я мой реакции взаимодействия с углеродом с затратой тепла:
(FeO) + С кокс = [Fe] + {СO} – 152,67 кДж;
(MnO) + С кокс = [Mn] + {СO} – 298,3 кДж.
Таким образом, окисл ительно -восстано вительные процессы с участием железа мо ж но представить следующей схемой, основа н ной на обмене электронами между железом, кислородом и восстановителем:
Fe – 2 e ↔ Fe+2 – e ↔ Fe+3 + e ↔
↔ Fe+2 + 2e ↔ Fe;(10)
O2 + 4e ↔ 2O–2 + 4e ↔ O2;(11)
B – 2e ↔ B+2 + 2e ↔ B.(12)
Рассмотрим роль железа в живой природе на примере крови человека.
Кровь (ссылки по «Википедии») – жид кость, циркулирующая в кровеносной системе и переносящая газы и другие растворенные вещества, необходимые для метаб олизма либо образующиеся в результате обменных пр о цессов. Кровь состоит из плазмы (прозрачной жидкости бледно- желтого цвета) и взвеше н ных в ней клеточных элементов. Имеется три основных типа клеточных элементов крови: красные кровяные клетки (эритроциты), бе лые кровяные клетки (лейкоциты) и кровяные пластинки (тромбоциты). Красный цвет крови определяется наличием в эритроцитах красн о го пигмента гемоглобина. В артериях, по к о торым кровь, поступившая в сердце из легких, переносится к тканям организма, гемогло бин насыщен кислородом и окрашен в ярко красный цвет; в венах, по которым кровь пр и текает от тканей к сердцу, гемоглобин пра к тически лишен кислорода и темнее по цвету.
Металлы Zn, Cu, Fe, Mn, Co, Mo (металлы жизни), входящие в состав крови, играют наиважнейшую роль в жизнедеятельности всех без исключения живых организмов. Они стимулируют обменные процессы, влияют на рост, наследственность, размножение, активно участвуют в кроветворении и выполняют целый ряд иных жизненно важных функций. Самым полезным из подобных микроэлементов для человеческого организма является железо. Несмотря на то, что содержание этого металла в человеческой крови ничтожно мало (до 5 г у взрослых и около 350 мг у новорожденных), именно благодаря ему в организме происходит бесперебойное снабжение кислородом всех внутренних органов и тканей. Примерно 70 % от общего объема содержащегося в организме железа используется для насыщения гемоглобина, скрытого в эритроцитах, 5–10 % приходится на миоглобин, участвующий в обмене кислорода и углекислого газа в мышечных тканях, 20–25 % резервируется в печени, а около 0,1 % металла связывается с белком трансферрином в кровяной плазме. Как недостаток железа в крови, так и его переизбыток влечет за собой ряд негативных последствий, способных значительно ухудшить общее самочувствие и качество жизни больного.
Гемоглобин является сложным белком класса хромопротеинов. В качестве простети-ческой группы (небелковых частей белков) здесь выступает особая пигментная группа, содержащая железо – гем (от др.-греч. ἁίμα – кровь), комплексные соединения порфиринов с железом II (Fe+2). Структурная формула гема представлена на рис. 6.
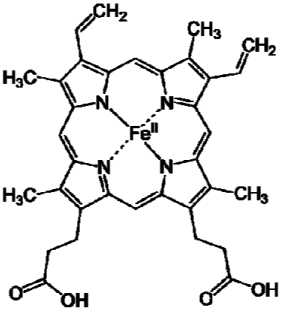
Рис. 6. Структурная формула гема B («Википедия»)
Железо II (Fe+2) в геме характеризуется октаэдрической координацией, то есть связы- вается с шестью лигандами (лиганды (от лат. ligo – связываю) – нейтральные молекулы, ионы или радикалы, связанные с центральным атомом комплексного соединения). Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две другие координационные связи лежат на оси, перпендикулярной плоскости порфирина. Одна из них (пятая) занята азотом, другая (шестая) предназначена для связывания гемоглобином молекулы кислорода.
Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в лёгких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу (II) гема на 6-ю координационную связь. На эту же связь присоединяется и монооксид углерода СО, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбооксигемоглобин. Связь монооксида углерода с гемоглобином более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с монооксидом углерода, не участвует в транспорте кислорода. Отдав кислород тканям, гемоглобин присоединяет к себе ионы водорода и углекислый газ, перенося их в лёгкие.
В работе [14] реакция обратимого присоединения кислорода гемоглобином (гемоглобин условно обозначен Hb·Fe+2) записана следующим образом:
(Hb·Fe+2) + O2 ↔ (Hb·Fe+2·O2), где (Hb·Fe+2) + O2 – дезоксигемоглобин, (Hb·Fe+2·O2) – оксигемоглобин.
Обратим внимание, что в такой записи кислород присоединяется к гемоглобину в молекулярной форме (4 молекулы кислорода), а степень окисления железа +2 не меняется. Изменение цвета крови с тёмной венозной на ярко-красную артериальную связывают с присоединением к гему молекулы кислорода. Но как разместить в кровеносных сосудах без раздутия большой объём молекулярного кислорода: в состоянии покоя человек потребляет 200–300 мл/мин кислорода. При работе этот объем увеличивается до 2000–3000, а у хорошо тренированных спортсменов – до 5000 мл/мин (см3/мин) [15], или 5000/25 390 = = 0,197 молей, или 0,197·6,023·1023 = 1,19·1023 молекул кислорода, где 25390 мл – объём
1 моля газа при 36,5 °С. Ответ очень простой: в природе есть способ тысячекратного сжатия объёма кислорода [16]. Он заключается в окислении металлов до оксидов (см. реакции (1) и (2), в частности в окислении Fe+2 до Fe+3 по реакции:
4FeO + O 2 = 2Fe 2 O 3 . (13)
Прирост массы продуктаFe 2 O 3 реакции (13) за счёт присоединения 1 моля кислорода составляет 32 г. При примерной плотности оксида железа Fe 2 O 3 4 г/см3 объём приращённой массы составит 32/4 = 8 см3, это в 25 390/8 = 3174 раз меньше объёма потреблённого кислорода. И максимальный объём потребления кислорода в 5000 см3/мин в лёгких сжимается до 1,575 см3/мин за счёт прироста массы Fe 2 O 3 , что безболезненно для кровеносной системы. Здесь оксид Fe 2 O 3 выступает в роли хранителя (запаса) кислорода, который в дальнейшем высвобождается в капиллярах.
Выразим свою точку зрения на процессы, протекающие с участием крови в организме. Первое: почему кровь красная? Кровь красная потому, что в ней, в гемоглобине, присутствует как железо Fe+2, так и железо Fe+3. Напомним, что только железо Fe+3 может окрасить кровь в красный цвет. Второе. Соотношение долей железа Fe+2 и железа Fe+3 в гемоглобине зависит от парциального давления кислорода и объёма потребляемого кислорода. В лёгких высокое парциальное давление кислорода РО2 = 0,21 атм = 0,21·105 Па. В этом случае часть железа приобретает степень окисления +3, и артериальная кровь становится ярко красной. Из диаграммы Fe–О (см. рис. 5) следует, что при парциальных давлениях кислорода, свойственных воздуху, равновесному состоянию соответствует оксид железа Fe3O4(FeO·Fe2O3) со средней степенью окисления железа 2,67. Третье. В капиллярах, при весьма низком парциальном давлении кислорода, согласно диаграмме на рис. 5, средняя степень окисления железа за счёт отдачи кислорода тканям снижается до +2,1, и цвет венозной крови темнеет. Но за счёт более высокой, чем +2, усреднённой степени окисления железа кровь сохраняет красный цвет. Теперь становится ясным, почему структуру гема строят вокруг катиона Fe+2. Потому что все анализы, как мы предполагаем, проводили в состоянии покоя пациента с использованием венозной крови, в которой действительно преобладает Fe+2. Отбор артериальной крови, в которой наличест- вует Fe+3, инструментально сложный и фактически выполняется редко. И ясно, почему гем, если в нём железо будет в форме иона Fe+3, не способен дальше присоединять кислород. Просто присоединение кислорода сопровождается повышением степени окисления железа, а степень окисления железа Fe+4 и выше реализуется только в сложных соединениях, которых нет в составе крови. В природе не существует конденсированный оксид железа FeO2 (аналогичный MnO2), в котором железо имело бы степень окисления +4.
Роль потребления кислорода человеком при дыхании на степень окисления железа в гемоглобине оценим по реакции (13): 4FeO + + O 2 = 2Fe 2 O 3 . При избытке FeO количество образующегося Fe 2 O 3 будет определяться потреблением кислорода: чем выше потребление кислорода, тем больше будет образовываться оксида железа Fe+3, тем больше будет доставлено кислорода в капилляры. Не исключено, что с ростом потребления кислорода цвет крови становится всё более алой.
Можно предложить следующую запись реакций в крови с участием гемоглобина. Реакция в лёгких при высоком парциальном давлении кислорода:
(Hb·4Fe+2) + O 2 ↔ (Hb·4Fe+3·2O–2);
4Fe+2 = 4Fe+3 + 4 e ; O 2 +4 e = 2O–2.
Реакция в капиллярах:
(Hb·4Fe+3·2O–2) + C среды = (Hb·4Fe+2) + CO 2 ;
4Fe+3 = 4Fe+2 + 4 e ; 2O–2+ 4 е + C = CO 2 .
В предложенной записи реакций нет места молекулярному кислороду. Да и сомнительно, что столь большой объём молекулярного кислорода О 2 двигается по кровеносным сосудам, прикрепившись к гему. Гораздо проще представить, что окислительно-восстановительные реакции в лёгких и капиллярах протекают по предложенной электрохимической схеме с большой скоростью с участием и переносом электронов (сравните предложенные записи реакций с участием гемоглобина с реакциями (10)–(12)). Подтверждение этому может быть высокая электрическая проводимость крови.
Оценим качественно термодинамическую сторону реакции (13). В лёгких за счет окисления FeO до Fe2O3 происходит выделение теплоты. В капиллярах развиваются за счёт высвобождаемого кислорода окислительные процессы также с выделением теплоты. Выделяющаяся теплота, количество которой возрастает по мере роста потребления кислорода, рассеивается организмом человека за счёт теплоизлучения и потовыделения. Кроме того, по-видимому, теплота преобразуется сложным путем в другие виды энергии и расходуется на совершение разнообразных движений организма.
У некоторых моллюсков и членистоногих кровь имеет голубой цвет за счёт наличия гемоцианина («Википедия»). Гемоцианин (от др.-греч. αἷμα – кровь и др. – греч. κυανoῦς – лазурный, голубой) – дыхательный пигмент из группы металлопротеинов, является медьсодержащим функциональным аналогом гемоглобина.
Из рассмотренных примеров окислительно-восстановительных реакций с участием железа в неживой и живой природе следует их общность. В природе всё подчиняется общим законам. Главным аккумулятором и переносчиком кислорода является железо, которое в зависимости от внешнего парциального давления кислорода изменяет свою степень окисления.
Список литературы Железо в неживой и живой природе
- Еланский, Г.Н. Сталь и Периодическая система элементов Д.И. Менделеева/Г.Н. Еланский. -М.: МГВМИ, 2012. -196 с.
- Физическое металловедение/под ред. Р. Кана. -М.: Мир, 1967. -Вып. 1. -333 с.
- Бокий, Г.Б. Кристаллохимия/Г.Б. Бокий. -М.: Наука, 1971. -400 с.
- Карапетьянц, М.Х. Общая и неорганическая химия/М.Х. Карапетьянц, С.И. Дракин. -М.: Химия, 1981. -632 с.
- Некрасов, Б.В. Курс общей химии/Б.В. Некрасов. -М.: Изд-во хим. лит., 1954. -С. 971.
- Диоксид железа. -http://www.chem. msu.su/Zn/Fe/FeO2.html (дата обращения: 19.12.2016).
- Wüstit. -https://de.wikipedia.org/wiki/W%C3%BCstit (дата обращения: 19.12.2016).
- Wüstit. -https://www.mineralienatlas.de/lexikon/index.php/MineralData?lang=de&language =german&mineral=W%FCstit (дата обращения: 19.12.2016).
- Levin, E. Phase Diagrams for Ceramists/E. Levin, C.R. Robbins, H.F. McMurdie. -The American Ceramic Society, USA. 1969. -625 с.
- Fritz Wüst. -https://de.wikipedia.org/wiki/Fritz_W%C3%BCst (дата обращения: 19.12.2016).
- Воскобойников, В.Г. Общая металлургия/В.Г. Воскобойников, В.А. Кудрин, А.М. Якушев. -М.: ИКЦ «Академкнига», 2005. -768 с.
- Левков, Л.Я. Теоретические предпосылки и практические методы управления физико-химическими и теплофизическими процессами при электрошлаковом переплаве, определяющие качество ответственных изделий: автореф. дис. … д-ра техн. наук/Л.Я. Левков. -М.: АО «НПО «ЦНИИТМАШ», 2015. -45 с.
- Рощин, В.Е. Физическая концепция теории восстановления/окисления металлов/В.Е. Рощин//Сборник трудов XIV Конгресса сталеплавильщиков. -М.: Электросталь, 2016. -С. 93-101.
- Общая химия. Биофизическая химия. Химия биогенных элементов/Ю.А. Ершов, В.А. Попков, А.С. Берлянд и др. -М: Высш. шк., 1993. -560 с.
- Википедия. Дыхательная система человека. - https://ru.wikipedia.org/wiki/%D0% 94%D1%8B%D1%85%D0%B0%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%B0%D1%8F_%D1%81%D0%B8%D1%81%D1%82% D0%B5%D0%BC%D0%B0_%D1%87%D0%B5%D0%BB%D0%BE%D0%B2%D0%B5%D0%BA%D0%B0 (дата обращения: 19.12.2016).
- Цимбал, В.П. Введение в теорию самоорганизации с примерами из металлургии/В.П. Цимбал. -Новокузнецк: СибГИУ, 2001. -254 с.


