Жирнокислотный состав фекалий аборигенных сельскохозяйственных животных
Автор: Цыренова Д.Д., Дамбаев В.Б., Данилова Э.В., Лаврентьева Е.В., Базарсадуева С.В., Бархутова Д.Д.
Журнал: Природа Внутренней Азии @nature-inner-asia
Рубрика: Биология
Статья в выпуске: 4 (22), 2022 года.
Бесплатный доступ
Проведен сравнительный анализ жирнокислотных профилей в фекалиях аборигенных сельскохозяйственных животных - верблюдов забайкальской породы и бурятских лошадей. Тридцать восемь образцов фекалий животных были отобраны и извлеченные ЖК были проанализированы методом хромато-масс-спектрометрии. В образцах фекалий животных обнаружено 39 различных жирных кислот. Жирнокислотный состав представлен насыщенными, мононенасыщенными и одной полиненасыщенной кислотами. Наряду с прямоцепочечными жирными кислотами в образцах фекалий найдены характерные для растений коричная и фенилбензойная кислоты, а также разветвленные изо-, антеизо- кислоты, альдегиды и спирты, характерные для бактерий и микроскопических грибов.
Жирные кислоты, микробиом, аборигенные сельскохозяйственные животные, верблюд забайкальской породы, бурятская лошадь
Короткий адрес: https://sciup.org/148325692
IDR: 148325692 | УДК: 574.24 | DOI: 10.18101/2542-0623-2022-4-115-126
Текст научной статьи Жирнокислотный состав фекалий аборигенных сельскохозяйственных животных
На территории Бурятии и Забайкальского края распространены аборигенные виды сельскохозяйственных животных — бурятская овца, бурятская лошадь, бурятская корова, забайкальский верблюд, як бурятской популяции, а также тофаларские олени. Биологические особенности этих животных позволяют им почти круглогодично обеспечивать себя за счет использования подножного корма [Тайшин и др., 1999].
Забайкальские верблюды — это отделившиеся особи монголо-бурятской породы, которые были выведены в течение многих лет и проживали отдельно от монгольской породы. Они представлены видом двугорбый верблюд или бактриан ( Camelus bactrianus ). Забайкальские верблюды приспособлены к жизни в суровых климатических условиях и нетребовательны к содержанию и кормлению. Почти круглый год питаются подножным кормом. Они способны использовать естественные пастбища, недоступные другим видам животных.
Бурятская порода лошадей распространена на территории Восточной Сибири и Дальнего Востока, в частности Бурятии и Забайкальского края. Бурятские лошади — одна из самых древних пород, которые активно используются в сельском хозяйстве и конном спорте в наши дни [Тайшин и др., 1999]. Они отлично приспособлены для разведения табунным методом и идеально приспособлены для содержания на степных пастбищах, независимо от времени года.
Экология, структура и разнообразие микробного сообщества желудочно-кишечного тракта верблюдов и лошадей являются предметом исследований в последние годы [Gharechahi, Salekdeh, 2018; He et al., 2018; Fernandes et al., 2021]. Различия в пищеварительной системе, экстремальная окружающая среда и пищевые привычки верблюдов и лошадей могут привести к возникновению отличительной кишечной микробиоты. Изменения фекальной микробиоты являются адаптацией к изменениям кормовой базы и окружающей среды [Ming et al., 2017].
Учитывая, что менее 1% всех встречающихся в природе микроорганизмов можно культивировать на синтетических средах, широко применяются независимые от культивирования методы, такие как анализ жирных кислот (ЖК) в качестве биомаркеров [Willers, Jansen van Rensburg and Claassens, 2015]. Этот метод используется как средство для характеристики микробных сообществ. Жирнокислотный состав микробных сообществ может свидетельствовать об их реакции на изменения окружающей среды, вызванные климатическими условиями или антропогенной деятельностью. ЖК в микробных клетках функционируют как основные составляющие мембран для хранения углерода, облегчают передачу сигналов и могут использоваться для идентификации бактерий на уровне видов. Количественная оценка и идентификация этих ЖК способствуют пониманию функционирования микробных сообществ, могут быть применены при скрининге патогенных бактерий и выявлении структуры и разнообразия микробного сообщества.
Исследования состава жирных кислот фекалий аборигенных сельскохозяйственных животных и факторов, влияющих на микробное сообщество желудочно-кишечного тракта, ранее не проводились.
Цель настоящей работы — изучение качественного и количественного состава жирных кислот фекалий аборигенных сельскохозяйственных животных
Материал и методика
Сбор проб фекалий у верблюдов и лошадей проводился в ноябре 2021 г., всего отобрано 38 проб (маркировка 1–38). Образцы (примерно по 200 г каждый) были собраны с земли сразу же после наблюдаемой дефекации у каждой идентифицированной особи верблюда и лошади и помещены в герметичные пластиковые пакеты для определения жирнокислотного состава. В течение 6 часов после сбора образцы были транспортированы при 5 °С и помещены на хранение в лаборатории при -20°C до физико-химических анализов
Жирнокислотный состав в образцах фекалий определяли хромато-масс-спектрометрическим методом. Метиловые и триметил-силильные эфиры ЖК исследовали методом хромато-масс-спектрометрии на газовом хроматографе Agilent 6890 с квадрупольным масс-спектрометром MSD 5973N в качестве детектора. Процентный состав смеси вычислялся по площади газо-хроматографических пиков. Качественный анализ основан на сравнении времен удерживания и полных масс-спектров соответствующих чистых соединений с использованием библиотеки данных NIST14.L и стандартных смесей (Bacterial Acid Methyl Esters (CP Mix, Supelco, Bellefonte, PA, USA) [Radnaeva L. D. et al., 2020]. Полученные данные были обработаны методом главных компонент (МГК) с помощью программного пакета Sirius, фирмы Pattern Recognition Systems a/s (г. Берген, Норвегия) [Померанцев, 2008; Зиновьев, 2000; Эсбенсон, 2005].
Результаты и обсуждение
Образцы фекалий двугорбых верблюдов забайкальской породы были отобраны 15.11.2021 г. в местности Хапшур, с. Цаган-Ола (Агинский Бурятский округ) (табл. 1), и бурятских лощадей в местности Зурган-Дэбэ, с. Нойохон (Селенгин-ский район Республики Бурятия), 25.11.2021 г. (табл. 2). Верблюды и лошади находятся на свободном выгуле, питанием является подножный корм.
Возраст, пол животных, характеристика образцов фекалий представлены в табл. 1, 2. Значения рН в образцах фекалий варьировали от 8 до 9, что характерно для здоровых животных.
В образцах фекалий обнаружено 39 различных ЖК (табл. 3–6). Жирнокислотный состав представлен насыщенными, мононенасыщенными и одной полинена-сыщенной кислотами.Активность ферментов синтеза жирных кислот определяется внешними факторами, что и обусловливает различие в путях синтеза жирных кислот [Wang, Meng, Zhang, 2010]. В связи с этим меняются относительное содержание различных жирных кислот, длина их цепей, насыщенность.
Таблица 1
|
Образец |
Пол, возраст |
Фекалии |
рН фекалий |
|
1 |
самка, 7 лет |
жидкий, не оформленный |
9 |
|
2 |
самка, 15 лет |
жидкий, не оформленный |
8 |
|
3 |
самец, 2,5 года |
жидкий, не оформленный |
8 |
|
4 |
самец, 3 года |
жидкий, не оформленный |
9 |
|
5 |
самка, 5 лет |
жидкий, не оформленный |
9 |
|
6 |
самка, 12 лет |
более твердый |
9 |
|
7 |
самка, 14 лет |
жидкий, не оформленный |
9 |
|
8 |
самка, 17 лет |
жидкий, не оформленный |
8 |
|
9 |
самец, 3 года |
жидкий, не оформленный |
9 |
|
10 |
самка, 9 лет |
жидкий, не оформленный |
9 |
|
11 |
самка, 7 лет |
жидкий, не оформленный |
8 |
|
12 |
самец, 3 года |
жидкий, не оформленный |
9 |
|
13 |
самка, 6 лет |
жидкий, не оформленный |
9 |
|
14 |
самец, 4 года |
жидкий, не оформленный |
9 |
|
15 |
самка, 7 лет |
жидкий, не оформленный |
9 |
|
16 |
самка, 12 лет |
жидкий, не оформленный |
9 |
|
17 |
самка, 8 лет |
жидкий, не оформленный |
9 |
|
18 |
самка, 18 лет |
жидкий, не оформленный |
9 |
|
19 |
самка, 17 лет |
жидкий, не оформленный |
9 |
|
20 |
самка, 5 лет |
жидкий, не оформленный |
9 |
|
21 |
самец, 1,5 года |
жидкий, не оформленный |
9 |
|
22 |
самка, 16 лет |
твердый, оформленный |
9 |
|
23 |
самка, 12 лет |
твердый, оформленный |
9 |
|
24 |
самец, 4 года |
твердый, оформленный |
9 |
Характеристика верблюдов забайкальской породы и образцов их фекалий
В ЖК составе всех образцов (табл. 3) встречается коричная кислота с содержанием от 0,8 до 3,0 отн. %, а в образцах в основном лошадей — фенилпропионовая кислота с содержанием от 0,3 до 2,2 отн.%. Известно, что фенольные соединения имеют универсальное распространение в растительном мире и свойственны каждому растению и даже каждой растительной клетке. На долю веществ этой группы приходится до 2–3% массы органического вещества растений, а в некоторых случаях — до 10% и более. Сумма дикарбоновых кислот в исследуемых образцах фекалий верблюдов составила от 1,1 до 3,0 отн.%, а в образцах фекалий лошадей — от 2,0 до 5,7 отн. %. Гексадикарбоновая кислота не обнаружена в образцах верблюдов.
Таблица 2
|
Образец |
Пол, возраст |
Фекалии |
рН фекалий |
|
25 |
самец, 8 мес. |
твердые, оформленные |
8 |
|
26 |
самка, 8 мес. |
твердые, оформленные |
8 |
|
27 |
самка, 8 лет |
твердые, оформленные |
8 |
|
28 |
самка, 1,5 лет |
твердые, оформленные |
9 |
|
29 |
самка, 8 лет |
не оформленные, жидкие |
8 |
|
30 |
самец, 8 мес. |
не оформленные, жидкие |
8 |
|
31 |
самка, 8 лет |
твердые, оформленные |
8 |
|
32 |
самка, 9 лет |
твердые, оформленные |
8 |
|
33 |
самка, 13 лет |
твердые, оформленные |
8 |
|
34 |
самка, 1,7 лет |
твердые, оформленные |
8 |
|
35 |
самка, 11 лет |
не оформленные, жидкие |
8 |
|
36 |
самка, 1,7 лет |
твердые, оформленные |
8 |
|
37 |
самец, 8 мес. |
менее твердые |
9 |
|
38 |
самка, 11 лет |
твердые, оформленные |
8 |
Таблица 3
Все насыщенные ЖК, в том числе и разветвленные, представлены в табл. 4. Принято считать, что насыщенные жирные кислоты с прямой цепью 14:0, 15:0, 16:0, 17:0 и 18:0 имеют бактериальное происхождение [Гладышев, 2012]. Среди насыщенных ЖК доминирующими являются пальмитиновая 16:0 (около 19,6 отн. %) и стеариновая 18:0 кислоты (около 13.4 отн. %). Сумма изо и антеизо разветвленных кислот в образцах фекалий составило около 10 отн.%. Терминально разветвленные насыщенные жирные кислоты, такие как i14:0 (до 1,86 отн. %), i15:0 (до 3,96 отн. %), i16:0 (до 2,02 отн. %), i17:0 (до 2,86 отн. %), указывают на присутствие грамположительных бактерий [Willers, Jansen van Rensburg and Claassens, 2015], тогда как грамотрицательные бактерии представлены мононенасыщенными жирными кислотами, гидроксилсодержащими биомаркерами.
Содержание насыщенных жирных кислот в образцах фекалий верблюдов и лошадей, отн. %
Таблица 4
|
ЖК |
Верблюд |
Лошадь |
ЖК |
Верблюд |
Лошадь |
|
9:0 |
0,08-0,28 0,137±0,042 |
0,01-0,22 0,066±0,034 |
16:0 |
17,32-20,29 18,449±13,405 |
19,03-27,31 22,555±72,628 |
|
10:0 |
0,33-0,64 0,437±0,134 |
0,12-0,45 0,267±0,149 |
ai17:0 |
0,77-1,54 1,147±0,989 |
0,7-1,23 0,965±0,414 |
|
11:0 |
0,05-5,06 0,406±23,833 |
0,02=0,32 0,134±0,101 |
i17:0 |
1,42-2,68 2,175±2,946 |
0,8-1,86 1,161±1,402 |
|
12:0 |
4,99-8,74 6,703±17,340 |
0,74-1,24 0,953±0,245 |
17:0 |
4-5,48 4,797±3,398 |
2,76-4,46 3,813±2,033 |
|
13:0 |
0,23-5,14 0,591±21,898 |
0,23-0,65 0,450±0,179 |
18:0 |
10,45-14,8 12,365±36,757 |
12,49-19,38 15,94±41,69 |
|
i14:0 |
0,64-0,99 0,845±0,202 |
0,94-1,89 1,235±0,735 |
i20:0 |
0,12-0,31 0,18±0,065 |
0,48-1,57 0,822±1,644 |
|
14:0 |
4,09-5,78 4,667±4,676 |
5,5-8,53 7,242±15,575 |
20:0 |
0,65-1,66 0,968±1,676 |
1,12-2,2 1,47±1,312 |
|
ai15:0 |
1,06-1,76 1,444±0,802 |
1,28-1,76 1,504±0,275 |
22:0 |
1,78-3,51 2,440±4,043 |
1,74-4,18 2,888±8,264 |
|
i15:0 |
1,06-4,28 3,561±2,777 |
1,89-3,04 2,508±1,485 |
23:0 |
1,1-2,21 1,661±2,075 |
0,46-1,98 1,13±2,326 |
|
15:0 |
1,49-4,72 3,9±9,576 |
6,81-10,19 8,36±20,585 |
24:0 |
2,56-6,5 3,856±16,267 |
1,95-6,21 3,313±26,035 |
|
i16:0 |
0,77-1,23 1,015±0,228 |
0,98-2,02 1,445±1,006 |
∑РЖК |
7,77-12,4 10,227±28,8 |
7,56-12,23 9,538±26,261 |
|
∑НЖК |
57.6-66,25 61,348±83,648 |
63,05-71,8 68,168±73,35 |
Сумма ненасыщенных жирных кислот в образцах фекалий верблюдов была выше и составила около 16,7 отн. %, а в образцах фекалий лошадей — около 11,2 отн. % (табл. 5). Основной вклад в сумму ненасыщенных жирных кислот вносят олеиновая 18:1n9, пальмитолеиновая 16:1n7 и вакценовая 18:1n7 кислоты, содержание которых также выше в образцах фекалий верблюдов. Среди полинена-сыщенных ЖК обнаружена только незаменимая линолевая 18:2n6 кислота, которая поступает в организм только с пищей (с содержанием около 2,7 отн. % во всех исследуемых образцах). Известно, что высшие растения имеют гены, кодирующие десатуразы Δ15 и Δ12,т. е. они способны синтезировать ЖК с двойными связями в положении n-6 и n-3 [Harwood, 1996; Tocher et al., 1998; Cohen et al., 1995; Heinz, 2002]. В растениях из стеариновой кислоты (18:0) образуется ненасыщенная олеиновая 18:1n9 кислота. Наличие в растениях характерных десатураз способствует превращению олеиновой кислоты в линолевую 18:2n6 кислоту.
Содержание ненасыщенных жирных кислот в образцах фекалий верблюдов и лошадей, отн. %
Таблица 5
|
ЖК |
Верблюд (n=24) |
Лошадь (n=14) |
|
12:1n7 |
0,16 - 0,37 —тт7— + °.°77 0,24 |
0,05 - 0,11 -—— + °-005 0,082 |
|
15:1 |
0,51 - 1,18 --777— + 0-552 0,882 |
0,43 - 0,97 —7777--+ °-518 0,722 |
|
16:1n7 |
0,1 - 0,35 , n. + 0,094 0,196 |
0,06 - 0,12 ---------+ 0.001 0,09 - |
|
16:1n9 |
0,58 - 6,54 2,255 138891 |
0,1 - 0,32 —7777- + 0063 0,193 |
|
16:1n5 |
0,22 - 1,69 --777---± ±915 0,61 |
- |
|
17:1n9 |
0,07 - 0,69 —77^7— ± °'487 0,252 |
0,09 - 0,32 —7777--±0,042 0,146 |
|
18:1n9 |
4,61 - 6,44 _ ± 5,812 6,641 |
2,27 - 6,02 . ± 12'93 |
|
18:1n7 |
2,03 - 4,32 —7777--+ 6-797 2,895 |
0,98 - 2,09 1 ± 1845 |
|
18:1n5 |
0,75 - 4,32 1,125 ±1Л32 |
0,99 - 3,13 2.031 ±4'805 |
|
22:1n9 |
0,1 - 0,36 ~777^— + 0117 0,217 |
0,19 - 0,31 ---77----+ 0,007 0,24 - |
|
18:2n6 |
1,76 - 3,99 --7777--+ 5-785 2,677 |
1,89 - 3,73 —777^— - 3,548 2,777 - |
|
∑ННЖК |
13,47 - 21,97 --——--± 112,232 16,882 |
7,74 - 14,09 11,172 ± 44 365 |
Количество альдегидов в образцах фекалий верблюдов составило около 4,5 отн. %, а в образцах фекалий лошадей — 2,9% от суммы всех компонентов (табл. 6). В составе липидных компонентов обнаружено 2 спирта. Докозанол (С22OH) присутствует только в некоторых образцах фекалий верблюдов, а в образцах лошадей — около 0,9 отн. %. Содержание стеринов холеста-7-ол и холеста-5-ен-3-ол невысокое (до 0,77 отн. %), а копростанол обнаружен практически во всех образцах фекалий (верблюдов — 2,1 отн. %, лошадей — 0,8 отн. %).
Содержание альдегидов, спиртов и стеринов в образцах фекалий верблюдов и лошадей, отн. %
Таблица 6
|
ЖК |
Верблюд (n=24) |
Лошадь (n=14) |
|
8а |
0,44 - 1,53 --—---± 1,009 0,618 |
0,27 - 0,45 ----777---+ 0,046 0,375 |
|
9а |
0,17 - 1,63 —7777--+ I-767 0,352 |
0,17 - 1,41 ---777---+ I-234 0,39 |
|
11:1a |
0,58 - 0,94 ---7777---+ 0,166 0,738 |
0,27 - 0,59 ----777---+ 0,096 0,397 |
|
11а |
1,34 - 2,24 —гт7— + °'963 1,82 |
0,75 - 1,15 1.152 ±ОвЮ |
|
16а |
0,67 - 1,68 0.981 ± 1011 |
0,39 - 1,01 —7777--±0,413 0,625 |
|
4,8,12,16-4Me17-OH |
0,14 - 0,4 + 0.118 0,223 |
0,16 - 0,39 —7777--+0.054 0,247 |
|
22OH |
0,44 - 1,53 --—---± 1,009 0,618 |
0,54 - 1,78 --——--4 2-021 0,899 |
|
cholest-7-ol |
0,2 - 0,46 + 0,105 0,303 |
0,33 - 0,77 —7777--±0,183 0,569 |
|
cholesy-5en-3ol |
- |
0,56 - 0,92 ----777---± 0,065 0,745 |
|
coprostanol |
1,42 - 3,27 —7777--+ 5-502 2,220 |
0,42 - 1,34 —7777--+0.046 0,813 |
|
∑альдегидов |
3,31 - 6,99 --7777--± 1047 4,482 |
2,17 - 4,09 —7777--±4.587 2,941 |
|
∑спиртов |
0,15 - 0,6 ——— + °-42 0,328 |
0,64 - 1,98 1,128 ± 2,049 |
|
∑стеринов |
1,65 - 3,79 2,562 ± 6,61 |
0,51 - 2,1 1467 ±3'°77 |
Полученные данные (возраст, состав липидных компонентов) были подвергнуты мультивариационной обработке (рис. 1 и 3). Метод главных компонент образцов фекалий показал, что они подразделяются на отчетливо различающиеся кластеры: образцы фекалий верблюдов расположились в правой части графика, а образцы фекалий лошадей — в левой части графика. Кластеризация образцов фекалий по составу липидных компонентов, возможно, связана и с видовой принадлежностью животных, и с различным местом обитания, соответственно и разной пищевой базой. Как видно из рисунка 1, зависимости образцов фекалий по составу липидных компонентов и концентрации ДНК от пола животного не обнаружено.
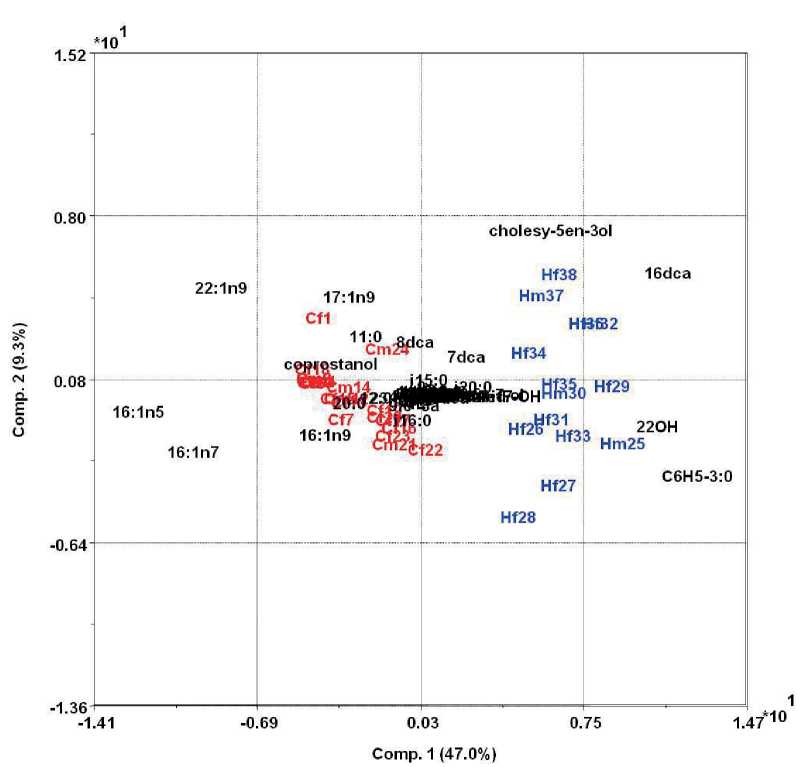
Рис. 1. Распределение образцов фекалий лошадей (синий цвет) и верблюдов (красный цвет) по возрасту и составу липидных компонентов: квадрат — самки, круг — самцы
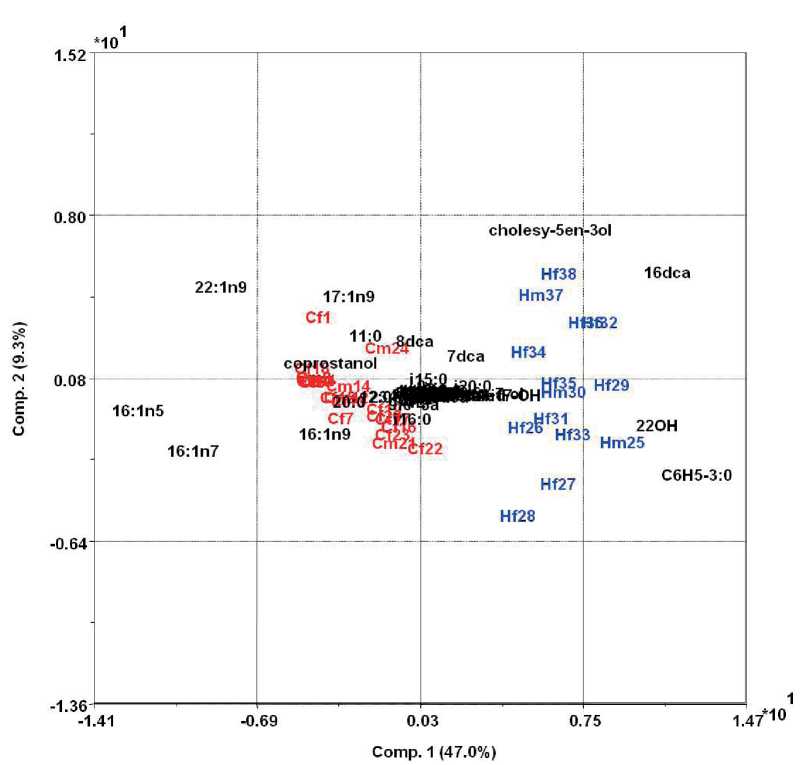
Рис. 2. График нагрузок. Распределение образцов фекалий лошадей (синий цвет) и верблюдов (красный цвет) по возрасту и составу липидных компонентов
На рис. 2 представлен биплот с графиком нагрузок всех компонент на образцы фекалий верблюдов и лошадей. На такое распределение образцов на биплоте оказали основное влияние отсутствие в фекалиях верблюдов мононенасыщенных 16:1n7, 16:1n5, 22:1n9 кислот, а в фекалиях лошадей отсутствие дикарбоновой 16dca кислоты, 22OH спирта и фенилпропионовой кислоты.
Список литературы Жирнокислотный состав фекалий аборигенных сельскохозяйственных животных
- Гладышев М. И. Незаменимые полиненасыщенные жирные кислоты и их пищевые источники для человека // Журнал Сибирского федерального университета. 2012. Вып. 4, № 5. C. 352–386. Текст: непосредственный.
- Зиновьев А. Ю. Визуализация многомерных данных. Красноярск: Изд-во КГТУ, 2000. 179 с. Текст: непосредственный.
- Померанцев А. Л. Анализ многомерных данных. URL: http://www.chemometrics.ru/materials/textbooks/pca.htm (дата обращения: 12.08.2022). Текст: электронный.
- Атлас номадных животных / В. А. Тайшин, Б. Б. Лхасаранов, Р. Джеймс [и др.]. Новосибирск: Изд-во СО РАН, 1999. 284 с. Текст: непосредственный.
- Эсбенсон К. Анализ многомерных данных / перевод с английского О. Родионовой. Москва: ИПХФРАН, 2005. 170 с. Текст: непосредственный.
- Cohen Z., Margheri M.C., Tomaselli L. Chemotaxonomy of cyanobacteria. Phytochemistry. 1995; 40(4): 1155–1158.
- Fernandes K. A., Gee E. K., Rogers C. W., Kittelmann S., Biggs P. J., Bermingham E. N., Bolwell C. F., Thomas D. G. Seasonal variation in the faecal microbiota of mature adult horses maintained on pasture in New Zealand. Animals. 2021; 11(8): 2300. https://doi.org/10.3390/ani11082300
- Gharechahi J., Salekdeh G. H. A metagenomic analysis of the camel rumen’s microbiome identifies the major microbes responsible for lignocellulose degradation and fermentation. Biotechnol Biofuels. 2018; 11: 216. https://doi.org/10.1186/s13068-018-1214-9
- Harwood J. L. Recent advances in the biosynthesis of plant fatty acids. Biochim. Biophys. Acta. 1996; 1301: 7–56.
- He J., Yi L., Hai L. et al. Characterizing the bacterial microbiota in different gastrointestinal tract segments of the Bactrian camel. Sci Rep. 2018; 8: 654. https://doi.org/10.1038/s41598-017-18298-7
- Heinz E. DNA in transgenic seeds: which approach will be successful first. Eur. J. Lipid Sci.Tech. 2002; 104(1): 1–2.
- Ming L., Yi L., Siriguleng, Hasi S., He J., Hai L. et al. Comparative analysis of fecal microbial communities in cattle and Bactrian camels. PLoSONE. 2017; 12(3): e0173062. https://doi.org/10.1371/journal.pone.0173062
- Radnaeva L. D.,Bazarsadueva S. V., Taraskin V. V., Tulokhonov A. K. First data on lipids and microorganisms of deepwater endemic sponge Baikalospongia intermedia and sediments from hydrothermal discharge area of the Frolikha Bay (North Baikal, Siberia). Journal of Great Lakes Research. 2020; 46(1): 67–74. https://doi.org/10.1016/j.jglr.2019.09.021
- Tocher D. R., Leaver M. J., Hodson P. A Recent advances in the biochemistry and molecular biology of fatty acyl desaturases. Prog. Lipid Res. 1998; 37(2/3): 73–117.
- Wang L-Q., Meng X-Ch., Zhang B-R. Influence of Cell Surface Properties on Adhesion Ability of Bifidobacteria. World Journal of Microbiology and Biotechnology. 2010; 26: 1999–2007.
- Willers C., Jansen van Rensburg P. J. and Claassens S. Microbial signature lipid biomarker analysis — an approach that is still preferred, even amid various method modifications. Journal of Applied Microbiology. 2015; 118: 1251–1263.


