Жирнокислотный состав подкожного жира байкальской нерпы разного возраста
Автор: Аверина Е.С., Пинтаева Е.Ц., Раднаева Л.Д.
Журнал: Вестник Бурятского государственного университета. Философия @vestnik-bsu
Рубрика: Органическая химия
Статья в выпуске: 3, 2009 года.
Бесплатный доступ
Исследован жирнокислотный состав подкожной жировой ткани особей байкальской нерпы различного возраста. Сравнительный анализ выявил систематические различия между образцами жира взрослых особей, щенками и эмбрионами байкальской нерпы и объектом их питания. Выявлено, что особи байкальской нерпы имеют различный жирнокислотный состав во внутреннем и внешнем слое подкожного жира: жирнокислотный состав внутреннего слоя более близок к составу жира объектов питания, чем состав жирных кислот внешнего слоя.
Байкальская нерпа, жировая ткань, липиды, жирные кислоты
Короткий адрес: https://sciup.org/148178795
IDR: 148178795
Текст научной статьи Жирнокислотный состав подкожного жира байкальской нерпы разного возраста
Байкальский тюлень (нерпа) Phoca (Pusa) Sibirica Gmel – единственное эндемичное млекопитающее Байкала, является вершиной пищевой пирамиды озера. Статус байкальской нерпы как основного объекта биомониторинга закреплен в ФЗ "Об охране озера Байкал". Популяция насчитывает около 100 тыс. особей [1].
Липиды играют важную роль в метаболических процессах водных организмов и являются основным источником энергии для роста и воспроизводства гидробионтов. Липиды подкожного жира морских млекопитающих (а это до 50% массы тела у некоторых видов) являлись объектом многих исследований [2-8]. Основное внимание в этих работах уделяется жирным кислотам – «строительным блокам» липидов, изучение которых позволяет осветить экологические, таксономические и медицинские аспекты.
Несмотря на уникальные экологические и биологические характеристики озера Байкал, исследования, связанные с изучением состава липидов этого единственного вида млекопитающих Байкала, в литературе весьма немногочисленны [9, 10]. Тогда как жирнокислотный состав подкожного жира арктического кольчатого тюленя P. Hispida hispida и трех других подвидов: P. Hispida botnica (Балтийское море), P. Hispida ladogensis (Ладожское озеро) и P. Hispida saimensis (оз. Сайма, Финляндия) достаточно хорошо изучен [11-13].
В связи с этим большой интерес представляет анализ состава жиров пресноводных тюленей, вопрос зависимости жирнокислотного состава жира тюленей от состава кислот в жирах пищевых объектов, а также анализ жирнокислотного состава особей в возрастном аспекте.
Материалы и методы
Особи байкальской нерпы различного возраста были выловлены во время промыслового лова в районе Ушканьих островов оз. Байкал, заливах Провал и Чивыркуйский, в различные сезоны 20012008 гг., общее число животных – 52. Образцы жира весом около 20 мг были отобраны из подкожного жира тюленей послойно: возле шкуры (верхний слой) и непосредственно возле мышечной ткани животного (внутренний слой) и перенесены в толстостенные стеклянные пробирки с тефлоновыми закручивающимися пробками. Байкальские голомянки (основной объект пищевой базы нерпы) были пойманы сетями в районе Ушканьих островов. Рыбы были тщательно гомогенизированы, около 40 мг каждой пробы были перенесены в стеклянные пробирки.
Все образцы были метилированы одноступенчатым методом [14] обработкой 2 н раствором хлороводорода в метиловом спирте в течение 2 ч при 90°С. Анализ жирнокислотного состава проводился методом ГЖХ на хроматографе НР-6890 с масс-селективным детектором 5973N, колонка CP-WAX 52CB Chrompack (25 м х 0.25 мм), температура инжектора - 250°С, температура колонки программировалась следующим образом: 90°С в течение 4 мин, далее температура повышалась до 165°С со ско- ростью 30°С/мин., с последующим увеличением до 225°С (3°С/мин.). Температура масс-селективного детектора - 250°С. Для анализа образцов была использована стандартная смесь, содержащая 20 жирнокислотных эфиров (GLC-68D Nu-Chek-Prep; Elysian, Minnesota, USA).
Полученные данные жирнокислотного состава исследованных образцов были обработаны методом главных компонент, представленным в программном пакете «Sirius 7.0» [15]. Этот проекционный метод статистического анализа позволяет интегрировать информацию обо всех объектах и показателях одновременно в n-мерном пространстве и получить график, который является проектированием всех образцов на двухмерную систему, где оси системы – первая и вторая принципиальные компоненты [16].
Результаты и обсуждение
Анализ состава жировой ткани пресноводных тюленей и объектов их питания
В изученных образцах жира байкальской нерпы и основного объекта их питания – байкальской голомянки – идентифицировано 50 жирных кислот (табл. 1). Состав ЖК подкожного жира млекопитающих – это результат сложных процессов запаса, мобилизации, биосинтеза и транспорта липидов. Доминирующим источником ЖК для морских млекопитающих является пищевая база, так, все ЖК липидов изученных рыб обнаружены в подкожном жире изученных тюленей, хотя и в различных концентрациях.
В подкожном жире байкальской нерпы отмечается высокое содержание С18- и n6 ПНЖК, источниками которых является планктон. Общее увеличение концентраций n6 ПНЖК в жирах пресноводных тюленей наблюдается на фоне более низких концентраций n3 ПНЖК, в основном 20:5n3. Высокие уровни n6 и С18 ПНЖК и низкие уровни С20 и С22 МНЖК характерны также для пресноводных подвидов Phoca vitulina mellonae из северного Квебека (Канада) в отличие от его морских сородичей P. vitulina concolor и P. vitulina richardsi [17]. Несмотря на то, что в литературных источниках описан общий ЖК состав пресноводных гидробионтов [18], сравнительные данные по составу ЖК основных объектов питания и водных млекопитающих до сих пор не были освещены.
Применение мультивариационного анализа главных компонент позволило ясно продемонстрировать выявленные различия жирнокислотного состава между образцами байкальского тюленя и голомянки, с одной стороны, и морскими кольчатыми тюленями и полярной треской – с другой (рис. 1). Полученный график показывает наличие различий между образцами жира байкальской нерпы и объектами их питания – голомянками. Необходимо также отметить, что тюлени имеют различный жирнокислотный состав во внутреннем и внешнем слое подкожного жира (рис.1).
Обнаружено, что концентрации МНЖК с 14 и 18 углеродными атомами и более высоки в верхнем слое, а МНЖК с 20 и 24 углеродными атомами – во внутреннем слое подкожного жира тюленей; уровень 16:1n9 и 20:1n11 кислот (которые, в соответствии с положением двойной связи, являются результатом пероксисомального укорачивания цепи) повышается в верхнем слое. Содержание насыщенных жирных кислот выше в липидах внутреннего слоя. Что касается ПНЖК, изомеры 18:2 кислот в наибольшей степени аккумулируются в липидах верхнего слоя, ПНЖК с 16 углеродными атомами – во внутреннем слое жира.
В настоящее время для объяснения стратификации ЖК в подкожных жирах морских млекопитающих рассматриваются эндогенные ЖК, т.е. НЖК и ПНЖК с 14, 16 и 18 углеродными атомами [19, 20]. Полагают, что эндогенно синтезируемые ЖК мобилизуются в меньшей степени и потому доминируют в более стабильном верхнем слое, тогда как диетарные ЖК запасаются или мобилизуются по мере необходимости [21].
При сравнении ЖК состава внутреннего и верхнего слоев подкожного жира байкальской нерпы с жирнокислотным составом объектов питания (голомянки) было показано, что состав внутреннего слоя наиболее близок к составу пищевой базы (рис. 1), что не противоречит литературным данным [22, 23]. Послойные различия ЖК состава проявляются в наибольшей степени у взрослых байкальских тюленей по сравнению с составом жира щенков нерпы. Выявлено, что на ЖК состав внутреннего слоя оказывает влияние не только диетарный эффект, но и происходит эндогенный синтез и селективные процессы послойного распределения ЖК. Такие же различия наблюдались также у дельфинов Phocoena phocoena [21]. При этом, хотя состав внутреннего слоя подкожного жира тюленей отличен от состава жирных кислот объектов пищевой базы (табл. 1, рис. 1), тем не менее наблюдается общий характер изменения состава в направлении «рыба – внутренний слой подкожного жира тюленя» как для морских, так и для пресноводных гидробионтов.
Жирнокислотный состав байкальской нерпы различного возраста
Наряду с распределением ЖК в подкожной жировой ткани представляет интерес сравнительный анализ ЖК состава подкожного жира особей разного возраста. Обнаружено, что жирнокислотный состав подкожного жира щенков байкальской нерпы (25-30 дней) отличен от состава жира взрослых животных (рис.2). График главных компонент демонстрирует явные различия состава как в ряду «щенки нерпы – взрослые животные» (по первой принципиальной компоненте), так и различия между внутренним и верхним слоями, по второй принципиальной компоненте. В составе жиров щенков наблюдаются более высокие относительные концентрации 18:1n9 и 18:1n7 и низкие концентрации всех n6 и n3 ПНЖК (табл. 1).
Рис. 1. График метода главных компонент образцов жира байкальской нерпы и их основной пищевой базы – голомянки
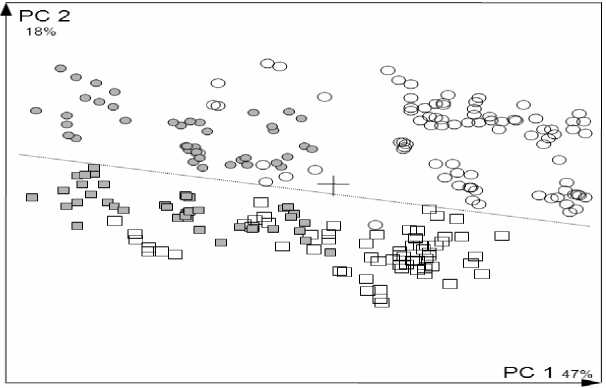
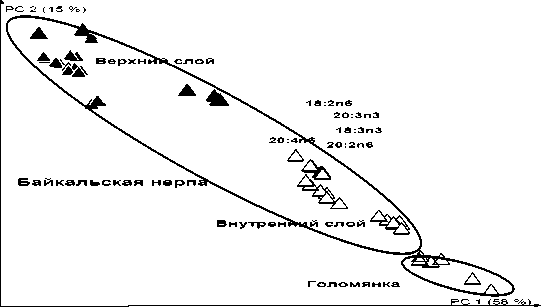
Рис. 2. График метода главных компонент образцов жира байкальской нерпы разного возраста: круг – образцы внутреннего слоя, квадрат – образцы верхнего слоя, темные фигуры – образцы щенков нерпы, светлые – взрослые животные
Жирнокислотный состав подкожного жира эмбрионов и щенков байкальской нерпы отличается от состава подкожного жира взрослых особей более низким содержанием ПНЖК, короткоцепочечных НЖК и МНЖК. При этом указанные различия проявлялись в наибольшей степени у эмбрионов, нежели у щенков нерпы. Подобные закономерности были обнаружены в подкожной жировой ткани новорожденных и взрослых тюленей Cystophora cristata [24] и новорожденных и взрослых особей белых китов Delphinapterus leucas [25]. Предполагается, что ПНЖК из жировой ткани самок тюленей, например Phoca vitulina , трансформируются в организм эмбрионов без изменений [24], и эти ПНЖК в основном используются для построения внутренних органов и тканей растущих эмбрионов и потому запасаются в подкожной жировой ткани в меньшей степени. Эндогенная продукция НЖК и МНЖК (которая происходит в раннем возрасте, ввиду необходимости быстрого накопления запаса жира и таким образом формирования необходимой защиты) также может вносить вклад в различие состава подкожного жира эмбрионов, щенков и взрослых особей. Высокие уровни НЖК в жире эмбрионов могут являться следствием стабильных высоких температур, в которых они находятся.
Таблица 1
Жирнокислотный состав (% ± станд. отклон.) жиров байкальской нерпы Phoca sibirica , кольчатого тюленя Phoca hispida , байкальской голомянки Comephorus baikalensis и полярной трески Boreogadus saida
|
Жирные кислоты * |
Эмбрионы нерпы |
Щенки нерпы |
Взрослые особи нерпы |
Голомянка |
||
|
Верхний слой |
Внутренний слой |
Верхний слой |
Внутренний слой |
|||
|
14:0 |
5,0 ± 0,1 |
4,0 ± 0,4 |
4,2 ± 0,4 |
3,8 ± 0,7 |
5,9 ± 0,9 |
6 ± 1 |
|
14:1n5 |
1,3 ± 0,3 |
1,5 ± 0,2 |
0,8 ± 0,2 |
2,0 ± 0,4 |
0,9 ± 0,3 |
0,25 ± 0,09 |
|
15:0 |
0,32 ± 0,01 |
0,34 ± 0,02 |
0,37 ± 0,03 |
0,31 ± 0,04 |
0,45 ± 0,08 |
0,46 ± 0,04 |
|
i-15:0 |
0,09 ± 0,01 |
0,68 ± 0,06 |
0,62 ± 0,04 |
0,59 ± 0,07 |
0,71 ± 0,09 |
0,7 ± 0,2 |
|
ai-15:0 |
0,11 ± 0,01 |
0,28 ± 0,02 |
0,27 ± 0,02 |
0,29 ± 0,04 |
0,31 ± 0,05 |
0,31 ± 0,07 |
|
16:0 |
24,0 ± 3,0 |
6,4 ± 0,4 |
10,0 ± 1 |
5,0 ± 1,0 |
11,0 ± 2 |
15,6 ± 0,3 |
|
16:1n9 |
4,0 ± 0,5 |
0,75 ± 0,07 |
0,69 ± 0,06 |
0,7 ± 0,1 |
0,7 ± 0,2 |
0,41 ± 0,07 |
|
16:1n7 |
19,0 ± 4,0 |
21,5 ± 0,7 |
17 ± 2 |
20 ± 2,0 |
15 ± 2 |
11 ± 3 |
|
16:1n5 |
0,23 ± 0,02 |
0,36 ± 0,03 |
0,35 ± 0,04 |
0,35 ± 0,03 |
0,35 ± 0,05 |
0,32 ± 0,02 |
|
16:2n6 |
0,10 ± 0,09 |
0,7 ± 0,1 |
0,7 ± 0,1 |
0,9 ± 0,1 |
1,1 ± 0,4 |
1,0 ± 0,3 |
|
16:3n4 |
<0,01 ± 0,00 |
0,26 ± 0,07 |
0,24 ± 0,06 |
0,3 ± 0,1 |
0,4 ± 0,1 |
0,5 ± 0,2 |
|
16:4n1 |
0,07 ± 0,06 |
0,14 ± 0,04 |
0,12 ± 0,03 |
0,20 ± 0,06 |
0,3 ± 0,1 |
0,2 ± 0,1 |
|
17:0 |
0,5 ± 0,2 |
0,32 ± 0,06 |
0,43 ± 0,07 |
0,24 ± 0,05 |
0,40 ± 0,09 |
0,29 ± 0,07 |
|
i-17:0 |
0,32 ± 0,08 |
0,51 ± 0,02 |
0,52 ± 0,03 |
0,46 ± 0,08 |
0,48 ± 0,07 |
0,54 ± 0,02 |
|
ai-17:0 |
0,25 ± 0,03 |
0,5 ± 0,1 |
0,55 ± 0,05 |
0,55 ± 0,06 |
0,6 ± 0,1 |
0,69 ± 0,08 |
|
b-17:1 |
0,1 ± 0,1 |
0,22 ± 0,05 |
0,21 ± 0,04 |
0,25 ± 0,03 |
0,27 ± 0,04 |
0,27 ± 0,04 |
|
17:1n8 |
0,3 ± 0,1 |
0,76 ± 0,04 |
0,69 ± 0,05 |
0,8 ± 0,1 |
0,56 ± 0,08 |
0,45 ± 0,08 |
|
18:0 |
3,2 ± 0,8 |
0,59 ± 0,07 |
1,3 ± 0,3 |
0,6 ± 0,1 |
1,5 ± 0,3 |
3,0 ± 0,3 |
|
i-18:0 |
0,02 ± 0,02 |
0,24 ± 0,02 |
0,26 ± 0,01 |
0,26 ± 0,06 |
0,24 ± 0,08 |
0,5 ± 0,1 |
|
18:1n9 |
21,0 ± 1,0 |
30,0 ± 5 |
32,0 ± 5 |
24,0 ± 6,0 |
18,0 ± 6,0 |
16,0 ± 2,0 |
|
18:1n7 |
6,5 ± 0,2 |
7,1 ± 0,8 |
7,6 ± 0,7 |
5,9 ± 0,9 |
5,0 ± 1 |
4,9 ± 0,8 |
|
18:1n5 |
0,7 ± 0,2 |
0,33 ± 0,03 |
0,31 ± 0,02 |
0,32 ± 0,09 |
0,30 ± 0,07 |
0,34 ± 0,05 |
|
18:2n7 |
1,2 ± 0,1 |
0,25 ± 0,05 |
0,20 ± 0,04 |
0,22 ± 0,09 |
0,15 ± 0,08 |
0,05 ± 0,03 |
|
18:2n6 |
0,6 ± 0,1 |
3,5 ± 0,4 |
3,9 ± 0,4 |
4,2 ± 0,7 |
4,1 ± 0,5 |
4,4 ± 0,8 |
|
18:2n4 |
0,3 ± 0,1 |
0,31 ± 0,03 |
0,31 ± 0,03 |
0,33 ± 0,03 |
0,33 ± 0,04 |
0,27 ± 0,05 |
|
18:3n6 |
0,15 ± 0,03 |
0,59 ± 0,05 |
0,47 ± 0,06 |
0,40 ± 0,07 |
0,28 ± 0,07 |
0,19 ± 0,04 |
|
18:3n3 |
0,13 ± 0,06 |
1,6 ± 0,3 |
1,7 ± 0,3 |
2,3 ± 0,6 |
3,0 ± 0,7 |
3,0 ± 0,6 |
|
18:4n3 |
0,1 ± 0,1 |
2,1 ± 0,5 |
1,9 ± 0,4 |
2,1 ± 0,5 |
2,7 ± 0,8 |
2,1 ± 0,3 |
|
19:0 |
0,18 ± 0,09 |
0,2 ± 0,1 |
0,16 ± 0,06 |
0,23 ± 0,07 |
0,2 ± 0,1 |
0,14 ± 0,02 |
|
20:0 |
0,13 ± 0,02 |
0,3 ± 0,3 |
0,1 ± 0,1 |
0,05 ± 0,07 |
0,1 ± 0,1 |
0,16 ± 0,03 |
|
20:1n11 |
1,8 ± 0,9 |
0,1 ± 0,1 |
0,1 ± 0,1 |
0,3 ± 0,1 |
0,3 ± 0,2 |
0,12 ± 0,04 |
|
20:1n9 |
0,35 ± 0,04 |
0,2 ± 0,1 |
0,3 ± 0,1 |
0,35 ± 0,06 |
0,5 ± 0,2 |
0,8 ± 0,1 |
|
20:1n7 |
0,36 ± 0,08 |
0,4 ± 0,2 |
0,2 ± 0,2 |
0,3 ± 0,1 |
0,3 ± 0,2 |
0,20 ± 0,02 |
|
20:2n6 |
1,2 ± 0,1 |
0,2 ± 0,1 |
0,2 ± 0,1 |
0,4 ± 0,1 |
0,6 ± 0,3 |
0,71 ± 0,08 |
|
20:3n3 |
<0,01 ± 0,00 |
0,17 ± 0,03 |
0,18 ± 0,04 |
0,20 ± 0,04 |
0,23 ± 0,04 |
0,28 ± 0,02 |
|
20:4n6 |
2,1 ± 0,2 |
1,7 ± 0,3 |
1,3 ± 0,3 |
2,0 ± 0,3 |
2,0 ± 0,3 |
4,0 ± 2,0 |
|
20:4n3 |
0,03 ± 0,03 |
0,4 ± 0,1 |
0,3 ± 0,1 |
0,6 ± 0,2 |
0,6 ± 0,2 |
0,38 ± 0,04 |
|
20:5n3 |
1,0 ± 0,2 |
3,0 ± 0,8 |
2,4 ± 0,6 |
4,0 ± 1,0 |
4,0 ± 1,0 |
7,0 ± 2,0 |
|
21:5n3 |
<0,01 ± 0,00 |
0,18 ± 0,06 |
0,17 ± 0,05 |
0,25 ± 0,07 |
0,28 ± 0,09 |
0,20 ± 0,04 |
|
22:0 |
<0,01 ± 0,00 |
0,01 ± 0,01 |
0,00 ± 0,01 |
0,01 ± 0,02 |
0,02 ± 0,02 |
0,08 ± 0,01 |
|
22:1n11 |
0,04 ± 0,02 |
0,03 ± 0,02 |
0,04 ± 0,01 |
0,01 ± 0,00 |
0,01 ± 0,00 |
<0,01 ± 0,00 |
|
22:1n9 |
<0,01 ± 0,00 |
0,01 ± 0,01 |
0,00 ± 0,01 |
0,05 ± 0,03 |
0,07 ± 0,02 |
0,16 ± 0,04 |
|
22:1n7 |
0,22 ± 0,09 |
0,10 ± 0,03 |
0,09 ± 0,03 |
0,05 ± 0,02 |
0,05 ± 0,02 |
0,08 ± 0,01 |
|
22:4n6 |
0,2 ± 0,2 |
0,23 ± 0,05 |
0,23 ± 0,05 |
0,3 ± 0,1 |
0,5 ± 0,1 |
0,16 ± 0,05 |
|
22:5n6 |
0,4 ± 0,1 |
0,5 ± 0,1 |
0,5 ± 0,2 |
1,0 ± 0,4 |
1,3 ± 0,5 |
1,2 ± 0,4 |
|
22:5n3 |
0,5 ± 0,2 |
2,2 ± 0,6 |
2,2 ± 0,6 |
3,4 ± 0,9 |
4,0 ± 1,0 |
0,9 ± 0,2 |
|
22:6n3 |
1,8 ± 0,5 |
4,0 ± 1 |
4,0 ± 1 |
7,0 ± 2,0 |
10,0 ± 3,0 |
10,0 ± 4,0 |
|
24:0 |
0,02 ± 0,02 |
<0,01 ± 0,00 |
<0,01 ± 0,00 |
0,01 ± 0,01 |
0,01 ± 0,01 |
0,05 ± 0,02 |
|
24:1n9 |
0,24 ± 0,04 |
0,01 ± 0,01 |
0,02 ± 0,02 |
0,05 ± 0,05 |
0,15 ± 0,06 |
1,1 ± 0,6 |
|
неид |
0,2 0,1 |
0,10 0,03 |
0,09 0,03 |
0,05 0,03 |
0,04 0,07 |
<0,00 0,00 |
* – первая цифра указывает на число углеродных атомов, вторая – на количество ненасыщенных связей, третья – на первый углеродный атом при двойной связи от метильной группы.
ЖК состав подкожного жира эмбрионов имеет 2 специфические особенности: 1) содержание 16:1n9 кислоты (положение двойной связи, которое указывает на то, что она является результатом пероксисомального укорачивания цепи) выше по сравнению с жирами щенков и взрослых нерп. Таким образом, в эмбрионах происходит пероксисомальное укорачивание цепи кислот для регуляции физико-химических свойств липидов; 2) в подкожной жировой ткани эмбрионов наблюдаются более высокие концентрации 20:1n11 кислоты. В случае байкальской нерпы этот факт не может быть объяснен укорачиванием цепи 22:1n11 кислоты, так как содержание данной кислоты очень мало и в подкожном жире и в основных пищевых объектах. Таким образом, появление 20:1n11 кислоты может объясняться удлинением цепи кислоты 20:0 с последующим Δ9-десатурированием. Это предположение обосновано также с учетом того, что процессы удлинения цепи могут протекать более активно в условиях высоких температур, в которых находятся эмбрионы, чем при холодных температурах окружающей среды, воздействующих на подкожную жировую ткань взрослых животных.
С возрастом состав подкожного жира щенков постепенно достигает ЖК состава жировой ткани взрослых животных. Было показано, что эти изменения от новорожденных к взрослым соответствуют лактационному периоду. Так, для щенков хохлача изменения происходят в течение очень короткого лактационного периода – 4 дня [24], тогда как детеныши белого кита (лактационный период – более года) достигают состава подкожного жира, который близок к составу жира их матери через 1 г [25]. Различия, выявленные в жирнокислотном составе жиров взрослых особей и щенков байкальской нерпы, обусловлены тем, что продолжительность лактационного периода байкальского тюленя составляет 45-75 дней (в зависимости от ледовой ситуации), а возраст исследованных в настоящей работе щенков байкальской нерпы составлял 25-30 дней. Таким образом, представленный сравнительный анализ выявил систематические различия между образцами жира взрослых особей, щенками и эмбрионами байкальской нерпы, а также между объектом их питания. Необходимо также отметить, что особи байкальской нерпы имеют различный жирнокислотный состав во внутреннем и внешнем слое подкожного жира, при этом жирнокислотный состав внутреннего слоя более близок к жирнокислотному составу жира объектов питания, чем ЖК состав внешнего слоя.
Работа выполнена при поддержке гранта РФФИ р _ Сибирь № 08-05-98029.


