Жирные кислоты мембран эритроцитов и сыворотки крови как биомаркеры для диагностики ранних стадий колоректального рака
Автор: Кручинина М.В., Кручинин В.Н., Громов А.А., Шашков М.В., Соколова А.С., Яковина И.Н., Шестов А.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 т.21, 2022 года.
Бесплатный доступ
Цель исследования - выявить перечень жирных кислот (ЖК) мембран эритроцитов и сыворотки крови, которые могут служить потенциальными биомаркерами ранних стадий колоректального рака. Материал и методы. Обследованы 65 пациентов с КРР I-II стадий (средний возраст - 63,3 ± 9,6 года), из них 30 мужчин, 35 женщин, и 35 человек группы сравнения, сопоставимых по возрасту и полу. Исследование состава жирных кислот мембран эритроцитов и сыворотки крови проведено с помощью ГХ/МС системы на основе трех квадруполей Agilent 7000B (США). Для статистической обработки использованы методы программного обеспечения MATLAB (R2019a, MathWorks) и языка программирования R: T-тест, анализ главных компонент (PCA), Fold Change, Volcano plot, метод машинного обучения (Random Forest), ROC-анализ, построение тепловых карт (Heatmap). Результаты. У пациентов с КРР I-II стадий выявлено снижение уровней насыщенных, отдельных мононенасыщенных и высокодостоверное повышение большей части уровней полиненасыщенных ЖК с преобладанием омега-3. Для большей части уровней жирных кислот достоверные различия в группах касались мембран эритроцитов с той же тенденцией в сыворотке крови. Уровни эритроцитарных миристиновой, пентадекановой, 7-пальмитолеиновой, отношения насыщенные/полиненасыщенные ЖК (содержание которых достоверно ниже при КРР I-II стадий, чем в контроле) и уровни α-линоленовой, эйкозапентаеновой, докозапентаеновой, докозагексаеновой, суммы омега-3 ЖК, EPA + DHA, докодиеновой, дигомо-γ-линоленовой, докозатетраеновой ЖК (содержание которых достоверно выше при КРР, чем у здоровых) являются дифференцирующими при различении больных КРР I-II стадий и здоровых лиц. В сыворотке крови уровень биомаркеров имели следующие ЖК: арахидоновая, миристиновая, докозагексаеновая, сумма омега-3 ПНЖК, отношение омега-6/омега-3 ПНЖК, пентадекановая, докозапентаеновая и докодиеновая. Модель, включающая перечень жирных кислот (С14:0, С15:0, С16:1;7, С18:3 n-3, C20:2 n-6, C20:3 n-6, C20:5 n-3, C22:4 n-6,C22:5 n-3, C22:6 n-3, сумма омега-3, омега-3(EPA + DHA), отношение насыщенные/полиненасыщенные ЖК, обеспечила AUC 0,916 со специфичностью 0,90, чувствительностью 0,95 при различении пациентов с КРР I-II стадий от здоровых лиц. Заключение. Изучение уровней и соотношений жирных кислот в мембранах эритроцитов и сыворотке крови следует считать перспективным направлением в поиске биомаркеров для ранней диагностики КРР.
Ранняя диагностика, колоректальный рак, жирные кислоты, липидомика, эритроциты, сыворотка крови
Короткий адрес: https://sciup.org/140293900
IDR: 140293900 | УДК: 616.34-006.6-072.5
Текст научной статьи Жирные кислоты мембран эритроцитов и сыворотки крови как биомаркеры для диагностики ранних стадий колоректального рака
В мире колоректальный рак (КРР) является 3-м по распространенности типом рака и 4-й ведущей причиной смерти от рака [1]. Около 85 % КРР считаются спорадическими, и развитие рака с прогрессией от аденомы до инвазивного рака обычно занимает около 10 лет [2]. Ранняя диагностика является ключом к долгосрочному выживанию пациентов. Из-за отсутствия методов ранней диагностики менее 40 % пациентов с КРР выявляются на ранней стадии. Колоноскопия является золотым стандартом для точной диагностики КРР, но ее инвазивный характер, высокая стоимость, иногда труднодоступность ограничивают ее широкое применение [3]. В клинической практике также используются некоторые биомаркеры опухоли, такие как раковоэмбриональный антиген (РЭА), опухолевая М2-пируваткиназа кала, анализ кала на скрытую кровь (FOBT), однако недостаточная чувствительность и специфичность, эпизодичность истечения крови из новообразования или его отсутствие снижают эффективность данных методов диагностики [4]. Поэтому разработка эффективных молекулярных биомаркеров для диагностики ранних стадий КРР и предрака становится все более важной.
Рак как метаболическое заболевание характеризуется биохимическими превращениями в клетках, необходимыми для поддержания их более высоких пролиферативных показателей и противодействия сигналам гибели клеток с измененным потоком по ключевым метаболическим путям, таким как гликолиз и цикл трикарбоновых кислот. Метаболомика позволяет количественно измерить динамический многопараметрический метаболический ответ живых систем на патофизиологические стимулы или генетическую модификацию. Эта технология широко использовалась для идентификации биомаркеров на основе метаболитов при различных формах рака [5–7].
Состав жирных кислот (ЖК) сывороточных липидов считается надежным показателем, отражающим потребление ЖК в течение нескольких недель или месяцев [8, 9]. Изменения состава ЖК в эритроцитах происходят в более отдаленные сроки, чем в сыворотке крови [10]. Несмотря на то, что в литературе имеются сведения о связи заболевания КРР с составом, а также с уровнем ЖК в сыворотке и мембранах эритроцитов [11–13], неясно, возможно ли использование отдельных видов ЖК как биомаркеров в диагностике ранних стадий КРР и предрака.
Цель исследования – выявить перечень жирных кислот мембран эритроцитов и сыворотки крови, которые могут служить потенциальными биомаркерами ранних стадий колоректального рака.
Материал и методы
Обследованы 65 пациентов с впервые выявленным КРР I–II стадий: I стадия – у 12, II – у 53
больных, из них 30 мужчин, 35 женщин (средний возраст – 63,3 ± 9,6 года), и 35 человек группы сравнения, сопоставимых по возрасту и полу (средний возраст – 61,7 ± 7,5 года, 18 мужчин, 17 женщин). Больные КРР наблюдались в ГБУЗ НСО «Новосибирский областной онкологический диспансер» и обследованы в соответствии с существующими клиническими рекомендациями, включая методы визуализации, маркеры опухоли в сыворотке крови и кале, с обязательным гистологическим подтверждением диагноза (у 44 больных – умереннодифференцированная, у 6 – высокодифференцированная, у 3 – низкодифференцированная аденокарцинома). Обследованные не принимали препараты и пищевые добавки, содержащие полиненасыщенные жирные кислоты. Стадия опухоли толстой кишки уточнена после операции при морфологическом исследовании операционного материала с учетом наличия метастазов в регионарных лимфатических узлах или обнаружения отдаленных метастазов в соответствии с классификацией по TNM.
Опухоли локализовались в различных отделах кишки: в слепой кишке (n=7), восходящем отделе (n=2) и поперечно-ободочной кишке (n=4), нисходящем отдели и в сигмовидной кишке (n=17), в прямой кишке (n=32). У 3 пациентов с КРР диагностирована первично-множественная локализация образований в толстой кишке.
В качестве группы сравнения были отобраны лица, у которых при обследовании в ГБУЗ НСО «НООД» и НУЗ «Дорожная клиническая больница на ст. Новосибирск-Главный ОАО «РЖД» были исключены злокачественные новообразования, без манифестирующей патологии внутренних органов. Пациенты исключались из исследования, если они получали какие-либо добавки омега-3 полинена-сыщенных жирных кислот или статины, имели гиперлипидемию, которая могла потребовать лекарственной коррекции, какие-либо значительные отклонения, по данным исследования общего анализа крови или биохимии, или имели холестериновые камни в желчном пузыре, поскольку эти факторы оказывают существенное влияние на профиль ЖК сыворотки крови и мембран эритроцитов [8]. Лица, включенные в группу сравнения, вели здоровый образ жизни, в большинстве не курили, употребляли алкоголь в дозах, не превышающих 20 г в сут в пересчете на чистый этанол, не чаще 1–2 раз в течение месяца.
Индекс массы тела (ИМТ) высчитывался как масса тела (кг)/рост (в метрах в квадрате). Курение и употребление алкоголя представлены как статус текущего употребления (Т), употребления в прошлом (П) и отсутствие вообще (О) – Т/П/О в процентах от общего числа лиц в группе. Показатели красной крови, биохимические параметры определены стандартными методами.
Забор крови у пациентов и ее исследование осуществляли при поступлении в стационар до прове- дения всех видов терапии после ночного голодания (12–14 ч): 8–9 мл – в пробирку без антикоагулянта для получения сыворотки и 8–9 мл – в пробирку с 3,8 % раствором цитрата натрия (0,129 моль/л, соотношение цитрата к количеству крови 1:9) для последующего получения взвеси эритроцитов. Для получения сыворотки проводили центрифугирование цельной крови при 2000 об/мин в течение 20 мин, затем сыворотку переносили в пробирки меньшего объема для исследования.
Исследование состава жирных кислот сыворотки крови и мембран эритроцитов (с их предварительным выделением) проведено с помощью газовой хроматографии/масс-спектрометрии – ГХ/ МС системы на основе 3 квадруполей Agilent 7000B (США). Концентрации жирных кислот выражали в относительных процентах. Предел обнаружения жирной кислоты ~1 мкг на образец. Кроме содержания отдельных ЖК, определяли суммарное содержание насыщенных, ненасыщенных, поли-ненасыщенных (ПНЖК), омега-3 ПНЖК, омега-6 ПНЖК, их соотношения [14]. Подробное описание пробоподготовки для определения состава жирных кислот представлено в работе [15].
Статистическая обработка данных и вычисления с помощью метода машинного обучения (Random Forest) проводились с применением программного обеспечения MATLAB (R2019a, MathWorks) и языка программирования R с использованием стандартных библиотек обучающих классификаций и наборов инструментов статистики. Random Forests – это комбинация предикторов дерева решений. Каждое дерево зависит от значений случайного вектора, выбираемого независимо и с одинаковым распределением для всех деревьев в лесу. Детали и основы метода Random Forests, используемые в этой статье, описаны в публикации [16].
Неконтролируемый анализ главных компонент (PCA) использовался для визуализации изменений в общем метаболическом паттерне между группами и кластеризации групп из-за размера набора данных. PCA выполняли с использованием количественных липидомных данных ГХ-МС. Липидомные тепловые карты (heatmaps) для жирных кислот мембран эритроцитов и сыворотки крови были созданы на основе количественного анализа данных ГХ-МС для визуализации метаболических паттернов.
Статистически значимые различия были выявлены с использованием двустороннего t-критерия Стьюдента с поправкой Бонферрони для множественных сравнений, в случаях отклонения распределения от нормального использовались непараметрические критерии (U-критерий Манна– Уитни). Во всех процедурах статистического анализа критический уровень значимости нулевой гипотезы (p) принимался равным 0,05 и значения p ≤ 0,05 считались значимыми.
Исследование одобрено комитетом биомедицинской этики Научно-исследовательского института терапии и профилактической медицины (29.11.2016; протокол № 123). Все обследуемые подписали информированное согласие на участие в исследовании.
Результаты
Обследуемые обеих групп не различались по возрасту, полу, индексу массы тела (табл. 1). Вместе с тем, в группе с КРР оказалось больше курящих в настоящем и прошлом, меньше не куривших в течение жизни (p<0,0001). Пациенты с КРР чаще употребляли алкоголь в анамнезе (p<0,001), среди них оказалось достоверно меньше не употребляющих алкоголь (p<0,05). Показатели липидного профиля сыворотки крови достоверно не различались в группах. Выявлены отличия в показателях красной крови: уровни гемоглобина, цветового показателя, гематокрита оказались выше, а количество ретикулоцитов, СОЭ – выше у пациентов с КРР, чем в группе сравнения (p<0,0001–0,01).
Суммарное содержание насыщенных жирных кислот оказалось достоверно ниже в мембранах эритроцитов пациентов с КРР I–II стадий, чем у здоровых лиц (p=0,008), в сыворотке крови отмечена та же тенденция, не достигающая уровня достоверности (табл. 2). При этом уровень миристиновой кислоты С14:0 оказался достоверно ниже как в мембранах эритроцитов (p<0,0001), так и в сыворотке (p=0,03). Для пентадекановой С15:0, гексадекановой С16:0, маргариновой С17:0 кислот достоверное снижение отмечено лишь в мембранах эритроцитов; в сыворотке отмечена та же тенденция. Содержание стеариновой ЖК С18:0 оказалось достоверно ниже в сыворотке крови (p=0,04) с тем же трендом в эритроцитах. Уровень арахиновой кислоты С20:0 имел тенденцию к снижению в мембранах клеток красной крови и сыворотке у пациентов с КРР по сравнению с контролем.
Суммарное содержание полиненасыщенных ЖК у пациентов с КРР I–II стадий оказалось достоверно выше в мембранах эритроцитов (p<0,0001), с той же тенденцией в сыворотке крови. Подобное повышение обеспечивалось преимущественно за счет полиненасыщенных ЖК (суммарное содержание мононенасыщенных ЖК в группах не различалось), которые оказались достоверно повышенными как в мембранах эритроцитов (p<0,0001), так и в сыворотке крови (p=0,02). Основную роль в обнаруженном преобладании ПНЖК играли омега-3 и омега-6 с большим увеличением первых, что отразилось в снижении соотношения омега-6/ омега-3 у пациентов с КРР по сравнению со здоровыми как в мембранах эритроцитов (p=0,006), так и в сыворотке крови (p<0,0001).
Снижение уровня насыщенных и повышение ненасыщенных ЖК сказались на изменении их соотношений – данный индекс оказался достоверно
Таблица 1/table 1
Показатели общего анализа крови у больных колоректальным раком i–ii стадий и лиц группы сравнения indicators of the general blood analysis in patients with colorectal cancer stages i–ii and healthy controls
|
Показатель/Indicator |
Группа cравнения/ Comparison group (n=35) |
Группа больных с ранними стадиями КРР/ Group of patients with early CRC stages (n=65) |
|
Возраст (годы)/Age (years) |
61,7 ± 7,5 |
63,3 ± 9,6 |
|
Пол (мужчины/женщины)/Gender (men/women) |
18/17 |
30/35 |
|
Курение Т/П/О (%)/Smoking C/P/A (%) |
5,7/17,4/ 80 |
21,5**/33,8**/32,3*** |
|
Алкоголь Т/П/О (%)/Alcohol C/P/A (%) |
22,8/25,7/57,1 |
30,7/53,8**/32,3* |
|
Индекс массы тела (кг/м2)/Body mass index (kg/m2) |
25,5 ± 3,2 |
24,8 ± 3,6 |
|
Количество эритроцитов (×1012/л)/ RBC count (×1012/L) |
4,62 ± 0,32 |
4,41 ± 0,56 |
|
Уровень гемоглобина (г/л)/Hemoglobin level (g/l) |
142,44 ± 8,29 |
118,7 ± 22,9*** |
|
Цветовой показатель/Color indicator |
0,94 ± 0,01 |
0,89 ± 0,13*** |
|
Гематокрит (%)/Hematocrit (%) |
44,2 ± 2,1 |
37,5 ± 10,2** |
|
СОЭ (мм/ ч)/ESR (mm/h) |
10,4 ± 3,4 |
27,9 ± 19,5*** |
|
Ретикулоциты (%)/Reticulocytes (%) |
0,00 ± 0,00 |
2,08 ± 1,85 |
|
Общий холестерин (мг/дл)/Total cholesterol (mg/dl) |
180,8 ± 20,4 |
182,7 ± 49,8 |
|
ХС ЛПВП (мг/дл)/HDL cholesterol (mg/dl) |
54,4 ± 10,3 |
56,47 ± 23,8 |
|
ХС ЛПНП (мг/дл)/LDL cholesterol (mg/dl) |
95,5 ± 10,1 |
111,3 ± 11,3 |
|
Триглицериды (мг/дл)/Triglycerides (mg/dl) |
131,8 ± 41,4 |
134,6 ± 56,7 |
Примечание: * – достоверность различий от группы сравнения (p<0,05); ** – p<0,01; *** – p<0,0001; Т/П/О – текущее/прошлое/отсутствие.
Note: * – significance of differences from the comparison group (p<0.05); ** – p<0.01; *** – p<0.0001; C/P/A – current/past/absence.
Таблица 2/table 2
Уровни жирных кислот в мембранах эритроцитов и сыворотке крови у пациентов с КРР i–ii стадий и лиц группы сравнения (M ± sd; Me (25 %;75 %)
levels of fatty acids in erythrocyte membranes and blood serum in patients with stage i–ii cRc and healthy controls (M ± sd; Me (25 %; 75 %)
|
Мембраны эритроцитов/RBC membranes |
Сыворотка крови/Blood |
serum |
||||
|
Жирные кислоты (%)/ |
Группа |
Группа КРР I–II |
Критерий |
Группа |
Группа КРР I–II |
Критерий Манна– |
|
Fatty acids (%) |
сравнения/ |
стадий/ |
Манна–Уитни/ |
сравнения/ |
стадий/ |
|
|
Сomparison |
Group CRC I–II |
Mann–Whitney |
Сomparison |
Group CRC I–II |
Mann– |
|
|
group (n=35) |
stages (n=65) |
test |
group (n=35) |
stages (n=65) |
Whitney test |
|
|
Омега-6 ПНЖК/ Omega-6 PUFA |
22,57 ± 8,14 |
27,69 ± 6,76 |
36,69 ± 8,33 |
39,50 ± 6,68 |
||
|
23,57 (17,9; 27,8) |
28,78 (23,6; 32,6) |
p=0,0001 |
38,48 (31,7; 45,3) |
40,18 (34,6; 42,7) |
p=0,002 |
|
|
Омега-3 ПНЖК (ЭПК+ДГК)/ Omega-3 PUFA (EPA + DHA) |
2,58 ± 1,36 |
3,93 ± 1,63 |
1,48 ± 1,05 |
2,26 ± 1,13 |
||
|
2,39 (1,89; 3,14) |
3,73 (2,71; 5,27) |
p=0,0001 |
1,37 (0,61; 1,94) |
1,89 (1,51; 2,77) |
p=0,0001 |
|
|
Омега-6/омега-3 ПНЖК/ |
6,58 ± 3,04 |
5,56 ± 2,31 |
24,4 ± 17,5 |
14,95 ± 7,5 |
||
|
5,87 |
5,08 |
p=0,006 |
16,74 |
14,67 |
p=0,0001 |
|
|
Omega-6/omega-3 PUFA |
(4,53; 8,11) |
(3,87; 6,54) |
(14,2; 33,8) |
(8,78; 19,04) |
||
|
Насыщенные/нена-сыщенные жирные |
1,43 ± 0,93 |
1,13 ± 0,69 |
0,61 ± 0,24 |
0,56 ± 0,19 |
||
|
кислоты/ |
1,04 |
0,89 |
p=0,014 |
0,55 |
0,51 |
p=0,0008 |
|
Saturated/unsaturated |
(0,86; 1,97) |
(0,78; 1,18) |
(0,47; 0,70) |
(0,43; 0,59) |
||
|
fatty acids |
||||||
|
Насыщенные/ |
||||||
|
полиненасыщенные |
2,36 ± 1,66 |
1,71 ± 1,03 |
0,96 ± 0,39 |
0,84 ± 0,19 |
||
|
жирные кислоты/ |
1,82 |
1,30 |
p=0,001 |
0,94 |
0,76 |
p>0,1 |
|
polyunsaturated fatty |
(1,42; 3,01) |
(1,14; 1,88) |
(0,69; 1,22) |
(0,63; 0,92) |
||
|
acids |
||||||
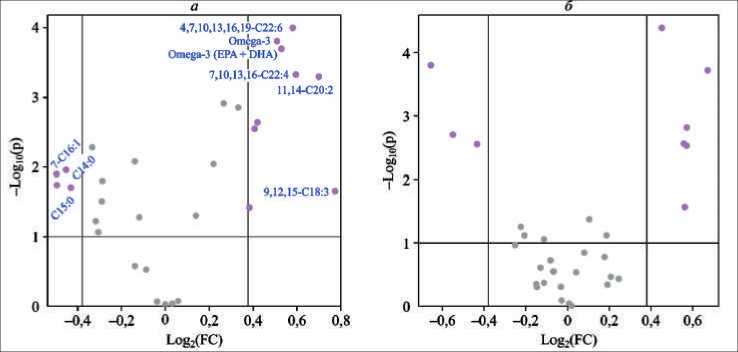
Рис. 1. Использование вулканной диаграммы к уровням ЖК мембран эритроцитов ( а ) и сыворотки крови ( б ), их соотношений для различения больных КРР Ӏ–ӀӀ стадий и здоровых лиц. График рассеяния для большого массива данных – это комбинация кратных изменений и t-тестов. Ось x – это log (кратных изменений); ось y – log10 (значение «p») и основана на скорректированных значениях «p»
Fig. 1. Тhe use of the Volcanic diagram to the levels of fatty acids of erythrocyte membranes ( a ) and blood serum ( б ), their ratios to distinguish of patients with colorectal cancer Ӏ–ӀӀ stage from healthy individuals. Тhe Volcano plot is a combination of fold change and t-tests. Note, the X-axis is log (Fold Сhange), Y-axis is – log10 («p» value), and is based FDR adjusted «p» values
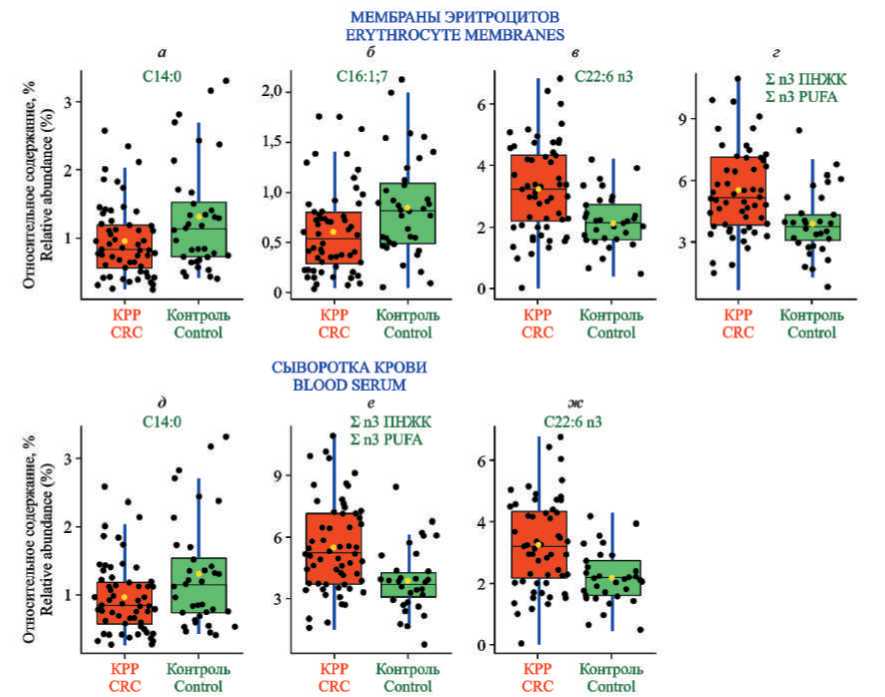
Рис. 2. Уровни ЖК мембран эритроцитов (сверху) и сыворотки крови (снизу), отвечающих критериям биомаркеров, у больных КРР Ӏ–ӀӀ стадий и в группе сравнения. Уровни жирных кислот в мембранах эритроцитов: а – С14:0 (миристиновой); б – С16:1;7 (7-пальмитоолеиновой); в – С22:6 n3 (докозагексаеновой); г – суммарное содержание омега 3 ПНЖК. Уровни ЖК в сыворотке крови: д – С14:0 (миристиновой); е – суммарное содержание омега 3 – ПНЖК; ж – С22:6 n3 (докозагексаеновой)
Fig. 2. Levels of FA of erythrocyte membranes (top) and blood serum (bottom) meeting the criteria for biomarkers in patients with colorectal cancer Ӏ–ӀӀ stage and in the comparison group. Levels of fatty acids in erythrocyte membranes: a – С14:0 (myristic), б – С16:1;7 (7-palmitooleic), в – С22:6 n3 (docosahexaenoic), г – total content of omega 3 РUFA. Ѕerum fatty acids levels: д – С14: 0 (myristic), е – total content of omega 3 РUFA, ж – С22: 6 n3 (docosahexaenoic)
ниже у пациентов с КРР, чем в контроле, как в эритроцитах, так и в сыворотке крови (p=0,014, p=0,0008 соответственно). Соотношение насы-щенные/полиненасыщенные ЖК было достоверно ниже только в мембранах эритроцитов (p<0,001), с той же тенденцией в сыворотке крови.
Анализ уровней отдельных жирных кислот в составе ненасыщенных выявил следующие закономерности. Содержание двух мононенасыщенных ЖК в мембранах эритроцитов С16:1;7 Цис-7гексадекановой (7-Пальмитоолеиновой) и С16:1;9 Цис-9-гексадекановой (9-Пальмитоолеиновой) оказалось достоверно ниже у пациентов с КРР, чем в контроле (p<0,001 и p=0,003 соответственно).
Содержание большей части ПНЖК было достоверно выше у пациентов с КРР, чем у здоровых лиц. При этом для докодиеновой С20:2 n-6, арахидоновой С20:4 n-6, докозапентаеновой С22:5 n-3 и докозагексаеновой С22:6 n-3 такое повышение с высокой степенью достоверности выявлено как в мембранах эритроцитов, так и в сыворотке крови. Для ряда других ПНЖК – α-линоленовой
С18:3 n-3, дигомо-γ-линоленовая C20:3 n-6, эйко-запентаеновой С20:5 n-3, докозатетраеновой C22:4 n-6 – достоверное повышение выявлено лишь в мембранах эритроцитов, с той же тенденцией в сыворотке крови.
Таким образом, у пациентов с КРР I–II стадий выявлено снижение насыщенных, отдельных моно-насыщенных и высокодостоверное повышение большей части полиненасыщенных ЖК с преобладанием омега-3. Для большей части уровней жирных кислот достоверные различия в группах касались мембран эритроцитов, с той же тенденцией в сыворотке крови.
На следующем этапе проведено выявление жирных кислот, являющихся значимыми в различении пациентов с КРР I–II стадий от здоровых лиц. Для анализа произведена стандартизация уровней жирных кислот мембран эритроцитов и сыворотки крови. Использование T-теста для различения состава ЖК в мембранах эритроцитов и сыворотке крови пациентов с КРР I–II стадий и здоровых позволило получить отчетливое дифференцирование
Таблица 3/table 3
Жирные кислоты мембран эритроцитов и их соотношения – потенциальные биомаркеры для различения больных КРР i–ii стадий и здоровых лиц (данные получены при использовании Volcano plot)
Fatty acids of erythrocyte membranes and their ratios – potential biomarkers for distinguishing between i–ii stages of colorectal cancer and healthy individuals (data obtained using the Volcano plot)
Использование графика рассеяния для большого массива данных (вулканной диаграммы – Volcano plot) позволило выявить 13 параметров – отдельных ЖК мембран эритроцитов и их соотношений, и 9 – сыворотки крови, которые дают возможность точно различить больных КРР I–II стадий от здоровых лиц и могут рассматриваться как потенциальные биомаркеры (рис. 1). На рис. 2 представлены коробчатые диаграммы уровней отдельных ЖК мембран эритроцитов и сыворотки крови у пациентов с КРР I–II стадий (красный цвет) и у здоровых лиц (зеленый цвет), которые отвечают критериям биомаркеров.
Перечень 13 параметров, представляющих уровни отдельных ЖК мембран эритроцитов и их соотношения, которые отвечают требованиям для дифференцирующих биомаркеров (больные

КРР Контроль КРР Контроль
CRC Control CRC Control
КРР Контроль КРР Контроль
CRC Control CRC Control
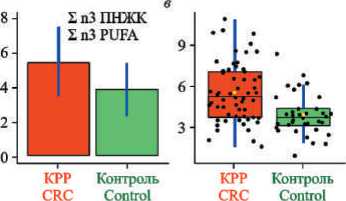
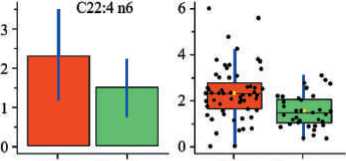
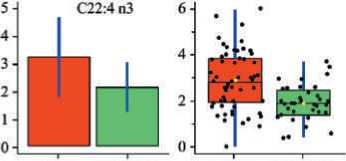
Рис. 3. Коробчатые диаграммы уровней докозатетраеновой ( а ), докозагексаеновой ( б ), суммы омега-3 ПНЖК ( в ) в мембранах эритроцитов у пациентов с Ӏ–ӀӀ стадиями КРР (красные столбцы) и здоровых лиц (зеленые столбцы) (представлены начальные данные – рисунки слева и нормализованные – рисунки справа)
Fig. 3. Box diagrams of levels of docatetraenoic ( a ), docosahexaenoic ( б ), total content of omega-3 РUFA ( в ) in erythrocyte membranes in patients with colorectal cancer Ӏ–ӀӀ stage (red columns) and healthy individuals (green columns) (initial data – figures on the left and normalized – figures on the right)
КРР I–II стадий против здоровых лиц), представлены в табл. 3. Данные получены при применении Volcano plot.
При этом уровни эритроцитарных миристиновой, пентадекановой, 7-пальмитолеиновой, отношения насыщенные/полиненасыщенные ЖК (содержание которых достоверно ниже при КРР I–II стадий, чем в контроле) и уровни α-линоленовой, эйкозапентаеновой, докозапентаеновой, докозагек-саеновой, суммы омега-3 ПНЖК, эйкозапентае-новой+докозапентаеновой (EPA + DHA), докодиеновой, дигомо-γ-линоленовой, докозате-траеновой ЖК (содержание которых достоверно выше при КРР, чем у здоровых) являются дифференцирующими при различении больных КРР I–II стадий от здоровых лиц. Коробчатые диаграммы для отдельных ЖК, претендующих на роль биомаркеров, представлены на рис. 3 (уровни ЖК показаны до и после нормализации).
Уровни 9 ЖК сыворотки крови, которые дифференцируют пациентов с КРР I–II стадий от здоровых лиц, представлены в табл. 4. В сыворотке крови уровень биомаркеров для различения больных КРР I–II стадий от здоровых лиц имели следующие ЖК: арахидоновая, миристиновая, докозагексаеновая, сумма омега-3 ПНЖК, отношение омега-6 к омега-3 ПНЖК, пентадекановая, докозапентаеновая и докодиеновая. Пример нормализации уровня арахидоновой кислоты сыворотки крови представлен на рис. 4.
Корреляции уровней жирных кислот мембран эритроцитов и сыворотки крови у пациентов с ранними стадиями КРР между собой представлены на рис. 5. Выявлено наличие кластеров ЖК с высокой и очень высокой силой положительной связи: суммарные содержания ненасыщенных, полинена-сыщенных, омега-3, омега-6, EPA+DHA, С20:4 n-6, C22:5 n-3, C22:6 n-3 коррелировали между собой. Напротив, отношения насыщенные/ненасыщенные, насыщенные/полиненасыщенные, сумма насыщенных ЖК, С18:0, С20:0 отрицательно коррелировали с суммой мононенасыщенных ЖК.
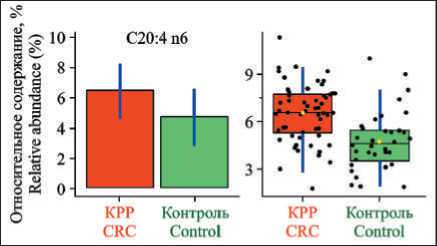
Рис. 4. Пример нормализации уровня арахидоновой кислоты сыворотки крови (слева – уровни до, справа – после нормализации значений)
Fig. 4. An example of normalization of serum arachidonic acid levels (on the left – the levels before, on the right – after the normalization of values)
Таблица 4/table 4
Жирные кислоты сыворотки крови и их соотношения – потенциальные биомаркеры для различения больных КРР i–ii стадий и здоровых лиц (данные получены при использовании Volcano plot) serum fatty acids and their ratios – potential biomarkers for distinguishing between colorectal cancer stage i–ii and healthy individuals (data obtained using the Volcano plot)
|
Название жирных кислот/ Name of fatty acids |
Кратность изменений/ Fold Change (FC) |
log2(FC) |
Значения «р»/ «p» values (raw. p val) |
–log10(p) |
|
C20:4;5,8,11,14 (n-6) |
||||
|
Эйкозатетраеновая (Арахидоновая)/ |
1,3652 |
0,44906 |
3,9083Е-5 |
4,408 |
|
Eicosatetraenoic (Arachidonic) |
||||
|
С14:0 |
||||
|
Тетрадекановая (Миристиновая)/ |
0,63296 |
–0,65982 |
1,6257Е-4 |
3,789 |
|
Tetradecanoic (Myristic) |
||||
|
C22:6;4,7,10,13,16,19 (n-3) |
1,592 |
0,670088 |
1,9712Е-4 |
3,7053 |
|
Докозагексаеновая/Docosahexaenoic |
||||
|
Омега-3 ПНЖК/ Omega-3 PUFA |
1,4809 |
0,56643 |
0,0015021 |
2,8233 |
|
Омега-6/омега-3 ПНЖК/ Omega-6/omega-3 PUFA |
0,68248 |
–0,55113 |
0,001928 |
2,7149 |
|
Омега-3 ПНЖК (ЭПК+ДГК)/ Omega-3 PUFA (EPA + DHA) |
1,4663 |
0,55223 |
0,0027073 |
2,5675 |
|
С15:0 Пентадекановая/Pentadecanoic |
0,73958 |
–0,43522 |
0,0027106 |
2,5669 |
|
C22:5;7,10,13,16,19 (n-3) |
1,4851 |
0,57054 |
0,0028467 |
2,5457 |
|
Докозапентаеновая/Docosapentaenoic |
||||
|
C20:2;11,14 (n-6) Докодиеновая/Docodienic |
1,4713 |
0,55707 |
0,02684 |
1,5712 |
Метод главных компонент (PCA-анализ) позволил выявить паттерны жирных кислот мембран эритроцитов и сыворотки крови для лиц группы сравнения и с КРР I–II стадий (рис. 6). Кроме перечня ЖК, которые являются общими для обеих групп, определяются ЖК, которые ассоциированы только с КРР или здоровыми лицами. Heatmap обеспечила визуализацию различий жирнокислотных профилей как мембран эритроцитов, так и сыворотки крови у пациентов обследованных групп (рис. 7).
Проведение ROC-анализа продемонстрировало перспективы использования даже отдельных ЖК как мембран эритроцитов, так и сыворотки крови из числа претендующих на роль биомаркеров для различения больных КРР I–II стадий и здоровых лиц (рис. 8). Характеристики ранжируются на основе площади под кривой ROC (AUC ROC), T-теста или Log2-кратного изменения (FC). Для ЖК мембран эритроцитов AUC составила: для до-козагексаеновой – 0,735, докозатетраеновой – 0,725, суммы полиненасыщенных ЖК – 0,711, суммы до-козагексаеновой и эйкозапентаеновой ЖК – 0,737. Для жирных кислот сыворотки крови уровни AUC оказались следующими: для арахидоновой – 0,758, для миристиновой – 0,713, для докозагексаеновой 0,724, суммы омега-3 ПНЖК – 0,712.
Использование панели ЖК, состоящей из вышепредставленных биомаркеров, обеспечило высокую диагностическую точность различения больных КРР I–II стадий от здоровых лиц. Модель, включающая уровни жирных кислот С14:0, С15:0, С16:1;7, С18:3 n-3, C20:2 n-6, C20:3 n-6, C20:5 n-3, C22:4 n-6, C22:5 n-3, C22:6 n-3, сумма омега-3, омега-3 (EPA + DHA), отношение насыщенные/ полиненасыщенные ЖК, обеспечила AUC 0,916 со специфичностью 0,90, чувствительностью 0,95 при дифференцировании пациентов с КРР I–II стадий от здоровых лиц.
Обсуждение
На 1-е место по значимости в различении больных КРР I–II стадий от здоровых выходят омега-3 ПНЖК, особенно докозагексаеновая (С22:6 n3), суммарное содержание эйкозапентаеновой (С20:5 n3) и докозагексаеновой (С22:6 n3), а также сумма всех омега-3 ПНЖК как в мембранах Эр, так и сыворотке крови. Их повышение преобладает над повышением омега-6 ПНЖК (С20:2 n6, С22:3 n6, С22:4 n6), особенно в сыворотке крови.
Только в сыворотке крови отмечено высокодостоверное повышение уровня арахидоновой кислоты С20:4 n6 (p<0,00003) у пациентов с КРР по сравнению со здоровыми. Вносят вклад в различение больных I–II ст. КРР от здоровых насыщенные ЖК – миристиновая (С14:0), пентадекановая (С15:0), мононенасыщенная пальмитолеиновая (7-С16:1), но он существенно меньше, чем у ПНЖК.
Снижение насыщенных ЖК, возможно, происходит в результате их расхода в процессе аци-
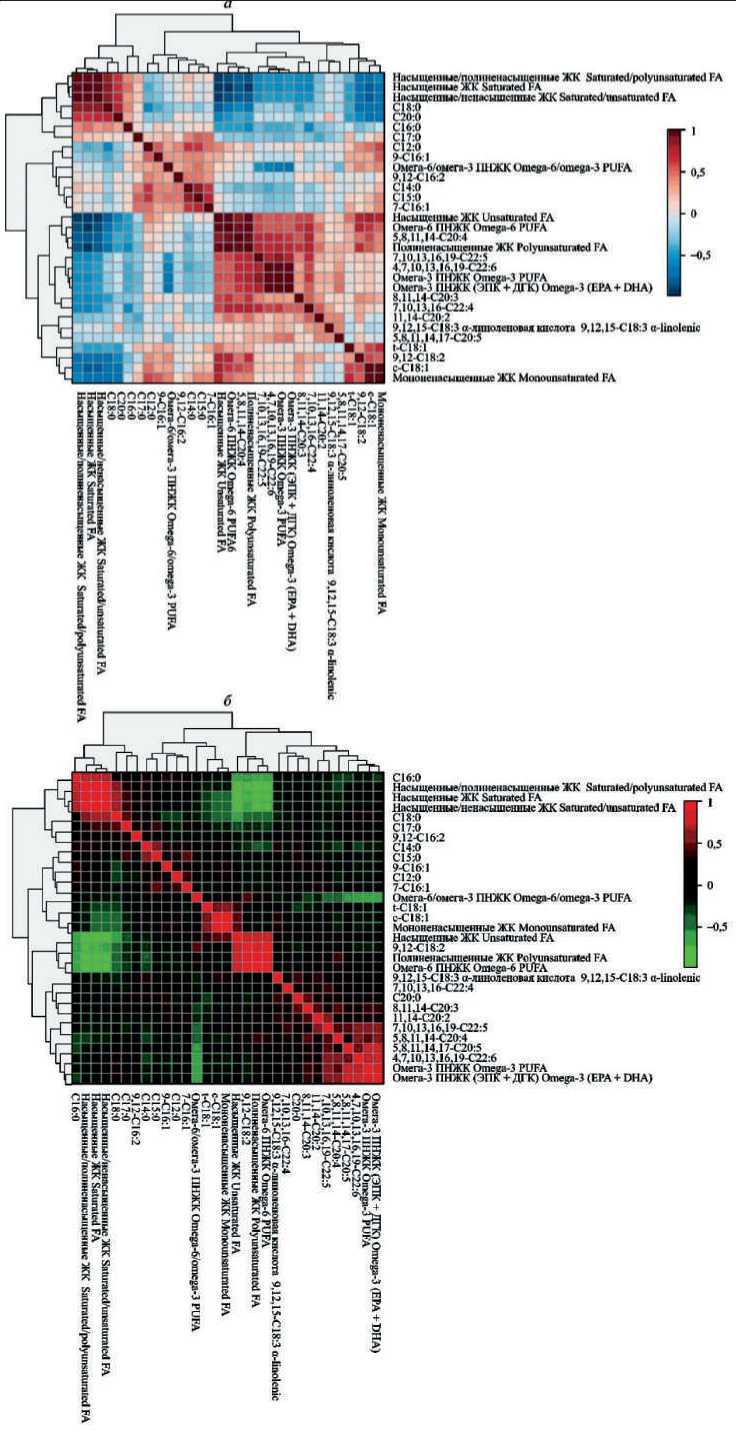
Рис. 5. Корреляции уровней жирных кислот мембран эритроцитов ( а ) и сыворотки крови ( б ) у больных КРР Ӏ–ӀӀ стадий между собой.
Цветами обозначен характер связи: для мембран эритроцитов – оттенки коричневого цвета – положительная корреляция; оттенки синего цвета – отрицательная корреляция. Для сыворотки крови – оттенки краснокоричневого цвета – положительная корреляция; оттенки зеленого цвета – отрицательная корреляция. Интенсивность цвета отражает силу связи между параметрами
Fig. 5. Сorrelation of the levels of fatty acids in the membranes of erythrocytes ( a ) and blood serum ( b ) in patients with colorectal cancer Ӏ–ӀӀ stage with each other. Тhe colors indicate the nature of the relationship: for erythrocyte membranes – shades of brown – positive correlation, shades of blue – negative correlation. For blood serum, shades of red-brown color are positive correlation, shades of green are negative correlation. Сolor intensity reflects the strength of the relationship between parameters
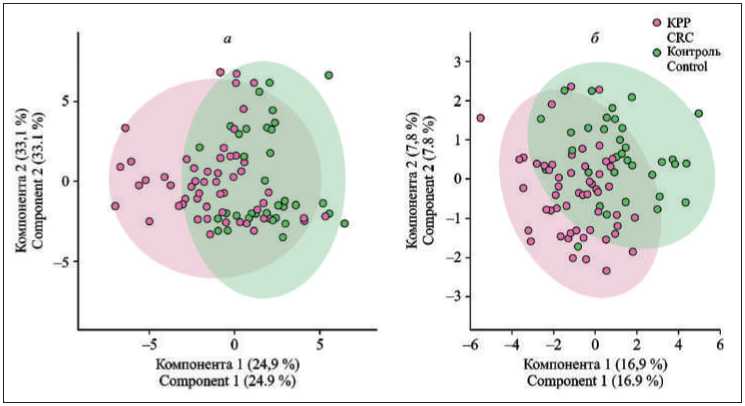
Рис. 6. Метод главных компонент (РСA) в различении жирных кислот мембран эритроцитов ( а ) и сыворотки крови ( б ) у больных КРР Ӏ–ӀӀ стадий и здоровых лиц. Красные точки ассоциированы с ЖК у пациентов с Ӏ–ӀӀ стадиями КРР; зеленые – у здоровых лиц Fig. 6. Рrincipal component analysis (РСA) in distinguishing between fatty acids of erythrocyte membranes ( а ) and blood serum ( b ) in patients with colorectal cancer Ӏ–ӀӀ stage and healthy individuals. Red points are associated with FA for patients with stages 1–2 of colorectal cancer, green points are associated with healthy individuals
Группа Group
016:0
020:0
018:0
Насыщенные ЖК Saturated FA
Насыщенныененасыщенные ЖК Saturated unsaturated FA
7,10,13,16,19-022:5
4,7,10,13,16,19-022:6
Омега 3 ПНЖК Omega-3 PUFA
Омега-3 ПНЖК (ЭПК * ДГК) Omega-З (ЕРА * ОНА) 5,8.11,14-020:3
Насыщенные ЖК Unsaturated FA
Полннсткытснныс ЖК Polyunsaturated FA Омега-6 ПНЖК Omcga-6 PUFA 11,14-020:2 8,11.14-020:3 7.10.13.16-022:4
9,12,15-018:3 а-линолеяовал кислота 9,12,15-018:3 a-lmolenic 5.8,11.14,17-020:5
1-018:1 с-018:1
Миноненасышенные ЖК Monounsaturated FA 9,12-018:2
Омега-6 омега-3 ПНЖК Omega-6 omega-3 PUFA 9,12-016:2 012:0 9-016:1 017:1 7-016:1 014:0 015:0

Группа Group 016:0
Насыщенные полннснасышснныс ЖК Saruratcd^polyunsafuratcd ГА Насыщенные ЖК Saturated FA
Насышснные'ненасышснные ЖК Sanirateduosanirated FA 9,12-016:2 017:0 018:0
Насыщенные ЖК Unsaturated FA 9,12-018:2
Патпненасышеяные ЖК Polyunsaturated FA Омега-6 ПНЖК Omcga-6 PUFA 4,7.10.13,16,19-022:6 5,8.11,14,17-020:5
Омега-3 ПНЖК Omega-3 PUFA
Омега-3 ПНЖК (ЭПК ♦ ДГК) Omega-З (ЕРА * DHA) 5,8,11,14-020:4 020:0 8.11.14-020:3
9,12,15-018:3 а-лнноленовая кислота 9,12,15-018:3 a-linotenK
7,10.13.16-022:4
11.14^?20:2
7,10.13.16.19-022:5 t-018:1
с-018:1
Мононенасышенные ЖК Monoun.saturated FA
Омега-6/оыега-З ПНЖК Omcga-6 omega-3 PUFA 9-016:1 014:0 015:0 012:0 7-016:1
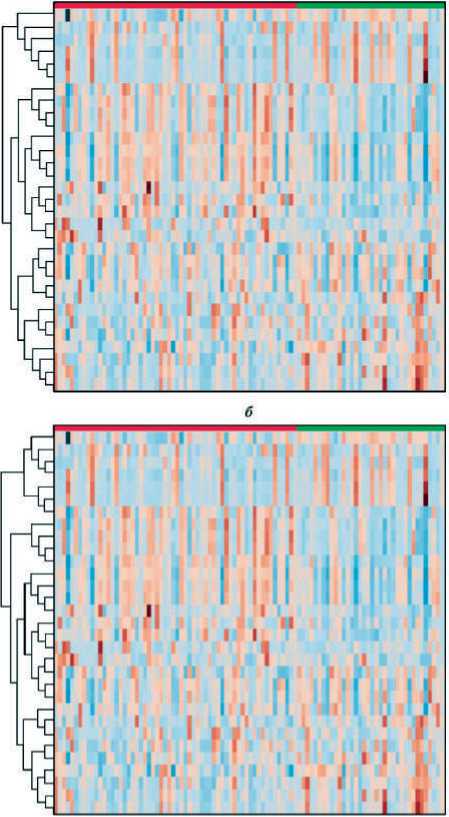
Рис. 7. Heatmap, обеспечивающая визуализацию жирнокислотных профилей мембран эритроцитов ( а ) и сыворотки крови ( б ) у больных КРР
Ӏ–ӀӀ стадий (красная полоса сверху) и группы сравнения (зеленая полоса сверху). Цветовая гамма отражает степень представленности метаболита в данной группе (краснокоричневый диапазон – высокие уровни метаболита; сине-голубой – низкие уровни ЖК)
Fig. 7. Heatmap, which provides visualization of fatty acid profiles of erythrocyte membranes ( a ) and blood serum ( b ) for patients with colorectal cancer Ӏ–ӀӀ stage (red bar top) and healthy controls (green bar top). Тhe color scale reflects the degree of representation of the metabolite in this group (red-brown range – high levels of metabolite; blue-blue – low levels of fatty acids)
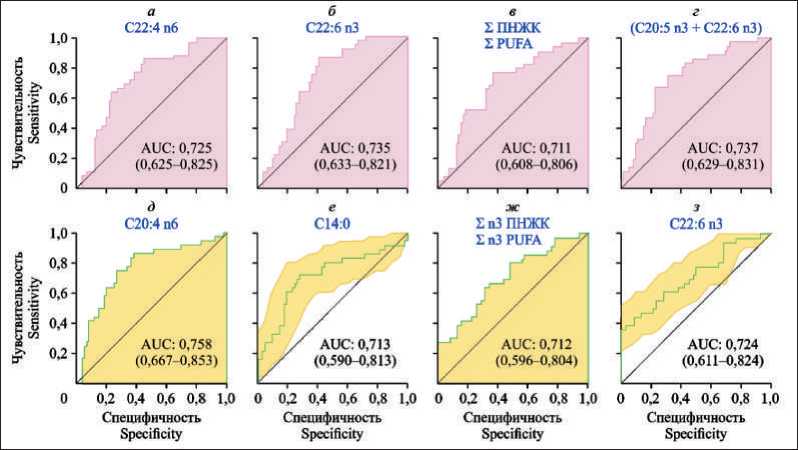
Рис. 8. ROС-анализ по использованию уровней отдельных ЖК мембран эритроцитов и сыворотки крови для дифференцирования больных КРР Ӏ–ӀӀ стадий от здоровых лиц
Fig. 8. ROС analysis using the levels of individual fatty acids of erythrocyte membranes and blood serum to differentiate patients with colorectal cancer Ӏ–ӀӀ stage from healthy individuals
лирования, посттрансляционной модификации секретируемых сигнальных белков Hedgehog (Hh), Wnt, что приводит к значительному возрастанию активности последних с последующим влиянием на пролиферацию, дифференциацию и миграцию клеток [17].
Расходование миристиновой кислоты происходит и для синтеза фермента N-миристоилтрансферазы, необходимого для работы антиоксиданта FSP1, который защищает раковые клетки от ферроптоза (гибели клеток в присутствии железа из-за разрушения липидов в составе мембраны), что обеспечивает устойчивость опухолевых клеток [18]. Очевидно, вносит вклад и повышенная активность фермента стеароил-КоА-десатуразы-1 (жирный ацил-Δ9-десатурирующий фермент), который превращает насыщенные жирные кислоты в моно-ненасыщенные жирные кислоты [19].
Вклад стеароил-КоА-десатуразы в распространение клеток рака зависит от МНЖК (в т. ч. наиболее распространенной олеиновой ЖК – C18:1 n-9), подавляющих передачу сигналов PTEN/Akt и регулирующих эпителиально-мезенхимальный переход. PTEN, классический ген-супрессор опухолей, является наиболее важным негативным регулятором сигнального пути PI3K/Akt [20]. Показано, что потеря функции PTEN способствует прогрессированию КРР. Снижение уровня МНЖК, по данным настоящего исследования, может быть обусловлено их избыточным расходом в связи с подавлением сигнальных путей PI3K/Akt [21].
L. Baró et al. было показано, что сниженные уровни линолевой кислоты в мембранах эритроцитов могут повышать активность ферментативной системы – десатуразы z-6-ЖК в печени, приводя к значительному повышению уровня арахидоновой кислоты [22]. F. Veglia et al. установили, что полиморфноядерные миелоидные супрессорные клетки (PMN-MDSC), которые являются патологически активированными нейтрофилами и имеют решающее значение для регуляции иммунных реакций при раке, исключительно активируют транспортный белок жирных кислот 2 (FATP2). Основной механизм подавляющей активности, опосредованной FATP2, заключался в повышенном поглощении линолевой, арахидоновой кислот и синтезе простагландина E2 [23].
Показана активация синтеза ПНЖК, ассоциированная с канцерогенезом. R.M. Kortlever et al. выявили, что два онкогена KRAS и MYC, значимых для КРР, взаимодействуют, что приводит к немедленному переходу к развитию высокопролиферативных и инвазивных аденокарцином, которые характеризуются выраженной воспалительной, ангиогенной и иммуносупрессированной стромой [24]. MYC индуцирует белок транскрипционного стерол-регулируемого фактора (transcription factor sterol-regulated element-binding protein) SREBP1, и они взаимодействуют для активации синтеза жирных кислот из глюкозы и глютамина и регуляции удлинением цепи жирных кислот [25].
Ацил-КоА-связывающий белок (ACBP) высоко экспрессируется в опухолевых клетках, и, связываясь с ацил-КоА, он автономно поддерживает высокие скорости пролиферации, стимулирование роста опухоли, приводя к снижению выживаемости пациентов. ACBP поддерживает рост опухоли, контролируя доступ длинноцепочечных жирных ацил-КoA к митохондриям и способствуя их окислению, что обеспечивает высокие энергетические потребности опухолевых клеток [26].
Одним из факторов, ведущих к нарастанию уровня жирных кислот при развитии опухолевого процесса, следует считать повышение активности синтазы жирных кислот – фермента FASN при КРР, а также активацию гена LUR1, регулятора поглощения липидов 1, который активирует гены белков, непосредственно участвующих в поглощении липидов из внеклеточного пространства [27].
В ряде исследований показано изменение роли ПНЖК, в т. ч. омега-3, в канцерогенезе в зависимости от их концентрации. Известно, что омега-3 ПНЖК в мембране могут конкурировать с омега-6 ПНЖК в качестве субстратов ферментов циклооксигеназы и липоксигеназы, они могут уменьшить продукцию производных омега-6 – эйкозаноидов, таких как PGE2, LTB4, которая требуется для нормальной функции Т-клеток. Кроме того, при низкой концентрации омега-3 ПНЖК могут связываться с PPAR-γ для регулирования уровней IL-8, iNOS и MMP-1, что приводит к ингибированию пролиферации клеток, они также могут увеличить ROS с нарастанием апоптоза клеток. При высокой концентрации омега-3 ПНЖК могут встраиваться в мембранные фосфолипиды, изменяя текучесть липидного бислоя, в результате чего происходит ингибирование пролиферации Т-клеток. Высокие уровни n-3 ПНЖК могут подавлять иммунную среду посредством изменений в производстве цитокинов, пролиферации Т-клеток и опосредуемой Т-клеточной цитотоксичности. Кроме того, C22:6 n-3 также может исключительно подавлять регуляторную функцию T-лимфоцитов [28].
Другие авторы обнаружили, что высокая активность воспаления и канцерогенез, вызванные диетическим C22: 6 n-3, были связаны с измененными популяциями T-клеток CD8 +, активацией CD69 +, экспрессией FoxP3 и активностью клеток FoxP3 + CD25 + CD4 + Treg, экспрессирующих L-селектин. Эти данные свидетельствуют о том, что высокие дозы потребления DHA могут способствовать ослаблению иммунной функции [29].
Высокие уровни омега-3 ПНЖК нарушают липидные «плоты» с последующим изменением структуры белковой композиции, локализованной в липидном слое внутренней части мембраны, и ингибируют реакции Т-киллеров. Кроме того, активные формы кислорода, ROS, повышенная продукция которых приводит к оксидативному стрессу, могут вызвать окисление ДНК, что приводит к повреждению всех четырех оснований и молекулы дезоксирибозы, провоцируя возникновение генетических мутаций и инициирование канцерогенеза колоректального рака [30].
Вероятно, омега-3 ПНЖК обладают протектив-ным эффектом в отношении развития предопухоли, что продемонстрировано в 6 исследованиях по использованию омега-3 ПНЖК у пациентов со спорадическими колоректальными аденомами. Результаты этих исследований показали снижение индекса пролиферации эпителиальных клеток слизистой оболочки на 13–70 % по сравнению с группой плацебо [31]. Канцерогенез, по-видимому, обусловливает изменение роли ПНЖК, которые уже на ранних стадиях обеспечивают промоцию опухолевого процесса.
Данные нашей работы позволяют сделать выводы о наличии значимых различий между здоровыми донорами и пациентами с КРР I–II стадий, а также выявить жирные кислоты, отвечающие требованиям для дифференцирующих биомаркеров. Ограничениями настоящего этапа исследований являются небольшая численность обследованных, отсутствие групп сравнения – пациентов с доброкачественными заболеваниями – аденомами и полипами толстой кишки, проспективного наблюдения, внутренней и внешней валидизации. Тем не менее изучение уровней и соотношений жирных кислот в мембранах эритроцитов и сыворотке крови следует считать перспективным направлением в поиске биомаркеров для ранней диагностики КРР.
Заключение
Таким образом, у пациентов с КРР I–II стадий выявлено снижение насыщенных, отдельных моно-насыщенных и высокодостоверное повышение большей части полиненасыщенных ЖК с преобладанием омега-3. Для большей части уровней жирных кислот достоверные различия в группах касались мембран эритроцитов с той же тенденцией в сыворотке крови.
Уровни эритроцитарных миристиновой, пентадекановой, 7-пальмитолеиновой, отношения насыщенные/полиненасыщенные ЖК (содержание которых достоверно ниже при КРР I–II стадий, чем в контроле) и уровни α-линоленовой, эйкозапен-таеновой, докозапентаеновой, докозагексаеновой, суммы омега-3 ЖК, EPA + DHA, докодиеновой, дигомо-γ-линоленовой, докозатетраеновой ЖК (содержание которых достоверно выше при КРР, чем у здоровых) являются дифференцирующими при различении больных КРР I–II стадий от здоровых лиц.
В сыворотке крови уровень биомаркеров имели следующие ЖК: арахидоновая, миристиновая, докозагексаеновая, сумма омег-3 ПНЖК, отношение омега-6/омега-3 ПНЖК, пентадекановая, докозапентаеновая и докодиеновая. Модель, включающая перечень жирных кислот С14:0, С15:0, С16:1;7, С18:3 n-3, C20:2 n-6, C20:3 n-6, C20:5 n-3, C22:4 n-6, C22:5 n-3, C22:6 n-3, сумма омега-3, омега-3 (EPA+DHA), отношение насыщенные/ полиненасыщенные ЖК, обеспечила AUC 0,916 со специфичностью 0,90, чувствительностью 0,95 при различении пациентов с КРР I–II стадий от здоровых лиц. Полученные данные свидетельствуют о перспективности исследования изучаемых показателей как возможных маркеров для ранней диагностики КРР.
Список литературы Жирные кислоты мембран эритроцитов и сыворотки крови как биомаркеры для диагностики ранних стадий колоректального рака
- Ferlay J., Soerjomataram I., Dikshit R., Eser S., Mathers C., RebeloM., Parkin D.M., Forman D., Bray F. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer. 2015; 136(5): 359-86. doi: 10.1002/ijc.29210.
- Garborg K., Holme O., L0berg M., Kalager M., Adami H.O., Bretthauer M. Current status of screening for colorectal cancer. Ann Oncol. 2013; 24(8): 1963-72. doi: 10.1093/annonc/mdt157.
- BrennerH., Arndt V., Stürmer T. Cost-effectiveness of colonoscopy in screening for colorectal cancer. Arch Intern Med. 2002; 162(19): 2249. doi: 10.1001/archinte.162.19.2249.
- Pignone M., Rich M., Teutsch S.M., Berg A.O., Lohr A.N. Screening for colorectal cancer in adults at average risk: a summary of the evidence for the U.S. Preventive Services Task Force. Ann Intern Med. 2002; 137(2): 132-41. doi: 10.7326/0003-4819-137-2-200207160-00015.
- BianX., Qian Y., TanB., LiK., HongX., Wong C.C., FuL., ZhangD., Li D., Wu J.-L. In-depth mapping carboxylic acid metabolome reveals the potential biomarkers in colorectal cancer through characteristic fragment ions and metabolic flux. Anal Chim Acta. 2020; 1128: 62-71. doi: 10.1016/j.aca.2020.06.064.
- Monedeiro F., Monedeiro-Milanowski M., Ligor T., Buszewski B. A Review of GC-Based Analysis of Non-Invasive Biomarkers of Colorectal Cancer and Related Pathways. J Clin Med. 2020; 9: 3191-224. doi: doi:10.3390/jcm9103191.
- Sun L., Kang Q., Pan Y., Li N., Wang X., He Y., Wang H., Yu D., Xie H., Yang L., Lu Y., Jin P., Sheng J. Serum metabolite profiling offamilial adenomatous polyposis using ultra performance liquid chromatography and tandem mass spectrometry. Cancer Biol Ther. 2019; 20(7): 1-12. doi: 10.1080/15384047.2019.1595277.
- Arab L., Akbar J. Biomarkers and the measurement of fatty acids. Public Health Nutr. 2002; 5: 865-71. doi: 10.1079/phn2002391.
- Zeleniuch-Jacquotte A., Chajes V., Van Kappel A.L., Riboli E., Toniolo P. Reliability of fatty acid composition in human serum phospho-lipids. Eur J Clin Nutr. 2000; 54: 367-72. doi: 10.1038/sj.ejcn.1600964.
- Katan M.B., van Birgelen A., Deslypere J.P., Penders M., van Staveren W.A. Biological markers of dietary intake, with emphasis on fatty acids. Ann Nutr Metab. 1991; 35: 249-52. doi: 10.1159/000177653.
- Mika A., Kobiela J., Czumaj A., Chmielewski M., Stepnowski P., Sledzinski T. Hyper-Elongation in Colorectal Cancer Tissue - Cerotic Acid is a Potential Novel Serum Metabolic Marker of Colorectal Malignancies. Cell Physiol Biochem. 2017; 41(2): 722-30. doi: 10.1159/000458431.
- Rifkin S.B., Shrubsole M.J., Cai Q., Smalley W.E., Ness R.M., Swift L.L., Zheng W., Murff H.J. PUFA levels in erythrocyte membrane phospholipids are differentially associated with colorectal adenoma risk. Br J Nutr. 2017; 117(11): 1615-22. doi: 10.1017/S0007114517001490.
- Crotti S., Agnoletto E., Cancemi G., Di Marco V., Traldi P., Puc-ciarelli S., Nitti D., Agostini M. Altered plasma levels of decanoic acid in colorectal cancer as a new diagnostic biomarker. Analytical and bioanalyti-cal chemistry. 2016; 408(23): 6321-8. doi: 10.1007/s00216-016-9743-1.
- Kang J.X., Wang J. A simplified method for analysis of polyun-saturated fatty acids. BMC Biochem. 2005; 6: 5-13. doi: 10.1186/14712091-6-5.
- Shashkov M.V., Sidelnikov V.N. Properties of columns with several pyridinium and imidazolium ionic liquid stationary phases. J Chromatogr A. 2013; 1309: 56-63. doi: 10.1016/j.chroma.2013.08.030.
- BreimanL. Random Forests. Machine Learning. 2001; 45: 5-32. https://doi.org/10.1023/A:1010933404324.
- Gradilla A.-C., Sanchez-Hernandez D., Brunt S., Scholpp L. From top to bottom: Cell polarity in Hedgehog and Wnt trafficking. BMC Biology. 2018; 16: 37-46. doi: 10.1186/s12915-018-0511-x.
- Doll S., Freitas F.P., Shah R., Aldrovandi M., da Silva M.C., IngoldI., Goya Grocin A., Xavier da Silva T.N., PanziliusE., Scheel C.H., Mourao A., Buday K., Sato M., Wanninger J., Vignane T., Mohana V., Rehberg M., Flatley A., Schepers A., Kurz A., White D., Sauer M., Sattler M., Tate E.W., Schmitz W, Schulze A., O'Donnell V., Proneth B., Popowicz G.M., PrattD.A., Angeli J.P.F., ConradM. FSP1 is a glutathione-independent ferroptosis suppressor. Nature. 2019; 575(7784): 693-8. doi: 10.1038/s41586-019-1707-0.
- Igal R.A. Stearoyl-CoA desaturase-1: a novel key player in the mechanisms ofcell proliferation, programmed cell death and transformation to cancer. Carcinogenesis. 2010; 31: 1509-15. doi: 10.1093/carcin/ bgq131.
- Danielsen S.A., Eide P.W., Nesbakken A., Guren T, Leithe E, Lothe R.A. Portrait of the PI3K/AKT pathway in colorectal cancer. Biochim Biophys Acta. 2015; 1855: 104-21. doi: 10.1016/j.bbcan.2014.09.008.
- Zhou X.P., Loukola A., Salovaara R., Nystrom-Lahti M., Pelto-makiP., de laChapelle A., AaltonenL.A., Eng C. PTEN mutational spectra, expression levels,and subcellular localization in microsatellite stable and unstable colorectalcancers. Am J Pathol. 2002; 161: 439-47. doi: 10.1016/ S0002-9440(10)64200-9.
- Baro L., Hermoso J.C., Nunez M.C., Jimenez-Rios J.A., Gil A. Abnormalities in plasma and red blood cell fatty acid profiles of patients with colorectal cancer. Br J Cancer. 1998; 77: 1978-83. doi: 10.1038/ bjc.1998.328.
- Veglia F., Tyurin V.A., Blasi M., De Leo A., Kossenkov A.V., Donthireddy L., To T.K.J., Schug Z., Basu S., Wang F., Ricciotti E., DiRusso C., Murphy M.E., VonderheideR.H., LiebermanP.M., Mulligan C., Nam B., Hockstein N., Masters G., Guarino M., Lin C., Nefedova Y., Black P., Kagan V.E., Gabrilovich D.I. Fatty acid transport protein 2 reprograms neutrophils in cancer. Nature. 2019; 569(7754): 73-8. doi: 10.1038/s41586-019-1118-2.
- Kortlever R.M., Sodir N.M., Wilson C.H., Burkhart D.L., Pel-legrinetL., SwigartL.B., Littlewood T.D., Evan G.I. Myc Cooperates with Ras by Programming Inflammation and Immune Suppression. Cell. 2017; 171: 1301-15. doi: 10.1016/j.cell.2017.11.013.
- Singh K.B., Hahm E.R., Kim S.H., Wendell S.G., Singh S.V A novel metabolic function of Myc in regulation of fatty acid synthesis in prostate cancer. Oncogene. 2021; 40(3): 592-602. doi: 10.1038/s41388-020-01553-z.
- Duman C., Yaqubi K., Hoffmann A., Acikgoz A.A., Korshunov A., Bendszus M., Herold-Mende C., Liu H.K., Alfonso J. Acyl-CoA-Binding Protein Drives Glioblastoma Tumorigenesis by Sustaining Fatty Acid Oxidation. Cell Metabolism. 2019; 30(2): 274-89. doi: 10.1016/j. cmet.2019.04.004.
- AreggerM., LawsonK.A., BillmannM., CostanzoM., TongA.H.Y., Chan K., Rahman M., Brown K.R., Ross C., Usaj M., Nedyalkova L., Sizova O., Habsid A., Pawling J., Lin Z.-Y., Abdouni H., Wong C.J., Weiss A., Mero P., Dennis J.W., Gingras A.C., Myers C.L., Andrews B.J., Boone C., Moffat J. Systematic mapping of genetic interactions for de novo fatty acid synthesis identifies C12orf49 as a regulator of lipid metabolism. Nature Metabolism. 2020; 2: 499-513. doi: 10.1038/s42255-020-0211-z.
- Yessoufou A., Ple A., Moutairou K., Hichami A., Khan N.A. Do-cosahexaenoic acid reduces suppressive and migratory functions of CD4+ CD25+ regulatory T-cells. J Lipid Res. 2009; 50: 2377-88. doi: 10.1194/ jlr.M900101-JLR200.
- WoodworthH.L., McCaskey S.J., DuriancikD.M., ClinthorneJ.F., Langohr I.M., Gardner E.M., Fenton J.I. Dietary fish oil alters T lymphocyte cell populations and exacerbates disease in a mouse model of inflammatory colitis. Cancer Res 2010; 70(20): 7960-9. doi: 10.1158/0008-5472. CAN-10-1396.
- OhmoriH., FujiiK., Kadochi Y., Mori S., Nishiguchi Y., FujiwaraR., Kishi S., Sasaki T., Kuniyasu H. Elaidic Acid, a Trans-Fatty Acid, Enhances the Metastasis of Colorectal Cancer Cells. Pathobiology. 2017; 84(3): 144-51. doi: 10.1159/000449205.
- CockbainA.J., Toogood G.J., HullM.A. Omega-3 polyunsaturated fatty acids for the treatment and prevention of colorectal cancer. Gut. 2012; 61: 135-49. doi: 10.1136/gut.2010.233718.


