Зимография: особенности постановки метода визуализации активности ферментов в почвах
Автор: Тимофеева М. В., Абросимов К. Н., Юдина А. В., Фомин Д. С., Клюева В. В.
Журнал: Бюллетень Почвенного института им. В.В. Докучаева @byulleten-esoil
Рубрика: Статьи
Статья в выпуске: 113, 2022 года.
Бесплатный доступ
Ферменты, продуцируемые почвенной биотой, являются ключевым звеном в регуляции биохимических процессов. Активность ферментов в почве может быть визуализирована с помощью зимографии - метода, основанного на применении флуоресцирующих субстратов и позволяющего получать двумерные изображения (зимограммы). Авторами предложен вариант зимографической установки, представлены параметры освещения, фотоаппаратуры и режимов съемки, подготовка реактивов и калибровка. На примере контрастных по гранулометрическому составу почв (песок и тяжелый суглинок) детально описаны процессы подготовки образцов к анализу и сам анализ. Рассмотрены различные варианты внесения субстрата: раскапывание, окунание, насыщение, также проведена оценка влияния длительности инкубирования образцов на качество получаемых изображений. Оценены возможности и недостатки метода, предложены варианты решения методических проблем, возникающих в процессе анализа. Зимография - перспективный метод, позволяющий сопоставить данные с результатами других методов. Использование нейросетевых технологий позволяет с высокой достоверностью получить объемное распределение почвенных ферментов. Зимография требует качественно проделанной подготовительной работы и предельной аккуратности при проведении анализа. Необходимо обеспечить максимальный контакт между субстратом и почвой, так как это один из ключевых факторов, определяющих качество результатов. Установлено, что наиболее оптимальным способом внесения субстрата является насыщение мембран в растворе на протяжении 60 минут. На данном этапе развития метода нет возможности установить универсальное время инкубирования образцов, так как оно зависит от ряда характеристик как исследуемой почвы, так и условий проведения зимографии. При презентации результатов метода необходимо детально документировать условия его проведения.
Β-глюкозидаза, зимограммы, зимографическая установка, methylumbelliferone
Короткий адрес: https://sciup.org/143179664
IDR: 143179664 | УДК: 631.4 | DOI: 10.19047/0136-1694-2022-113-58-89
Текст научной статьи Зимография: особенности постановки метода визуализации активности ферментов в почвах
Ферментативная активность (ФА) почв – показатель функциональной активности почвенной биоты и ее способности к разнообразным биохимическим превращениям. Ферменты, продуцируемые почвенной биотой, являются ключевым звеном в регуляции всех биохимических процессов. Именно ферменты участвуют в переработке, стабилизации и дестабилизации органического вещества (ОВ) почв, круговороте элементов в наземных экосистемах, процессах самоочищения почвы (Gramms et al., 1999;
Tabatabai, Dick, 2002; Burns et al., 2013; Steinweg et al., 2013). Общая ферментативная активность почв складывается из трех типов ФА: 1) внутриклеточной; 2) внеклеточной, ассоциированной с почвенными коллоидами; 3) внеклеточной, обусловленной фер- ментами, находящимися свободно в почвенном растворе. Вклад каждого из этих трех компонентов в общую активность значительно меняется со временем, зависит от типа почвы, от конкретного фермента (Burns, 1977).
Обычно ферменты измеряют, наблюдая за исчезновением специфичного для них субстрата или за появлением продуктов его распада. Анализы, проводимые в почвенных суспензиях (enzyme assays), измеряют “максимальный потенциал” ферментативной активности почвы (Burns, 1977; Tabatabai, Dick, 2002; Wallenstein, Weintraub, 2008) , так как оценивают все типы ФА, выделенные из взятого для анализа объема почвы. Почвенная зимография – молекулярный метод, позволяющий количественно оценить распределение активности ферментов в срезе почвы и визуализировать ее in situ (Razavi et al., 2019) . Зимография не заменяет классический анализ, так как отражает ФА, связанную с поверхностью конкретного среза образца, а не со всем его объемом (Baldrian, Větrovský, 2012) . Активность, обнаруживаемая методом почвенной зимографии, обычно приписывается внеклеточным ферментам, выделяемым корнями или микроорганизмами, которые либо иммобилизованы без потери реакционной способности на поверхности частиц твердой фазы, либо присутствуют в почвенном растворе в свободной форме (Gianfreda, Bollag, 1994; Rao et al., 2000) .
Зимография основана на детекции в ультрафиолете флуоресцентного соединения, образующегося при реакции субстрата со специфичным для него ферментом. На поверхность образца почвы помещают мембрану, пропитанную фермент-специфическим флуоресцентным субстратом. Субстрат состоит, как правило, из органической молекулы, которая связана с флуоресцентной меткой. При контакте субстрата со специфическим почвенным ферментом происходит гидролиз (Dong et al., 2007) , и высвобождается флуоресцирующее соединение (рис. 1.). Его концентрация на мембране соответствует степени яркости и фиксируется в УФ-свете. Получившаяся картина отражает пространственное распределение активных ферментов на поверхности почвы и называется зимограммой.
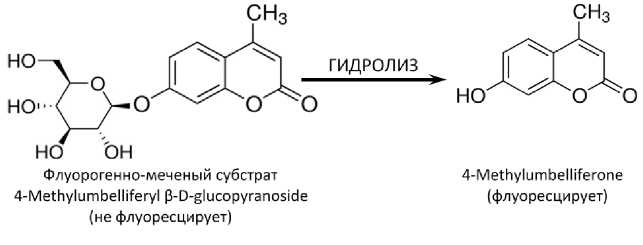
Рис. 1. Высвобождение флуоресцирующей молекулы в зимографии.
Fig. 1. Release of fluorescent product during soil zymography.
Для пересчета зимограмм в количественные данные необходима калибровочная кривая, получаемая на основе растворов с известной концентрацией флуоресцирующего вещества. Для этого делают цифровой фотоснимок мембранных фильтров, пропитанных раствором точно известной концентрации, а затем его переводят в графическом редакторе в оттенки серого.
Впервые для почв данный метод предложен в лаборатории Университета Гёттингена в 2013 г. (Spohn et al., 2013) . Хотя попытки визуализировать почвенную ФА с помощью флуоресцентно-меченых субстратов предпринимались и до этого (Baldrian, Větrovský, 2012) . Отметим, что первоначально использовали электрофорезный гель или агар, в которые замешивали флуоресцентно-меченый субстрат. Протокол, которым сегодня пользуются ученые по всему миру, разработала группа исследователей из Германии. Переломным моментом стало использование мембранных фильтров вместо геля (Spohn, Kuzyakov, 2013; Sanaullah et al., 2016; Razavi et al., 2016) , что поспособствовало популяризации метода и его распространению.
Большинство опубликованных исследований, в которых используется зимография почв, написано сотрудниками лаборатории Университета Геттингена, где был поставлен метод, или совместно с ними. Они рассматривают технические особенности метода (Guber et al., 2018; Guber et al., 2021), совмещение зимограмм с результатами других анализов, дающих пространственное распределение свойств (например, с данными компьютерной томографии (Kravchenko et al., 2019a), 14C-визуализацией и нейтронной радиографией (Bilyera et al., 2021)), применимость метода для изучения микробной активности (Ge et al., 2017) и биологических циклов элементов (например, цикла углерода) (Kravchenko et al., 2019b). Сегодня зимография активно применяется для изучения ФА почв учеными из разных стран (Duan et al., 2018; Giles et al., 2018; Heitkötter, Marschner, 2018; Cao et al., 2022).
В России на текущий момент использование зимографии не распространено. Хотя изучение биологической активности органогенных (Инишева и др., 2003; Ефремова, Овчинникова, 2008) и минеральных (Девятова, 2006; Даденко и др., 2009; Каширская и др., 2020) почв с использованием классической ФА ведется давно (Хазиев, 1990) .
В данной статье мы обобщили опыт постановки и использования зимографии почв, накопленный в лаборатории физики и гидрологии почв Почвенного института имени В.В. Докучаева. Описание зимографической установки и протокол, приведенные в статье, позволят воспроизвести метод в других почвенных лабораториях.
ОБЪЕКТЫ И МЕТОДЫ
Конструкция зимографической установки
В настоящее время коммерчески доступных решений зимографических установок для исследования почв не существует. В каждом из опубликованных на сегодняшний день исследований авторы использовали самодельные конструкции из сочетания бытового и лабораторного оборудования. Учитывая их опыт, мы решили сделать собственную установку, которая бы позволяла работать с партией образцов одновременно и с образцами разного размера (от единиц до десятков см).
По своей сути зимографическая установка очень близка к конструкциям, используемым для предметной рекламной фотографии, с той разницей, что фотокамера нацелена на предмет съемки сверху вниз под прямым углом и зафиксирована, а для равномерного освещения используются ультрафиолетовые лампы.
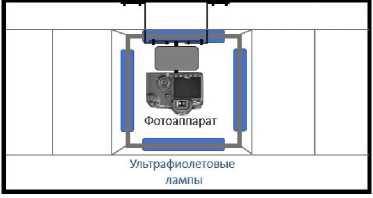
При конструировании установки мы старались избежать неоправданных расходов без гарантии заметно лучшего результата. Зимографическая установка сделана на основе лабораторной тяги габаритами 120 × 60 × 80 см. Тяга обеспечивает удаление мелкой пыли во время работы, которая может зашумлять получаемые в УФ изображения. Фотокамера расположена над геометрическим центром рабочей области. В качестве жесткого крепления камеры к стене использовали стальные уголки с ребром жесткости. Возможность вертикального перемещения камеры ± 5 см обеспечивается штативной головкой для макросъемки. По сторонам от нее на равном удалении от препарата расположены УФ-светильники, закрепленные на раму из ПВХ-труб. Для минимизации влияния отраженных УФ-лучей на результаты фотосъемки вся рабочая область окрашена черной матовой краской “BLACK 2.0” (Stuart Semple, Великобритания) с максимальной способностью к поглощению УФ-излучения. Управление фотокамерой осуществляется с помощью ноутбука через штатное ПО по USB.
Освещение
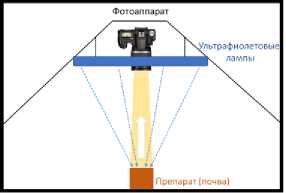
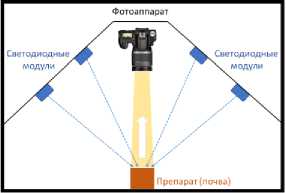
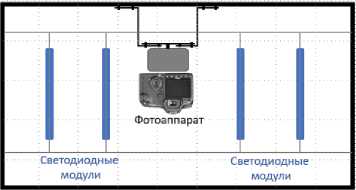
Использовали два варианта УФ-светильников: 1) на основе четырех газоразрядных ламп из черного стекла “FOTON 9W G23”, выстроенных квадратом вокруг оси фотокамера – препарат (рис. 2); 2) на основе четырех светодиодных модулей мощностью 10W, но расположенных параллельно друг другу и на равном удалении от препарата (рис. 3).
В исследовании Spohn, Kuzyakov (2014) применяли УФ-лампы с длинной волны УФ-излучения 365 нм. Мы использовали аналогичные по максимуму излучения светильники.
Следует отметить, что светодиодные модули за счет направленного потока света значительно эффективнее газоразрядных ламп. Кроме того, производство ламп из черного стекла в мире в последние годы сокращается, а их стоимость возрастает. На момент конструирования установки их уже было непросто приобрести, в отличие от повсеместно распространенных диодных модулей.
Б)
Рис. 2. Расположение газоразрядных ламп в зимографической установке.
А) Вид сбоку; Б) Вид сверху.
Fig. 2. Arrangement of the gas-discharge lamps in the zymographic device. A) Side view; Б) Top view.
А)
А)
Рис. 3. Расположение светодиодных ламп в зимографической установке.
А) вид сбоку; Б) вид сверху.
Fig. 3. Arrangement of LED lamps in the zymographic device. A) Side view;
Б) Top view.
Б)
Фотокамера и рекомендуемая оптика
Для стационарной зимографической установки фотокамера – центральное звено. Ей необходимо обладать рядом особенностей: 1) возможность удаленного управления с ПК или планшета через соответствующее приложение; 2) жесткая фиксация и неподвижность во время срабатывания затвора (подъема зеркала), т. е. камера как минимум должна иметь возможность крепления к штативу; 3) возможность подключения тросика для интервальной фотосъемки; 4) возможность сохранения данных в несжатый графи- ческий формат данных (RAW). Набору этих параметров соответствует довольно много цифровых камер профессионального и полупрофессионального класса. Нами был выбран для работы цифровой зеркальный фотоаппарат Сanon EOS 50D, соответствующий вышеперечисленным параметрам.
Из-за различных габаритов препаратов (диаметр и высота) меняется дистанция фокусировки. Это следует учитывать, иначе можно потерять возможность съемки некоторых образцов, поверхность которых будет слишком близко к передней линзе объектива, – может не хватить дистанции фокусировки. Для этого очень удобно использовать специализированные макрообъективы, спроектированные для съемки вблизи.
Для съемки образцов диаметром от 2.5 до 7 см мы использовали светосильные объективы: Зенитар 50/1.2 для 7 см и Калейнар 150/2.8Б с переходником и макрокольцами для 2.5 см. Автофокус-ные объективы для зимографической установки совершенно не нужны, как и оптика со стабилизацией изображения. Использование зум-объектива с низкой светосилой (Guber et al., 2018) представляется сомнительным из-за проблемы цифровых шумов изображения. Светосильная оптика позволяет фотографировать на более коротких выдержках и с использованием более низкой светочувствительности, что ухудшает чистоту изображений и увеличивает уровень цифрового шума.
Режим съемки и настройки камеры
В результате съемки необходимо получить серию с одинаковыми настройками и уровнем цифровых шумов. Для этого придется полностью исключить любое влияние автоматики цифровой камеры и использовать только ручные настройки съемки. У абсолютного большинства моделей – это режим “М”.
Настройка фотокамеры в ручном “М” режиме . Мы использовали следующие настройки:
– ISO (светочувствительность) – 400,
– выдержка 1/50,
– диафрагма 2.8,
– баланс белого – в ручном режиме, 6500К,
– вспышка принудительно отключена.
Фотографии мы сохраняли в RAW формат (CR2 для камер Canon). Этот формат благодаря 14-bit процессору фотокамеры позволяет сохранять и обрабатывать в 4 раза больше цветовых оттенков, чем BMP или JPEG максимального качества. Управление съемкой, настройками и сохранением файлов осуществляли удаленно с ноутбука по USB-проводу с помощь фирменного ПО Canon EOS Utility.
Перед проведением работ следует учитывать ряд нюансов фотосъемки. Резкость изображения (микродетальность) можно регулировать диафрагмой. Обычно на диафрагме 1.2 резкость заметно ниже, чем в диапазоне 2.8–5.6, где она максимальна. Именно по этой причине мы стараемся открытую диафрагму не использовать. Впрочем, диапазон максимальной микрорезкости индивидуален для каждого объектива, и может быть смещен до 8–11 для недорогих зум-объективов любительского класса. Выдержка не должна быть излишне длинной, чтобы свести к минимуму вероятность смазывания изображения при подъеме зеркала и/или срабатывании затвора камеры. Считается, что длина выдержки не должна быть меньше фокусного расстояния объектива: для 50 мм фокусного расстояния – не длиннее 1/50, для 150 мм – не длиннее 1/150. Кроме того, при работе на коротких выдержках цифровых шумов проявляется заметно меньше, чем на длинных.
Стабилизатор изображения (при его наличии) необходимо отключить. Оптический стабилизатор при выдержках короче 1/30 не помогает, а наоборот вредит результату появлением эффекта “дрейфа линз” когда изображение выглядит неравномерно смазанным. Цифровой – позволяет увеличить значения ISO, что грозит усилением цифровых шумов.
Значения ISO желательно излишне не завышать. ISO – это программное усиление сигнала, поступающего от ПЗС-датчика (цифровой матрицы камеры). При высоких значениях ISO на фотографиях наблюдается обилие цифрового шума. Даже на более современных моделях фотокамер мы рекомендуем ограничиться ISO равным 400.
Подготовка реактивов
Для проведения зимографии необходим синтетический фермент-специфичный флуоресцентно-меченый субстрат. Принцип метода основан на том, что в процессе эксперимента субстрат, связанный с 4-метилумбеллифероном (MУФ), истощается, и выделяется MУФ, флуоресценция которого затем измеряется.
Для постановки метода зимографии использовали субстратный раствор β-глюкозидазы (4-Methylumbelliferyl β-D-glucopy-ranoside), раствор метилумбеллиферона (4-Methylumbellife-rone, MUF), выступающего в качестве конечного флуоресцирующего агента, MES-буфер и диметилсульфоксид (использовались реагенты производства фирмы Sigma Aldrich). Выбор субстрата обусловлен тем, что β-глюкозидаза является важным ферментом при рассмотрении углеродного цикла почв, так как отвечает за разложение целлюлозы (Alkorta et al., 2003) и является одним из наиболее распространенных ферментов в почве.
Приготовление всех растворов необходимо осуществлять на основе стерильной воды одинаковой температуры во избежание ошибок разведения, связанных с изменением объема воды. Массу порошка субстрата отмеряют с точностью до десятитысячных. Все отборы реактивов для растворов проводили на одних и тех же аналитических весах (OHAUS Explorer EX124/AD000000). Посуда для работы – приготовления растворов – должна быть стерилизована автоклавированием (15 минут, 120 °С).
Для проведения анализов использовали раствор субстрата β-глюкозидазы с концентрацией 10 мМ (Spohn, Kuzyakov, 2014), для чего навеску в количестве 1/10 000 молекулярной массы (0.0338 г) субстрата растворяли в 300 мкл диметилсульфоксида и доливали 9.7 мл стерильной воды. Диметилсульфоксид необходим ввиду низкой растворимости порошка субстрата в воде. Перед запуском зимографии мы провели подготовительную работу с несколькими вариантами концентраций и установили указанную как наиболее подходящую для изучаемых образцов. Во время работы необходимо контролировать, чтобы раствор субстрата был истинным, без взвеси или выпадения осадка. При необходимости для растворения образовавшегося осадка необходимо использовать вихревые смесители типа Вортекс. Раствор 10 mM MUF готовили на основе метилового спирта и стерильной воды, раствор 0.1 M MES-буфера – исключительно на основе стерильной воды. MES-буфер характеризовался величиной рН равной 6.5 ед.
Хранению реактивов как в виде порошков, так и в виде растворов необходимо уделять особое внимание. Сухой порошок субстрата β-глюкозидазы необходимо хранить в морозильной камере при -20 °С в рамках указанного производителем срока годности. Раствор субстрата (10 мМ) хранят в замороженном виде при -20 °C не более 6 месяцев. При работе с субстратным раствором комнатной температуры во время проведения экспериментов необходимо держать его в темноте. Порошки MES и MUF хранятся в темном и сухом месте при комнатной температуре также в рамках указанного срока годности, растворы MES и MUF – в холодильнике в темной посуде или завернутыми в фольгу при +4 °C в течение одного месяца.
Калибровка
Для калибровки использовали 9 растворов MUF с концентрацией 0.0, 0.5, 1.0, 1.5, 2.0, 2.5, 5.0, 7.5, 10.0 мМ. Мембранные фильтры с нанесенным раствором фотографировали в УФ-свете. На основе калиброванных данных строится прямая зависимости суммарной яркости изображения от концентрации MUF. Результаты позволяют пересчитать яркость каждого пикселя в концентрацию MUF.
ПРОВЕДЕНИЕ ЗИМОГРАФИЧЕСКИХ ИЗМЕРЕНИЙ
Подготовка почвенных микрокосмов к зимографии
Зимография почв активно применяется для изучения активности ферментов в ризосфере и биопорах in situ, в том числе в полевых условиях (Razavi et al., 2017). В этом случае подготавливаются специальные контейнеры, в которых проращиваются растения, – ризобоксы, и зимограмму получают на одной из его сторон с почвой и корнями растения, после удаления стенки ризобокса. Или используется свежезачищенная стенка почвенного разреза. То есть мембранный фильтр кладется непосредственно на открытую сторону образца почвы. В своих исследованиях мы использовали сконструированные микрокосмы и монолиты, которые использо- вались в инкубационных экспериментах, и определяли зимографию послойно. В качестве сосудов для микрокосмов использовали ПВХ-контейнеры цилиндрической формы объемом 373 мл (h = 9.7 см, d = 7.9 см) с плотно закрывающимися крышками.
Для отработки методики и уточнения спорных методических моментов использовали насыпные образцы. Тут были выбраны контрастные по гранулометрическому составу средние почвенные образцы: песок (горизонт AO, подзол типичный, Тверская область), тяжелый суглинок (горизонт AY, серая лесная почва, Тульская область). Образцы гомогенизировали, пропустив через сито 3.2 мм, и из них собирали насыпные варианты в чашки Петри (d = 2.5 см, h = 0.5 см), в которых проводили отработку методики. Перед проведением зимографии все почвы инкубировали при температуре +24 °С и влажности 60% от ППВ: микрокосмы – в течение 180 дней, насыпные образцы – в течение 7 дней.
Подробно остановимся на специфике работы с описанными типами почвенных образцов. При высоте почвенного образца около 6.5 см мы определяли ферментативную активность в 4-х слоях, через каждые 1.5–3.0 см. Отсчет изучаемых слоев удобно вести от дна, т. е. первый слой – самый глубокий, поэтому в рабочем положении микрокосм был перевернут (рис. 4).
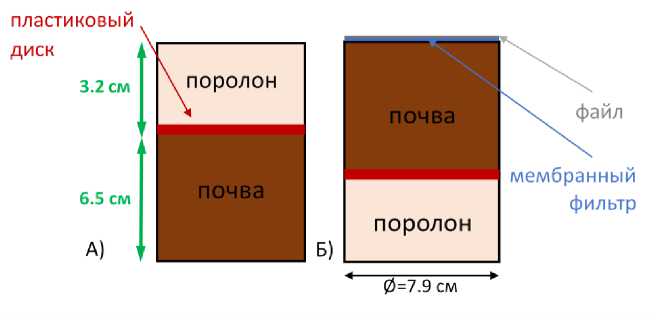
Рис. 4. Положение микрокосмов во время инкубации и во время работы.
Fig. 4. Microcosms position during incubation and operating time.
При послойном исследовании приходится постепенно выдавливать почву из сосуда, частично срезая ее для высвобождения нового слоя для исследований. Удобно начинать работать с нижней стороны микрокосма, поэтому перед работой у контейнера срезали дно. В микрокосм на поверхность почвы клали диск из плотного материала (пластик), на него – прокладочный материал (поролон), далее закрывали стакан крышкой. Количество прокладочного материала – важный фактор, так как он обеспечивает стабильность почвенного образца в микрокосме во время работ. И, если положить поролона недостаточно, почва в стакане будет проваливаться при переворачивании стакана, а если положить материала больше необходимого, поролон вытолкнет почву. И в первом, и во втором случае это грозит нарушением естественного сложения микрокосма и появлением трещин, что создает трудности для проведения анализа и интерпретации результатов. По мере выдавливания почвы ее объем уменьшался. Поэтому для компенсации потери этого объема добавляли поролон в объеме, равном объему выдавленной почвы. В начале работы в сосудах для микрокосмов было 6.5 см почвы и 3.2 см поролона, к концу работы – около 1.5–2 см почвы и 7.5–8 см прокладочного материала.
Во время резки мы столкнулись с рядом сложных моментов. Во-первых, нож при обрезании дна может повредить структуру исследуемой почвы. Во избежание этого мы не срезали почвенный слой вместе с дном, а только обрезали стенки ПВХ-сосуда, чтобы можно было снять дно. Во-вторых, при обрезке контейнера возникает некоторое количество ПВХ-опилок, которые ярко светятся в УФ-свете и создают помехи при дальнейшей работе. Мы использовали циркулярную пилу со скоростью 6 600 об./мин и диск по дереву с мелким зубом. Такой способ практически не создает опилок – они плавятся или выбрасываются вращающимся диском за пределы рабочей области. Важно следить за тем, чтобы диск не повредил почвенный образец. В-третьих, после обрезки по краям контейнера иногда мы все же наблюдали оплавления ПВХ, которые светятся в УФ и мешают дальнейшей работе. Удаляли эти обрезки кусачками или острым канцелярским ножом.
Подготовленный таким образом образец вставляли в выдавливающее устройство авторской конструкции, которое представ- ляет собой скелетный пистолет для герметика со стенками для удерживания ПВХ-сосуда (рис. 5). Во избежание нарушения почвы в микрокосме во время работы сосуд для микрокосмов дополнительно фиксировали в пистолете. Для этого в стенках сосуда делали отверстия при помощи дремеля и закрепляли микрокосм в выдавливающем устройстве в неподвижном положении с помощью шурупа-кольца.
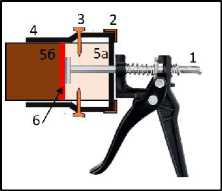
Рис. 5. Схема выдавливающего устройства: 1 – пистолет для герметика, 2 – стальная крепежная лента, 3 – шуруп-кольцо, 4 – ПВХ-труба с крышкой, 5а – часть микрокосма без почвы, 5б – часть микрокосма с почвой, 6 – пластиковый диск, разделяющий микрокосм.
Fig. 5. An extrusion device scheme: 1 – Caulking Gun, 2 – steel strap, 3 – steel screw eye rings, 4 – PVC pipe with cap, 5a – part of the microcosm without soil, 5б – part of the soil microcosm with soil, 6 – plastic disc dividing the microcosm.
Пистолет при работе держали вертикально, выдавливали почву настолько, чтобы слой толщиной 3–5 мм можно было удалить. Во время работы следили, чтобы образец выдавливался равномерно по всей площади образца. Выдавливали образец медленно, не сжимая микрокосм сильно в руках, так как при сдавливании сосуда нарушается сложение почвы и появляются трещины. Срезав выдавленный слой, фиксировали глубину расположения рабочей поверхности почвы с помощью линейки. Почву срезали так, чтобы уровень поверхности почвы был вровень с краем стакана. Перед внесением субстратных растворов при искусственном освещении делали фото поверхности почвы в микрокосме.
Подготовленную поверхность почвы опрыскивали облаком дистиллированной воды из пульверизатора для обеспечения рав- номерного контакта с мембранным фильтром, содержащим субстрат. Опрыскивание проводили с расстояния 0.5 м, держа микрокосмы в вертикальном положении. На поверхность почвы клали мембрану, использовали нейлоновые фильтры с порами размером 0.22 мкм. Для предотвращения высыхания мембранного фильтра, пропитанного раствором, его накрывали материалом, не задерживающим и не отражающим УФ-лучи, в качестве которого использовали обычные канцелярские файлы для бумаг. Дальнейшее фотографирование и инкубирование образцов проводили также с файлами. Непосредственно после внесения субстрата проводили фотосъемку. Это фото считали 0-моментом, именно эта точка является началом периода инкубации и контролем. Контроль нужен для того, чтобы выявить активность за указанный промежуток времени. Повторное фото делали спустя 1, 2, 4, 8 и 24 часа, и получали собственно зимограмму (рис. 9). Важно, чтобы положение фильтра на всех фото было одинаково ориентировано в пространстве. Для этого на рабочий стол и на стакан с микрокосмом наносили метку белым маркером, а при фотографировании эти метки совмещали. Для этого удобно использовать маркер белого цвета, так как его хорошо видно в темноте. Все работы с микрокосмами проводили строго в перчатках, для перекладывания фильтров использовали пинцеты. При фотографировании в УФ-свете использовали защитные очки Uvex Ай-воркс (UV 400).
Обеспечение контакта на границе почва – мембранный фильтр
Контакт между субстратом и почвой – один из ключевых факторов, определяющих качество результатов зимографии. Рисунок на зимограмме подразумевает, что в области, где выделилось много флуоресцирующих молекул, активность высокая, в точках, где таких молекул мало или нет, соответственно, активность низкая или ее нет. Однако, в случае, когда обеспечен недостаточный контакт между почвой и раствором субстрата, реакция не происходит, и мы получим картину, не отражающую реальную ферментативную активность в почве (Guber et al., 2018). Чем более неровная и шероховатая поверхность почвы, тем меньше контакта между почвой и субстратом. Некоторые исследователи (Razavi et al., 2019) указывают на необходимость проведения лазерного сканирования поверхности почвы перед проведением зимографии.
Мы срезали поверхность почвы максимально ровно, не замазывая при этом слой – важно естественное сложение поверхности. Также мы, во-первых, немного увлажняли образец из пульверизатора непосредственно перед зимографией, чтобы можно было “приклеить” мембранный фильтр к поверхности почвы. Во-вторых, с помощью пинцета или руками в перчатках прижимали фильтр к почве без оказания сильного давления, чтобы не нарушить естественного сложения почвы. В-третьих, после внесения субстрата и фото 0-момента на поверхность ставили стеклянную чашку Петри, на которую помещали дополнительный груз. Razavi et al. (2019) утверждают, что разный вес может оказывать разное влияние на результаты, поэтому мы везде использовали одинаковую массу груза. Во избежание получения некорректных результатов, важно распределять вес равномерно по всей поверхности образца. Это доказывает тот факт, что, когда мы поставили колбу непосредственно на поверхность мембраны, без использования чашки Петри, имеющей ровное дно, мы получили рисунок, отражающий активность в тех точках, где несколько более выпуклые краевые участки дна колбы соприкасались с поверхностью почвы в большей степени (рис. 6).
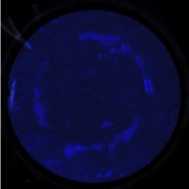
Рис. 6. Зимограмма почвы при неравномерном контакте мембранного фильтра с поверхностью микрокосма.
Fig. 6. Soil zymogram after non-equilibtium contact between membrane filter and soil surface.
Особенности внесения раствора субстрата
Для корректной обработки данных и получения репрезента- тивных результатов важно знать количество вещества, внесенного на фильтр. Протоколы по зимографии расписаны довольно подробно (Razavi et al., 2019), однако в них не уделено внимание процедуре внесения субстратов. Мы протестировали три способа внесения субстрата.
Раскапывание . Первоначально мы вносили субстрат согласно схеме (рис. 7А), которая обеспечивает промачивание фильтра по всей его площади. Для мембранных фильтров из нейлона диаметром 70 мм и размером пор 0.22 мкм использовали 270 мкл 10 мМ раствора субстрата, который вносили 30 каплями по 9 мкл с помощью высокоточного микродозатора Sarorius Picus (т. е. расход субстрата составлял 0.087 мкл на 1 мм2). Однако при анализе почв легкого гранулометрического состава (легкий суглинок) на итоговом фото отобразилась сетка раскапывания (рис. 7Б). При анализе почв тяжелого гранулометрического состава этого явления мы не наблюдали. Легкие по гранулометрическому составу почвы характеризуются хорошей водопроницаемостью, и растворы субстратов, видимо, тяготеют к вертикальной фильтрации, обеспечивая быстрый поток влаги за счет силы тяжести, не позволяя субстрату должным образом промочить весь фильтр. Для того, чтобы избежать появления сетки раскапывания на итоговом фото мы протестировали дополнительно два способа внесения субстрата. Анализ проводили на насыпных образцах почв.
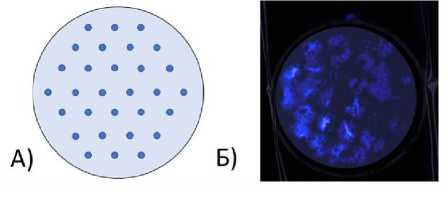
Рис. 7. А) Схема раскапывания раствора субстрата; Б) Зимограмма после 4-х часов инкубирования.
Fig. 7. А) The substrate pipetting scheme; Б) Zymogram after 4 hours of incubation.
Окунание . Каждый фильтр смачивали в растворе непосредственно перед анализом. Для этого раствор наливали в чашку Петри соответствующую диаметру фильтра и ставили ее на аналитические весы. Количество вещества, поглощенного фильтром, определялось по разнице в весе раствора до и после погружения в него фильтра (в среднем расход субстрата на 1 мм2 фильтра составлял 0.078 мкл). Несомненное преимущество этого способа внесения в том, что можно точно рассчитать количество внесенного вещества. Недостатками являются трудоемкость; необходимость в дополнительном оборудовании; быстрое высыхание субстрата и, соответственно, постоянный контроль веса; стекание части субстрата к нижнему краю, при доставании его из чашки, что обеспечивает неравномерное распределение раствора субстрата по фильтру.
Насыщение . Фильтры складывали стопкой (в нашем случае, мы одновременно насыщали 32 фильтра) в чашку Петри подходящего диаметра, содержащую раствор в количестве, незначительно большем, чем объем, необходимый для пропитывания фильтров. Нами было рассчитано при раскапывании, что для используемых нами фильтров необходимо вносить раствор в количестве 0.087 мкл/мм2. Фильтры насыщали в течение одного часа. Похожий способ использовали Guber et al. (2019) при построении калибровочной кривой. Такой промежуток времени был выбран, т. к. именно столько времени уходит на внесение субстратов раскапыванием на партию из 32 образцов диаметром 70 мм. Через 30 минут стопку переворачивали для более равномерного промачивания. Несомненное достоинство этого метода в том, что он легок в использовании, не требует дополнительных затрат времени и оборудования. Оставшееся количество субстрата контролировали с помощью аналитических весов, для этого взвешивали массу раствора до и после насыщения фильтров, получившуюся разницу делили на количество фильтров, допуская равномерность смачивания всех используемых мембран. Расход субстрата при таком внесении выше, чем в случае с раскапыванием, так как при заливке использовали субстрата с избытком для полного смачивания, а раствор, оставшийся после насыщения, повторно не использовали.
В способах “Окунание” и “Насыщение” на итоговой зимо- грамме не наблюдали дефектов распределения субстратного раствора на фильтре, как в способе “Раскапывание” в легких (рис. 7А), и тяжелых (рис. 7Б) по гранулометрическому составу почвах. Таким образом, наилучшим мы выбрали способ “Насыщение”, т. к. он обеспечивает равномерное смачивание мембран, возможность точно рассчитать количество внесенного вещества, а также наиболее прост в работе.
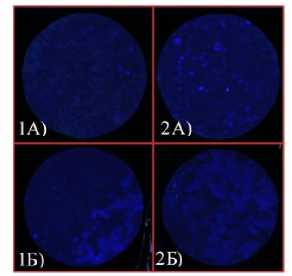
Рис. 8. Зимограмма в песчаных ( А ) и суглинистых ( Б ) почвах в зависимости от способа внесения субстрата: 1 – окунание, 2 – насыщение.
Fig. 8. Zymogram of the sandy ( А ) and loam ( Б ) soils. 1 – dipping, 2 – saturation.
Оптимальное время инкубирования образцов
Критериями для выбора оптимального времени инкубации образца являются стабильная интенсивность свечения без горизонтальной диффузии на мембране, не увеличивающаяся со временем (Razavi et al., 2019) . Для выявления оптимального периода инкубации провели ряд анализов. Для этого делали фото образцов через 1, 2, 4, 8 и 24 часа.
Несмотря на то, что мы использовали метод прямой зимографии (Razavi et al., 2016; Hoang et al., 2016), когда насыщенная субстратом мембрана кладется непосредственно на поверхность почвы, 1 часа инкубации (Schofield et al., 2019) явно было недостаточно для достижения максимальной интенсивности. Мы установили, что для образцов тяжелого гранулометрического состава необходимо от 4 до 6 часов инкубации для достижения равновесного состояния и стабильного свечения (рис. 9). Через 1 и 2 часа инкубирования мы не наблюдали стабильного свечения ни в одном из рассмотренных вариантов. На 8-часовых пробах видно, что начались процессы горизонтальной диффузии, из-за чего мы наблюдаем размытие картины, что на суточной пробе видно особенно хорошо.
0-момент 1 час 2 часа
4 часа 8 часов 24 часа
Рис. 9. Зимограммы суглинистой почвы в зависимости от длительности периода инкубации.
Fig. 9. Clay loam soils zymogram after different incubation time.
В почвах легкого гранулометрического состава стабилизация происходит быстрее. Оптимальным периодом инкубации здесь являются 2–3 часа (рис. 9). На 4-часовой пробе видно, что горизонтальная диффузия уже началась и только усиливается далее.
Разница обусловлена тем, что тяжелые почвы содержат преимущественно внутриклеточные ферменты, адсорбированные в мелких частичках и для протекания реакции и разрыва связи 1 часа недостаточно. В легких по гранулометрическому составу почвах ферменты преимущественно находятся в почвенном растворе и способны к быстрой реакции. Стоит отметить, что ФА почв разных типов также отличается.
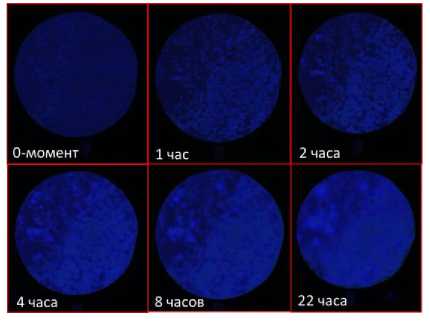
Рис. 10. Зимограммы песчаной почвы в зависимости от длительности периода инкубации.
Fig. 10. Sandy soils zymogram after different incubation time.
Таким образом, для изученных суглинистых почв оптимальным временем инкубирования был выбран интервал 2–4 часа, а для песчаных почв – 1–2 часа. Стоит отметить, что данный интервал не является универсальным, в разных по свойствам почвах биохимические процессы могут протекать с разной скоростью.
ПЕРСПЕКТИВЫ МЕТОДА
Почвенная зимография – перспективный метод для определения пространственного распределения ферментативной активности почв. Однако особенно перспективной является возможность сопоставить данные зимографии с другими методами, дающими пространственную характеристику свойств, например, совмещение с данными компьютерной томографии (Guber et al., 2019; Razavi et al., 2016) и радиоизотопными анализами (Kravchenko et al., 2021). Использование нейросетевых технологий позволяет на основе томографических срезов и зимографических изображений с высокой достоверностью получить объемную модель ферментативной активности в почве (Hapca et al., 2015). Совместно с другими методами зимография может помочь визуализировать и выявить “hotspots” – так называемые “горячие точки”, где почвенная активность является наиболее высокой (Kuzyakov, Blagodatskaya, 2015; Bilyera et al., 2020). Данный показатель можно использовать в качестве индикатора состояния почв.
Использование зимографии может значительно расширить наши представления о функциях почвенной микробиоты, являющейся основным продуцентом ферментов. Биохимические циклы элементов контролируются микробиотой, поэтому изучение их сквозь призму активности микроорганизмов позволит установить механизмы трансформации органических веществ и стабилизации углерода почвами. Также зимография позволяет количественно оценить пространственную изменчивость ФА вокруг корней (Khosrozadeh et al., 2022) , возникающую из-за сложной структуры и разнообразия микробных сообществ ризосферы (Pinton et al., 2001) .
ЗАКЛЮЧЕНИЕ
Зимография – новый метод, позволяющий визуализировать активность почвенных ферментов. Мы подробно показали, как может быть реализована зимографическая установка для исследования образцов почв различного формата и размера в лабораторных условиях, а также уделили внимание методическим тонкостям, реализация которых необходима для получения репрезентативных результатов анализа.
Зимография как метод, основанный на использовании микроколичеств активных веществ и дающий пространственную визуализацию активности ферментов на масштабе мкм-мм, требует качественно проделанной подготовительной работы и предельной аккуратности при проведении самого анализа. Важно заранее проанализировать и подобрать подходящие концентрации фермент-специфичного субстратного раствора, внимание этому уделяли еще Razavi et al. (2019). На основе экспериментальных данных и моделирования было показано, что выявляемая зимографией ФА составляет до 30% от потенциальных реакций, протекающих в общем объеме почвы (Ma et al., 2017; Guber et al., 2018). Однако непонятно, насколько можно предсказать результаты зимографии, ориентируясь на величины классической ФА и на основе этих данных готовить, например, субстратные растворы необходимой концентрации. Остается открытым вопрос и об оптимальном времени инкубации. На данном этапе пока еще нет возможности установить универсальное время инкубирования образцов, для каждого типа (возможно, и подтипа) почв оно является своим и зависит от ряда характеристик: скорости протекания биохимических процессов в почвах, гранулометрического состава, условий проведения зимографии (температура инкубирования образцов во время проведения зимографии). Поэтому при презентации результатов метода необходимо детально документировать условия проведения эксперимента и параметры использованных реактивов, расходных материалов и образцов.
Список литературы Зимография: особенности постановки метода визуализации активности ферментов в почвах
- Даденко Е.В., Казеев К.Ш., Колесников С.И., Вальков В.Ф. Изменение ферментативной активности при хранении почвенных образцов // Почвоведение. 2009. № 12. С. 1481-1486.
- Девятова Т.А. Ферментативная активность чернозема выщелоченного при длительном систематическом применении удобрений // Агрохимия. 2006. № 1. С 12-15.
- Ефремова Т.Т., Овчинникова Т.М. Сезонная оксиредуктазная активность осушенных торфяных почв в связи с гидротермическими условиями среды // Сибирский экологический журнал. 2008. Т. 15. № 3. С. 441-449.
- Инишева Л.И., Ивлева С.Н., Щербакова Т.А. Руководство по определению ферментативной активности торфяных почв и торфов. Т.: Национальный исследовательский Томский государственный университет, 2003. 119 с.
- Каширская Н.Н., Плеханова Л Н., Чернышева Е.В., Ельцов М.В., Удальцов С.Н., Борисов А.В. Пространственно-временные особенности фосфатазной активности естественных и антропогенно-преобразованных почв // Почвоведение. 2020. № 1. С. 89-101. https://doi.org/10.1134/S0032180X20010098.
- Хазиев Ф.Х. Методы почвенной энзимологии. М.: Наука, 1990. 192 с.
- Alkorta I., Aizpurua A., Riga P., Albizu I., Amézaga I., Garbisu C. Soil enzyme activities as biological indicators of soil health // Rev. Environ. Health. 2003. Vol. 18. No. 1. P. 65-73. https://doi.org/10.1515/REVEH.2003.18.1.65.
- Baldrian P., Větrovský T. Scaling down the analysis of environmental processes: Monitoring enzyme activity in natural substrates on a millimeter resolution scale // Appl. Environ. Microbiol. 2012. Vol. 78. No. 9. P. 3473-3475. https://doi.org/10.1128/AEM.07953-11.
- Bilyera N., Kuzyakova I., Guber A., Razavi B.S., Kuzyakov Y. How “hot” are hotspots: Statistically localizing the high-activity areas on soil and rhizosphere images // Rhizosphere. 2020. Vol. 16. P. 100259. https://doi.org/10.1016/j.rhisph.2020.100259.
- Bilyera N., Zhang X., Duddek P., Fan L., Banfield C.C., Schlüter S., Carminati A., Kaestner A., Ahmed M.A., Kuzyakov Y., Dippold M.A., Spielvogel S., Razavi B.S. Maize genotype-specific exudation strategies: an adaptive mechanism to increase microbial activity in the rhizosphere // Soil Biol. Biochem. 2021. Vol. 162. P. 108426. https://doi.org/10.1016/j.soilbio.2021.108426.
- Burns R.G. Soil enzymology // Sci. Prog. 1977. Vol. 64. No. 254. P. 275-285. URL: https://www.jstor.org/stable/43420415.
- Burns R.G., DeForest J.L., Marxsen J., Sinsabaugh R.L., Stromberger M.E., Wallenstein M.D., Weintraub M.N., Zoppini A. Soil enzymes in a changing environment: Current knowledge and future directions // Soil Biol. Biochem. 2013. Vol. 58. P. 216-234. https://doi.org/10.1016/j.soilbio.2012.11.009.
- Cao T., Kong X., He W., Chen Y., Fang Y., Li Q., Chen Q., Luo Y., Tian X. Spatiotemporal characteristics of enzymatic hotspots in subtropical forests: In situ evidence from 2D zymography images // Catena. 2022. Vol. 216. P. 106365. https://doi.org/10.1016/j.catena.2022.106365.
- Dong S., Brooks D., Jones M.D., Grayston S.J. A method for linking in situ activities of hydrolytic enzymes to associated organisms in forest soils // Soil Biol. Biochem. 2007. Vol. 39. No. 9. P. 2414-2419. https://doi.org/10.1016/j.soilbio.2007.03.030.
- Duan C., Fang L., Yang C., Chen W., Cui Y., Li S. Reveal the response of enzyme activities to heavy metals through in situ zymography // Ecotoxicol. Environ. Saf. Safety. 2018. Vol. 156. P. 106-115. https://doi.org/10.1016/j.ecoenv.2018.03.015.
- Ge T., Wei X., Razavi B.S., Zhu Z., Hu Y., Kuzyakov Y., Jones D.L., Wu J. Stability and dynamics of enzyme activity patterns in the rice rhizosphere: effects of plant growth and temperature // Soil Biol. Biochem. 2017. Vol. 113. P. 108-115. https://doi.org/10.1016/j.soilbio.2017.06.005 .
- Gianfreda L., Bollag J.M. Effect of soils on the behavior of immobilized enzymes // SSSA Journal. 1994. Vol. 58. No. 6. P. 1672-1681. https://doi.org/10.2136/sssaj1994.03615995005800060014x.
- Giles C.D., Dupuy L., Boitt G., Brown L.K., Condron L.M., Darch T., Blackwell M.S.A., Menezes-Blackburn D., Shand C.A., Stutter M.I., Lumsdon D.G., Wendler R., Cooper P., Wearing C., Zhang H., Haygarth P.M., Georgea T.S. Root development impacts on the distribution of phosphatase activity: improvements in quantification using soil zymography // Soil Biol. Biochem. 2018. Vol. 116. P. 158-166. https://doi.org/10.1016/j.soilbio.2017.08.011.
- Gramms G., Voigt K.D., Kirsche B. Oxidoreductase enzymes liberated by plant roots and their effects on soil humic material // Chemosphere. 1999. Vol. 38. P. 1481-1494. https://doi.org/10.1016/S0045-6535(98)00369-5.
- Guber A., Kravchenko A., Razavi B.S., Uteau D., Peth S., Blagodatskaya E., Kuzyakov Y. Quantitative soil zymography: mechanisms, processes of substrate and enzyme diffusion in porous media // Soil Biol. Biochem. 2018. Vol. 127. P. 156-167. https://doi.org/10.1016/j.soilbio.2018.09.030.
- Guber A., Kravchenko A., Razavi B.S., Blagodatskaya E., Kuzyakov Y. Calibration of 2‐D soil zymography for correct analysis of enzyme distribution // Eur. J. Soil Sci. 2019. Vol. 70. No. 4. P. 715-726. https://doi.org/10.1111/ejss.12744.
- Guber A., Blagodatskaya E., Juyal A., Razavi B.S., Kuzyakov Y., Kravchenko A. Time-lapse approach to correct deficiencies of 2D soil zymography // Soil Biol. Biochem. 2021. Vol. 157. P. 108225. https://doi.org/10.1016/j.soilbio.2021.108225.
- Hapca S., Baveye P. C., Wilson C., Lark R. M., Otten W. Three-dimensional mapping of soil chemical characteristics at micrometric scale by combining 2D SEM-EDX data and 3D X-Ray CT images // Plos one. 2015. Vol. 10. No. 9. P. e0137205. https://doi.org/10.1371/journal.pone.0137205 .
- Heitkötter J., Marschner B. Soil zymography as a powerful tool for exploring hotspots and substrate limitation in undisturbed subsoil. Soil Biol. Biochem. 2018. Vol. 124. P. 210-217. https://doi.org/10.1016/j.soilbio.2018.06.021.
- Hoang D.T.T., Razavi B.S., Kuzyakov Y., Blagodatskaya E. Earthworm burrows: kinetics and spatial distribution of enzymes of C-, N-and P-cycles // Soil Biol.Biochem. 2016. Vol. 99. P. 94-103. https://doi.org/10.1016/j.soilbio.2016.04.021.
- Khosrozadeh S., Guber A., Kravchenko A., Ghaderi N., Blagodatskaya E. Soil oxidoreductase zymography: Visualizing spatial distributions of peroxidase and phenol oxidase activities at the root-soil interface // Soil Biol. Biochem. 2022. Vol. 167. P. 108610. https://doi.org/10.1016/j.soilbio.2022.108610.
- Kravchenko A., Guber A., Razavi B.S., Koestel J., Blagodatskaya E., Kuzyakov Y. Spatial patterns of extracellular enzymes: combining X-ray computed micro-tomography and 2D zymography // Soil Biol. Biochem. 2019a. Vol. 135. P. 411-419. https://doi.org/10.1016/j.soilbio.2019.06.002.
- Kravchenko A.N., Guber A.K., Razavi B.S., Koestel J., Quigley M.Y., Robertson G.P., Kuzyakov Y. Microbial spatial footprint as a driver of soil carbon stabilization // Nat. Commun. 2019b. Vol. 10. No. 1. P. 1-10. https://doi.org/10.1038/s41467-019-11057-4.
- Kravchenko A., Guber A., Gunina A., Dippold M., Kuzyakov Y. Pore‐scale view of microbial turnover: Combining 14C imaging, μCT and zymography after adding soluble carbon to soil pores of specific sizes // Eur. J. Soil Sci. 2021. Vol. 72. No. 2. P. 593-607. https://doi.org/10.1111/ejss.13001.
- Kuzyakov Y., Blagodatskaya E. Microbial hotspots and hot moments in soil: Concept and review // Soil Biol. Biochem. 2015. Vol. 83. P. 184-199. https://doi.org/10.1016/j.soilbio.2015.01.025.
- Ma X., Razavi B.S., Holz M., Blagodatskaya E., Kuzyakov Y. Warming increases hotspot areas of enzyme activity and shortens the duration of hot moments in the root-detritusphere // Soil Biol. Biochem. 2017. Vol. 107. P. 226-233. https://doi.org/10.1016/j.soilbio.2017.01.009 .
- Pinton R., Varanini Z., Nannipieri P. The rhizosphere as a site of biochemical interactions among soil components, plants, and microorganisms // The rhizosphere. CRC Press, 2000. P. 17-34.
- Rao M.A., Violante A., Gianfreda L. Interaction of acid phosphatase with clays, organic molecules and organo-mineral complexes: kinetics and stability // Soil Biol. Biochem. 2000. Vol. 32. P. 1007-1014.
- Razavi B.S., Zarebanadkouki M., Blagodatskaya E., Kuzyakov Y. Rhizosphere shape of lentil and maize: spatial distribution of enzyme activities // Soil Biol. Biochem. 2016. Vol. 96. P. 229-237. https://doi.org/10.1016/j.soilbio.2016.02.020.
- Razavi B.S., Zhang X., Bilyera N., Guber A., Zarebanadkouki M. Soil zymography: simple and reliable? Review of current knowledge and optimization of the method // Rhizosphere. 2019. Vol. 11. P. 100161. https://doi.org/10.1016/j.rhisph.2019.100161.
- Razavi B.S., Hoang D., Kuzyakov Y. Visualization of enzyme activities in earthworm biopores by in situ soil zymography // Methods in Molecular Biology. Zymography. N.Y.: Humana Press, 2017. P. 229-238. https://doi.org/10.1007/978-1-4939-7111-4.
- Sanaullah M., Razavi B.S., Blagodatskaya E., Kuzyakov Y. Spatial distribution and catalytic mechanisms of β-glucosidase activity at the root-soil interface // Biol. Fertil. Soils. 2016. Vol. 52. P. 505-514. https://doi.org/10.1007/s00374-016-1094-8.
- Schindelin J., Arganda-Carreras I., Frise E., Kaynig V., Longair M., Pietzsch T., Preibisch S., Rueden С., Saalfeld S., Schmid B., Tinevez J.-Y., White D.J., Hartenstein V., Eliceiri K., Tomancak P., Cardola A. Fiji: an open-source platform for biological-image analysis // Nature methods. 2012. Vol. 9. No. 7. P. 676-682. https://doi.org/10.1038/nmeth.2019.
- Schofield E.J., Brooker R.W., Rowntree J.K., Price E.A.C., Brearley F.Q., Paterson E. Plant-plant competition influences temporal dynamism of soil microbial enzyme activity // Soil Biol. Biochem. 2019. Vol. 139. P. 107615. https://doi.org/10.1016/j.soilbio.2019.107615.
- Spohn M., Kuzyakov Y. Distribution of microbial-and root-derived phosphatase activities in the rhizosphere depending on P availability and C allocation - Coupling soil zymography with 14C imaging // Soil Biol. Biochem. 2013. Vol. 67. P. 106-113. https://doi.org/10.1016/j.soilbio.2013.08.015.
- Spohn M., Carminati A., Kuzyakov Y. Soil zymography - a novel in situ method for mapping distribution of enzyme activity in soil // Soil Biol. Biochem. 2013. Vol. 58. P. 275-280. https://doi.org/10.1016/j.soilbio.2012.12.004.
- Spohn M., Kuzyakov Y. Spatial and temporal dynamics of hotspots of enzyme activity as affected by living and dead roots - a soil zymography analysis// Plant Soil. 2014. Vol. 379. P. 67-77. https://doi.org/10.1007/s11104-014-2041-9.
- Steinweg J.M., Dukes J.S., Paul E.A., Wallenstein M.D. Microbial responses to multi-factor climate change: effects on soil enzymes // Front. Microbiol. 2013. Vol. 4. P. 146. https://doi.org/10.3389/fmicb.2013.00146 .
- Tabatabai M.A., Dick W.A. Enzymes in soil: research and developments in measuring activities // Enzymes in the environment: Activity, ecology, and applications. N.Y.: Marcel Dekker, 2002. P. 567-596.
- Wallenstein M.D., Weintraub M.N. Emerging tools for measuring and modeling the in-situ activity of soil extracellular enzymes // Soil Biol. Biochem. 2008. Vol. 40. No. 9. P. 2098-2106. https://doi.org/10.1016/j.soilbio.2008.01.024.


