Злокачественные неэпителиальные опухоли яичников
Автор: Гуторов С.Л., Анохин А.Ю., Новикова Е.Г., Румянцев А.А., Трякин А.А., Урманчеева А.Ф., Хохлова С.В.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Практические рекомендации
Статья в выпуске: 3S2-2 т.14, 2024 года.
Бесплатный доступ
Герминогенные опухоли, дисгерминома, стромальные опухоли, тератома, недисгерминома
Короткий адрес: https://sciup.org/140307405
IDR: 140307405 | DOI: 10.18027/2224-5057-2024-14-3s2-1.2-03
Текст статьи Злокачественные неэпителиальные опухоли яичников
Злокачественные неэпителиальные опухоли яичников (ЗНЭОЯ) происходят из клеток стромы (клеток Лейдига) или полового тяжа (гранулезоклеточные опухоли, происходят из клеток Сертоли) или из обоих видов (опухоль Сертоли–Лейдига); относятся к редким нозологиям, составляя менее 8% всех злокачественных опухолей яичников. В большинстве случаев диагностируются в относительно ранних стадиях, редко метастазируют в лимфатические узлы. Характер распространения и вероятность отдаленного метастазирования варьируют в зависимости от фенотипа опухоли. С учетом возникновения из специализированных клеток возможна секреция эстрогенов, андрогенов или других стероидных гормонов с соответствующими клиническими проявлениями.
1. КЛАССИФИКАЦИЯ И ОПРЕДЕЛЕНИЕ СТАДИИ
Стадирование ЗНЭОЯ проводится так же, как и эпителиальных, по результатам интраоперационной ревизии и послеоперационного гистологического исследования; используются классификации ТNM (8-е издание, 2017 г.) и FIGO (2009 г.) (табл. 1). Морфологическая классификация (ВОЗ 2020 г.) представлена в табл. 2.
Таблица 1. Система стадирования рака яичников по TNM (8-е издание, 2017 гг.) и FIGO (2009 г.)
|
TNM |
FIGO |
|
|
Т1 |
I |
Опухоль ограничена яичниками |
|
Т1а |
IA |
Опухоль ограничена одним яичником, капсула не повреждена, нет опухолевых разрастаний на поверхности яичника, нет злокачественных клеток в асцитической жидкости или смывах из брюшной полости |
|
TNM |
FIGO |
|
|
Т1b |
IB |
Опухоль ограничена двумя яичниками, их капсулы не повреждены, нет опухолевых разрастаний на поверхности яичников, нет злокачественных клеток в асцитической жидкости или смывах из брюшной полости |
|
T1c |
IC |
Опухоль ограничена одним или двумя яичниками в сочетании с одним из следующих факторов |
|
T1c1 |
IC1 |
Повреждение капсулы во время операции |
|
T1c2 |
IC2 |
Повреждение капсулы до операции или опухоль на поверхности яичника/ маточной трубы |
|
T1c3 |
IC3 |
Злокачественные клетки в асцитической жидкости или смывах из брюшной полости |
|
T2 |
II |
Опухоль поражает один или два яичника с распространением на малый таз |
|
T2a |
IIA |
Врастание и/или метастазирование в матку и/или в одну или обе маточные трубы |
|
T2b |
IIB |
Распространение на другие ткани таза |
|
T3 и/или N1 |
III |
Опухоль поражает один или оба яичника с гистологически подтвержденными внутрибрюшинными метастазами за пределами таза и/или метастазами в регионарных лимфатических узлах (внутренних, наружных и общих подвздошных, запирательных, крестцовых, поясничных или паховых лимфоузлах) |
|
N1 |
IIIA1 |
Метастазы только в забрюшинных лимфатических узлах |
|
IIIA1 (i) |
Метастазы в лимфатических узлах размерами до 10 мм |
|
|
IIIA (ii) |
Метастазы в лимфатических узлах размерами более 10 мм |
|
|
T3a |
IIIA2 |
Микроскопические гистологически подтвержденные внутрибрюшинные метастазы за пределами таза ± метастазы в забрюшинных лимфатических узлах |
|
T3b |
IIIB |
Макроскопические внутрибрюшинные метастазы за пределами таза до 2 см включительно в наибольшем измерении ± метастазы в забрюшинных лимфатических узлах |
|
T3с |
IIIC |
Внутрибрюшинные метастазы за пределами таза более 2 см в наибольшем измерении ± метастазы в забрюшинных лимфатических узлах (включая распространение опухоли на капсулу печени и селезенки без поражения паренхимы органов) |
|
M1 |
IV |
Отдаленные метастазы (исключая внутрибрюшинные метастазы) |
|
IVA |
Плевральный выпот со злокачественными клетками |
|
|
IVB |
Метастазы в паренхиматозных органах и других органах вне брюшной полости (в том числе паховых лимфатических узлах и лимфатических узлах за пределами брюшной полости) |
Таблица 2. Морфологическая классификация неэпителиальных опухолей яичников (ВОЗ 2020 г., 5 издание)
Опухоли стромы и полового тяжа
СТРОМАЛЬНЫЕ ОПУХОЛИ
Фиброма
8810/1 — клеточная фиброма
8600/0 — текома
8601/0 — текома лютеинизирующая
8602/0 — склерозирующая стромальная опухоль
8590/0 — мелкокистозная стромальная опухоль
8590/0 — перстневидноклеточная стромальная опухоль
8650/0 — опухоль из клеток Лейдига
8670/0 — стероидноклеточная опухоль
8670/3 — стероидноклеточная опухоль, злокачественная
8810/3 — фибросаркома
ОПУХОЛИ ПОЛОВОГО ТЯЖА
8620/3 — гранулезоклеточная опухоль взрослого типа
8622/1 — гранулезоклеточная опухоль ювенильного типа
8640/1 — опухоль из клеток Сертоли
8623/1 — опухоль полового тяжа с кольцевидными трубочками
СМЕШАННЫЕ ОПУХОЛИ СТРОМЫ И ПОЛОВОГО ТЯЖА
8631/1 — опухоль из клеток Сертоли–Лейдига
8631/0 — опухоль из клеток Сертоли–Лейдига высокодифференцированная
8631/1 — опухоль из клеток Сертоли–Лейдига умереннодифференцированная
8631/3 — опухоль из клеток Сертоли–Лейдига низкодифференцированная
8633/1 — опухоль из клеток Сертоли–Лейдига ретиформная
8590/1 — опухоль полового тяжа
8632/1 — гинандробластома
Герминогенные опухоли
9080/0 — тератома доброкачественная зрелая
9080/3 — незрелая тератома
9060/3 — дисгерминома
9071/3 — опухоль желточного мешка
9100/3 — хориокарцинома
9070/3 — эмбриональный рак
9085/3 — смешанная злокачественная герминогенная опухоль
МОНОДЕРМАЛЬНЫЕ ТЕРАТОМЫ И ОПУХОЛИ СОМАТИЧЕСКОГО ТИПА, РАЗВИВШИЕСЯ
В ДЕРМОИДНОЙ КИСТЕ
9090/0 — струма яичника
9090/3 — струма яичника злокачественная
9091/1 — струмальный карциноид
9084/3 — тератома со злокачественной трансформацией
9080/0 — кистозная тератома
ГЕРМИНОГЕННЫЕ ОПУХОЛИ В СОЧЕТАНИИ С ОПУХОЛЯМИ СТРОМЫ И ПОЛОВОГО ТЯЖА
90731/1 — гонадобластома
8594/1 — смешанная герминогенная опухоль и опухоль стромы и полового тяжа
Индексом «…/3» в классификации МКБ-О обозначаются злокачественные опухоли, индексом «…/1» — опухоли с низким или неизвестным потенциалом злокачественности.
В отличие от классификации ВОЗ герминогенных опухолей у мужчин, классификация герминогенных опухолей у женщин по-прежнему предусматривает разделение тератомных опухолей яичников на зрелые (доброкачественная тератома) и незрелые (злокачественная опухоль).
2. ДИАГНОСТИКА
Диагноз ЗНЭОЯ устанавливается на основании результатов послеоперационного морфологического обследования. План обследования должен быть идентичен для всех пациенток с подозрением на злокачественное новообразование яичников и включать:
• сбор анамнеза, включая гинекологический и наследственный анамнез, изучение клинических симптомов;
• физикальное, в том числе гинекологическое исследование (бимануальное ректовагинальное исследование);
• общий биохимический и общеклинический анализы крови, анализ мочи, коагулограмма
• определение уровня опухолевых маркеров и гормонов:
– АФП, β-ХГЧ, ЛДГ определяют при подозрении на герминогенные опухоли яичников (обязательно определение всем пациенткам с новообразованиями яичников в возрасте до 40 лет);
– ингибин В рекомендуется определять при подозрении на опухоли стромы полового тяжа (при наличии клинических показаний);
– тестостерон и эстрадиол может повышаться при опухолях из клеток Сертоли–Лейдига (вирилизация отмечается у 70–85% больных) и других опухолях стромы полового тяжа (определять при наличии клинических показаний);
– для женщин старше 40 лет: маммография для исключения метастазов рака молочной железы в яичниках;
– СА125 и HE4-при подозрении на эпителиальные опухоли яичников;
– CA19-9 и РЭА — для исключения метастазов аденокарцином ЖКТ;
– хромогранин А, серотонин ± НСЕ в сыворотке крови; 5-ГИУК в моче — при подозрении на карциноидные опухоли;
• КТ органов грудной клетки / рентгенография органов грудной клетки;
• УЗИ органов малого таза, брюшной полости и забрюшинного пространства / КТ органов брюшной полости и малого таза с в/в контрастированием/МРТ органов брюшной полости и малого таза с в/в контрастированием (при планировании оперативного лечения желательно выполнение КТ или МРТ);
• ПЭТ-КТ с в/в контрастированием при подозрении на наличие отдаленных метастазов (при наличии клинических показаний);
• ЭГДС, колоноскопия по показаниям (при невозможности выполнения колоноскопии возможно выполнение рентгенологического исследования толстой кишки);
• МРТ головного мозга при наличии клинических симптомов, указывающих на его возможное вовлечение в опухолевый процесс; скрининговое МРТ с в/в контрастированием головного мозга показано при высоком уровне β-ХГЧ (> 50000 мМЕ/мл) или множественных метастазах в легких в связи с высоким риском поражения головного мозга (при невозможности выполнения МРТ возможна КТ головного мозга с в/в контрастированием);
• при наличии гиперплазии эндометрия — диагностическая гистероскопия, взятие аспирата из полости матки или выскабливание полости матки с гистологическим исследованием;
• генетическое исследование кариотипа с целью исключения дисгенезии гонад (синдром Свайера (Swyer), ассоциированный с кариотипом 46, XY) у молодых пациенток с первичной аменореей;
• остеосцинтиграфия при подозрении на метастатическое поражение скелета;
• до начала лечения необходимо информировать пациенток, планирующих в будущем беременность, о целесообразности консультации врача-репродуктолога.
3. ЛЕЧЕНИЕ
3.1. Опухоли стромы полового тяжа3.1.1. Лечение ранних (IA, В, C) стадий опухолей стромы полового тяжа
Определение концентрации опухолевых маркеров необходимо выполнять на самом раннем этапе диагностического поиска, особенно у молодых пациенток. Выявление высокой концентрации опухолевых маркеров, в первую очередь АФП и β-ХГЧ, в отсутствие данных о наличии беременности и характерной клинической картины позволяет сразу установить диагноз герминогенной опухоли яичников без необходимости в морфологической верификации диагноза. В этом случае, если клиническое состояние больной требует быстрого начала противоопухолевой терапии (см. раздел 3.2), остальной объем обследования может быть определен исходя из клинической ситуации.
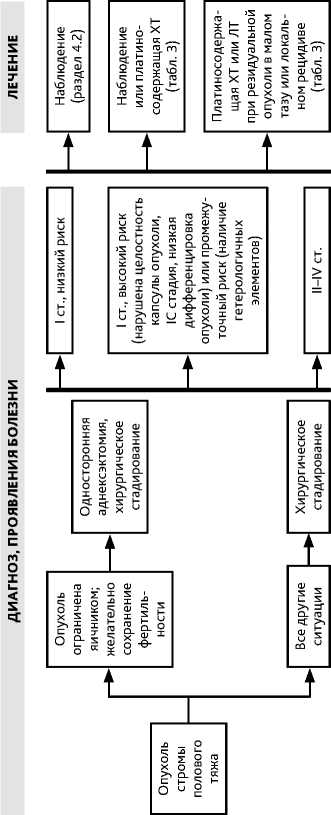
Подавляющее большинство всех опухолей стромы полового тяжа (ОСПТ) составляют гранулезоклеточные опухоли. Алгоритм обследования и лечения больных с ОСПТ представлен на рис. 1.
На первом этапе показано хирургическое лечение. Рекомендуемый хирургический доступ — лапаротомия. Лапароскопический доступ возможен в исключительных случаях на ранних стадиях заболевания, при опухолях небольших размеров при условии высокой квалификации хирурга и выполнения операции с учетом всех правил абластики. Больным менопаузального возраста рекомендована экстирпация матки с придатками.
Хирургическое стадирование включает резекцию большого сальника, биопсию подозрительных участков брюшины, взятие мазков с париетальной брюшины диафрагмы, латеральных каналов, малого маза, интраоперационное взятие смывов с брюшной полости для цитологического исследования.
Выполнение лимфодиссекции (тазовой и парааортальной) не обязательно.
У больных репродуктивного возраста с IА/С стадиями, желающих сохранить фертильность, возможна односторонняя аднексэктомия. Биопсию контралатерального яичника выполнять нецелесообразно, если он визуально не изменен.
У больных репродуктивного возраста предпочтение отдается органосохраняющим объемам хирургического вмешательства.
При ультразвуковых признаках гиперплазии эндометрия необходимо выполнять раздельное диагностическое выскабливание матки или аспирационную биопсию эндометрия для исключения рака эндометрия.
Больным с I стадией ОСПТ с низким риском прогрессирования (целостность капсулы не нарушена, капсула опухоли интактна, по поверхности капсулы опухоли нет, высокая степень дифференцировки опухоли) рекомендовано динамическое наблюдение.
У больных с I стадией ОСПТ с высоким (нарушена целостность капсулы опухоли, IC стадия, низкая дифференцировка опухоли) или промежуточным (наличие гетерологичных элементов в опухоли) риском прогрессирования возможны или наблюдение или адъювантная ХТ. При I стадии (включая IС) гранулезоклеточной опухоли взрослого типа адъювантная платиносодержащая ХТ не снижает частоту рецидивов болезни.
В адъюванте обычно применяются комбинации «паклитаксел + карбоплатин» (4–6 курсов) или EP (4 курса), возможен режим ВЕР (4 курса). У молодых женщин (до 40 лет) отдается предпочтение режиму ВЕР (табл. 3).
Повторные стадирующие операции (удаление большого сальника, биопсия брюшины, взятие смывов из брюшной полости) рекомендованы, если данная процедура не была выполнена первоначально.
Если первоначально выполнялась резекция пораженного яичника у больных с предположительно I стадией заболевания, рекомендуется повторная операция в объеме аднексэктомии (у молодых пациенток, желающих сохранить репродуктивную и гормональную функции) или пангистерэктомии (у больных в менопаузе или молодых пациенток, не желающих сохранять репродуктивную и гормональную функции) и выполнение всех этапов стадирования.
-
3.1.2. Лечение распространенных стадий и рецидивов опухоли стромы полового тяжа
На первом этапе при II–IV стадиях показано хирургическое лечение в объеме лапаротомии, экстирпации матки с придатками, удаления большого сальника, взятие смывов и биопсии брюшины. Тазовая и парааортальная лимфодиссекция выполняются по показаниям (подозрение на метастатическое поражение лимфоузлов).
Наиболее эффективными являются оптимальные циторедуктивные операции. Всем больным со II–IV стадиями и рецидиве заболевания рекомендуется проведение адъювантной ХТ 3–4 курсами ХТ по схеме ЕР или BEP или 4–6 курсами «паклитаксел + карбоплатин» (табл. 3).
При рецидиве болезни выбор режима ХТ зависит от варианта, эффективности и осложнений ранее проведенного лечения. Рекомендуемые режимы представлены в табл. 3.
При наличии изолированной резидуальной (остаточной) опухоли в малом тазу или локализованного рецидива возможно проведение дистанционной ЛТ. Повторные циторедуктивные операции опциональны.
Определенной эффективностью обладает ГТ: ингибиторы ароматазы (анастрозол, летрозол), прогестагены (мегестрола ацетат, медроксипрогестерона ацетат), тамоксифен, агонисты ГРГ, особенно при гранулезоклеточных опухолях взрослого типа.
Несмотря на высокую чувствительность опухоли к ХТ (> 80%), ее эффекты недолговечны, что подчеркивает важность выполнения циторедуктивных вмешательств (локального контроля).
Гранулезоклеточные опухоли, несмотря на относительно благоприятный прогноз, рецидивируют сравнительно часто, что требует длительного наблюдения, поскольку рецидив и прогрессирование становятся потенциальной причиной смерти больных.
Таблица 3. Рекомендуемые режимы химиотерапии опухолей стромы полового тяжа
|
Режимы адъювантной ХТ при опухолях стромы полового тяжа и стероидноклеточных опухолях |
|
|
BEP |
Блеомицин 1 30 мг в/в в 1-й, 3-й и 5-й дни + этопозид 100 мг/м 2 в/в в 1–5-й дни + цисплатин 20 мг/м 2 в/в в 1–5-й дни, интервал 3 нед., 4 курса |
|
BEP + Г-КСФ2 |
Блеомицин1 30 мг в/в в 1-й, 3-й и 5-й дни + этопозид 100 мг/м2 в/в в 1–5-й дни + цисплатин 20 мг/м2 в/в в 1–5-й дни + Г-КСФ (филграстим)3 5 мкг/кг п/ к в 6–15-й дни или до нормализации АЧН, интервал 3 нед., 4 курса |
|
CPtx |
Карбоплатин AUC5–6 в/в в 1-й день или цисплатин 75 мг/м 2 в/в в 1-й день + паклитаксел 175 мг/м 2 в/в в 1-й день, интервал 3 нед., 4–6 курсов |
|
EP |
Этопозид 100 мг/м 2 в/в в 1–5-й дни + цисплатин 20 мг/м 2 в/в в 1–5-й дни, интервал 3 нед., 4 курса |
|
EP + Г-КСФ2 |
Этопозид 100 мг/м2 в/в в 1–5-й дни + цисплатин 20 мг/м2 в/в в 1–5-й дни + Г-КСФ (филграстим)3 5 мкг/ кг п / к в 6–15-й дни или до нормализации АЧН, интервал 3 нед, 4 курса |
|
Режимы ХТ при распространенных стадиях и рецидивах опухолей стромы полового тяжа и стероидноклеточных опухолях (у получавших ранее режим ВЕР) |
|
|
CPtx |
Карбоплатин AUC6 в/в или цисплатин 75 мг/м 2 в/в в 1-й день + паклитаксел 175 мг/м 2 в/в в 1-й день, интервал 3 нед., 4–6 циклов |
|
TIP |
Паклитаксел 175 мг/м 2 в/в в 1-й день (или 120 мг/м 2 в/в дни 1, 2) + цисплатин 25 мг/м 2 в/в во 2–5-й дни + ифосфамид 1500 мг/м 2 в/в во 2–5-й дни + месна 4 в/в во 2–5-й дни + Г-КСФ (филграстим) 3 5 мкг/кг п/к в 6–15-й дни или до нормализации АЧН, интервал 3 нед., 4 цикла |
|
CDE |
Циклофосфамид 1000 мг/м 2 в/в в 1-й день + доксорубицин 45 мг/м 2 в/в в 1-й день + этопозид 100 мг/м 2 в/в в 1–3-й дни, интервал 3 нед., 4–6 циклов |
|
CAV |
Циклофосфамид 1000 мг/м 2 в/в в 1-й день + доксорубицин 50 мг/м 2 в/в в 1-й день + винкристин 1,4 мг/м 2 в/в в 1-й день, интервал 3 нед., 4–6 циклов |
Режимы ХТ II и более поздних линий при распространенных стадиях и рецидивах опухолей стромы полового тяжа и стероидноклеточных опухолях
Ифосфамид 1600 мг/м 2 в/в в 1–3-й дни + месна 4 в/в в 1–3-й дни + паклитаксел 175 мг/м 2 в/в в 3-й день, интервал 3 нед.
Паклитаксел 80 мг/м 2 в/в в 1-й, 8-й,15-й дни + бевацизумаб 10 мг/кг в/в в 1-й и 15-й дни интервал 3 нед.
Доцетаксел 75 мг/м 2 в/в в 1-й день, интервал 3 нед.
Бевацизумаб 7,5–15 мг/кг в/в в 1-й день, интервал 3 нед. (в качестве поддерживающей терапии у ранее его получавших)
Тамоксифен 20 мг внутрь 2 раза в сутки ежедневно
Ингибиторы ароматазы
-
• летрозол 2,5 мг внутрь ежедневно
-
• анастрозол 1 мг внутрь ежедневно
-
• эксеместан 25 мг внутрь ежедневно
Аналоги ГРГ
-
• лейпрорелин 3,75 мг в/м 1 раз в 28 дней
-
• гозерелин 3,6 мг п/к 1 раз в 28 дней или 10,8 мг п/к 1 раз в 84 дня
-
• бусерелин 3,75 мг в/м 1 раз в 28 дней
-
1 Блеомицетина гидрохлорид (изомер А5) и блеомицина сульфат (смесь изомеров А2 и В2) не являются идентичными лекарственными средствами. При использовании блеомицина сульфата в режиме ВЕР используется доза 30 мг, которая вводится в 1-й, 3-й, 5-й (или 1-й, 8-й, 15-й) дни. При использовании менее изученного блеомицетина гидрохлорида рекомендуется снижение курсовой дозы на 30–40 %, например, по 30 мг в 1-й и 5-й дни. Введение цисплатина осуществляется на фоне в / в гидратации физиологическим раствором хлорида натрия (суммарный суточный объем 2,5 л), необходимой для поддержания диуреза > 100 мл / час в процессе введения цисплатина и в последующие 3 часа;
-
2 Данная опция не отражена в клинических рекомендациях Минздрава РФ
-
3 Возможно применение пролонгированных форм Г-КСФ;
-
4 Месна применяется в суточной дозе, составляющей 100 % от дозы ифосфамида и разделенной на 3 введения в течение дня: непосредственно перед введением ифосфамида и далее через 4 и 8 часов после начала его инфузии. Возможна замена второго и третьего (через 4 и 8 часов) в / в введения месны на пероральный прием. Для этого она применяется в большей разовой дозе (40 % от дозы ифосфамида) в виде раствора в соке в соотношении от 1:1 до 1:10.
-
3.2. Злокачественные герминогенные опухоли яичников
Принято разделять злокачественные герминогенные опухоли яичников (ЗГОЯ) на дис-герминомы (аналогичны семиномам) и недисгерминомы (аналогичны несеминомным опухолям). Повышенный уровень АФП и высокий уровень β-ХГЧ (> 1000 мМЕ/мл) при дис-герминоме свидетельствуют о наличии элементов недисгерминомы (опухоли желточного мешка, хориокарциномы), что требует проведения терапии в соответствии с принципами лечения недисгерминомных опухолей. Такие опухоли обозначаются как недисгермином-ные вне зависимости от формального патоморфологического заключения.
-
3.2.1. Первичное лечение злокачественных герминогенных опухолй яичников
Наличие повышенного уровня АФП или β-ХГЧ при зрелой тератоме свидетельствует о наличии в опухоли компонента ЗГОЯ (например, незрелой тератомы, опухоли желточного мешка, хориокарциномы), что также требует проведения специализированного противоопухолевого лечения в соответствии с принципами лечения других герминоген-ных опухолей данной локализации.
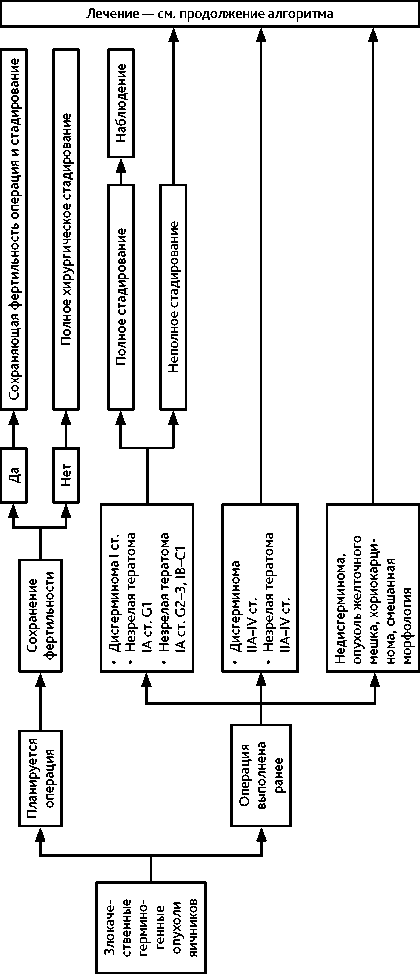
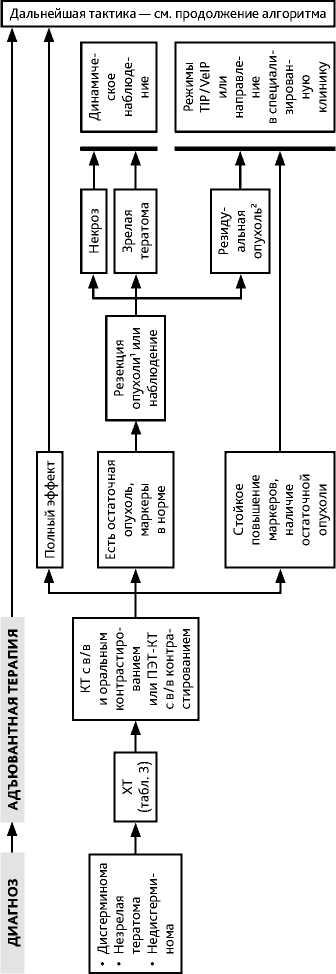
Рекомендуемый алгоритм обследования и лечения при ЗГОЯ представлен на рис. 2 (1, 2, 3) и в табл. 4, 5.
Таблица 4. Тактика лечения больных ЗГОЯ после хирургического стадирования
|
Тип ЗГОЯ |
Стадия заболевания |
|||
|
IA G1 |
IA G2–3 |
IB–IC |
IIA–IV |
|
|
Дисгерминома |
Наблюдение |
2 цикла карбоплатина AUC7 |
3 цикла BEP |
|
|
Незрелая тератома |
Наблюдение |
3 цикла BEP или наблюдение 2 |
3–4 цикла BEP 1 |
|
|
Опухоль желточного мешка, хориокарцинома, эмбриональный рак, смешанная злокачественная герминогенная опухоль |
3 цикла BEP |
3 цикла BEP |
3 цикла BEP |
3–4 цикла BEP 1 |
1 При отсутствии резидуальной опухоли рекомендуются 3 курса ХТ по схеме BEP; при наличии резидуальной опухоли рекомендуются 4 курса по схеме BEP.
2 При условии выполнения всех процедур хирургического стадирования и возможности динамического наблюдения.
Всем пациенткам молодого и репродуктивного возраста с новообразованиями яичников необходимо исследовать уровень АФП, β-ХГЧ и ЛДГ в плазме крови перед началом какого-либо противоопухолевого лечения.
Хирургическое стадирование имеет большое значение для определения тактики последующего лечения. Особенно это касается дисгерминомы, при которой в случае установления I стадии можно избежать ХТ. Хирургическое лечение включает срединную или нижнесрединную лапаротомию и, вне зависимости от распространенности процесса, одностороннюю сальпингоовариэктомию у желающих сохранить репродуктивную и гормональную функции. Пациенткам, не желающим сохранить репродуктивную и гормональную функции, а также находящимся в постменопаузе, рекомендуется экстирпация матки с придатками.
Повреждение капсулы опухоли, попадание содержимого опухоли в брюшную полость, на брюшину, касание брюшины инструментами, контактировавшими с опухолью, должно быть исключено.
Срочное интраоперационное гистологическое исследование удаленного яичника является обязательным для определения адекватного хирургического объема. Резекция контралатерального яичника выполняется только при макроскопических признаках поражения. При дисгенезии гонад (кариотип ХY устанавливается при обследовании генетиком) производят двустороннюю гонадэктомию. Необходимость выполнения оментэктомии при ЗГОЯ четко не определена, однако выполнение оментэктомии по по- перечной ободочной кишке рекомендовано с целью определения стадии заболевания и дальнейшей тактики лечения. Для определения стадии заболевания также обязателен забор смывов с париетальной брюшины диафрагмы, латеральных каналов, малого таза для дальнейшего цитологического исследования, биопсия подозрительных участков брюшины. Подвздошная и/или парааортальная лимфодиссекция выполняется только при наличии увеличенных лимфоузлов. Принцип хирургического лечения включает удаление всех видимых метастатических образований без резекции смежных органов.
С учетом высокой чувствительности ЗГОЯ к ХТ объем циторедуктивного вмешательства не должен носить калечащего характера и приводить к потенциальному росту частоты послеоперационных осложнений, которые могут задержать начало ХТ после операции. Важно своевременное начало ХТ с соблюдением основных принципов терапии герминогенных опухолей.
При неадекватном хирургическом стадировании повторная циторедукция с целью рестадирования рекомендуется только в том случае, если в дальнейшем может рассматриваться только наблюдение. В остальных случаях выполнение рестадирующих операций не рекомендуется.
-
3.2.1.2. Тактика лечения после хирургического этапа
-
3.2.1.2.1. ЛЕЧЕНИЕ ДИСГЕРМИНОМНЫХ ОПУХОЛЕЙ ЯИЧНИКОВ
-
3.2.1.2.2. ЛЕЧЕНИЕ НЕЗРЕЛОЙ ТЕРАТОМЫ
Лечение после хирургического этапа зависит от гистологического типа опухоли и стадии заболевания. В случае смешанного типа ЗГОЯ лечение планируется по наиболее неблагоприятному морфологическому варианту. После операции обязательно повторное определение уровней ЛДГ, АФП и β-ХГЧ, если они были повышены исходно. Если планируется динамическое наблюдение, следует учитывать нормальный период полужизни для АФП и β-ХГЧ. Адекватное время полужизни АФП составляет менее 5–7 дней, β-ХГЧ — до 3,5 дней. Если концентрация исходно повышенного маркера после операции снижается соразмерно времени его полужизни, рекомендуется контроль его динамики каждые 7–10 дней до нормализации значений, стабилизации повышенного уровня или выявления роста концентрации. Отсутствие нормализации опухолевых маркеров свидетельствует о наличии резидуальной опухоли и требует проведения соответствующей противоопухолевой терапии (табл. 4, 5).
IA стадия. При адекватном стадировании и подтверждении IA стадии дисгерминомы яичников рекомендовано динамическое наблюдение (график наблюдения — см. пункт 3.2.1.3).
IB–IC стадии. При выполнении адекватного хирургического стадирования возможно динамическое наблюдение. При отсутствии адекватного хирургического стадирования или в случае отказа от динамического наблюдения рекомендуется проведение 3 курсов адъювантной ХТ по схеме BEP либо два курса ХТ карбоплатином AUC7 в монорежиме.
IIA–IV стадии. Рекомендуется проведение 3 циклов ХТ по схеме BEP. При уровне ЛДГ > 2 × ВГН или при наличии висцеральных метастазов рекомендуется проведение 4 циклов ВЕР. В связи с риском развития поздней пульмональной токсичности блеомицина его не рекомендуется применять у больных старше 40 лет, а также в случае сопутствующего интерстициального поражения легких. Для этой категории больных рекомендуется проведение 4 циклов ЕР.
IA стадия, G1. При адекватном стадировании и подтверждении IA G1 рекомендуется динамическое наблюдение (см. пункт 3.2.1.3).
IA стадия, G2–G3. При адекватном хирургическом стадировании и нормализации концентрации опухолевых маркеров после хирургического лечения возможно динамическое наблюдение. При отсутствии адекватного хирургического стадирования и/или отказе пациентки от динамического наблюдения рекомендовано проведение 3 курсов ХТ по схеме BEP.
IB-C стадии. Наблюдение или 3 курса ХТ в режиме ВЕР.
IC–IV стадии. Рекомендуется проведение ХТ по схеме BEP. Количество циклов зависит от наличия резидуальной опухоли после хирургического лечения. При ее отсутствии и нормальной концентрации опухолевых маркеров 3 курса ХТ ВЕР. При наличии остаточной опухоли — 4 курса BEP. Наличие повышенных уровней опухолевых маркеров АФП или β-ХГЧ свидетельствует о наличии резидуальной опухоли. При противопоказаниях к применению блеомицина возможна ХТ в режиме PEI.
-
3.2.1.2.3. ЛЕЧЕНИЕ ОПУХОЛИ ЖЕЛТОЧНОГО МЕШКА,
-
3.2.2. Принципы проведения химиотерапии
ХОРИОКАРЦИНОМЫ, ЭМБРИОНАЛЬНОГО РАКА, ПОЛИЭМБРИОМЫ, СМЕШАННОЙ ЗЛОКАЧЕСТВЕННОЙ ГЕРМИНОГЕННОЙ ОПУХОЛИ
Эти опухоли являются высокозлокачественными, в связи с чем назначение ХТ является обязательным при любой стадии заболевания. Больным с ранними стадиями и/или отсутствием резидуальной опухоли рекомендованы 3 курса BEP, при наличии резидуальной опухоли рекомендуются 4 цикла BEP. При противопоказаниях к применению блеомицина возможна химиотерапия в режиме PEI.
При распространенных формах рекомендуется начать ХТ в ближайшие сроки (10–14 дней) после хирургического этапа лечения и стадирования. В табл. 5 представлены режимы адъювантной или ХТ I линии ЗГОЯ.
При противопоказаниях к назначению блеомицина возможно проведение 3–4 курсов в режиме EP или PEI в зависимости от наличия остаточной опухоли (при дисгерминоме в случае отсутствия резидуальной опухоли возможной альтернативой являются 3 цикла ЕР, при наличии опухоли — 4 цикла ЕР). При лечении дисгерминомных опухолей в случае противопоказаний к применению цисплатина возможно использование 3–4 курсов в режиме JEB (карбоплатин, этопозид, блеоцимин) или комбинации карбоплатина с этопозидом . Режимы с карбоплатином не следует использовать при недисгермином-ных опухолях.
У пациенток с распространенной недисгерминомой комбинация PEI (этопозид, цисплатин, ифосфамид) сопоставима по эффективности с режимом BEP, но является более миелотоксичной. При отсутствии резидуальной опухоли показаны 3 цикла ХТ по схеме PEI, при ее наличии — 4 цикла PEI.
Вследствие рисков развития поздней токсичности блеомицина в виде пульмонитов рекомендуется исключить блеомицин из схемы терапии у пациенток старше 40 лет, а также в случае хронических заболеваний легких.
Все циклы ХТ проводятся каждые 3 недели (считая от дня начала предыдущего курса). Возможна задержка очередного курса лечения при наличии инфекции, нейтропении с АЧН < 0,5 × 10 9 /л или тромбоцитопении с числом тромбоцитов < 50,0 × 10 9 /л в первый день планируемого курса (табл. 6). При развитии фебрильной нейтропении, нейтропении IV ст. длительностью свыше 7 дней или нейтропении, осложненной инфекцией, обосновано профилактическое назначение Г-КСФ при всех последующих циклах ХТ. Наличие неосложненной нейтропении, в т. ч. глубокой (количество нейтрофилов > 0,5 × 10 9 /л) не является основанием для задержки очередного курса лечения. В специализированных центрах возможно проведение очередного курса ХТ в режиме ВЕР вне зависимости от количества нейтрофилов перед его началом. У больных с большой распространенностью опухолевого процесса и/или находящихся в неудовлетворительном общем состоянии (ECOG ≥ 2, наличие выраженных опухоль-ассоциированных симптомов) рекомендуется применение Г-КСФ при проведении I линии терапии.
При тяжелом общем состоянии, обусловленном распространенностью опухолевого процесса, первый цикл ХТ может быть проведен с редукцией доз препаратов на 40–60% (например, этопозид 100 мг/м 2 и цисплатин 20 мг/м 2 в течение 2–3 дней). После нормализации состояния пациентки (обычно в течение 7–10 дней), рекомендуется продолжить ХТ по одной из стандартных схем (табл. 4). Необходимо перед каждым циклом ХТ определять опухолевые маркеры, по ее окончании — повторить КТ исходных зон поражения.
У пациенток с недисгерминомой увеличение в размерах или появление новых очагов при снижающихся или нормальных на фоне терапии опухолевых маркерах (АФП и β-ХГЧ) вероятнее всего свидетельствует о синдроме растущей зрелой тератомы, а не о прогрессировании. В данных ситуациях необходимо завершение запланированного объема ХТ с последующим хирургическим удалением опухоли.
-
3.2.3. Лечение остаточной опухоли после химиотерапии
-
3.2.3.1. Дисгерминома
-
-
3.2.3.2. Недисгерминома (опухоль желточного мешка, эмбриональный рак, хорио карцинома, полиэмбриома, незрелая тератома, смешанная герминогенная опухоль)
-
3.2.4. Лечение рецидивов ЗГОЯ
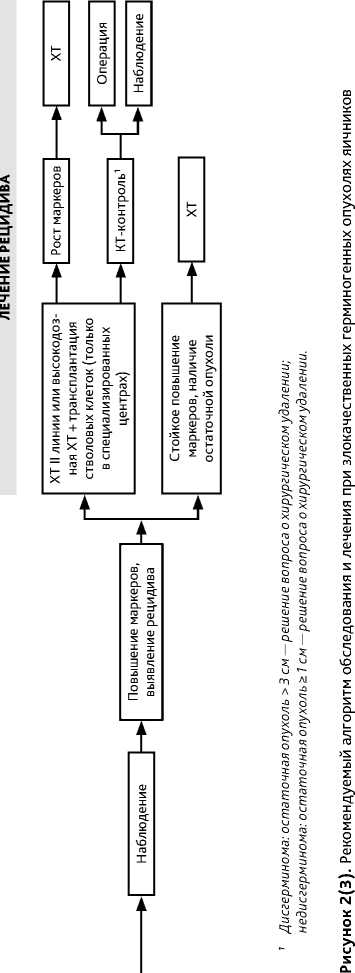
При наличии остаточной опухоли (по брюшине, в забрюшинных лимфоузлах, легких, лимфоузлах средостения и др.) после завершения ХТ и нормализации опухолевых маркеров дальнейшее лечение не показано, рекомендуется динамическое наблюдение. При размере остаточной опухоли > 3 см возможно выполнение ПЭТ-КТ (не ранее чем через 8 нед. после завершения ХТ). При патологическом накоплении РФП в остаточной опухоли рекомендуется ее удаление. При отказе пациентки или технической невозможности хирургического лечения — динамическое наблюдение.
При наличии остаточной опухоли (по брюшине, в забрюшинных лимфоузлах, легких, лимфоузлах средостения и др.) размером < 1 см после завершения ХТ и нормализации опухолевых маркеров дальнейшее лечение не показано, рекомендуется только динамическое наблюдение. При размере ≥ 1 см. показано ее удаление. При синдроме растущей зрелой тератомы рекомендуется хирургическое удаление опухоли, ХТ не показана.
При обнаружении в остаточной опухоли элементов злокачественной герминогенной опухоли показана ХТ II линии (режимы TIP или VeIP): 2 цикла — в случае радикального (R0) объема операции, 4 цикла — при наличии остаточной опухоли. При негестационной хорионкарциноме в случае развития рецидивов, не чувствительных к стандартной ХТ, возможно применение режимов лечения трофобластических опухолей .
Перед началом ХТ рецидива необходимо исключить синдром растущей зрелой тератомы — появление или увеличение в размерах опухолевых узлов на фоне снижаю-щихся/нормальных опухолевых маркеров. В данной ситуации показано хирургическое лечение в объеме радикального удаления всех опухолевых узлов. Как правило, при наличии остаточной опухоли происходит рост узлов, что требует повторных операций. При подтверждении зрелой тератомы при гистологическом исследовании удаленного препарата проведение системного лекарственного лечения не требуется.
Стандартной ХТ рецидива являются комбинации на основе ифосфамида и цисплатина (табл. 5). Оптимальным является режим TIP, альтернатива — режим VeIP. Обычно проводятся 4 цикла. Высокодозная ХТ с поддержкой костномозгового кроветворения может применяться во II–III линиях в центрах, имеющих опыт ее проведения. После завершения ХТ показано хирургическое вмешательство с целью максимального удаления остаточной опухоли.
В случае роста маркеров, несмотря на проводимую терапию, исчерпанности возможностей ХТ, локализации опухоли в одной анатомической области возможна попытка ее удаления. Этот подход дает шанс излечить около 25% пациентов, особенно с поздними рецидивами, умеренно повышенным уровнем АФП и забрюшинной локализацией резидуальной опухоли. При бурном прогрессировании с ростом β-ХГЧ оперативное лечение не показано. У больных с dMMR/MSI-H в качестве III и последующих линий терапии возможно применение иммунотерапии (пембролизумаб, ниволумаб или комбинации ниволумаба с ипилимумабом ).
При поздних рецидивах, возникших спустя два года или более после предшествующей ХТ, основным методом лечения является хирургический. Их особенностью является низкая чувствительность к ХТ, что позволяет рекомендовать в случае потенциально резектабельных опухолей на первом этапе хирургическое лечение даже в случае повышенных маркеров. При невозможности радикального удаления опухоли и повышенных маркерах необходимо начинать ХТ II линии с последующим выполнением операции.
Таблица 5. Рекомендуемые режимы лекарственной терапии герминогенных опухолей яичников
|
I линия |
|
|
BEP |
Блеомицин 1 30 мг в/в в 1-й, 3-й и 5-й дни + этопозид 100 мг/м 2 в/в в 1–5-й дни + цисплатин 20 мг/м 2 в/в в 1–5-й дни, интервал 3 нед., 3–4 цикла |
|
BEP + Г-КСФ |
Блеомицин 1 30 мг в/в в 1-й, 3-й и 5-й дни + этопозид 100 мг/м 2 в/в в 1–5-й дни + цисплатин 20 мг/м 2 в/в в 1–5-й дни + Г-КСФ (филграстим) 3 5 мкг/кг п/к в 6–15-й дни или до нормализации АЧН, интервал 3 нед., 4 цикла |
|
ЕР |
Этопозид 100 мг/м 2 в/в в 1–5-й дни + цисплатин 20 мг/м 2 в/в в 1–5-й дни, интервал 3 нед., 3–4 цикла |
|
EP + Г-КСФ2 |
Этопозид 100 мг/м2 в/в в 1–5-й дни + цисплатин 20 мг/м2 в/в в 1–5-й дни + Г-КСФ (филграстим)3 5 мкг/кг п/к в 6–15-й дни или до нормализации АЧН, интервал 3 нед., 4 цикла |
|
PEI |
Ифосфамид 1200 мг/м 2 в/в в 1–5-й дни + месна 4 доза 800 мг в/в в 1–5-й дни + этопозид 75 мг/м 2 в/в в 1–5-й дни + цисплатин 20 мг/м 2 в/в в 1–5-й дни + Г-КСФ (филграстим) 3 5 мкг/кг п/к в 6–12-й дни, интервал 3 нед., 3–4 цикла |
|
JEB2 |
Карбоплатин AUC5 в/в в 1-й день + этопозид 120 мг/м2 в/в в 1–3-й дни + блеомицин 15 мг/м2 в/в 1-й день, интервал 3 нед., 4 курса |
|
JB2 |
Карбоплатин AUC5 в/в в 1-й день + этопозид 120 мг/м2 в/в 1–3-й дни, интервал 4 нед., 3 курса. (для отдельных пациентов с целью минимизации токсичности) |
|
II линия |
|
|
TIP |
Паклитаксел 120 мг/м 2 в/в в 1-й и 2-й дни + цисплатин 25 мг/м 2 в/в во 2–5-й дни + ифосфамид 1500 мг/м 2 в/в во 2–5-й дни + месна 4 в/в во 2–5-й дни + Г-КСФ (филграстим) 3 5 мкг/кг п/к в 6–15-й дни, интервал 3 нед., 4 цикла |
|
VeIP |
Винбластин 0,11 мг/кг в/в в 1-й и 2-й дни + ифосфамид 1200 мг/м 2 в/в в 1–5-й дни + месна 4 в/в в 1–5-й дни + цисплатин 20 мг/м 2 в/в в 1–5-й дни + Г-КСФ (филграстим) 3 5 мкг/кг п/к в 6–15-й дни, интервал 3 нед., 4 цикла |
|
III линия |
|
|
TGO |
Паклитаксел 80 мг/м 2 в/в в 1-й и 8-й дни + гемцитабин 800 мг/м 2 в/в в 1-й и 8-й дни + оксалиплатин 130 мг/м 2 в/в в 1-й день, интервал 3 нед., 4 цикла |
|
GemOx |
Гемцитабин 1000 мг/м 2 в/в в 1-й и 8-й дни + оксалиплатин 130 мг/м 2 в/в в 1-й день, интервал 3 нед., 4 цикла |
|
При dMMR/ MSI-H2 |
Пембролизумаб 200 мг в/ в в 1-й день, интервал 3 нед. или пембролизумаб 400 мг в/в в 1-й день, интервал 6 нед. |
|
Высокодозная ХТ с трансплантацией клеток-предшественников гемопоэза (II–III линии терапии) |
|
|
TI2 |
Паклитаксел 200 мг/м2 в /в 3-часовая инфузия в 1-й день + ифосфамид 2000 мг/м2 в / в в 1–3-й дни + месна4 в /в в 1–3-й дни + Г-КСФ (филграстим) 10 мкг/ кг п /к в 4–12-й дни; 1–2 курса, длительность курса — 2 недели (в интервале — лейкаферез до сбора CD34 + клеток ≥ 8,0 × 106 /кг) |
|
CE2 |
Карбоплатин AUC8 в/в в 1–3-й дни + этопозид 400 мг/м2 в/в в 1–3-й дни + Г-КСФ (филграстим) 5 мкг / кг п / к в 4–12-й дни; сбор стволовых клеток — предшественников (CD34 + клеток) ≥ 2,0 × 106 /кг в/ в 5-й день; 3 курса, длительность 3 нед. |
-
1 Блеомицетина гидрохлорид (изомер А5) и блеомицина сульфат (смесь изомеров А2 и В2) не являются идентичными лекарственными средствами. При использовании блеомицина сульфата в режиме ВЕР используется доза 30 мг, которая вводится в 1-й, 3-й, 5-й (или 1-й, 8-й, 15-й) дни. При использовании менее изученного блеомицетина гидрохлорида рекомендуется снижение курсовой дозы на 30–40 %, например, по 30 мг в 1-й и 5-й дни. Введение цисплатина осуществляется на фоне в / в гидратации физиологическим раствором хлорида натрия (суммарный суточный объем 2,5 л), необходимой для поддержания диуреза > 100 мл / час в процессе введения цисплатина и в последующие 3 часа;
-
2 Данная опция не отражена в клинических рекомендациях Минздрава РФ
-
3 Возможно применение пролонгированных форм Г-КСФ;
-
4 Месна применяется в суточной дозе, составляющей 100 % от дозы ифосфамида и разделенной на 3 введения в течение дня: непосредственно перед введением ифосфамида и далее через 4 и 8 часов после начала его инфузии. Возможна замена второго и третьего (через 4 и 8 часов) в / в введения месны на пероральный прием. Для этого она применяется в большей разовой дозе (40 % от дозы ифосфамида) в виде раствора в соке в соотношении от 1:1 до 1:10.
-
3.3. Редкие опухоли яичников
-
3.3.1. Нейроэндокринные опухоли яичников (мелкоклеточный / крупноклеточный рак и карциноиды яичников) —см. нейроэндокринные неоплазии в соответствующих разделах
-
Схема редукции доз препаратов в режимах ВЕР/ЕР при гематологической токсичности представлена в табл. 6.
Таблица 6. Схема редукции доз препаратов в режимах ВЕР/ЕР при гематологической токсичности (на основе показателей общеклинического анализа крови на 21-й день от начала предыдущего курса)
|
Количество тромбоцитов (× 109/л) |
≥ 100,0 |
75,0–99,0 |
50,0–74,0 |
< 50,0 |
||||
|
АЧН 1 (× 10 9 /л) |
Этопозид |
Цисплатин |
Этопозид |
Цисплатин |
Этопозид |
Цисплатин |
Этопозид |
Цисплатин |
|
≥ 1,0 |
100% |
100% |
75% |
100% |
50% |
100% |
Отсрочка до восстановления числа тромбоцитов ≥ 50,0 × 10 9 /л |
|
|
0,5–0,99 |
100% |
100% |
50% |
100% |
Отсрочка до восстановления числа тромбоцитов ≥ 75,0 × 10 9 /л |
Отсрочка до восстановления числа тромбоцитов ≥ 50,0 × 10 9 /л |
||
|
< 0,5 |
Отсрочка до восстановления АЧН ≥ 0,5 × 10 9 /л |
Отсрочка до восстановления АЧН ≥ 0,5 × 10 9 /л |
Отсрочка до восстановления АЧН ≥ 0,5 × 10 9 /л |
Отсрочка до восстановления АЧН ≥ 0,5 × 10 9 /л и тромбоцитов > 50,0 × 10 9 /л |
||||
Первичные нейроэндокринные опухоли составляют 1–2% всех злокачественных опухолей яичников. С учетом фенотипа условно различают карциноид и атипичный карциноид (низкой степени злокачественности), мелкоклеточный рак и крупноклеточный рак (высокой степени злокачественности). Мелкоклеточный рак яичников характеризуется агрессивным течением, морфологически схож с мелкоклеточным раком легкого.
Общие принципы хирургического лечения сходны с таковыми при эпителиальном раке яичников. Стандартным является оптимальная циторедуктивная операция (абдоминальная гистерэктомия с билатеральной сальпингоовариэктомией и оментэктомией) с последующей адъювантной ХТ, рекомендуемой при всех стадиях (по аналогии с таковой при мелкоклеточном раке легкого). Оптимальная стратегия I линии лечения для рака яичников не разработана. Предпочтительны режимы с включением цисплатина и этопозида. Имеются данные об эффективности высокодозной ХТ.
Гиперкальциемический тип мелкоклеточного рака яичников является редким фенотипом и составляет менее 0.01 % всех злокачественных опухолей яичников. Опухоль характеризуется наличием соматической мутации SMARCB1 (> 95% случаев), часто сочетается с гиперкальциемией, гипонатриемией и задержкой жидкости. При этом наличие гиперкальциемии не является обязательным критерием диагноза.
Если хирургическое лечение на первом этапе не было проведено по объективным причинам, назначается ХТ с возможной интервальной циторедукцией. При прогрессировании болезни обсуждается ЛТ при наличии показаний; возможна реиндукция с включением цисплатина и этопозида, если срок без прогрессирования был более 6 мес. Возможны альтернативные режимы по аналогии с лечением немелкоклеточного рака легкого (см. соответствующий раздел). При сроке без проявлений болезни более 12 мес. при возможности удаления всех проявлений болезни рекомендуется обсудить повторную циторедукцию.
Крупноклеточный рак яичников относится к крайне редкому фенотипу высоко агрессивной опухоли. Прогноз неблагоприятный даже при ранних стадиях после радикального хирургического лечения и адъювантной терапии. Опухоль часто имеет смешанное строение, включая плоскоклеточный рак и, более часто,— аденокарциному. Согласно классификации ВОЗ, является синонимом недифференцированного типа немелкоклеточного нейроэндокринного рака. Секреция вазоактивных пептидов редка. Существует мнение, что при смешанной морфологии с преобладанием эпителиального компонента последний является предпочтительной мишенью ХТ I (возможный вариант — комбинация карбоплатина и паклитаксела). При преобладании нейроэндокринного компонента или «чистом» крупноклеточном/нейроэндокринном раке вариантами выбора являются комбинации с включением цисплатина и этопозида (предпочтительный режим — ВЕР). Крупноклеточный рак яичников может быть ассоциирован с герминальной мутацией BRCA2. В связи с этим тестирование на наличие мутаций BRCA 1/2 рационально с учетом потенциальной эффективности PARP ингибиторов (доказательная база отсутствует). Адъювантная ХТ рекомендуется начиная с IС стадии и G2/3.
Карциноиды яичника — это высокодифференцированные нейроэндокринные опухоли с менее агрессивным течением, которые часто ошибочно принимают за метастазы злокачественных опухолей ЖКТ в яичниках (необходимо исключить первичную опухоль ЖКТ). Молодым женщинам при одностороннем поражении яичника может быть предложена органосохраняющая операция, в остальных случаях выполняется оптимальная циторедуктивная операция (абдоминальная гистерэктомия с билатеральной сальпингоовари-эктомией и оментэктомией). При наличии карциноидного синдрома назначаются аналоги соматостатина. Принципы лечения карциноидов яичника схожи с лечением высокодифференцированных нейроэндокринных опухолей ЖКТ и изложены в соответствующем разделе.
3.3.2. Карциносаркомы яичников (см. эпителиальные опухоли яичников в соответствующем разделе)
4. НАБЛЮДЕНИЕ
4.1. Принципы динамического наблюдения после хирургического лечения при I стадии дисгерминомы и незрелой тератомы4.2. Злокачественные герминогенные опухоли
Это редкий вариант прогностически неблагоприятных новообразований яичников, на долю которых приходится не более 2–4% всех злокачественных опухолей яичников. Карциносаркомы яичников следует классифицировать как опухоли эпителиального происхождения. Лечение их следует проводить в соответствии с принципами терапии high-grade серозной аденокарциномы яичников. После циторедуктивной операции (абдоминальная гистерэктомия с билатеральной сальпингоовариэктомией и оментэктомией, хирургическим стадированием) в оптимальном объеме (по возможности) всем пациенткам независимо от стадии показано проведение 4–6 циклов ХТ (табл. 4). При III–IV стадиях и наличии мутации BRCA1/2 после ХТ в случае полного или частичного эффекта целесообразна поддерживающая терапия олапарибом 300 мг × 2 раза в день в течение 2 лет.
Рекомендуется тщательное динамическое наблюдение согласно графику при условии выполненного хирургического стадирования.
При дисгерминоме график наблюдения включает физикальный и гинекологический осмотр, определение уровней β-ХГЧ, ЛДГ, УЗИ органов брюшной полости и малого таза — каждые 3 мес. в течение 1-го года; каждые 4 мес. — в течение 2-го и 3-го года; каждые 6 мес. — в течение 4-го года; далее — ежегодно (до 10 лет). Рентгенография органов грудной клетки выполняется каждые 6 мес. в течение первых 2 лет, далее — ежегодно (до 5 лет).
При незрелой тератоме: физикальный и гинекологический осмотр, уровни АФП, β-ХГЧ — каждые 1–2 мес.; УЗИ органов брюшной полости и малого таза — каждые 2 мес.
в течение 1-го года; каждые 3 мес. — в течение 2-го и 3-го года; каждые 6 мес. — в течение 4-го года; далее — ежегодно (до 10 лет). Рентгенография органов грудной клетки выполняется каждые 6 мес. в течение первых 2 лет, далее — ежегодно (до 5 лет).
Вместо УЗИ возможно использование МРТ органов брюшной полости и малого таза; вместо рентгенографии органов грудной клетки — КТ.
С учетом высокой курабельности и длительной ожидаемой продолжительности жизни необходима профилактика и ранняя диагностика поздних осложнений ХТ (сердечнососудистые заболевания, метаболический синдром, гипогонадизм, инфертильность, легочная токсичность и др.) с привлечением соответствующих профильных специалистов. Для больных герминогенными опухолями яичников, получавших ХТ в запланированном объеме, рекомендуется:
-
• физикальный осмотр, определение опухолевых маркеров, УЗИ органов брюшной полости, забрюшинного пространства и пахово-подвздошных областей — каждые 2–3 мес. в первый год, каждые 3 мес. — во второй год, каждые 4 мес. — в третий и четвертый годы, раз в полгода — пятый год и далее — ежегодно;
-
• рентгенография органов грудной клетки выполняется каждые 6 мес. в первые два года, далее — ежегодно в течение 5 лет.
-
4.3. Опухоли стромы и полового тяжа
-
4.4. Редкие опухоли яичников
ОСПТ низкого риска и ранних стадий: физикальный осмотр, определение опухолевых маркеров (ингибин, антимюллеров гормон, эстрадиол, тестостерон — в зависимости от гистологической формы опухоли), УЗИ органов брюшной полости, забрюшинного пространства и пахово-подвздошных областей — каждые 6–12 мес. в течение 10 и более лет.
ОСПТ ранних стадий высокого риска и распространенных стадий: физикальный осмотр, опухолевые маркеры (ингибин, антимюллеров гормон, эстрадиол, тестостерон — в зависимости от гистологической формы опухоли), УЗИ органов брюшной полости, забрюшинного пространства и пахово-подвздошных областей — каждые 4–6 мес. в течение 10 и более лет.
Рентгенография органов грудной клетки — 1 раз в год; КГ органов брюшной полости и/или грудной клетки — по показаниям.
Физикальный осмотр, опухолевые маркеры (СА125 и др. — в зависимости от гистологической формы опухоли), УЗИ органов брюшной полости, забрюшинного пространства и пахово-подвздошных областей — каждые 3 мес. в течение первых 3 лет, в последующие годы 1 раз в 4–6 мес. КТ/МРТ брюшной полости с контрастированием — по показаниям. Рентгенография органов грудной клетки 1 раз в 6 мес. в течение первых 3 лет, далее — 1 раз в год.



том /vol. 14(3s2) 2024
ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ
Malignant Tumors


