Злокачественные опухоли печени и желчевыводящей системы
Автор: Бредер В.В., Базин И.С., Балахнин П.В., Ледин Е.В., Медведева Б.М., Моисеенко Ф.В., Мороз Е.А., Петкау В.В., Погребняков И.В., Покатаев И.А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Практические рекомендации
Статья в выпуске: 3S2-1 т.14, 2024 года.
Бесплатный доступ
Гепатоцеллюлярный рак, цирроз печени, тахэ, рча, абляция, иммунотерапия, атезолизумаб, бевацизумаб, сорафениб, регорафениб, ленватиниб, кабозантиниб, рамуцирумаб, ниволумаб, ипилимумаб, тремелимумаб, афп, рак билиарного тракта, холангиокарцинома, рак желчного пузыря, химиотерапия, химиолучевая терапия, дурвалумаб, пембролизумаб
Короткий адрес: https://sciup.org/140307396
IDR: 140307396 | DOI: 10.18027/2224-5057-2024-14-3s2-1.1-17
Текст статьи Злокачественные опухоли печени и желчевыводящей системы
1. КОДИРОВАНИЕ ЗЛОКАЧЕСТВЕННЫХНОВООБРАЗОВАНИЙ ПЕЧЕНИ ПО МКБ-10
Злокачественное новообразование печени и внутрипеченочных желчных протоков (C22) кодируются по МКБ-10:
C22.0 Гепатоцеллюлярный рак
C22.1 Холангиокарцинома внутрипеченочная
C22.2 Гепатобластома
C22.3 Ангиосаркома печени
C22.4 Другие саркомы печени
C22.7 Другие уточненные раки печени
C22.8 Злокачественное новообразование печени неуточненное
C22.9 Злокачественное новообразование печени неуточненное, первичное или вторичное
Злокачественные первичные опухоли печени — группа заболеваний, развивающихся из компонентов паренхимы печени. Гепатоцеллюлярный рак (ГЦР) составляет около 85% случаев и представляет собой злокачественную опухоль печени, развивающуюся из гепатоцитов. Существенно реже (до 15%) встречаются внутрипеченочные холангио-карциномы, опухоли из эпителия внутрипеченочных желчных протоков, а также комбинированная гепатохолангиокарцинома (кГХК). Крайне редко встречаются опухоли мезенхимального происхождения — саркомы и их клинически более благоприятный вариант — гемангиоэндотелиомы.
Первичный рак печени (ПРП) часто манифестирует мультифокальным поражением печени, возможны комбинации различных его вариантов. Описаны случаи синхронного и метахронного ГЦР и внутрипеченочной холангиокарциномы.
Для ГЦР и внутрипеченочной холангиокарциномы основными факторами риска являются вирусные гепатиты и холангиты, цирроз печени различной этиологии. Реже — до 10% случаев, как для ГЦР, так и для большинства редких злокачественных заболеваний печени (фиброламеллярная карцинома (ФЛК), эпителиоидной гемангиоэндотелиомы, сарком, нейроэндокринных опухолей) каких-либо значимых предрасполагающих факторов риска развития опухоли выявить не удается. Значение фоновой печеночной патологии определяется «конкуренцией» опухолевого и неопухолевого заболеваний (чаще цирроза) печени за функциональные резервы органа, при внутриорганном распространении и/или замещении опухолью печеночной паренхимы, влияющем на возможность лечения в целом и лекарственной терапии в частности.
Алгоритм уточняющей диагностики при выявлении объемного образования в печени представлен на рис. 1.
2. КЛАССИФИКАЦИИ И ОПРЕДЕЛЕНИЕ СТАДИИ ГЦР 2.1. Общие принципы стадирования и классификации ГЦР
Для стадирования ГЦР применяется 8 редакция классификации ТNM AJCC/UICC, которая имеет более формальное значение, а также Барселонская система стадирова-ния ГЦР (BCLC) (рис 2), которая учитывает распространенность опухолевого процесса, функциональное состояния печени, объективное состояния больного и предполагаемую эффективность лечения.
Классификация TNM/AJCC (8-й пересмотр, 2017 г)
Гепатоцеллюлярный рак
Первичная опухоль (Т)
Tx — оценить первичную опухоль невозможно;
-
T0 — признаков первичной опухоли нет;
T1a — одиночная опухоль < 2 см в наибольшем измерении, с сосудистой инвазией или без нее;
T1b — одиночная опухоль > 2 см в наибольшем измерении, без сосудистой инвазии;
T2 — одиночная опухоль с сосудистой инвазией > 2 см или множественные опухоли не более 5 см в наибольшем измерении;
T3 — множественные опухоли, одна из которых > 5 см в наибольшем измерении;
T4 — одиночная или множественные опухоли любого размера с прорастанием в крупную ветвь воротной вены либо в печеночную вену, либо прорастание в соседние органы, включая диафрагму (кроме желчного пузыря), или прорастающие висцеральную брюшину.
Регионарные лимфоузлы (N)
Регионарные лимфатические узлы — лимфатические узлы ворот печени в печеночнодвенадцатиперстной связке.
Nx — недостаточно данных для оценки состояния регионарных лимфатических узлов;
N0 — нет признаков метастатического поражения регионарных лимфатических узлов;
N1 — имеется поражение регионарных лимфатических узлов метастазами.
Отдаленные метастазы (М)
Мх — недостаточно данных для определения отдаленных метастазов;
M0 — отдаленных метастазов нет;
M1 — имеются отдаленные метастазы;
pTNM — патогистологическая классификация рТ, pN, рМ соответствуют требованиям к определению категорий Т, N, М.
G — гистопатологическая дифференцировка
Gx — степень дифференцировки не может быть установлена;
G1 — высокая степень дифференцировки;
G2 — средняя степень дифференцировки;
G3 — низкая степень дифференцировки,
G4 — недифференцированные опухоли.
Таблица 1. Группировка по стадиям ГЦР (AJCC)
|
Стадия |
T |
N |
M |
|
IA |
T1a |
N0 |
M0 |
|
IB |
T1b |
N0 |
M0 |
|
II |
T2 |
N0 |
M0 |
|
IIIA |
T3 |
N0 |
M0 |
|
IIIB |
T4 |
N0 |
M0 |
|
IVА |
Любое значение Т |
N1 |
M0 |
|
IVВ |
Любое значение Т |
Любое значение N |
M1 |
Классификация BCLC (рис. 2) обладает высокой прогностической значимостью и предлагает алгоритм лечения в зависимости от распространенности опухолевого процесса, функционального состояния печени и объективного состояния больного. В рамках этой классификации возможна миграция стадии как в сторону повышения (прогрессирование опухоли, ухудшение функции печени, ухудшение объективного статуса больного), так и понижения (эффективное лечение). Прогностическая значимость ГЦР сохраняется безотносительно наличия/отсутствия цирроза печени, а термин «сохранная функция печени» обозначает степень нарушения функций печени в пределах оценки по классификации Child–Turcotte–Pugh (CTP) А-В < 8 баллов. При изменении стадии необходимо повторное определение дальнейшей тактики лечения.
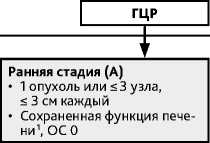
Самая ранняя стадия (BCLC 0) — солитарная опухоль менее 2 см в диаметре при сохранной функции печени.
Ранняя стадия (BCLC A) — солитарная опухоль печени любого размера или не более 3 узлов максимальным размером до 3 см, не распространяющаяся на магистральные сосуды печени, соседние анатомические структуры, без опухолеспецифических жалоб, при удовлетворительном объективном состоянии (ECOG 0 баллов) и сохранной функции печени.
Промежуточная стадия (BCLC В) — изолированное бессимптомное множественное опухолевое поражение печени без макрососудистой инвазии, у больных в удовлетворительном состоянии (ECOG 0 баллов) при сохранной функции печени. Эта стадия разделена на три подгруппы:
-
B1 — ограниченное внутрипеченочное узловое поражение, соответствующее «критериям до 7» (сумма числа узлов и диаметра наиболее крупного узла не должна превышать 7) и имеющее перспективы радикального лечения в виде трансплантации печени или резекции печени (при уменьшении стадии до BCLC A или BCLC 0 в результате эффективного регионарного лечения);
-
B2 — ограниченное внутрипеченочное многоузловое поражение, выходящее за «критерии до 7», при четко определяемых узлах и возможном селективном доступе к питающим их сосудам для последующего регионарного лечения;
-
В3 — диффузно-инфильтративное или многоочаговое билобарное поражение печени.
-
2.2. Группы высокого риска развития ГЦРи особенности диагностики
-
2.3. Особенности диагностическогоалгоритма при ПРП
Распространенная стадия (BCLC С) — объективное состояние пациента ECOG 0–2 балла, опухоль любого размера в сочетании или без инвазии магистральных печеночных сосудов и/или с внепеченочным распространением и при сохранной функции печени.
Терминальная стадия (BCLC D) — случаи заболевания с неудовлетворительным объективным состоянием (опухоль/цирроз), декомпенсированной функцией печени (CTP В/С≥8 баллов).
В группу высокого (> 1,5% за год наблюдения) риска развития ГЦР входят больные циррозом печени любой этиологии, носители вируса гепатита B, лица с семейным анамнезом ГЦР (для азиатов — мужчины старше 40 лет и женщины старше 50 лет); для них необходимо регулярное (каждые 6 мес.) УЗИ печени и одновременное определение уровня АФП плазмы. По данным разных исследований, уровень АФП считается позитивным при значении > 100 нг/мл или при увеличении на 7 нг/мл/мес. по результатам трехкратного ежемесячного измерения.
При АФП > 20 нг/мл пациенту из группы высокого риска развития ГЦР должны быть выполнена мультифазная контрастная КТ или контрастная МРТ брюшной полости независимо от результатов УЗИ печени. При выявленной очаговой патологии печени уровень АФП не влияет на дальнейший диагностический поиск.
Пациентам, находящимся в «листе ожидания» трансплантации печени, рекомендуется мультифазная контрастная КТ или контрастная МРТ брюшной полости не реже 1 раза в 3 месяца с целью раннего выявления ГЦР и своевременного проведения бридж-терапии.
Алгоритм обследования зависит от размеров образования в печени, наличия/отсут-ствия цирроза. Поскольку риск развития ГЦР коррелирует с длительностью существования и выраженностью цирроза печени, при длительном наблюдении за пациентами из группы риска при циррозе печени с признаками портальной гипертензии следует отдавать предпочтение ежегодной мультифазной МРТ (или КТ) с контрастным усилением.
Общие подходы к уточняющей диагностике при выявлении опухоли в печени представлены на рис. 1.
-
2.3.1. Общие принципы диагностики
Обследование направлено на уточнение гистологического варианта и распространенности опухолевого процесса, выраженности фоновой патологии печени и ее осложнений, объема и возможности проведения оптимального противоопухолевого лечения с учетом объективного состояния пациента и сопутствующей патологии. При наличии абсолютных противопоказаний к противоопухолевому лечению объем обследования определяется целями симптоматической терапии. Выявленные образования следует дифференцировать между печеночно-клеточным раком, холангиокарциномой, гепато-холангиокарциномой, а также вторичным поражением печени.
В диагностический поиск входят:
-
• сбор жалоб и анамнеза, уточнение наличия факторов риска развития ГЦР и хол-ангиокарциномы;
-
• врачебный осмотр, определение объективного статуса пациента по шкале ECOG;
-
• лабораторная диагностика: клинический анализ крови (включая количество тромбоцитов), биохимический анализ крови (включая концентрацию альбумина и электролитов), коагулограмма (протромбиновое время и/или МНО), общий анализ мочи;
-
• определение опухолевых маркеров АФП, CA19-9, РЭА;
-
• панель вирусных гепатитов:
– определяется на основании анамнеза, консультации инфекциониста или гастроэнтеролога
Тяжесть поражения печени оценивается на основании:
-
• состояния белково-синтетической, детоксикационной и экскреторной функции печени;
-
• выраженности портальной гипертензии.
Белково-синтетическая, детоксикационная и экскреторная функции печени, как правило, коррелируют между собой, при условии адекватного желчеотведения. В клинической практике для оценки белково-синтетической функции используют 3 основные шкалы оценки Child–Pugh (табл. 2), MELD и ALBI.
Для оценки функционального состояния печени у больных ГЦК и выбора возможных вариантов противоопухолевого лечения предлагается выделять функциональный резерв печени как оптимальный, субоптимальный, ограниченный и плохой.
Оптимальный резерв печени:
-
• класс А [5 баллов] по Чайлд –Пью;
-
• ALBI 1 балл;
-
• ранее не было признаков декомпенсации печени;
-
• получает этиотропное лечение (при необходимости);
-
• индекс MELD ≤ 9 баллов;
-
• нет клинически значимой портальной гипертензии.
Субоптимальный резерв печени:
-
• класс А [5 баллов (после рекомпенсации) или 6 баллов] по Чайлд–Пью;
-
• ALBI 1 или 2а балл.
Ограниченный резерв печени:
-
• класс В [7 баллов] по Чайлд–Пью;
-
• общий билирубин < 3 мг/дл;
-
• МНО < 1.7;
-
• ALBI 2b или 3 балла;
-
• нет асцита и явной энцефалопатии.
Плохой резерв печени
-
• класс В [8–9 баллов] или С по Чайлд–Пью;
-
• ALBI 3 балла;
-
• клинически значимая портальная гипертензия (асцит, энцефалопатия, ВРВП 2–3 ст.).
Клинически значимая портальная гипертензия определяется как:
или
-
• плотность печени (эластометрия, FIBROSCAN) ≥ 25 кПа
или
-
• плотность печени (эластометрия, FIBROSCAN) 20–25 кПа и тромбоциты < 150k
или
-
• плотность печени (эластометрия, FIBROSCAN) 15–20 кПа и тромбоциты < 110k.
Таблица 1. Классификация Child–Turcotte – Pugh (CTP) для оценки функции печени
|
Характеристика |
1 балл |
2 балла |
3 балла |
|
Энцефалопатия (степень) |
Нет |
I–II степень (или компенсируется медикаментозно) |
III–IV степень (или рефрактерная) |
|
Асцит |
Нет |
Незначительный |
Умеренный |
|
Альбумин плазмы (г/дл) |
> 3,5 (или > 35 г/л) |
2,8– 3,5 (или 28–35 г/л) |
< 2,8 (или < 28 г/л) |
|
Увеличение протромбинового времени (выше нормы 12–16 сек.) или |
+ 1–4 сек. |
+ 4–6 сек. |
> + 6 сек. |
|
МНО |
< 1,7 |
1,7–2,3 |
> 2,3 |
|
Билирубин общий |
1–2 мг/дл (или<34,2 мкмоль/л) |
2–3 мг/дл (или 34,2– 51,3 мкмоль/л) |
>3 мг/дл (или > 51,3 мкмоль/л) |
По шкале CТP каждый признак в зависимости от выраженности оценивается в баллах от 1 до 3 (табл. 2). Сумма баллов 5–6, 7–9 и 10–15 классифицируются как СТР класса A, B и C соответственно.
Коэффициент ALBI — класс нарушения функции печени, рассчитывается по формуле:
[log10 bilirubin (μmol/L) × 0.66 + [albumin (g/L × –0.085] ;
Онлайн калькулятор .
Коэффициент ALBI выделяет 4 категории нарушений функции печени: степень 1 (ALBI score ≤ - 2.60), степень 2a (- 2.60 < ALBI score < - 2.27), степень 2b (- 2.27 ≤ ALBI score ≤ - 1.39), и степень 3 (- 1.39 < ALBI score) (Hiraoka, A. et al. Liver Cancer 6, 325–336 (2017).
MELD (модель терминальной стадии заболевания печени) — это балльная система для оценки тяжести хронического заболевания печени (онлайн калькулятор . Рассчитывается на основании показателей креатинина (мкмоль /л), общего билирубина (мкмоль /л), МНО и натрия плазмы (ммоль /л).
-
2.3.3. Лучевая диагностика опухолей печени
-
• УЗИ органов брюшной полости, забрюшинного пространства и органов малого таза; обязательно изучение кровотока в бассейне воротной вены;
-
• рентгенография органов грудной клетки при невозможности выполнения КТ грудной клетки;
-
• мультифазная контрастная МРТ и/или КТ органов брюшной полости; обязательная оценка воротной вены, НПВ, печеночных вен на предметтромбоза (опухолевого/не-опухолевого);
-
• КТ грудной клетки, брюшной полости и малого таза с в / в контрастированием (для оценки распространенности опухолевого процесса);
-
• КТ-ангиография печени применяется в сложных случаях при планировании хирургического лечения.
-
• Плоскодетекторная компьютерная томография печени (ПДКТ) — артериогепатико-графия как составная вводная диагностическая часть (химио-) эмболизации опухолевых очагов печени может применяться для уточняющей диагностики у пациентов, являющихся кандидатами для локорегионарного лечения в том случае, если у них имеются противопоказания к проведению МРТ, или в том случае, если данных, полученных при мультиспиральной КТ и МРТ, недостаточно для точной постановки диагноза;
-
• ПЭТ-КТ может быть эффективна для выявления внепеченочных метастазов (с 18 F-хо-
- лином и 18F-ФДГ). ПЭТ-КТ с 18F-ФДГ обладает низкой чувствительностью и специфичностью при ГЦР, но позволяет идентифицировать небольшие (до 1 см) узловые формы холангиокарцином; обладает низкой чувствительностью для диагностики склерозирующих/инфильтративных форм опухолей желчных протоков;
-
• остеосцинтиграфия проводится при подозрении на метастатическое поражение скелета;
-
• МРТ или КТ головного мозга с в /в контрастированием применяется при симптомах
-
2.3.4. Морфологическое подтверждение диагноза
очагового поражения.
КТ и МРТ с в/в контрастированием играют важную роль в диагностике ГЦР и, в отличие от большинства солидных опухолей, диагноз ГЦР может быть установлен на основании его характерных рентгенологических признаков, без подтверждающей биопсии согласно алгоритму системы LI-RADS (Liver Imaging Reporting and Data System) (рисунки А, В, С, D, см. приложение 1).
Рекомендуемый базовый протокол КТ/МРТ описания печени у пациентов с подозрением на ГЦР включает детальное описание и трактовку выявляемых изменений (табл. 2), что позволяет клиницисту получить максимально информативное отражение распространенности процесса, его биологических характеристик, что имеет важное прогностическое значение.
Таблица 2. Рекомендуемый базовый протокол КТ/МРТ описания печени у пациентов с подозрением на ГЦР
Пункционная биопсия опухоли выполняется в случае выявления любого опухолевого образования в печени при подозрении на злокачественную природу. При технической невозможности/противопоказаниях или отказе пациента от морфологической верификации диагноза следует предпринять дополнительный диагностический поиск с учетом рекомендаций врачебного консилиума. Решение об отказе от биопсии, установлении диагноза ГЦР на основании клинических и рентгенологических (мультифазная контрастная КТ и МРТ печени; LR-4, LR-5, LR-TIV — см. приложение 1) данных должно приниматься на мультидисциплинарном онкологическом консилиуме с участием высококвалифицированного рентгенолога, имеющего опыт диагностики опухолей печени. Морфологическая верификация не обязательна при планируемом хирургическом лечении ПРП или обоснованном отказе мультидисциплинарного консилиума от специального противоопухолевого лечения.
При верификации опухоли в печени предпочтительна инцизионная (cor-) биопсия. ИГХ маркеры для подтверждения злокачественной природы опухоли — позитивная экспрессия двух из трех маркеров (глютамин синтетаза, глипикан 3 и HSP70) с дополнительными ИГХ-маркерами — цитокератином 19 и CD34. При формировании патоморфологического диагноза ПРП указывается степень дифференцировки (G1–G4) и наличие/отсутствие ангиолимфатической инвазии.
В результате обследования должна быть определена стадия опухолевого процесса согласно принятым классификациям TNM (8 пересмотра)/AJCC для внутрипеченочной холангиокарциномы и BCLC (рис. 2) для ГЦР, определен функциональный класс печени по CТP, сформулированы показания/противопоказания к противоопухолевому лечению, необходимость и объем терапии фоновой патологии печени.
3. ЛЕЧЕНИЕ ПЕРВИЧНОГО РАКА ПЕЧЕНИ (ПРП)
План лечения ПРП учитывает наличие и степень выраженности цирроза, распространенность опухолевого процесса, функциональные резервы печени, объективное состояние больного, прогноз основного и фонового заболеваний печени, а также сопутствующую патологию и пожелания пациента. Наилучшие результаты лечения могут быть получены при обсуждении результатов диагностики и определении плана лечения мультидисциплинарной группой на базе специализированного центра.
-
3.1. Гепатоцеллюлярный рак
-
3.1.1. Хирургическое лечение и локальная терапия
-
-
3.1.1.1. Резекция печени
-
3.1.1.2. Ортотопическая/родственная трансплантация печени
-
3.1.1.3. Абляция
-
3.1.2. РЕГИОНАРНАЯ ТЕРАПИЯ
-
3.1.2.1. Трансартериальная химиоэмболизация
Алгоритм выбора варианта локального вида лечения раннего ГЦР (классификация BCLC) представлен на рис. 3
Резекция печени с достижением R0 - метод выбора лечения раннего (BCLC 0-A) ГЦР без сопутствующего цирроза печени. Резекция возможна и у больных с циррозом при сохранной функции печени, нормальном уровне билирубина и без признаков портальной гипертензии. Конкурирующим методом лечения очень раннего рака (стадия BCLC 0) является абляция.
Метод выбора лечения раннего ГЦР (BCLC 0 /A) в случаях, не подходящих для резекции, ГЦР стадии BCLC B1, а также при декомпенсированном (CP В/С) циррозе печени с учетом принятых критериев трансплантации печени (ТП). При определении показаний к ТП, как правило, используются «Миланские критерии» : размер единственной опухоли не более 5 см или наличие в печени до 3 очагов с диаметром наибольшего узла не более 3 см без инвазии в сосуды. Пациенты, ожидающие ТП, могут получать как неоадъювантное, так и иное противоопухолевое лечение (bridge-терапия или терапия «ожидания»), в том числе абляцию, химиоэмболизацию, резекцию печени и/или системное лечение. При успешном лечении ГЦР, исходно не подходящего под критерии ТП, при рентгенологически подтвержденном «понижении» стадии (down-staging) до принятых критериев ТП возможна трансплантация.
Энергетическая абляция является основным методом радикального лечения солитарных опухолей диаметром до 2 см (стадия BCLC 0) у пациентов, не являющихся кандидатами для ТП. Абляция показана как радикальный метод лечения солитарной опухоли диаметром более 2 см (стадия BCLC A) в случае противопоказаний к резекции и ТП. При размере опухолевого узла от 3 до 5 см целесообразно выполнять абляцию после проведения предварительной ТАХЭ опухоли печени или осуществлять энергетическую абляцию в комбинации с чрескожным внутриопухолевым введением этилового спирта (химическая абляция).
ПРИНЦИПЫ РЕГИОНАРНОЙ ТЕРАПИИ
Классификация BCLC предполагает последовательную смену лечебной тактики, однако для пациентов с промежуточной и распространенной стадией обсуждается вопрос о сочетании регионарного лечения и системной терапии с целью увеличения частоты объективных ответов, выживаемости без прогрессирования (ВБП) и общей выживаемости (ОВ). Возможный алгоритм выбора вариантов лечения при промежуточной стадии (BCLC B) ГЦР представлен на рис. 4.
Проведение ТАХЭ возможно пациентам в группе очень ранней и ранней стадии заболевания BCLC 0 и A, находящимся в листе ожидания на ортотопическую ТП с целью сохранения пациента в пределах критериев, допускающих возможность проведения трансплантации (“bridge” терапия) и при невозможности или неудачах других радикальных видов лечения (абляция, резекция).
Проведение ТАХЭ возможно у пациентов группы BCLC В1 в качестве терапии, направленной на понижение стадии (“down-staging” терапия).
ТАХЭ в качестве основного лечения рекомендуется больным стадии BCLC B2 при четко определяемых узлах и возможном селективном доступе к питающим их сосудам для последующей химиоэмболизации и при сохранном портальном кровотоке. При мультифокальном билобарном поражении, инфильтративном типе роста и невозможности селективного доступа (группа BCLC B3) предпочтение отдается лекарственному лечению.
-
3.1.2.2. Трансартериальная радиоэмболизация
-
3.1.2.3. Стереотаксическая лучевая терапия
-
3.1.3. Системное лекарственное лечение ГЦР
Эндоваскулярная эмболизация сосудов при новообразованиях печени и желчевыводящих путей c применением иттрия-90 (Y90) — ТАРЭ — рекомендуется пациентам с ГЦР при стадии BCLC A в качестве bridge-терапии, при стадии BCLC C с тромбозом магистральных вен, не подходящих для системной терапии, для улучшения результатов лечения и выживаемости пациентов.
СЛТ (или стереотаксическая радиохирургия) рекомендуется для лечения очень раннего (BCLC 0) и раннего (BCLC A) ГЦР только в том случае, если имеются противопоказания к выполнению резекции печени, ТП, энергетической абляции, химической абляции, ТАРЭ, а также баллон-окклюзионной и суперселективной ТАХЭ.
Сочетание локорегионарных методов лечения с любыми вариантами системной терапии при промежуточной стадии в рутинной клинической практике не рекомендуется за исключением случаев, когда исходное системное лечение приводит к уменьшению распространенности опухолевого процесса и позволяет выполнить локорегионарные методики на оставшиеся очаги для консолидации эффекта (см. раздел 3.1.3).
В лекарственном лечении ГЦР используются мультикиназные ингибиторы, иммунотерапия МКА к PD1/PD-L1 и CTLA4, а также МКА, направленные на подавление неоангиогенеза. Показанием к лекарственной терапии является впервые выявленный локализованный или метастатический ГЦР с отсутствием возможности и нецелесообразностью локальных методов лечения, прогрессирование на них или отказ пациента от резекции, ТП или ТАХЭ (необходимо рассмотрение мультидисциплинарным консилиумом потенциального отношения «клинического риска-пользы»).
В настоящее время неизвестны предикторы эффективности терапии ГЦР; уровень экспрессии PD-L1 для иммунотерапии не имеет клинического значения. Факторы риска развития ГЦР не имеют прогностического значения и не влияют на выбор варианта лекарственного лечения.
Опухолевый тромбоз печеночных вен и/или тромбоз ветвей/ствола воротной вены не являются противопоказанием к системной терапии ГЦР и не требует антикоагулянтной терапии. При наличии в анамнезе пациента аутоиммунных заболеваний, требующих иммуносупрессивной терапии или трансплантации органа, иммунотерапия не применяется. Противоопухолевая терапия не влияет на течение цирроза печени. Вероятность реактивации вирусных гепатитов низкая, хотя в случаях серопозитивного (HBsAg+) хронического вирусного гепатита В всегда необходима одновременная непрерывная противовирусная терапия аналогами нуклеозидов.
При эффективности терапии с понижением стадии заболевания c BCLC B3 и BCLC C до BCLC B (уменьшение размеров узлов, уменьшение числа узлов, регрессия опухолевого тромба и/или внепеченочных метастазов) целесообразно рассмотреть возможность использования методов локорегионарного лечения (хирургическое лечение, ТАХЭ, абляция). Локорегионар-ное лечение может быть рассмотрено и при олигопрогрессировании внутри печени на фоне системной терапии при отсутствии противопоказаний.
-
3.1.5.1. Адъювантная противоопухолевая терапия ГЦР
-
3.1.5.2. I линия лекарственной терапии ГЦР
После радикального лечения ранних стадий ГЦР при сопутствующем хроническом вирусном гепатите В (HBs+, вирусная нагрузка > 10 000 копий/мл) рекомендуется противовирусная терапия аналогами нуклеозидов, поскольку она увеличивает ВБП и ОВ.
После радикального хирургического лечения ГЦР пациентам с хроническим вирусным гепатитом С (РНК-HCV+) рекомендуется противовирусная терапия по назначению инфекциониста/гастроэнтеролога; после радикального лечения эта терапия увеличивает безрецидивную и общую выживаемость. При нерадикальном хирургическом лечении ГЦР после периода восстановления пациента рекомендуется системная терапия I линии (разд. 3.1.5.2).
Адъювантная терапия мульти-киназными ингибиторами или иммунотерапия не проводится.
Методом выбора терапии I линии также является комбинация тремелимумаба (300 мг однократно в 1 день) с дурвалумабом (1500 мг в 1 день лечения), далее — дур-валумаб (режим STRIDE) 1 раз в 4 недели. В регистрационное исследование не включались пациенты с распространенным тромбозом (тип 3–4, долевые вены и ствол) воротной вены.
При начальных признаках декомпенсации цирроза печени (CTP B, 7–8 баллов, ALBI 2b-3) или при противопоказаниях к ингибиторам протеинкиназ/бевацизумабу возможна терапия ниволумабом или сорафенибом. Начальная доза сорафениба — 800 мг; в случае цирроза CТP В (7–8 баллов) и/или для ослабленных пациентов— 400 мг/сут.
Ленватиниб рекомендован пациентам с функцией печени не хуже CP А (< 7 баллов). Дозовый режим зависит от веса пациента: для больных с массой тела ≥ 60 кг лечение начинается с дозы 12 мг в день, для пациентов с массой < 60 кг— с суточной дозы 8 мг.
-
3.1.5.3. II и последующие линии лекарственного лечения ГЦР
II линия терапии ГЦР представлена несколькими опциями (рис. 6, табл. 3): включая комбинированную иммунотерапию; выбор последующего лечения определяется объективным состоянием пациента (не хуже ECOG 2 балла), выраженностью нарушений функции печени (не хуже CTP B, 8 баллов), учитываются ранее проведенное лечение, его эффективность и переносимость:
-
• после прогрессирования на иммунотерапии — ИПК ленватиниб или сорафениб (как II линия), регорафениб или кабозантиниб или рамуцирумаб (при уровне АФП > 400 нг/мл эффективность рамуцирумаба после использования бевацизумаба неизвестна), а также комбинированная иммунотерапия; при быстром объективном прогрессировании (2–3 курса) на иммунотерапии крайне сомнительна польза от ее продолжения;
-
• после ИПК могут использоваться регорафениб, кабозантиниб, рамуцирумаб или иммунотерапия, предпочтительно комбинированная.
Регорафениб рекомендован больным в удовлетворительном общем состоянии (ECOG 0–1 балл), с компенсированной функцией печени (CP A, при условии переносимости сорафениба в дозе ≥ 400 мг/сут.).
Кабозантиниб назначается в дозе 60 мг внутрь 1 раз в день ежедневно длительно пациентам в удовлетворительном общем состоянии (ECOG 0–1 балл) и при компенсированной функции печени (CТP A). Непереносимость сорафениба не является противопоказанием к назначению кабозантиниба.
Рамуцирумаб назначается пациентам с уровнем АФП ≥ 400 нг/мл при прогрессировании ГЦР или непереносимости терапии сорафенибом. Препарат назначается пациентам в удовлетворительном общем состоянии (ECOG 0–1 балла) и при компенсированной функции печени (CТP A) в дозе 8 мг/кг в/в каждые 2 недели.
В качестве II–III линий лечения прогрессирующего ГЦР или при непереносимости терапии мультикиназными ИПК (сорафенибом/ленватинибом/регорафенибом/кабозан-тинибом) возможны различные варианты лечения (рис. 6), в приоритете — возможность провести иммунотерапию одним из режимов.
Ниволумаб назначается в одном из дозовых режимов; пембролизумаб по 200 мг в/в 1 раз в 3 недели до клинически значимого прогрессирования опухоли; комбинация ниволумаба (1 мг/кг) и ипилимумаба (3 мг/кг) 4 введения 1 раз в 3 недели, далее — монотерапия ниволумабом в одном из стандартных дозовых режимов.
Таблица 3. Рекомендуемые режимы лекарственной терапии гепатоцеллюлярного рака
• Атезолизумаб 1200 мг в/в + бевацизумаб 15 мг/кг в/в 1 раз в 3 недели длительно1
• Тремелимумаб 300 мг однократно + дурвалумаб 1500 мг в/в 1 раз в 4 недели длительно (STRIDE)
• Дурвалумаб 1500 мг в/в 1 раз в 4 недели длительно
• Ниволумаб 3 мг/кг в/в 1 раз в 2 недели или 240 мг в/в 1 раз в 2 недели или 480 мг в/в 1 раз в 4 недели длительно1,2при CТP В7–8
• Сорафениб 400 мг × 2 раз/сут. внутрь длительно1
• Ленватиниб 8/12 мг (при массе тела < 60/≥ 60 кг) 1 раз/сут. внутрь длительно1
• Регорафениб 160 мг/сут. внутрь в 1–21-й день каждые 4 недели
• Кабозантиниб 60 мг внутрь 1 раз/сут. длительно
• Рамуцирумаб 8 мг/кг в/в 1 раз в 2 недели длительно
• Пембролизумаб 200 мг в/в 1 раз в 3 недели длительно (или 400 мг 1 раз в 6 недель)
• Ниволумаб 1 мг/кг в/в + ипилимумаб 3 мг/кг в/в 1 раз в 3 недели № 4, далее — ниволумаб 1 мг/кг в/в каждые 2 недели или 480 мг — каждые 4 недели
4. ОПУХОЛИ ЖЕЛЧЕВЫВОДЯЩЕЙ СИСТЕМЫ
4.1. Кодирование по МКБ-104.2. КЛАССИФИКАЦИЯ, СТАДИРОВАНИЕ И ПРОГНОЗЫ
4.2.1 Стадирование
в начальной дозе 400 мг/сут., при удовлетворительной переносимости рекомендуется эскалация дозы до 600–800 мг/сут. Переносимость ленватиниба в этой группе больных изучена недостаточно; рекомендуется начинать терапию с дозы 8 мг/сут., при хорошей переносимости лечения в течение 10–14 дней доза может быть увеличена до 12 мг/сут. Регорафениб и кабозантиниб используются в качестве II–III линий; дозовый режим подбирается с учетом переносимости предшествующего лечения. Иммунотерапия после ТП печени не используется.
С22.1 Злокачественное новообразование внутрипеченочных желчных протоков C23.9 Злокачественное новообразование желчного пузыря
C24.0 Злокачественное новообразование проксимальных желчных протоков или протоков ворот печени
C24.8 Злокачественное новообразование желчных путей, выходящее за пределы одной и более вышеуказанных локализаций, злокачественное новообразование, захватывающее внутрипеченочные и внепеченочные желчные протоки, злокачественное новообразование желчных путей, которое по месту возникновения не может быть отнесено ни к одной из рубрик C22.0-C24.1
C24.9 Злокачественное новообразование желчных путей неуточненное
Для выбора оптимальной тактики лечения немаловажным является точное разделение заболевания на местнораспространенный процесс с поражением регионарных лимфоузлов или вовлечение лимфоузлов, относящихся к отдаленным метастазам.
Внутрипеченочная холангиокарцинома (ХК)
Первичная опухоль (Т)
Тх — недостаточно данных для оценки первичной опухоли;
-
Т0 — первичная опухоль не определяется;
Тis — рак in situ (внутрипротоковая опухоль);
Т1 — солитарная опухоль без инвазии сосудов, < 5 см или > 5 см;
T1a — солитарная опухоль < 5 см без инвазии сосудов;
T1b — солитарная опухоль > 5 см без инвазии сосудов;
Т2 — солитарная опухоль c внутрипеченочной инвазией сосудов или множественные опухолевые узлы в сочетании или без инвазии сосудов;
Т3 — опухоль, прорастающая висцеральную брюшину;
Т4 — опухоль, вовлекающая местные структуры путем прямой инвазии.
Регионарные лимфатические узлы (N)
Nx — недостаточно данных для оценки состояния регионарных лимфатических узлов;
N0 — нет признаков метастатического поражения регионарных лимфатических узлов;
N1 — имеется поражение регионарных лимфатических узлов метастазами.
К регионарным лимфатическим узлам при внутрипеченочных ХК левой доли печени относятся лимфоузлы вдоль гепатодуоденальной связки (узлы вдоль общего желчного протока, печеночной артерии, воротной вены и пузырного протока), лимфатические узлы вдоль печеночно-желудочной связки, а также нижние диафрагмальные узлы (как частный вариант метастазирования).
При внутрипеченочной ХК правой доли печени к регионарным относятся лимфатические узлы вдоль гепатодуоденальной связки, а также околодвенадцатиперстные и перипанкреатические лимфатические узлы.
Для всех внутрипеченочных ХК отдаленным считается метастазирование в чревные, парааортальные или паракавальные лимфатические узлы. Типичными участками отдаленного распространения являются внутрипеченочные очаги (которые классифицируются в категории T как множественные опухоли), а также поражение брюшины и далее в порядке убывания по частоте встречаемости — кости, легкие и плевра.
Отдаленные метастазы (М)
М0 — нет признаков отдаленных метастазов;
M1 — имеются отдаленные метастазы.
Группировка по стадиям рака внутрипеченочных желчных протоков представлена в табл. 4.
Таблица 4. Группировка по стадиям рака внутрипеченочных желчных протоков (AJCC)
|
Стадия |
T |
N |
M |
|
0 |
Тis |
0 |
0 |
|
IА |
1а |
0 |
0 |
|
IВ |
1в |
0 |
0 |
|
II |
2 |
0 |
0 |
|
IIIA |
3 |
0 |
0 |
|
Стадия |
T |
N |
M |
|
IIIB |
4 |
0 |
0 |
|
любое |
1 |
||
|
IV |
любая |
любая |
1 |
Рак внепеченочных желчных протоков (в области ворот печени)
Первичная опухоль (Т)
TХ — недостаточно данных для оценки первичной опухоли;
T0 — первичная опухоль не определяется;
Тis — рак in situ (высокая степень дисплазии);
T1 — опухоль ограничена желчным протоком с расширением до мышечного слоя или волокнистой (фиброзной) ткани;
Т2 — опухоль проникает за стенку желчного протока в окружающую жировую ткань, проникает в соседнюю печеночную паренхиму;
T2a — опухоль прорастает за пределы стенки протока с инвазией в окружающую жировую ткань;
T2b — опухоль прорастает в прилежащую паренхиму печени;
T3 — опухоль прорастает в ветви воротной вены или печеночной артерии с одной стороны;
T4 — опухоль прорастает в главный ствол воротной вены или ее ветви с обеих сторон; или инвазия общей печеночной артерии; или распространение опухоли на протоки 2-го порядка с обеих сторон; или поражение протоков 2-го порядка с одной стороны с инвазией контралатеральной ветви воротной вены или вовлечением печеночной артерии.
Регионарные лимфатические узлы (N)
Регионарные лимфатические узлы (N) ворот печени, вдоль пузырного и общего желчного протоков, воротной вены, печеночной артерии, а также задние панкреатодуоденальные лимфоузлы
NX — недостаточно данных для оценки поражения лимфоузлов;
N0 — нет признаков метастатического поражения регионарных лимфатических узлов;
N1 — 1–3 положительных лимфатических узла, поражение лимфоузлов вдоль пузырного протока, общего желчного протока, печеночной артерии, задних панкреатодуоденальной и/или воротной вены;
N2 — ≥ 4 положительных лимфатических узла из участков, описанных для N1.
К регионарным относятся лимфатические узлы ворот печени, вдоль пузырного и общего желчного протоков, воротной вены, печеночной артерии, а также задние панкреатодуо- денальные лимфоузлы. Метастазы в лимфатических узлах, расположенных дистальнее гепатодуоденальной связки, классифицируются как отдаленные метастазы.
Отдаленные метастазы (М):
М0 — нет отдаленных метастазов;
М1 — есть отдаленные метастазы.
Группировка по стадиям рака внепеченочных желчных протоков (в области ворот печени) представлена в табл. 5.
Таблица 5. Группировка по стадиям рака внепеченочных желчных протоков (в области ворот печени)
|
Стадия |
Т |
N |
M |
|
Стадия 0 |
Tis |
N0 |
M0 |
|
Стадия I |
T1 |
N0 |
M0 |
|
Стадия II |
T2a–b |
N0 |
M0 |
|
Стадия IIIA |
T3 |
N0 |
M0 |
|
Стадия IIIB |
T4 |
N0 |
M0 |
|
Стадия IIIС |
Любая T |
N1 |
M0 |
|
Стадия IVA |
Любая T |
N2 |
M0 |
|
Стадия IVB |
Любая T |
Любая N |
M1 |
Рак внепеченочных желчных протоков (дистальные — ниже впадения пузырного протока)
Первичная опухоль (Т)
TХ — недостаточно данных для оценки первичной опухоли;
T0 — первичная опухоль не определяется;
Тis — рак in situ (высокая степень дисплазии);
T1 — опухоль проникает в стенку протока глубиной менее 5 мм;
T2 — опухоль проникает в стенку протока глубиной 5–12 мм;
T3 — опухоль проникает в стенку протока глубиной более 12 мм;
T4 — инвазия опухоли в чревный ствол, верхнюю брыжеечную и/ или общую печеночную артерию.
NX — недостаточно данных для оценки поражения лимфоузлов;
N0 — нет признаков метастатического поражения регионарных лимфатических узлов;
N1 — 1–3 положительных лимфатических узла;
N2 — ≥ 4 положительных лимфатических узла.
К региональным лимфоузлам дистальных внепеченочных желчных протоков относятся те же зоны, что и при протоковой карциноме головки поджелудочной железы, то есть лимфатические узлы вдоль общего желчного протока, общей печеночной артерии, воротной вены, передние и задние панкреатодуоденальные узлы и лимфатические узлы, расположенные справа и вдоль верхней брыжеечной артерии.
Отдаленные метастазы (М)
М0-нет отдаленных метастазов;
М1-есть отдаленные метастазы.
Группировка по стадиям рака внепеченочных желчных протоков (дистальных) представлена в табл. 6.
Таблица 6. Группировка по стадиям рака внепеченочных желчных протоков (дистальных)
|
Стадия |
Т |
N |
M |
|
Стадия 0 |
Tis |
N0 |
M0 |
|
Стадия I |
T1 |
N0 |
M0 |
|
Стадия IIА |
T1 |
N1 |
M0 |
|
Т2 |
N0 |
M0 |
|
|
Стадия IIВ |
T2 |
N1 |
M0 |
|
T3 |
N0 |
M0 |
|
|
T3 |
N1 |
M0 |
|
|
Стадия IIIA |
T1 |
N2 |
M0 |
|
T2 |
N2 |
M0 |
|
|
T3 |
N2 |
M0 |
|
|
Стадия IIIB |
T4 |
N0 |
M0 |
|
T4 |
N1 |
M0 |
|
|
T4 |
N2 |
M0 |
|
|
Стадия IV |
Любая T |
Любая N |
M1 |
Рак желчного пузыря
Первичная опухоль (Т)
TХ — недостаточно данных для оценки первичной опухоли;
T0 — первичная опухоль не определяется;
Тis — рак in situ ;
T1 — опухоль прорастает в собственную пластинку или мышечный слой;
T1a — опухоль прорастает в собственную пластинчатую оболочку;
T1b — опухоль прорастает в мышечный слой;
T2 — опухоль проникает в перимускулярную соединительную ткань на брюшной стороне без вовлечения серозы (висцеральной брюшины) или в пери-мышечную соединительную ткань на печеночной стороне без врастания в печень;
Т2а — опухоль проникает в перимускулярную соединительную ткань на брюшной стороне без вовлечения серозы (висцеральной брюшины);
Т2в — опухоль проникает в перимускулярную соединительную ткань на печеночной стороне без врастания в печень;
T3 — опухоль прорастает в серозу (висцеральную брюшину) и / или прямая инвазия в печень и/или другие соседние органы и структуры (желудок, двенадцатиперстная кишка, ободочная кишка, поджелудочная железа, сальник, внепеченочные желчные протоки);
T4 — инвазия опухоли в воротную вену или печеночную артерию или инвазия двух и более органов и структур.
Регионарные лимфатические узлы (N)
Регионарные лимфатические узлы (N) — лимфатические узлы вдоль гепатодуоденальной связки, а также околодвенадцатиперстные и перипанкреатические лимфатические узлы
NХ — недостаточно данных для оценки поражения лимфоузлов;
N0 — нет признаков метастатического поражения регионарных лимфатических узлов;
N1 — поражение 1–3 регионарных лимфатических узлов;
N2 — поражение ≥ 4 лимфатических узлов.
Отдаленные метастазы (М)
М0 — нет отдаленных метастазов;
М1 — есть отдаленные метастазы.
Группировка рака желчного пузыря по стадиям представлена в табл. 7.
Таблица 7. Группировка рака желчного пузыря по стадиям
|
Стадия |
Т |
N |
M |
|
Стадия 0 |
Tis |
N0 |
M0 |
|
Стадия I |
T1 |
N0 |
M0 |
|
Стадия IIА |
T2а |
N0 |
M0 |
|
Стадия IIВ |
T2в |
N0 |
M0 |
|
Стадия IIIA |
T3 |
N0 |
M0 |
|
Стадия IIIB |
T1–3 |
N1 |
M0 |
|
Стадия IVA |
T4 |
N0–1 |
M0 |
|
Стадия IVB |
Любая T |
N2 |
M0 |
|
Любая T |
Любой N |
M1 |
-
4.2.2. Анатомическая классификация, особенности распространения и прогнозы
-
4.3. Диагностика
-
4.3.1. Основные принципы диагностики
-
Рак билиарного тракта — это группа опухолей, развивающихся из эпителия внутри- и внепеченочных желчных протоков (ХК), а также желчного пузыря. Термин ХК подразумевает три типа опухолей с различными факторами риска, свойствами, молекулярно-генетическими характеристиками и лечебными подходами: это собственно ХК внутрипеченочных желчных протоков, внепеченочных желчных протоков (поражение желчных протоков ворот печени — опухоль Клацкина, относится к опухолям внепеченочной локализации) и рак желчного пузыря.
Внутрипеченочные опухоли составляют около 10% случаев рака желчных протоков, на опухоль Клацкина приходится 50% случаев, на опухоли дистальной локализации — 40 %.
Опухоли ворот печени (опухоли Клацкина) характеризуются склонностью к вну-трипеченочному внутрипротоковому поражению, а также распространению по периневральным и перидуктальным лимфатическим каналам. ХК дистальной части общего желчного протока часто распространяются на соседние структуры, отдаленные метастазы, чаще — в печень, легкие и брюшину.
Основой диагноза билиарного рака является морфологическое исследование. Биопсия обязательна для подтверждения диагноза при отказе от хирургического вмешательства и планируемой ЛТ или ХТ, а также в случаях сомнительной природы стриктур (например, хирургические вмешательства на протоках в анамнезе, первичный склерозирующий холангит, камни желчных протоков и т. д.). Решение о выполнении биопсии или обоснованном отказе от ее выполнения должно приниматься на мультидисциплинарном онкологическом консилиуме. Алгоритм уточняющей диагностики при билиарном раке представлен на рис. 7.
В ходе проведения обследования применяются:
-
• сбор жалоб и анамнеза;
-
• врачебный осмотр, определение общего состояния по ECOG, общеклиническое обследование;
-
• абораторная диагностика: клинический и биохимический анализы крови, определение онкомаркеров CA19-9, РЭА, АФП (для внутрипеченочного поражения);
следует учитывать, что CA19-9 повышается при билиарной обструкции, гепатитах, холелитиазе, муковисцидозе и др. При механической желтухе CA19-9 определяется после ее купирования;
-
• МРТ с контрастированием и МРХПГ;
-
• КТ грудной клетки, брюшной полости и малого таза с контрастированием;
-
• диагностическая лапароскопия — по показаниям; в связи с высокой частотой перитонеального метастазирования этот метод позволяет отказаться от неоправданной лапаротомии у трети больных, у которых по результатам МРТ/КТ/ПЭТ-КТ процесс представляется резектабельным, но есть подозрение на специфическое поражение брюшины;
-
• УЗИ печени обладает высокой чувствительностью в выявлении расширения желчных протоков и определении уровня обструкции;
-
• Эндо-УЗИ и ЭРХПГ — по показаниям; позволяют выполнить тонкоигольную биопсию или браш-биопсию для морфологической верификации опухоли; при недостаточной информативности ЭРХПГ возможно выполнение холангиоскопии (для прямой визуализации желчного протока) и биопсии. В тех случаях, когда опухолевое поражение недоступно эндоскопически, рекомендуется чрескожно-чреспеченочное дренирование и биопсия с антеградной холангиоскопией при необходимости;
-
• ПЭТ-КТ — по показаниям; позволяет идентифицировать относительно небольшие (до 1 см) узловые формы холангиокарцином. ПЭТ-КТ обладает низкой чувствительностью для диагностики склерозирующих/инфильтративных форм опухолей желчных протоков. ПЭТ-КТ, не улучшая стадирование по распространенности первичной опухоли (T), примерно у четверти пациентов выявляет отдаленные метастазы. Не заменяет диагностическую лапароскопию.
-
4.3.2. Особенности диагностики опухолей билиарного тракта (без желчного пузыря)
-
4.3.3. Особенности диагностики рака желчного пузыря
-
4.3.4. Особенности диагностики гепатохолангиокарциномы
Диагностический поиск при подозрении на рак желчных путей следует начинать при билиарной обструкции в отсутствие ее альтернативного объяснения, например, холедохолитиаза или патологического образования головки поджелудочной железы. При выявлении бессимптомных узловых образований в печени в первую очередь следует исключить метастазы опухолей других органов, а также доброкачественные и паразитарные образования печени. Внутрипеченочную ХК следует дифференцировать у пациентов с изолированными образованиями печени, выявленными при инструментальных методах при нормальном уровне АФП, РЭА и CA19-9 (рис. 8). Поскольку к факторам риска развития внутрипеченочной ХК, помимо вирусных гепатитов B и C и первичного склерозирующего холангита, относится цирроз печени, образования, выявленные на фоне цирроза печени, следует дифференцировать между ХК и ГЦР.
Пациенты с ранним раком желчного пузыря в большинстве случаев имеют неспецифические симптомы, схожие с холециститом. При подозрении на рак желчного пузыря и планируемом хирургическом лечении предоперационное обследование должно включать в себя МРХПГ для дифференцировки злокачественного и доброкачественного поражения желчного пузыря, а также КТ с в/в контрастированием для определения распространенности заболевания.
К факторам риска рака желчного пузыря относятся желчнокаменная болезнь (риск повышается по мере увеличения размера камней и длительности холелитиаза), полипы желчного пузыря более 1 см в диаметре, кальцинация органа, первичный склерозирующий холангит.
Очаговые изменения желчного пузыря размером более 20 мм следует исходно рассматривать как злокачественные, обследовать и лечить по программе лечения рака желчного пузыря. Регулярное выполнение УЗИ рекомендовано при полипах желчного пузыря размером 6–9 мм каждые 6 мес. в течение 1 года, далее — ежегодно с хирургическим лечением в случае увеличения их размеров (до 10–20 мм).
Гепатохолангиокарцинома — редкий вариант первичной опухоли печени, который характеризуется наличием в одном образовании двух морфологических структур ГЦР и внутрипеченочной ХК. Факторы риска — хронические вирусные гепатиты, употребление алкоголя и цирроз.
Диагноз основан на гистологическом исследовании биоптата, ИГХ исследование не обязательно, но может быть полезным для более детальной характеристики ПРП (HepPar1, AFP и glypican 3); маркерами холангиоцитов являются CK19 и CK7, «стволовыми» маркерами — EpCAM, CK19, CD133. Чувствительность биопсии при кГХК на доопераци-онном этапе составляет 48% при 100% специфичности.
Стандартом диагностики смешанной опухоли печени является гистологическое исследование. Смешанная опухоль может быть заподозрена при расхождении трактовок рентгенологической картины и профиля экспрессии опухолевых маркеров. Сывороточные биомаркеры сами по себе не могут рассматриваться как подтверждение диагноза кГХК: повышение уровня CA19-9 и АФП в плазме крови отмечается только в 45% случаев при ограниченной специфичности.
-
4.4. Лечение
-
4.4.1. Резектабельный рак билиарного тракта
-
4.4.1.1. Хирургическое лечение
-
-
-
4.4.1.2. Адъювантная терапия
-
4.4.2. Местно-распространенный нерезектабельный рак билиарного тракта
Операция остается единственным методом, способным излечить пациента с резек-табельной опухолью билиарного тракта. Цель хирургического лечения — достижение R0-резекции, что ассоциируется с наилучшей выживаемостью.
ТП может обсуждаться для тщательно отобранных пациентов с ранней стадией рака внепеченочных желчных протоков, возникшего на фоне первичного склерозирующего холангита, или пациентов с небольшим (менее 3 см) нерезектабельным первичным очагом в области ворот печени, у которых проведено тщательное стадирование и неоадъювантная ХТ, в ходе которой не произошло прогрессирования или не отмечен переход опухоли в резектабельное состояние.
При случайном выявлении рака желчного пузыря во время холецистэктомии или при T1b стадии или большем поражении по результатам гистологического исследования рекомендуется выполнение повторной операции. Частота R0-резекций во время повторной операции вариабельна вследствие дополнительных находок в ходе релапаротомии.
При опухоли Клацкина хирургические подходы определяются на основании стадирова-ния по Bismuth–Corlette и предполагают выполнение различных уровней резекции печени.
При внепеченочной ХК, как правило, требуется выполнение резекции головки поджелудочной железы и лимфодиссекции, т. е. выполнение стандартной панкреатодуоденальной резекции.
Всем пациентам при отсутствии противопоказаний к ХТ рекомендовано назначение в адъювантном режиме капецитабина в течение 6 месяцев, применение которого улучшает показатели выживаемости для всех групп больных (табл. 8). Тактика лечения пациентов с положительными краями резекции (R1/R2) определяется индивидуально. Возможными опциями являются выполнение ре-резекции, системная ХТ капецитабином и/или ХЛТ с фторпиримидинами. При запланированной ХЛТ в сочетании с адъювантной ХТ оптимальная последовательность методик точно не определена. Предпочтительным является начало лечения с системной ХТ (капецитабин) в течение 4 мес. с последующей ХЛТ, что позволяет избежать напрасной ЛТу пациентов с ранним отдаленным метастазированием.
Лечение большинства пациентов с нерезектабельным местно-распространенным процессом является паллиативным, а результаты лечения и прогнозы мало отличаются от таковых при диссеминированном процессе и, как правило, обусловлены быстро прогрессирующей билиарной обструкцией. Предоперационная ХТ, в том числе молекулярно-направленная, проводится в соответствии с принципами системой терапии, может быть оправдана в отдельных случаях для попытки перевода процесса из нере-зектабельного состояния в резектабельное. В подобном случае через 4–6 мес. терапии проводится повторная оценка резектабельности с принятием решения о хирургическом этапе лечения.
-
4.4.3. Метастатический билиарный рак
-
4.4.3.1. Общие принципы
-
-
4.4.3.2. Системная лекарственная терапия I линии
На рис. 8 представлен алгоритм лекарственного лечения пациентов распространенным билиарным раком.
Пациентам с неоперабельным или метастатическим процессом, осложненным механической желтухой, необходимо обеспечить желчеотток, что улучшает качество жизни и создаетусловия для проведения ХТ. При механической желтухе более чем в 25% случаев ХТ осложняется холангитом, чаще — после реконструкции/дренирования/стентирования желчевыводящих путей. Лечение обострений холангита заключается в ранней антибактериальной терапии (с учетом антибиотикограммы) при обеспечении адекватного оттока желчи, что предполагает своевременное дренирование, коррекцию положений дренажей, их регулярную замену, рестентирования.
Объективное состояние пациента, как правило, является определяющим при решении вопроса о возможности и целесообразности лекарственной терапии. Ухудшение объективного состояния до ECOG > 2 баллов является противопоказанием к специальному лечению; при этом основным методом становится паллиативный.
Умеренная гипербилирубинемия (2–3 × ВГН), механическая желтуха без системной токсичности при возможности успешного дренирования, повышение уровня трансаминаз более чем в 5–8 раз, признаки стойкого нарушения белково-синтетической функции печени (альбумин плазмы < 28 г/л, гипокоагуляция), острый холангит являются только относительными противопоказаниями к ХТ. Однако при развитии паренхиматозной печеночной недостаточности и невозможности ее коррекции или обострении сопутствующей патологии противопоказание к ХТ становится абсолютным.
В случаях заболевания на фоне цирроза проведение ХТ сопряжено со значимым увеличением риска развития тяжелых осложнений.
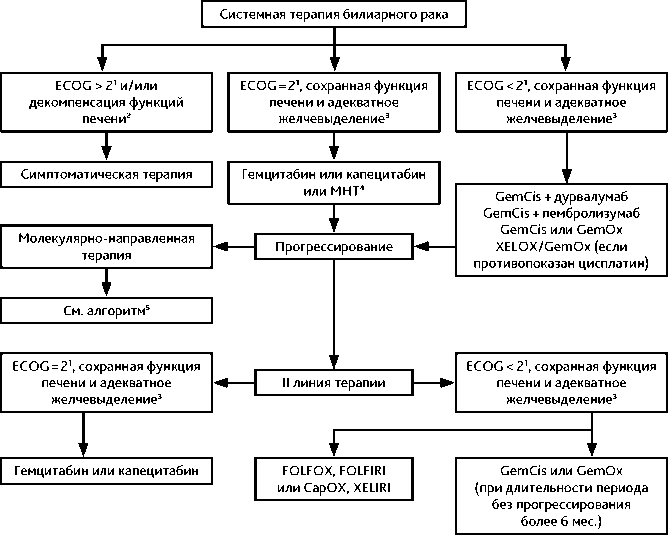
Основой I линии лекарственного лечения нерезектабельного, рецидивирующего или метастатического рака желчных путей является комбинация гемцитабина c цисплатином. Достоверное увеличение эффективности при комбинации ХТ и иммунотерапии дурвалумабом или пембролизумабом зарегистрировано в рандомизированных исследованиях III фазы TOPAZ-1 и KEYNOTE-966. Режимы химио-иммунотерапии не ухудшали профиль безопасности терапии и качества жизни пациентов. Эти и другие возможные режимы лечения рака желчевыводящей системы представлены в табл. 8.
Опционально у больных с нарушением функции почек (расчетный клиренс креатинина < 50 мл/мин.) может назначаться комбинация гемцитабина и оксалиплатина.
Для пациентов с низким с функциональным статусом (ECOG 2 балла) предпочтительна монотерапия гемцитабином или фторпиримидинами. Монотерапия капецитабином менее эффективна при ХК, чем при раке желчного пузыря.
Оптимальная продолжительность I линии терапии составляет 6–8 циклов с возможностью пролонгации лечения (при достижении и нарастании объективного ответа) либо до прогрессирования заболевания или развития выраженной клинически значимой токсичности.
Лекарственное лечение смешанной формы — кГХК, проводится по принципам лечения билиарного рака.
В настоящее время в I линии лечения билиарного рака молекулярно-направленная терапия рутинно не проводится. Однако у пациентов в неудовлетворительном функциональном статусе с противопоказаниями к ХТ при выявленной альтерации может рассматриваться соответствующий препарат с высоким уровнем объективного ответа (например, анти-BRAF, анти-HER2, анти-FGFR).
-
4.4.3.3. Лекарственная терапия II и последующих линий лечения
-
4.4.3.3.1. ХИМИОТЕРАПИЯ
Во II линии терапии может применяться ХТ, а также, при наличии таргетируемых альтераций, выявленных при ИГХ и/или генетическом исследованиях, — молекулярнонаправленная терапия.
Оптимальным режимом II линии терапии для пациентов с хорошим функциональным статусом (ECOG 0–1 балл) вне зависимости от чувствительности к комбинации цисплатина и гемцитабина, применяемых ранее, является схема FOLFOX (табл. 8). В отдельных случаях возможно применение режима FOLFIRI, однако данное назначение имеет меньшую доказательную базу. Могут применяться различные варианты лечения. При длительном ВБП (более 6 мес.) после эффективной I линии лечения возможно повторное использование гемцитабина с препаратом платины.
Таблица 8. Рекомендуемые режимы лекарственной терапии билиарного рака
|
Название режима |
Схема лечения |
|
GemCis + дурвалумаб 1 |
Гемцитабин 1000 мг/м 2 в/в в 1-й и 8-й дни + цисплатин 25 мг/м 2 в/в в 1-й и 8-й дни + дурвалумаб 1500 мг в/в в 1-й день каждые 3 недели до 8 циклов терапии, далее — дурвалумаб 1500 мг в/в каждые 4 недели до прогрессирования или неприемлемой токсичности |
|
Название режима |
Схема лечения |
|
GemCis + пембролизумаб 1 |
Гемцитабин 1000 мг/м 2 в/в в 1-й и 8-й дни без ограничения продолжительности применения + цисплатин 25 мг/м 2 в/в в 1-й и 8-й дни, максимум 8 циклов + пембролизумаб 200 мг в/в в 1-й день каждые 3 недели, максимум 35 циклов |
|
5-фторурацил + кальция фолинат |
Кальция фолинат 400 мг/м 2 в/в в течение 2 ч с последующим болюсом 5-фторурацила 400 мг/м 2 и 46-часовой инфузией 5-фторурацила 2400 мг/м 2 (1200 мг/м 2 в сутки) в/в каждые 2 нед. |
|
Капецитабин (адъювантный) |
Капецитабин по 1250 мг/м 2 × 2 раза в день внутрь в 1–14-й дни каждые 3 недели |
|
GemCis |
Гемцитабин 1000 мг/м 2 в/в в 1-й и 8-й дни + цисплатин 25 мг/м 2 в/в в 1-й и 8-й дни каждые 3 недели |
|
Гемцитабин |
Гемцитабин 1000 мг/м 2 в/в в 1-й, 8-й дни каждые 3 недели |
|
GemOx |
Гемцитабин 1000 мг/м 2 в/в в 1-й и 8-й дни + оксалиплатин 100 мг/м 2 в/в в 1-й день каждые 3 недели ИЛИ Гемцитабин 1000 мг/м 2 + оксалиплатин 85 мг/м 2 в/в в 1-й день каждые 2 недели |
|
CapOx |
Капецитабин по 1000 мг/м 2 × 2 раза в день внутрь в 1–14-й дни + оксалиплатин 130 мг/м 2 в/в 2-часовая инфузия в 1-й день каждые недели |
|
FOLFOX |
Оксалиплатин 85 мг/м 2 в/в 2-часовая инфузия в 1-й день + кальция фолинат 400 мг/м 2 в/в в течение 2 часов параллельно с оксалиплатином с последующим болюсом 5-фторурацила 400 мг/м 2 и 46-часовой инфузией 5-фторурацила 2400 мг/м 2 (1200 мг/м 2 в сутки) в/в каждые 2 нед. |
|
FOLFIRI |
Иринотекан 180 мг/м 2 в/в 90-минутная инфузия в 1-й день, кальция фолинат 400 мг/м 2 в/в в течение 2 ч параллельно с иринотеканом с последующим болюсом 5-фторурацила 400 мг/м 2 и 46-часовой инфузией 5-фторурацила 2400 мг/м 2 (1200 мг/м 2 в сутки) в/в каждые 2 недели |
|
Капецитабин (режим I и последующей линии) |
Капецитабин по 1000 мг/м 2 × 2 раза в день (2000 мг/м 2 в сутки) внутрь в 1–14-й дни каждые 3 недели |
|
XELIRI |
Иринотекан 200 мг/м 2 в 1-й день, капецитабин 1800 мг/м 2 в сутки в 2 приема 1-й – 14-й дни. Интервал — 3 недели |
|
Пембролизумаб (для MSI-H/dMMR и TMB-H опухолей) |
Пембролизумаб 200 мг в/в 30-минутная инфузия каждые 3 недели или 400 мг в/в капельно каждые 6 недель |
|
Ниволумаб и ипилиму-маб1 (TMB-H опухоли) |
Ниволумаб1 240 мг 1 раз в 2 недели в/в + ипилимумаб1 1 мг/кг в/в 1 раз в 6 недель до 2 лет |
|
BRAF + МЕК-ингибитор 1 (при BRAF V600E) |
Вемурафениб1 960 мг внутрь 2 раза в день ежедневно + кобиметиниб1 60 мг в сутки 21 день приема, 7 дней перерыв, или Дабрафениб 150 мг внутрь × 2 раза в сутки ежедневно + траметиниб 2 мг внутрь × 1 раз в сутки ежедневно длительно |
|
Регорафениб |
Регорафениб 160 мг внутрь ежедневно 1–21 день каждого 28-дневного цикла |
|
Название режима |
Схема лечения |
|
Трастузумаб + пертузу-маб1 (при гиперэкспресии или амплификации HER2) |
Трастузумаб 8 мг/кг в/в (нагрузочная доза) в 1-й день 1-го цикла, затем — 6 мг/кг в/в каждые 3 недели, пертузумаб1 840 мг в/в (нагрузочная доза) в 1-й день 1-го цикла, затем — 420 мг в/в каждые 3 недели |
|
Трастузумаб эмтанзин1 (при гиперэкспресии /амплификации HER2) |
Трастузумаб эмтанзин1 3,6 мг / кг в /в — каждые 21 день |
|
Трастузумаб деруксте-кан1 (при гиперэкспреcсии HER2 и диком типе генов RAS) |
Трастузумаб дерукстекан1 5,4 мг/кг в/в — каждые 21 день |
|
NTRK-ингибиторы1 (при NTRK-транслокациях) |
Ларотректиниб1 100 мг внутрь × 2 раза в сутки ежедневно Энтректиниб1 600 мг внутрь ежедневно |
|
Селперкатиниб1 (при слиянии гена RET) |
Селперкатиниб1 160 мг внутрь х 2 раза в день ежедневно |
|
Эрдафитиниб1 (при слиянии гена FGFR2) |
Эрдафитиниб1 8 мг в сутки х 1 раз в день ежедневно. Изменения дозы в зависимости от нежелательных явлений согласно инструкции по применению препарата. |
|
Соторасиб1 (только при мутации KRAS G12C) |
Соторасиб1 960 мг внутрь х 1 раз в день ежедневно |
1 Режим /препарат зарегистрирован в РФ, но не входит в клинические рекомендации, одобренные Минздравом РФ.
4.4.3.3.2. ГЕНЕТИЧЕСКИЕ АЛЬТЕРАЦИИ КАК МИШЕНИ МОЛЕКУЛЯРНО-НАПРАВЛЕННОЙ ТЕРАПИИ
5. СОСУДИСТЫЕ И ПЕРИВАСКУЛЯРНЫЕОПУХОЛИ ПЕЧЕНИ
Опухоли билиарного тракта нередко имеют молекулярно-генетические изменения, являющиеся потенциальными мишенями для специфических ингибиторов, многие из которых в настоящее время доступны (рис. 9). Эффективность молекулярно-направленной терапии в I линии не изучена, ее можно рекомендовать к применению в качестве II и последующих линий терапии. Применение в I линии оправдано только у пациентов в неудовлетворительном функциональном статусе с противопоказаниями к ХТ при выявленной альтерации под соответствующий препарат с высоким уровнем объективного ответа (например, анти-BRAF, анти-HER2, анти-FGFR).
При выявлении в опухоли мутации гена BRAF V600E можно рекомендовать комбинации ингибиторов киназ BRAF и MEK. В лечении билиарного рака с амплификацией/гиперэкс-прессией HER2 могут использоваться анти-HER2 препараты (назначение трастузумаба дерукстекана только при гиперэкспрессии HER2, выявленной при ИГХ исследовании, и настоятельно рекомендуется в отсутствие мутации KRAS). При выявлении мутации G12C в гене KRAS возможно назначение соторасиба. Недавно зарегистрированные в РФ ларотректиниб и энтректиниб обладают высокой эффективностью при опухолях, несущих транслокации NTRK (табл. 8). Диагностированная высокая мутационная нагрузка (10 mut/Mb в ткани опухоли или 16 mut/Mb в периферической крови) является показанием для назначения иммунотерапии, если она не применялась ранее.
В РФ в клинической практике пока малодоступна таргетная терапия, направленная на относительно часто встречаемые при внутрипеченочной ХК мутации IDH1 (ивосидениб), транслокации FGFR (пемигатиниб, футибатиниб, инфигратиниб), RET (селперкатиниб).
C22.3 Ангиосаркома печени
C22.4 Другие саркомы печени
Эпителиоидная гемангиоэндотелиома (ЭГ) печени относится к высокодифференцированным ангиосаркомам, в общей популяции встречается крайне редко (1 на 1 000 000 чел.), чаще — у 30–40-летних пациентов. Течение заболевания определяется злокачественным потенциалом опухоли; чаще в печени встречаются случаи местнодеструктивного и/или инфильтративного роста с вовлечением/сдавлением окружающих структур, реже — с внепеченочными метастазами.
При КТ (МРТ) опухоль чаще всего представляется в виде множественных отдельно расположенных узлов преимущественно под капсулой печени, неправильной треугольной формы или очагов округлой формы с симптомом «мишени».
Резекция печени — основной вариант радикального лечения ЭГ печени. Вероятность рецидива заболевания составляет около 30–40%. При нерезектабельной опухоли отмечены хорошие результаты ТП. Внепеченочные очаги и случаи разрыва капсулы опухоли являются главными противопоказаниями к трансплантации.
В ряде случаев мультифокальная ЭГ печени протекает бессимптомно и диагностируется случайно, и даже при мультиорганном поражении длительно медленно прогрессирует.
При явном прогрессировании заболевания или симптомном его течении показано начало лекарственной терапии. Наиболее целесообразно применение ИТК с антиангио-генным действием, например, пазопаниба, показывающих бóльшую эффективность в сравнении с цитостатической терапией (объективный ответ на антиангиогенных препаратах до 29%).
Потенциальную эффективность на уровне отдельных клинических случаев показали паклитаксел, гемцитабин, комбинация карбоплатина и этопозида, комбинация карбоплатина, пеметрекседа и бевацизумаба.
В отсутствие лечебных опций с доказанной эффективностью при индолентном течении ЭГ печени возможно динамическое наблюдение либо назначение пропранолола — неселективного β-блокатора в дозе 40–60 мг по 2–3 раза/сут. Препарат может ингибировать неоангиогенез, вызывает апоптоз клеток эндотелия капилляров и зарегистрирован EMEA в 2014 г. для лечения инфантильных гемангиом.
6. СОПРОВОДИТЕЛЬНАЯ ТЕРАПИЯ, ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ОСЛОЖНЕНИЙ ФОНОВОЙ ПАТОЛОГИИ ПЕЧЕНИ 6.1. Противовирусная терапия хронических вирусных гепатитов
Независимо от выраженности цитолитического синдрома для улучшения выживаемости пациентам с ГЦР настоятельно рекомендуется противовирусная терапия сопутствующего хронического гепатита В (ДНК HBV > 2 × 10 2 МЕ/мл) аналогами нуклеот (з) идов (энтекавир или тенофовир) и хронического гепатита С ингибиторами протеазы и полимеразы вируса (глекапревир/пибрентасвир или софосбувир/велпатасвир) одновременно с лекарственным или интервенционно-радиологическим лечением. При (ре-) активизации хронического вирусного гепатита С (цитолитический синдром с кратным увеличением уровней АСТ/АЛТ и повышением уровня билирубина) после радикального лечения, после ТАХЭ или на фоне системной терапии возможно одновременное проведение курса лечения прямыми противовирусными агентами у больных с компенсированной функцией печени. Клинически значимых межлекарственных взаимодействий между прямыми противовирусными препаратами и средствами для ХТ ГЦР не описано. Неспецифическая терапия лекарственного поражения печени — препараты урсодезоксихолевой кислоты (10–15 мг/кг/сут.), S-адеметионина (800 мг/сут.).
-
6.2. Особенности лечения больных раком печени и билиарного тракта на фоне цирроза печени
Сопроводительная корригирующая терапия осложнений фоновой патологии (в том числе цирроза) печени и опухолевого процесса увеличивает выживаемость больных ГЦР. В условиях длительного лекарственного лечения может возрастать клиническая значимость сопутствующего цирроза печени из-за усугубления портальной гипертензии и выраженности симптомов, ассоциированных с ней, декомпенсации функции органа. Декомпенсация цирроза печени конкурентно влияет на общую выживаемость больных, ухудшает переносимость лекарственного лечения. Рекомендуется регулярное, не реже 1 раза в мес., тщательное мониторирование функции печени, проведение активной профилактики и своевременное лечение осложнений цирроза печени. При декомпенсированном циррозе — класс CP В-С (> 8 баллов) — лекарственное лечение, как правило, не проводится в связи с ожидаемой высокой токсичностью и отсутствием подтверждения увеличения выживаемости.
Декомпенсация цирроза печени на фоне противоопухолевого лечения иногда ошибочно расценивается как клиническое прогрессирование ПРП: при отсутствии убедительных признаков прогрессии опухоли необходимо активное лечение осложнений цирроза под наблюдением гастроэнтерологов/гепатологов.
При нарастании проявлений печеночной недостаточности (CP ≥ + 2 балла от исходного) противоопухолевое лечение следует приостановить на 10–15 дней, провести активную терапию осложнений цирроза под наблюдением гастроэнтеролога. При положительной динамике лечение может быть возобновлено с редукцией дозы препарата.
При стойком ухудшении функции печени (CP ≥ 9 баллов, развитие осложнений цирроза — нарастание энцефалопатии, асцит-перитонита, гипокоагуляции, гепаторенального синдрома, при признаках желудочно-кишечного кровотечения) противоопухолевое лечение завершается до клинически значимого улучшения состояния больного со срочной консультацией гастроэнтеролога.
Оценка показаний к возобновлению терапии ГЦР обсуждается с гастроэнтеро-логом/гепатологом только при условии возможности профилактики рецидива печеночной недостаточности.
При снижении уровня альбумина плазмы < 28 г/л на фоне противоопухолевого лечения до плановой эвакуации значительного (> 5 литров) количества асцитической жидкости или после лапароцентеза рекомендуется заместительная курсовая терапия 20% раствором альбумина (100–200 мл/день, № 5–8) до целевого уровня 35–38 г/л. Цирротический асцит хорошо контролируется адекватной диуретической терапией (например, спиронолактон до 400 мг/сут., фуросемид/торасемид, комбинации препаратов под контролем электролитов крови).
При циррозе печени НПВС используются строго по показаниям в минимально необходимой дозе короткими курсами и с крайней осторожностью.
Больным с декомпенсированной функцией печени (CP В/С > 7 баллов) проводится симптоматическая терапия осложнений цирроза и опухолевого процесса. Однако при выявлении раннего ГЦР (BCLC O/A) оправдана консультация трансплантолога.
6.3. Билиарная гипертензия
7. НАБЛЮДЕНИЕ
Алгоритмы лечения билиарной гипертензии представлен на рис. 10.
Тактика отведения желчи у больных с механической желтухой при ХК учитывает перспективы противоопухолевого лечения, ожидаемую продолжительность жизни пациента, локализацию и распространенность блока желчеоттока, степень нарушения функции печени и должна определяться мультидисциплинарно в условиях специализированного центра гепатобилиарной хирургии до выполнения билиарного дренирования. При определении показаний к желчеотведению необходимо соотносить риски вмеша- тельства и предполагаемую клиническую пользу. Алгоритмы лечения механической желтухи представлены на рис. 10.
Механическая желтуха при ХК является показанием к билиарной декомпрессии, необходимость в которой становится абсолютной при наличии холангита, белково-энергетической или печеночно-почечной недостаточности, малом объеме будущего остатка печени < 50% при планировании хирургического вмешательства, портоэмболизации, а также при необходимости системного лекарственного лечения. Критический уровень общего билирубина, указывающий на необходимость дренирования желчных протоков в отсутствие вышеперечисленных показаний, точно не определен, но ориентиром порогового значения следует считать 40–50 мкмоль/л.
Перед хирургическим лечением пациентам с ХК при дистальном или проксимальном (Bismuth I, II) уровне билиарной обструкции для декомпрессии желчных протоков следует применять чрескожную чреспеченочную холангиостомию (ЧЧХС) или назобилиарное дренирование. Также возможно проведение эндоскопической папиллосфинктерото-мии (ПСТ) с последующим ретроградным стентированием. При планировании других видов лечения пациентам с ХК при дистальном или проксимальном (Bismuth I, II) уровне билиарной обструкции желчная декомпрессия может быть осуществлена посредством ЧЧХС или эндоскопической установки стентов.
При планировании любых видов лечения при проксимальном уровне блока (Bismuth III, IV) предпочтение отдается антеградным методикам желчной декомпрессии — ЧЧХС по наружному или реверсивному (внутреннему) типу без низведения в 12-перстную кишку (ДПК).
Целью активного наблюдения является выявление раннего местного прогрессирования, предполагающего возможность применения локальных методов лечения. До 65% рецидивов заболевания случаются в первые 2 года наблюдения и лишь 5% рецидивов диагностируются спустя 3 года. Это подтверждает целесообразность активного наблюдения: КТ органов грудной клетки, брюшной полости и малого таза с в/в мультифазным контрастированием, онкомаркеры (если были повышены до операции) каждые — 6 мес. в первые 2 года, далее — ежегодно в течение 3 лет; при невозможности выполнения КТ — применение УЗИ и рентгенографии.
Выявлена опухоль (и) в печени клинически, УЗТ, КТ, МРТ
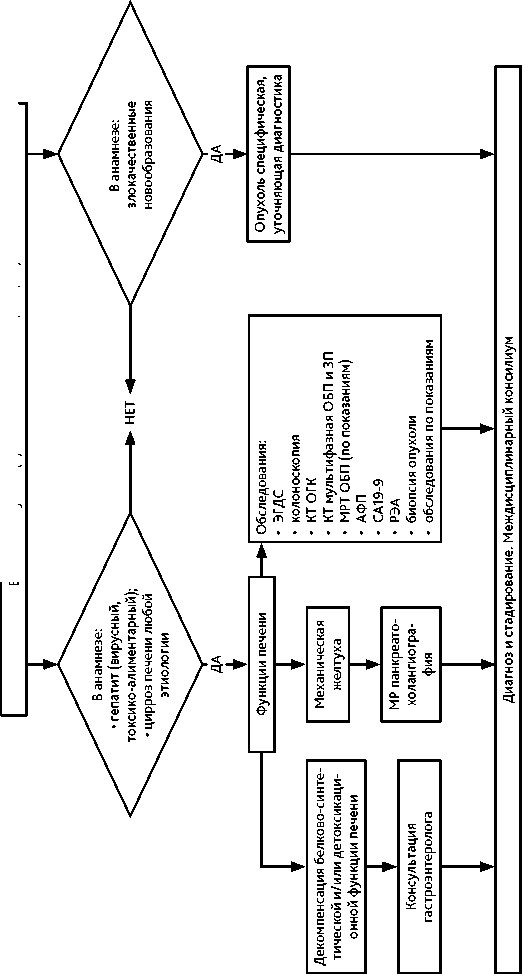
Рисунок 1. Алгоритм уточняющей диагностики при выявлении объемного образования в печени
Ф
Ф
X
На основании опухолевой нагрузки, состояния печени и общего состояния больного, с учетом АФП, соотношения альбумина /билирубина, методики Чайлд-Пью, МКСЗП
Для определения индивидуализированного подхода к лечению
Первичный метод лечения
Ожидаемая выживаемость
|
>s s Ф ф X s X u Ф s s X Ф s к s c |
Переход в этапах лечения Подготовка низкоприоритетных методов при клинической характеристике с отсутствием проблем, связанных с печенью (возраст, сопутствующие заболевания, предпочтения и доступность пациента) |
Потенциальный кандидат на трансплантацию печени
_______ i
Самая ранняя стадия (0)
• 1 опухоль ≤ 2 см
• Сохраненная функция печени, ОС 0
Давление в воротной вене, уровень билирубина
Абляция
1 опухоль
Повышены 2
≤ 3 узла, ≤ 3 см каждый
Противопоказания к ТП
|
Нормальное |
1 Есть 2 |
1 Нет |
|
* ♦ ♦ |
||
|
Резекция |
Абляция |
Трансплантация |
> 5 лет
Неосуществима или неудачная
ТАХЭ
Радиоэмболизация (только для одиночного очага ≤ 8 см)

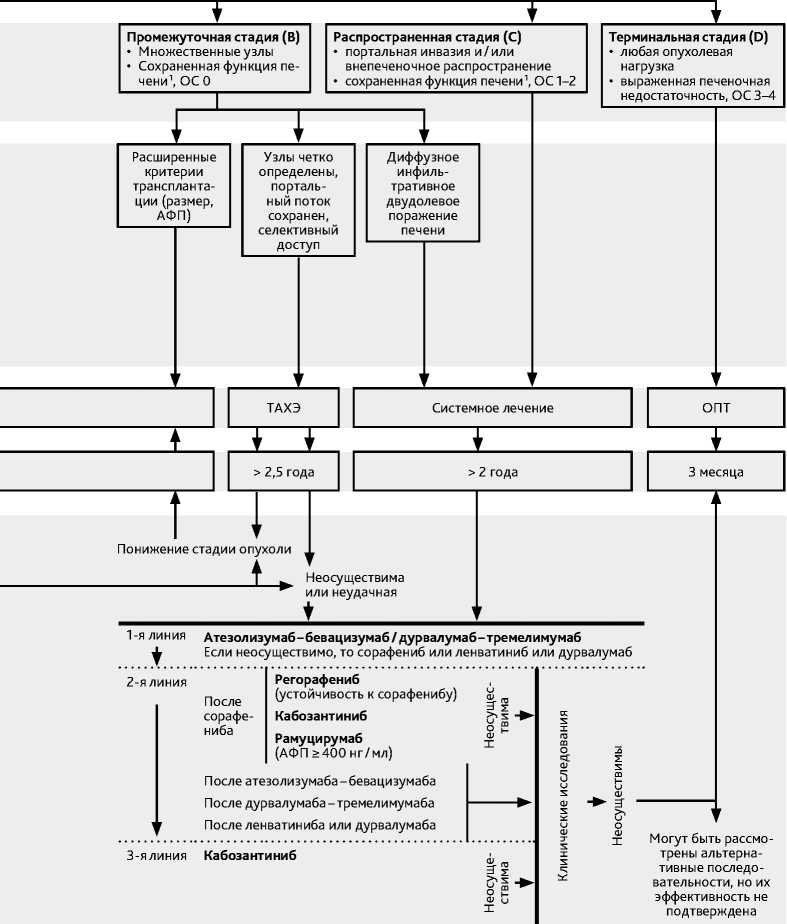
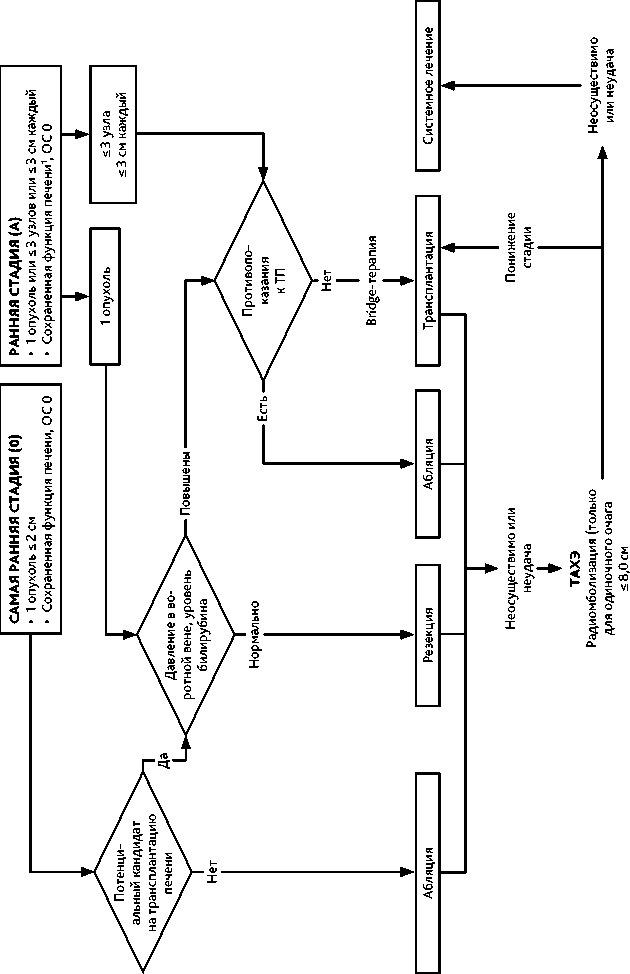
Рисунок 3. Алгоритм выбора варианта локального вида лечения ранних стадий ГЦР
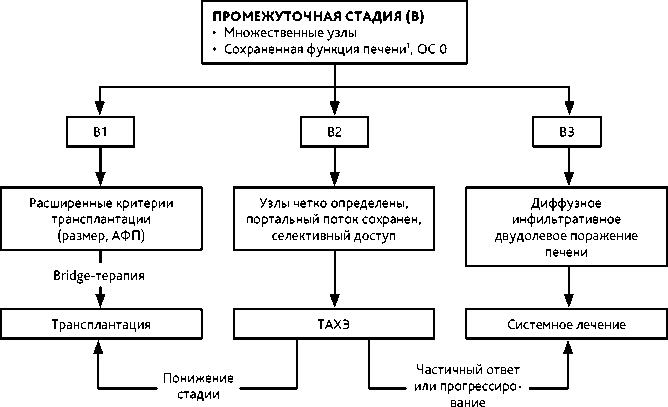
Рисунок 4. Алгоритм выбора варианта локального вида лечения при промежуточной стадии ГЦР (BCLC B)
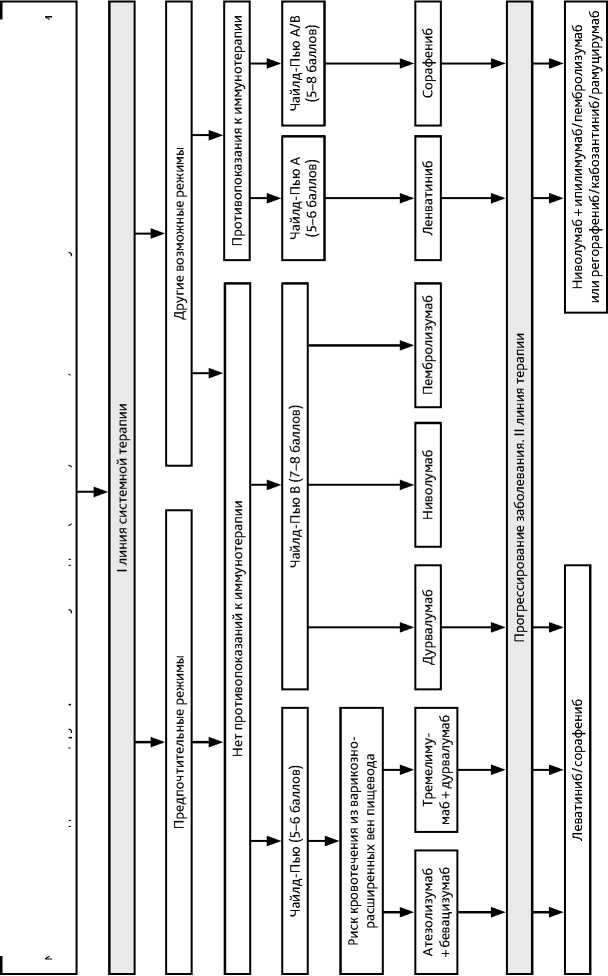
Рисунок 5. Алгоритм системной лекарственной терапии ГЦР
Гепатоцеллюлярный рак поздняя стадия (стадия C по BCLC, портальная инвазия и/или внепеченочное распространение) или промежуточная стадия (стадия B по BCLC, многоузловая, инфильтративная) с противопоказаниями или прогрессированием после локорегионарной терапии с противопоказаниями к локальным методам лечения, функция печени не хуже стадии B (8 баллов) по шкале CTP, объективный статус по шкале ECOG 0–1
I линия
II–III линии
Последующие линии
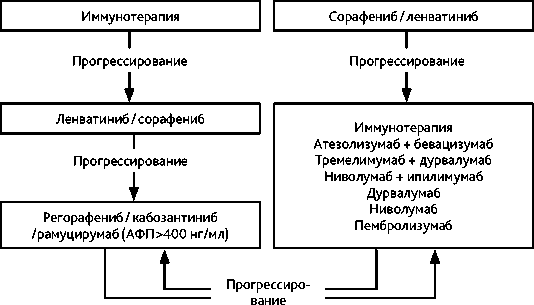
Рисунок 6. Вторая и последующие линии лекарственного лечения ГЦР
Подозрение на холангиокарциному (без первичного склерозирующего холангита в анамнезе)
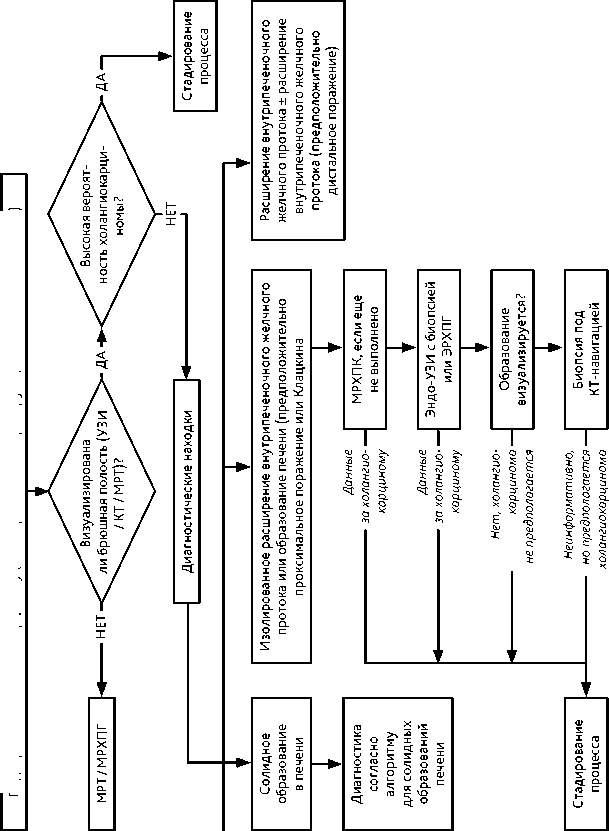
Рисунок 7. Алгоритм уточняющей дианостики при подозрениии на билиарный рак
-
1 ECOG 2 за счет общего состояния пациента, распространенности опухолевого процесса кроме патологического перелома костей;
-
2 Оценка белково-синтетической, детоксикационной и экскреторной функции печени см. раздел 2.3.2 Оценка функционального статуса печени
-
3 См. Алгоритм желчевыделения
-
4 МНТ (молекулярно-направленная терапия) при выявлении соответствующей альтерации, предполагающей высокую вероятность быстрого противоопухолевого ответа (BRAF, HER2, FGFR2)
-
5 Алгоритм «Молекулярно-направленная терапия билиарного рака»
Рисунок 8. Алгоритм лекарственного лечения больных распространенным/ метастатическим билиарным раком
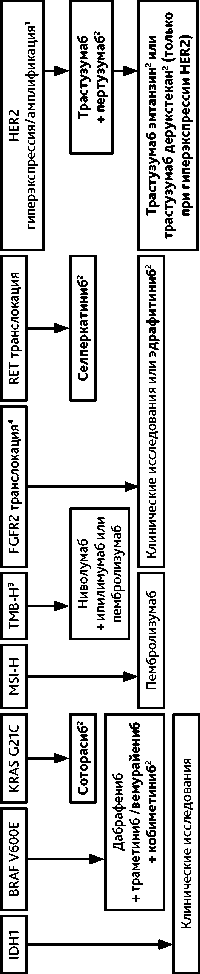
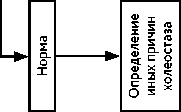
Рисунок 9. Молекулярно-направленная терапия билиарного рака
Дистальный блок Проксимальный блок (Bismuth I, II)
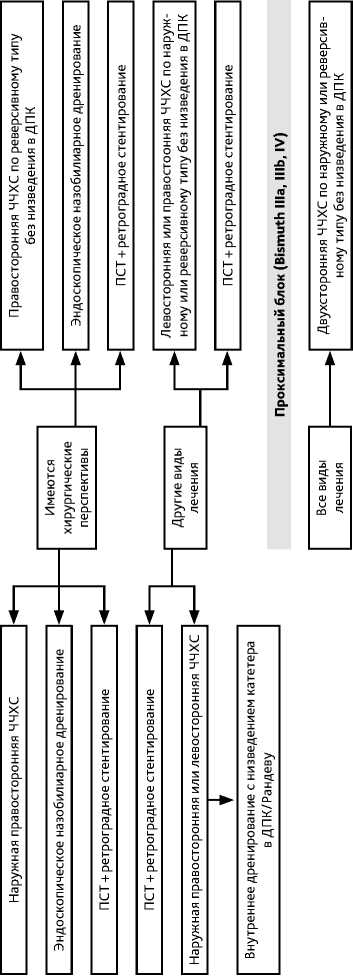
Рисунок 10. Алгоритм лечения билиарной гипертензии
Приложение 1.
LI-RADS применяется для пациентов с высоким риском развития ГЦР, имеющих:
-
• цирроз печени или
-
• хронический вирусный гепатит B или
-
• ГЦР в настоящее время или в анамнезе, включая кандидатов на трансплантацию печени и реципиентов.
LI-RADS не применяется для пациентов:
-
• без вышеперечисленных признаков;
-
• младше 18 лет;
-
• с циррозом вследствие врожденного фиброхолангиокистоза печени;
-
• с циррозом вследствие наследственной геморрагической телеангиэктазии, синдрома Бадда–Киари, хронического тромбоза портальной вены, сердечной недостаточности, очаговой узловой гиперплазии печени.
LI-RADS применяется для следующих мультифазных методик:
-
• КТ или МРТ с использованием внеклеточных контрастных препаратов или
-
• МРТ с использованием гепатоспецифических контрастных препаратов.
LI-RADS не применяется в следующих случаях:
-
• подтвержденное злокачественное новообразование или
-
• подтвержденное доброкачественное новообразование, не происходящее из гепатоцитов, например, гемангиома.
ГЛАВНЫЕ КРИТЕРИИ
-
• Непериферическое контрастирование в артериальной фазе (более выраженно, чем паренхима печени)
-
• Непериферическое вымывание в портальную венозную и отсроченную (гепатоспеци-фическую) фазы
-
• Наличие капсулы в портальной или отсроченной фазе (капсула включается в измерение)
-
• Измерение проводится в той фазе, где границы опухоли видны наиболее четко (нежелательно проводить изменение в артериальной фазе и на ДВИ)
-
ВСПОМОГАТЕЛЬНЫЕ КРИТЕРИИ
Вероятно ГЦР:
-
• Умеренная интенсивность в Т2
-
• Ограничение диффузии
-
• Мозаичная архитектоника
-
• Узел в узле
-
• Включения жира, гемосидерина
-
• Геморрагические включения
-
• Гипоинтенсивность в переходной и гепатоспецифической фазах
-
• Увеличение диаметра (ниже, чем при пороговом росте)
-
• Наличие капсулы
Вероятно доброкачественное образование
-
• Стабильность размера ≥ 2 лет
-
• Уменьшение размера
-
• Выраженная гомогенная гиперинтенсивность (гипоинтенсивность) в Т2
-
• Не нарушена архитектоника сосудов
-
• Контрастное усиление соответствует пулу крови
-
• Изоинтенсивность в гепатоспецифической фазе
Рисунок А. LI-RADS (Liver Imaging Reporting and Data System).
Комплексная система для стандартизации терминологии, методики проведения и описания результатов медицинской визуализации печени для диагностики ГЦР у пациентов группы высокого риска
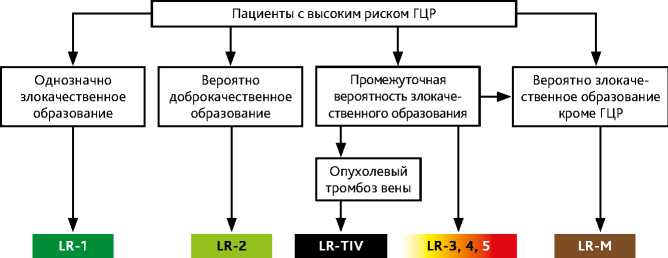
Гипо- или изоинтенсив- Диффузное гетерогенное усиление ность в артериальную в артериальную фазу (неперифери-фазу сканирования ческое)
|
Размер в мм |
< 20 ≥ 20 < 10 10–19 ≥ 20 |
||||
|
Усиление Нет капсулы признаков Вымывание (неперифери- к Один ческое) признак Рост ≥ 2 при- образования 1 знаков |
LR-3 |
LR-3 |
LR-3 |
LR-3 |
LR-4 |
|
LR-3 |
LR-4 |
LR-4 |
LR-4 LR-5 |
LR-5 |
|
|
LR-4 |
LR-4 |
LR-4 |
LR-5 |
LR-5 |
|
1 Пороговое значение роста: ≥ 50 % увеличение размеров образования за ≤ 6 месяцев.
Рисунок В. Алгоритм рентгенологической диагностики образований печени при подозрении на ГЦР по шкале LI-RADS том /vol. 14(3s2) 2024 |
ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ
Malignant Tumors


