Злокачественные трофобластические опухоли
Автор: Ульрих Е.А., Румянцев А.А., Телетаева Г.М., Хохлова С.В., Урманчеева А.Ф.
Журнал: Злокачественные опухоли @malignanttumors
Статья в выпуске: 3S2-1.2 т.15, 2025 года.
Бесплатный доступ
В данном разделе указаны критерии оценки клинической значимости применения дорогостоящей противоопухолевой лекарственной терапии в соответствии со шкалой, разработанной экспертной группой (см. стр. 7). В тексте они обозначены, как магнитуда клинической значимости (МКЗ).
Хориокарцинома, трофобластическая болезнь, трофобластическая неоплазия, опухоль плацентарного ложа, эпителиоидная трофобластическая опухоль, инвазивный пузырный занос
Короткий адрес: https://sciup.org/140312961
IDR: 140312961 | DOI: 10.18027/2224-5057-2025-15-3s2-1.2-07
Текст научной статьи Злокачественные трофобластические опухоли
Трофобластическая болезнь (ТБ) представлена спектром расстройств, связанных с беременностью, которые включают доброкачественные/предраковые заболевания (полный и частичный пузырный занос, атипический узел плацентарного ложа), а также злокачественные процессы, такие как инвазивный пузырный занос, хориокарцинома, трофобластическая опухоль плацентарного ложа и эпителиоидная трофобластическая опухоль (табл. 1). Трофобластическая неоплазия — термин, используемый для злокачественных и резистентных опухолей.
1. КЛАССИФИКАЦИЯ И ОПРЕДЕЛЕНИЕ СТАДИИ
Морфологическая классификация и принципы стадирования трофобластической болезни представлены в табл. 1 и 2, на рис. 1 и 2, классификация факторов риска резистентности — в табл. 3.
Таблица 1. Международная морфологическая классификация трофобластической болезни (IARC, 5-е издание, Лион, 2020 г.)
|
Источник |
Гистологический тип |
Морфологический код1 |
МКБ-10 |
|
Ворсины хориона |
Полный пузырный занос |
9100/0 |
О01 |
|
Частичный пузырный занос |
9103/0 |
О01 |
|
|
Инвазивный/метастатический пузырный занос |
9100/1 |
D39 |
|
|
Атипический ворсинчатый хорион |
– |
– |
|
Источник |
Гистологический тип Морфологический код1 МКБ-10 |
|
Промежуточный трофобласт |
Хориокарцинома 9100/3 С58 Трофобластическая опухоль 9104/1 D39 плацентарного ложа Гиперэргическая реакция – – плацентарного ложа Эпителиоидная трофобластическая 9105/3 С58 опухоль Узел плацентарного ложа/ – – атипический узел плацентарного ложа Смешанные трофобластические – – опухоли |
-
1 Морфологический код: цифра под дробью «0, 1, 3» означает: 0 — доброкачественная (опухоль), 1 — пограничная (опухоль), 3 — злокачественная (опухоль).
Таблица 2. Стадии трофобластической болезни в соответствии с классификацией FIGO 2020 г. (аналогичны классификации FIGO 2000 г. для трофобластической болезни)
Стадия Локализация опухоли
I Локализуется в пределах матки
II Распространяется за пределы матки, но ограничена половыми органами (придатки, широкая связка матки, влагалище)
III Метастазы в легких в сочетании или без поражения половых органов
IV Метастазы другой локализации
Таблица 3. Группы риска развития резистентности к лекарственной терапии при трофобластической болезни (прогностические критерии FIGO 2020 г. аналогичны классификации FIGO 2000 г. для трофобластической болезни)
|
Параметр/количество баллов |
0 |
1 |
2 |
4 |
|
Возраст |
< 40 лет |
≥ 40 лет |
– |
– |
|
Предшествовавшая беременность |
Пузырный занос |
Аборт |
Доношенная беременность |
– |
|
Интервал между окончанием последней беременности и началом химиотерапии (ХТ) |
< 4 мес. |
4–6 мес. |
7–12 мес. |
> 12мес. |
|
Уровень β-ХГЧ в крови до начала ХТ, мМЕ/мл |
< 1000 |
1000 – < 10 000 |
10 000 – < 100 000 |
≥ 100 000 |
|
Размер наибольшей опухоли (включая опухоль в матке), см |
< 3 |
3–5 |
> 5 |
– |
|
Параметр/количество баллов |
0 |
1 |
2 |
4 |
|
Локализация метастазов |
Легкие |
Селезенка, почки |
ЖКТ |
Головной мозг, печень |
|
Количество метастазов |
– |
1–4 |
5–8 |
> 8 |
|
Предшествующая неэффективная ХТ (количество препаратов) |
– |
– |
1 |
≥ 2 |
β-ХГЧ — бета-субъединица хорионического гонадотропина человека.
Сумма баллов ≤ 6 соответствует низкому риску развития резистентности опухоли к лекарственной терапии, сумма баллов ≥ 7 соответствует высокому риску развития резистентности опухоли к лекарственной терапии.
2. ДИАГНОСТИКА 2.1. Клинические проявления
Пузырный занос не является злокачественной опухолью, однако, в 1–15% случаев возможна его малигнизация (табл. 4), опухоль характеризуется кровянистыми выделениями из половых путей, болями внизу живота, токсикозом и несоответствием размеров матки предполагаемому сроку беременности.
Таблица 4. Критерии высокого риска развития трофобластической неоплазии после пузырного заноса
|
Критерии |
Пузырный занос высокого риска |
|
Возраст |
< 19 лет либо > 40 лет |
|
Уровень β-ХГЧ перед эвакуацией пузырного заноса |
> 100,000 мМЕ/мл |
|
Количество беременностей |
≥ 4 |
|
Размеры матки |
Больше, чем предполагаемый срок гестации (> 4–6 нед., размер > 6 см) |
|
Текалютеиновые кисты яичников |
Билатеральные, ≥ 6 см |
|
Другие |
Осложнения во время беременности (гипертиреоидизм, токсикоз, преэклампсия, дыхательная недостаточность и т. п.) Рецидивирующие пузырные заносы в анамнезе Плохая приверженность к последующему наблюдению |
Основной симптом хориокарциномы — маточные кровотечения во время беременности или после ее окончания.
Клиническая манифестация метастазов зависит от их локализации (легкие, головной мозг, печень): кровохарканье, острая неврологическая симптоматика и др.
Любая женщина с продолжающимися маточными кровотечениями после беременности (роды/аборт) относится к группе риска наличия трофобластической болезни.
При маточных кровотечениях, продолжающихся в течение более чем 8 нед. после беременности (роды/аборт), должен быть выполнен тест на наличие β-ХГЧ в моче.
-
2.2. Обследование
Рекомендуемый алгоритм обследования представлен на рис. 1 и 2. Диагностика включает следующие обследования:
-
• для установления диагноза гистологическая верификация не является обязательной, достаточными являются клиническая картина и уровень/динамика β-ХГЧ;
-
• гинекологический анамнез с подробным выяснением особенностей предшествовавшей беременности;
-
• гинекологический осмотр;
-
• ультразвуковое исследование (УЗИ) или магнитно-резонансная томография (МРТ) органов малого таза с внутривенным (в/в) контрастированием, УЗИ или компью-тераная томография (КТ) органов брюшной полости с в/в контрастированием;
-
• определение уровня β-ХГЧ в крови (в табл. 5 представлены показатели β-ХГЧ вне беременности и при нормально протекающей беременности);
-
• рентгенография/КТ легких;
-
• при наличии метастазов в легких — МРТ головного мозга с в /в контрастированием;
-
• при подозрении на пузырный занос — эвакуация пузырного заноса с гистологическим исследованием удаленных тканей и дальнейшим мониторингом уровня β-ХГЧ и инволюции матки;
-
• периодичность мониторинга β-ХГЧ после эвакуации пузырного заноса:
– при частичном пузырном заносе — 1 раз в нед. до нормализации, далее — контроль через 1 мес.;
– при полном пузырном заносе — 1 раз в нед. до нормализации (см. пункт 2.3), далее — ежемесячно в течение 6 мес.;
-
• общий анализ крови;
-
• биохимический анализ крови;
-
• коагулограмма;
-
• общий анализ мочи.
-
2.3. Критерии диагноза, необходимые для инициации лечения (достаточно одного из признаков)
Таблица 5. Нормальные значения β-ХГЧ в зависимости от сроков гестации
Сроки беременности, акушерские недели Показатель β-ХГЧ, мМЕ/мл
Небеременные женщины 0–5
Результат сомнительный 5–25
|
Сроки беременности, акушерские недели |
Показатель β-ХГЧ, мМЕ/мл |
|
Беременность 3–4 неделя |
25–156 |
|
Беременность 4–5 неделя |
101–4870 |
|
Беременность 5–6 неделя |
1110–31 500 |
|
Беременность 6–7 неделя |
2560–82 300 |
|
Беременность 7–8 неделя |
23 100–151 000 |
|
Беременность 8–9 неделя |
27 300–233 000 |
|
Беременность 9–13 неделя |
20 900–291 000 |
|
Беременность 13–18 неделя |
6140–103 000 |
|
Беременность 18–23 неделя |
4720–80 100 |
|
Беременность 23–41 неделя |
2700–78 100 |
• Плато уровня β-ХГЧ в 4 последовательных пробах в течение 3 нед. после эвакуации пузырного заноса (1-й, 7-й, 14-й, 21-й дни)
• Увеличение на 10% и более уровня β-ХГЧ в 3 пробах в течение 2 нед. (1-й, 7-й, 14-й дни) после эвакуации пузырного заноса
• Персистенция β-ХГЧ в течение более 6 мес. после эвакуации полного пузырного заноса
• Повышенный уровень β-ХГЧ и наличие отдаленных метастазов (в легких и /или печени и/или головном мозге) при выявленной связи с предшествующей беременностью
• Гистологически верифицированная хориокарцинома.
3. ЛЕЧЕНИЕ3.1. Пузырный занос
Основным методом лечения гестационной трофобластической неоплазии является противоопухолевая лекарственная терапия, позволяющая достичь выздоровления у большинства больных с сохранением репродуктивной функции. Лечение должно быть начато в кратчайшие сроки и проводиться в специализированных отделениях, имеющих опыт лечения таких больных. Кровотечение из опухоли не является противопоказанием к началу ХТ, которую необходимо проводить одновременно с интенсивной гемостатической терапией. Рекомендуемые алгоритмы лечения злокачественных трофобластических опухолей представлены на рис. 3–6.
-
• Вакуум-аспирация пузырного заноса, при необходимости — острый кюретаж полости матки и цервикального канала с обязательным исследованием биопсийного (операционного) материала матки. Пациенткам с резус-отрицательным фактором необходимо ввести антирезус-иммуноглобулин. ХТ после эвакуации пузырного заноса в рутинной практике не проводится.
-
• Хирургическое лечение (гистерэктомия с сальпингэктомией может рассматриваться как начальное лечение только у пациенток, не желающих сохранять фертильность).
-
• Мониторинг β-ХГЧ после эвакуации пузырного заноса:
– при частичном пузырном заносе — 1 раз в нед. до нормализации, далее — контроль через 1 мес.;
– при полном пузырном заносе — 1 раз в нед. до нормализации, далее — ежемесячно в течение 6 мес.
-
3.2. Инвазивный пузырный занос и хориокарцинома
-
• Данные опухоли высокочувствительны к ХТ. Лекарственная терапия (в сочетании с хирургическим вмешательством или без него) эффективна в 90–100% случаев трофобластической неоплазии низкого риска и в 80–90% случаев высокого риска. Для определения прогноза и тактики лечения необходимо классифицировать опухоль по стадии и группе риска развития резистентности (табл. 2, 3). Лечение следует проводить в специализированной клинике, располагающей современными возможностями диагностики и опытом успешного лечения этой категории больных. Тактика лечения должна быть определена на мультидисциплинарном консилиум. При опухолях низкого риска развития резистентности (< 6 баллов) рекомендуется монохимиотерапия (табл. 6, рис. 3); при опухолях высокого риска развития резистентности (≥ 7 баллов) — ХТ по схеме EMA-CO (табл. 6, рис. 4).
-
• При опухолях ультравысокого риска резистентности (≥ 13 баллов) возможно использование схемы EMA-CO, однако предпочтительнее схема EP/EMA (рис. 5). Для профилактики неконтролируемого лизиса опухоли и кровотечения, особенно при метастазах в головном мозге, а также в случае неудовлетворительного общего состояния пациентки (ECOG (Eastern Cooperative Oncology Group) ≥ 3 баллов), целесообразно начинать индукционную ХТ с использования редуцированного режима: этопозид 100 мг/м 2 в/в и цисплатин 20 мг/м 2 в/в в 1-й и 2-й дни, 1–3 курса еженедельно под контролем β-ХГЧ до начала стандартной ХТ.
– У пациентов с метастазами в головном мозге увеличение дозы метотрексата в режимах EP/EMA и EMA-CO до 1000 мг/м 2 улучшает проникновение через гематоэнцефалический барьер; необходимо увеличить длительность инфузии с 12 до 24 часов и дополнительно использовать кальция фолинат 15 мг
внутрь каждые 6 часов, 12 доз, начиная через 32 часа после начала инфузии метотрексата.
-
• При метастазах в головном мозге возможно стереотаксическое облучение или облучение гамма-ножом, а также лучевая терапия (ЛТ) всего головного мозга в СОД (суммарная очаговая доза) 30 Гр суточными фракциями по 2 Гр одновременно с ХТ.
-
• Самостоятельное хирургическое лечение (гистерэктомия с сальпингэктомией) при неметастатической форме может рассматриваться только у пациенток, не желающих сохранять фертильность.
-
• Лекарственное лечение рекомендуется проводить до нормализации β-ХГЧ с последующими 2–3 консолидирующими курсами ХТ (при низком риске развития лекарственной резистентности с 0–2 баллами возможно ограничиться 2 консолидирующими курсами химиотерапии).
-
• Требуется строгое соблюдение сроков начала очередного курса ХТ.
-
• Мониторинг после лечения включает анализ β-ХГЧ ежемесячно в течение 12 мес.;
-
• В течение 12 мес. после лечения рекомендуется контрацепция, предпочтительны гормональные оральные контрацептивы.
Таблица 6. Режимы химиотерапии 1-й линии трофобластических опухолей
Группа риска Режим химиотерапии
Низкий риск Метотрексат 1 мг/кг в/м в 1-й, 3-й, 5-й, 7-й дни + кальция фолинат 0,1 мг/кг в/м во 2-й, 4-й, 6-й, 8-й дни, через 30 ч после введения метотрексата; повторение курсов каждые 2 недели (с 15-го дня, считая от 1-го дня предыдущего курса химиотерапии) 1, 2, 3
Метотрексат 50 мг в/м в 1-й, 3-й, 5-й, 7-й дни, кальция фолинат 15 мг внутрь во 2-й, 4-й, 6-й, 8-й дни через 24 часов после введения метотрексата; повторение курсов каждые 2 недели (с 15-го дня, считая от 1-го дня предыдущего курса химиотерапии)
Метотрексат 0,4 мг/кг в/в в 1–5 дни каждые 14 дней (максимальная суточная доза 25 мг)
Дактиномицин 0,5 мг в/в струйно в 1–5-й дни (с противорвотной терапией); повторение курсов каждые 2 недели, (с 15-го дня, считая от 1-го дня предыдущего курса химиотерапии)
Дактиномицин 1,25 мг/м 2 (максимум 2 мг) в/в в 1-й день; повторение курсов каждые
2 недели, (с 15-го дня, считая от 1-го дня предыдущего курса химиотерапии)
Высокий риск ЕМА-СО
-
• Этопозид 100 мг/м² в/в кап. в 1-й и 2-й дни
-
• Дактиномицин 500 мкг в/в в 1-й и 2-й дни
-
• Метотрексат 2, 3 300 мг/м² в/в кап. 12-часовая инфузия (либо 100 мг/м² в/в струйно
с последующей 12-часовой инфузией в дозе 200 мг/м²) в 1-й день
– Кальция фолинат 15 мг в/м через 24 часа после введения метотрексата, затем — каждые 12 ч (всего 4 дозы)
-
• Циклофосфамид 600 мг/м² в/в кап. в 8-й день
-
• Винкристин 0,8 мг/м² (максимально до 2 мг) в/в струйно в 8-й день
– Г-КСФ (короткого действия) 5 мкг/кг п/к в течение 3–4 дней в неделю, т. е. на 4-й, 5-й, 6-й, (7-й) дни и на 10-й, 11-й, 12-й, (13-й) дни каждого курса EMA-CO.
Повторение курсов с 15-го дня, считая от 1-го дня предыдущего курса.
|
Группа риска |
Режим химиотерапии |
|
Ультравысокий риск 4, 5 |
ЕМА-ЕP
– Кальция фолинат 15 мг в/м через 24 ч после введения метотрексата, затем — каждые 12 ч (всего 4 дозы)
– Г-КСФ (короткого действия) 5 мкг/кг п/к в 9–14-й дни. Повторение курсов с 15-го дня, считая от 1-го дня предыдущего курса. ЕР-ЕМА
– Кальция фолинат 15 мг в/м через 24 ч после введения метотрексата, затем — каждые 12 ч (всего 4 дозы)
Повторение курсов с 15-го дня, считая от 1-го дня предыдущего курса. |
-
1 Предпочтительный режим ввиду равной эффективности при меньшей токсичности.
-
2 Длительность инфузии метотрексата не должна превышать 12 часов в силу меньшей эффективности более длительной инфузии.
-
3 При метастазах в головном мозге рекомендуется увеличить дозу метотрексата до 1000 мг /м 2 , увеличить продолжительность инфузии с 12 до 24 часов, дополнительно использовать кальция фолинат 15 мг внутрь каждые 6 часов, всего 12 доз, начиная через 32 часа после начала инфузии метотрексата.
-
4 Возможно использование режима EMA-CO, однако, предпочтительнее режимы ЕМА-ЕP либо EP-EMA.
-
5 Для профилактики неконтролируемого лизиса опухоли и кровотечения, особенно при метастазах в головном мозге, целесообразно начинать лечение с режима «щадящей» индукции (этопозид 100 мг /м 2 в /в кап. и цисплатин 20 мг /м 2 в /в кап. в 1-й и 2-й дни, повторение курсов еженедельно в течение 1–3 недель до начала стандартной ХТ); у пациентов с метастазами в головном мозге увеличение дозы метотрексата до 1000 мг /м 2 улучшает проникновение через гематоэнцефалический барьер.
-
3.3. Опухоль плацентарного ложа и эпителиоидная трофобластическая опухоль
При метастазах в головном мозге возможно стереотаксическое облучение или облучение гамма-ножом, либо ЛТ всего головного мозга в СОД 30 Гр суточными фракциями по 2 Гр одновременно с ХТ.
Решение вопроса о ЛТ должно приниматься на консилиуме с участием специалистов, имеющих опыт лечения таких больных.
-
• Эти опухоли менее чувствительны к ХТ, имеют более высокую вероятность развития резистентности. Первым этапом рекомендуется хирургическое лечение
(гистерэктомия с биопсией тазовых лимфатических узлов, удаление потенциально операбельных метастатических очагов).
-
• При I cтадии болезни после выполнения гистерэктомии возможно наблюдение при четком мониторинге с помощью определения β-ХГЧ или КТ/МРТ (при неин-формативности β-ХГЧ) при соблюдении всех следующих условий: – интервал от последней беременности менее 2 лет;
– поверхностная инвазия;
– отсутствие некротической ткани в опухоли;
– количество митозов менее 5/ 10.
-
• Во всех остальных случаях показано проведение системной лекарственной терапии с назначением адъювантной ХТ или ХТ 1-й линии при метастатических формах заболевания [ХТ с включением препаратов платины (EMA/EP, EP/EMA) либо другие режимы (TP/TE, BEP, VIP, ICE)].
-
• В случае крайней заинтересованности в сохранении фертильности возможна попытка неоадъювантной ХТ с включением препаратов платины и этопозида [(EMA/EP, EP/EMA) либо другие режимы (TP/TE, BEP, VIP, ICE)] с последующей органосохраняющей операцией и адъювантной ХТ в центрах, обладающих опытом лечения таких пациенток.
-
3.4. Лечение резистентных форм
Рекомендуемый алгоритм лечения опухоли плацентарного ложа и эпителиоидной трофобластической опухоли представлен на рис. 6.
Резистентность опухоли к ХТ 1-й линии возможна в 5% случаев трофобластической болезни низкого риска и в 30–40% трофобластической неоплазии высокого риска. Признаки резистентности:
-
• Отсутствие снижения β-ХГЧ (плато) или снижение уровня β-ХГЧ менее чем на 10% в трех последовательных анализах крови, сданных в течение 10 дней.
-
• Увеличение уровня β-ХГЧ во время или после окончания ХТ (в ближайшие 6 мес.) в трех последовательных анализах крови, сданных в течение 10 дней (однократное увеличение требует подтверждения). Необходимо повторное полное клинико-инструментальное обследование с перерасчетом группы риска по FIGO (в соответствии с новой суммой баллов, табл. 3), лекарственное/комбинирован-ное лечение (табл. 7).
Таблица 7. Лечение резистентных форм трофобластических опухолей
Группа риска Режим химиотерапии
Низкий риск 1 Дактиномицин 2 500 мкг в/в струйно в 1–5-й дни (с противорвотной терапией);
повторение курсов с 15-го дня, считая от 1-го дня предыдущего курса
ЕМА-СО 3 (см. табл. 6)
|
Группа риска |
Режим химиотерапии |
|
Высокий риск 1 |
ЕМА-ЕP (см. табл. 6) ЕР-ЕМА (см. табл. 6) ТР/ТЕ (чередование режимов с повторением курсов с 15-го дня, считая от первого дня предыдущего курса):
– паклитаксел 135 мг/м 2 в/в в 1-й день – цисплатин 60–75 мг/м 2 в/в в 1-й день
– паклитаксел 135 мг/м 2 в/в в 1-й день – этопозид 150 мг/м 2 в/в в 1-й день – Г-КСФ (пролонгированного действия) 6 мг п/к во 2-й и в 16-й дни BEP 4 :
– Г-КСФ 5 (короткого действия) 5 мкг/кг п/к в 6–14-й дни. Повторение курсов каждые 3 нед., считая от первого дня предыдущего курса VIP
– Г-КСФ (пролонгированного действия) 6 мг в 8-й день или – Г-КСФ (короткого действия) 5 мкг/кг п/к в 6–14-й дни. Повторение курсов каждые 3 нед., считая от первого дня предыдущего курса ICE:
– Г-КСФ (пролонгированного действия) 6 мг п/к в 4-й день или – Г-КСФ (короткого действия) 5 мкг/кг п/к в 6–14-й дни. Повторение курсов каждые 3 нед., считая от первого дня предыдущего курса TIP:
Повторение курсов каждые 3 нед., считая от первого дня предыдущего курса |
Группа риска Режим химиотерапии
Дополнительные режимы для пациенток с резистентностью к полихимио- терапии6
Капецитабин по 1250 мг/м 2 × 2 раза в день внутрь в 1–14-й дни
Повторение курсов каждые 3 нед., считая от первого дня предыдущего курса.
Гемцитабин + цисплатин
-
• гемцитабин 600–800 мг/м 2 в/в в 1, 8, 15-й дни
-
• цисплатин-25–30 мг/м 2 в/в в 1, 8, 15-й дни
Повторение курсов каждые 4 нед., считая от первого дня предыдущего курса.
Авелумаб 800 мг в/в каждые 2 нед., 3 консолидирующих цикла (МКЗ III-C)
Пембролизумаб 200 мг в/в каждые 3 нед. или 400 мг в/в каждые 6 нед., 5 консолидирующих циклов (МКЗ III-C)
Ниволумаб 240 мг в/в каждые 2 нед. или 480 мг в/в каждые 4 нед. (МКЗ III-C).
-
• Рентгенография легких с экранированием области матки или МРТ легких
-
• Пренатальное инвазивное тестирование кариотипа плода в случае сомнения, является ли беременность полным пузырным заносом с сосуществующим нормальным близнецом или возможной одноплодной беременностью с частичным пузырным заносом
-
• Пренатальное инвазивное тестирование кариотипа плода при монохориальной беременности в случаях подозрения на интраплацентарную хориокарциному
-
• Оценка функции щитовидной железы
-
• Оценка акушерских рисков.
-
3.6. Лечение пациенток с остаточной опухолью
-
3.7. Наблюдение
Необходимо совместное принятие решения о пролонгировании/прерывании беременности междисциплинарным консилиумом с участием онколога, акушера-гинеколога, неонатолога. В случае пролонгирования беременности существует риск преждевременных родов, замершей беременности, кровотечения, перинатальных осложнений.
Ведение пациентки осуществляется акушером-гинекологом, онкологом. Наблюдение и родоразрешение должны осуществляться в специализированном перинатальном центре, имеющем опыт ведения таких пациенток.
В случае пролонгирования беременности после родов обязательно гистологическое исследование опухоли, мониторинг уровня β-ХГЧ, мониторинг инволюции матки, КТ грудной клетки, брюшной полости.
В составе комбинированного лечения резистентных опухолей рассматривается в том числе хирургический метод лечения (гистеротомия, гистерэктомия, метастазэктомия).
Остаточные «опухолевые узлы» после завершения лечения и нормализации уровня β-ХГЧ не всегда требуют хирургического удаления, возможно их динамическое наблюдение. Нормальный уровень β-ХГЧ даже при наличии визуализируемой «остаточной опухоли» в матке или других локализаций свидетельствует о ремиссии и дополнительного лечения не требует.
Повышение уровня β-ХГЧ (в 3 последовательных исследованиях в течение 14 дней) в период ремиссии у больных с «остаточной опухолью» свидетельствует о неизлечен-ности (резистентности) опухоли. Если после тщательного обследования «остаточная опухоль» является единственной локализацией, следует рассмотреть вопрос о хирургическом лечении.
Необходим тщательный мониторинг за больными трофобластическими новообразованиями:
-
• После удаления частичного пузырного заноса наблюдение завершается после двух отрицательных результатов β-ХГЧ, полученных с интервалом 4 нед. (получение отрицательного результата, далее — контроль через 4 нед., при отрицательном β-ХГЧ — наблюдение завершается);
-
• После удаления полного пузырного заноса и нормализации уровня β-ХГЧ в течение 56 дней наблюдение следует продолжать еще 6 мес. от момента удаления пузырного заноса (с ежемесячным определением β-ХГЧ);
-
• После удаления полного пузырного заноса в отсутствие нормализации β-ХГЧ в течение 56 дней следует продолжать наблюдение до его нормализации и далее в течение еще 6 мес. от момента нормализации β-ХГЧ (с ежемесячным определением β-ХГЧ);
-
• После окончания лечения по поводу злокачественной трофобластической болезни рекомендуется ежемесячное определение β-ХГЧ в течение года;
-
• Во время мониторинга после эвакуации пузырного заноса обязательна контрацепция (предпочтение барьерным методам). Во время лекарственного лечения злокачественной трофобластической болезни обязательна контрацепция (предпочтение барьерным методам). После окончания лечения злокачественной трофобластической болезни рекомендуется контрацепция в течение 1 года (предпочтение гормональным контрацептивам).
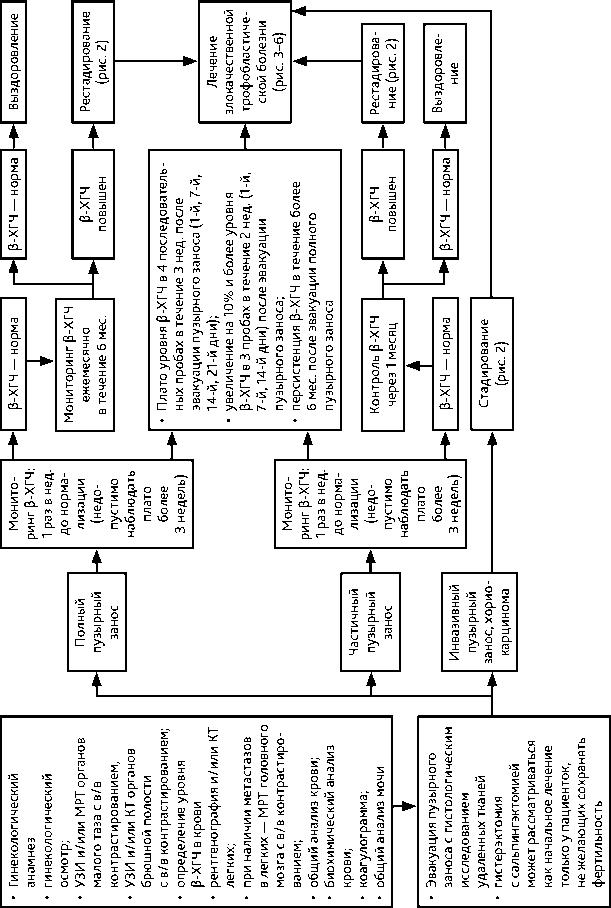
Рисунок 1. Рекомендуемый алгоритм лечения пузырного заноса
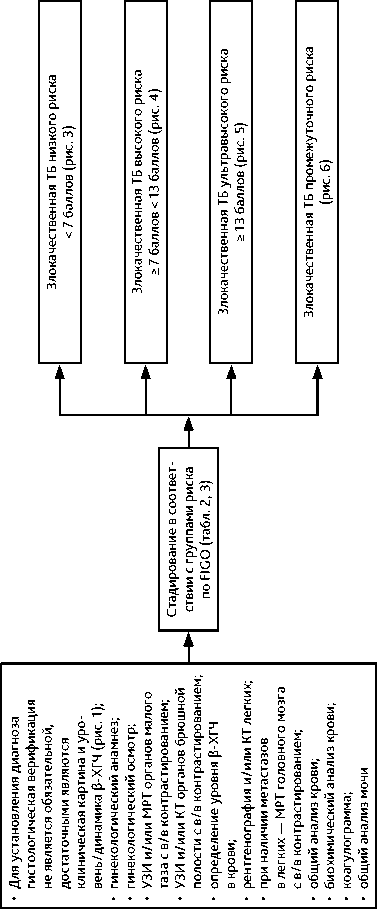
Рисунок 2. Рекомендуемый алгоритм диагностики и стадирования злокачественной трофобластической болезни (ТБ)
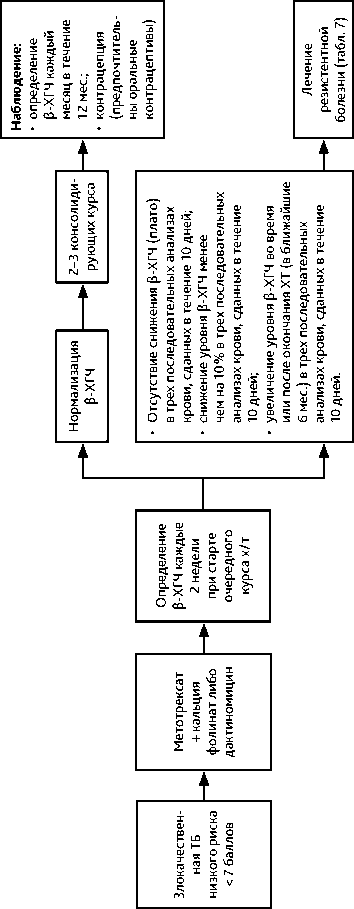
Рисунок 3. Рекомендуемый алгоритм лечения злокачественной трофобластической болезни (ТБ) низкого риска
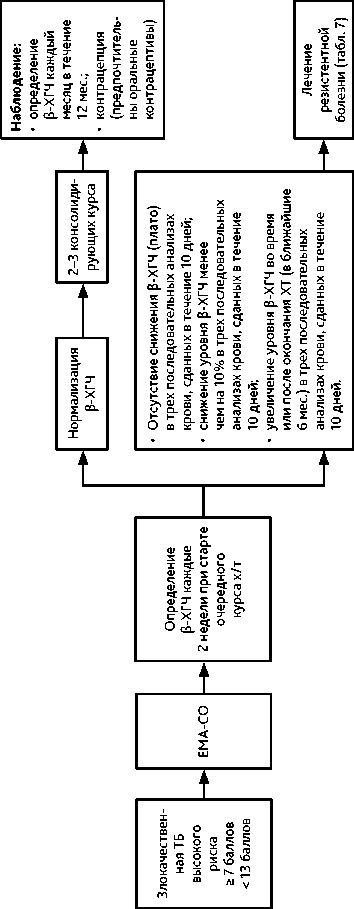
Рисунок 4. Рекомендуемый алгоритм лечения злокачественной трофобластической болезни (ТБ) высокого риска
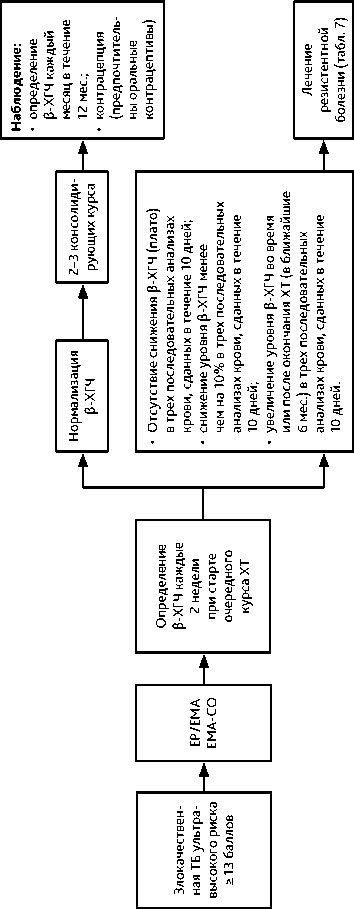
Рисунок 5. Рекомендуемый алгоритм лечения злокачественной трофобластической болезни (ТБ) ультравысокого риска
Наблюдение при четком мониторинге с помощью определения β-ХГЧ или КТ/МРТ (при неинформативности β-ХГЧ)
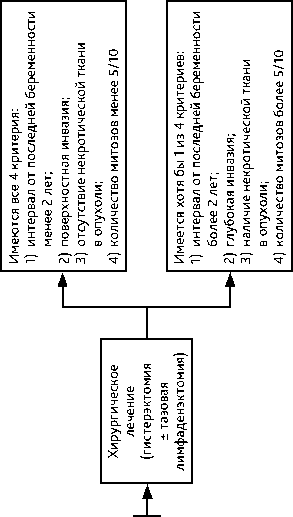



Рисунок 6. Рекомендуемый алгоритм лечения злокачественной трофобластической болезни (ТБ) промежуточного риска (опухоли плацентарного ложа и эпителиоидной трофобластической опухоли)
том/vol. 15(3s2)2025
|
ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ
Malignant Tumors


