Значение циркулирующей опухолевой ДНК в оценке эффективности лечения метастатического колоректального рака
Автор: Служев Максим Иванович, Семиглазов Владислав Владимирович, Семиглазова Татьяна Юрьевна, Ткаченко Елена Викторовна, Проценко Ветлана Анатольевна, Латипова Дилором Хамидовна, Кондратьев Сергей Вальерьевич, Бриш Надежда Александровна, Алексеева Юлия Владимировна, Беляев Алексей Михайлович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 5 т.20, 2021 года.
Бесплатный доступ
Проблемы диагностики, мониторинга эффективности лечения и прогноза при ряде диссеминированных злокачественных опухолей в настоящее время решаются путем определения циркулирующих опухолевых ДНК (цДНК). Особое значение оценка данного маркера приобрела при метастатическом колоректальном раке, системное лечение которого зависит от статуса гена RAS, имеющего прогностическую и предиктивную ценность. Однако возможности забора материала из первичного или метастатического очага для патоморфологического и молекулярного анализа при колоректальном раке зачастую ограничены. В такой ситуации определение цДНК с помощью жидкостной биопсии имеет преимущество по сравнению со стандартной биопсией ввиду малой инвазивности и высокой доступности метода. Анализ мутаций с помощью цДНК и изменения уровня данного маркера позволяет определить показания к адъювантному лечению раннего колоректального рака, является критерием эффективности системного лечения, а также фактором, определяющим риск прогрессирования заболевания. В настоящее время изучается потенциальная возможность использования цДНК для мониторинга эффективности химиотерапии в 1-й и 2-й линиях лечения, а также прогнозирования развития вторичной резистентности к ингибиторам EGFR (цетуксимаб и панитумумаб) в 1-й линии лечения и оценки статуса RAS для возращения к терапии ингибиторами EGFR в 3-й линии лечения метастатического колоректального рака. В ряде пилотных исследований получены данные, касающиеся эффективности повторной терапии ингибиторами EGFR. Выполнен анализ современных литературных данных, опубликованных в ведущих рецензируемых журналах в российских и международных базах научного цитирования Medline, Elibrary, PubMed. Из 138 проанализированных источников 56 были использованы для подготовки настоящего обзора.
Метастатический колоректальный рак, циркулирующие опухолевые днк, мутации ras, ингибиторы egfr
Короткий адрес: https://sciup.org/140261332
IDR: 140261332 | УДК: 616.34-006.6-033.2-08:577.21 | DOI: 10.21294/1814-4861-2021-20-5-149-161
Текст обзорной статьи Значение циркулирующей опухолевой ДНК в оценке эффективности лечения метастатического колоректального рака
Актуальность
В настоящее время уделяется большое внимание изучению прогностических и предиктивных молекулярных маркеров при метастатическом колоректальном раке (мКРР). Существенный интерес представляет определение свободной или циркулирующей ДНК (цДНК) [1]. Для оценки цДНК используется жидкостная биопсия, представляющая собой метод детекции производных опухоли в периферической крови. Высвобождение цДНК происходит как из опухолевой, так и из здоровой или воспаленной ткани в процессе апоптоза или некроза клеток [2]. В плазме у пациентов с мКРР концентрация цДНК больше в 2,5 раза по сравнению со здоровыми людьми [3]. Также известно, что соотношение митохондриальной и ядерной ДНК значимо отличается у пациентов с мКРР по сравнению со здоровыми пациентами [4]. Период полужизни цДНК в крови достаточно короткий (от 1 до 2 ч), что дает возможность отслеживать активность опухоли в динамике [5, 6].
Преимущества использования цДНК
Преимущества использования цДНК заключаются в малой инвазивности процедуры, быстроте анализа, отображении полного геномного профиля как первичной опухоли, так и метастазов. Использование данного метода целесообразно в тех ситуациях, когда стандартная биопсия невозможна или затруднена, например, при отказе пациента от инвазивной процедуры или наличии некачественного морфологического материала для выполнения генетического анализа, а также при расположении метастатического очага в труднодоступной для биопсии анатомической зоне. Кроме того, преимуществом использования цДНК по сравнению со стандартной биопсией является возможность быстрого получения окончательного результата [7]. Внедрение оценки цДНК потенциально позволит решить целый ряд задач, касающихся первичной диагностики, мониторинга эффективности терапии, оценки молекулярного профиля заболевания, в том числе выявления ключевых мутаций (рис. 1).
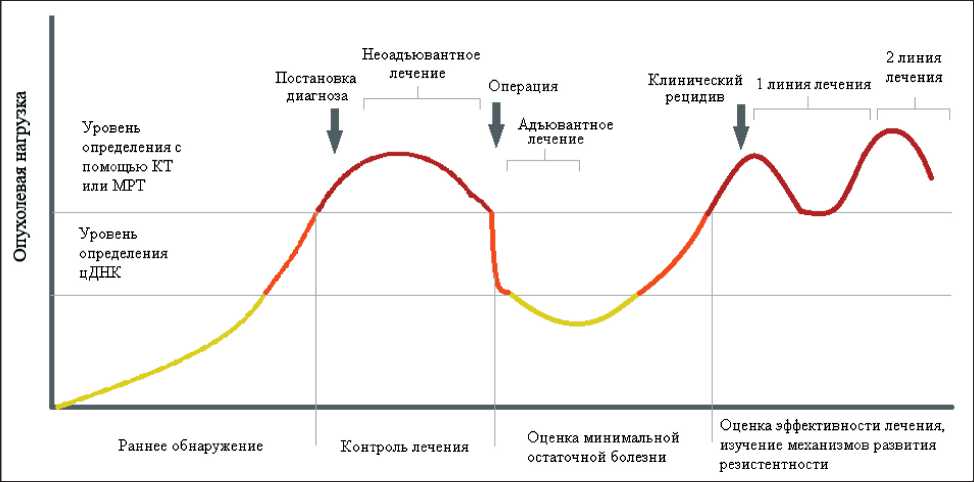
Рис. 1. Потенциальные возможности использования цДНК
Fig. 1. Potential Uses of ctDNA
Ограничения метода жидкостной биопсии
Необходимо отметить, что у метода жидкостной биопсии существуют и некоторые недостатки. По данным метаанализа, специфичность определения KRAS мутации в цДНК при КРР была высокой – 94,3 % [95 % ДИ: 93,0–95,4 %], тогда как чувствительность оказалась недостаточной и составила всего лишь 63,7 % [95 % ДИ: 60,7–66,6 %] [8]. Другая проблема состоит в том, что вероятность обнаружения мутации зависит от размера опухоли или общей опухолевой нагрузки и коррелирует с уровнем цДНК в периферической крови: средний уровень цДНК при сумме диаметров опухоли более или менее 46 мм равняется 17,2 % и 2,5 % соответственно (p=0,0009) [9]. Поэтому могут возникнуть сложности с определением цДНК при недостаточной опухолевой нагрузке. Кроме того, могут возникнуть проблемы интерпретации оценки уровня цДНК, обусловленные мутационной гетерогенностью КРР в различных отделах кишечника. Известно, что в левых отделах толстой кишки и прямой кишке по сравнению с правыми отделами чаще встречается мутация TP53 (68 % против 57 %; p<0,0001), вероятность возникновения мутации в гене APC равновероятна во всех отделах толстой кишки и составляет около 45 % (p=0,63). В правых отделах толстой кишки чаще встречаются мутации BRAF V600 (13 % против 4 %; p<0,0001) и PIK3CA (20 % против 14 %; p<0,0001) [10]. Однако с точки зрения практического применения и лечения КРР интересны мутации KRAS и NRAS, частота выявления которых максимальна в правых отделах толстой кишки – 58 % (слепая кишка и восходящая часть толстой кишки) и минимальна в левых отделах – 40 % (p<0,0001) (селезеночный изгиб, нисходящая часть и сигмовидный отдел толстой кишки) [10].
Методы определения цДНК
В качестве подготовительного этапа важно учитывать некоторые особенности забора и обработки плазмы крови (рис. 2) [11]. Во-первых, следует заранее уточнить объем забираемой крови. Например, при оценке минимально-остаточной
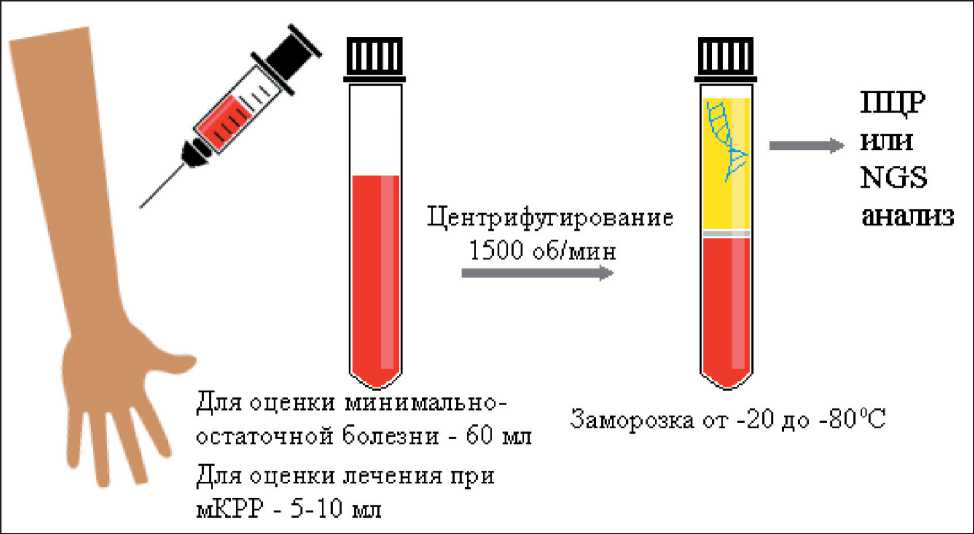
Рис. 2. Схема этапов забора крови, подготовки плазмы и последующего анализа цДНК Fig. 2. Flow chart of blood sampling, plasma preparation and subsequent ctDNA analysis
болезни необходимо около 60 мл, а при оценке эффективности лечения при мКРР достаточно 5–10 мл. Во-вторых, обработка крови должна быть произведена в ближайшее после забора время. Центрифугирование проводят при 1500 оборотах в 1 мин с последующей заморозкой плазмы крови при температуре от -20 °С до -80 °С [11]. Нельзя замораживать цельную кровь из-за развития гемолиза, а также нельзя подвергать образцы повторному замораживанию [11]. Известно несколько методов детекции цДНК, у каждого из них есть свои преимущества и недостатки (табл. 1).
Методы на основе полимеразной цепной реакции (ПЦР) (такие как цифровая капельная ПЦР или BEAMing) основаны на обнаружении конкретных известных мутаций с использованием праймеров, которые комплементарны к определенным мутантным последовательностям. Эти методы предлагают высокий уровень чувствительности (частота вариантных аллелей (VAF) для обнаружения ≤0,01 %). Недостатком этих методов является обнаружение одной или небольшого числа известных мутаций [12–16]. Секвенирование нового поколения (NGS) позволяет анализировать большое количество таблица 1/table 1
Преимущества и недостатки методов определения цДнкadvantages and disadvantages of ctdNa determining methods
|
ПЦР и жидкий чип на основе пептидной нуклеиновой кислоты (PAPL) [16]/ Peptide nucleic acid clamping asymmetric polymerase chain reaction and liquidchip (PAPL) [16] |
Мультиплексный анализ. Высокая специфичность и высокая чувствительность/ Multiplex analysis. High specificity and high sensitivity |
Обнаружение только уже известных мутаций. Только качественный анализ/ Detection of only known mutations. Qualitative analysis only |
|
Стратегия связывания наночастиц Fe-Au [20]/ Fe-Au nanoparticle-coupling strategy [20] |
Независимый от ПЦР анализ/ PCR independent analysis |
Обнаружение только уже известных мутаций. Низкая чувствительность/ Detection of only known mutations. Low sensitivity |
|
Электрохимический биосенсор ДНК [21]/ Electrochemical DNA biosensor [21] |
Высокая чувствительность. Независимый от ПЦР анализ. Обнаружение метилированной ДНК без предварительной обработки образцов/ High sensitivity. PCR independent analysis. Detection of methylated DNA without sample pretreatment |
Обнаружение только уже известных мутаций/ Detection of only known mutations |
Роль и место оценки цДНК после хирургического лечения колоректального рака
Использование метода детекции цДНК в периферической крови возможно на всех этапах лечения. Анализ цДНК позволяет оценить прогноз заболевания после хирургического лечения. В клинической практике для прогнозирования рецидива КРР после хирургического лечения используется раково-эмбриональный антиген (РЭА). Чувствительность оценки уровня цДНК для выявления рецидива статистически значимо превос- ходит чувствительность оценки РЭА (66 % против 31,9 %, p<0,001) [23]. По данным исследования J. Tie et al., в которое включено 485 пациентов с КРР II–III стадий, показатели 5-летней выживаемости без прогрессирования (ВБП) и общей выживаемости (ОВ) оказались ниже у пациентов с наличием цДНК в плазме после операции по сравнению с цДНК-отрицательными пациентами (ВБП 38,6 % против 85,5 %; p<0,001; ОВ 64,6 % против 89,4 %; p<0,001) [24]. По данным метаанализа R. Wang et al., риск прогрессирования был в 9 раз выше у пациентов с наличием цДНК после операции по сравнению с цДНК-отрицательными пациентами [ОР=9,14; 95 % ДИ 4,02–20,75, p<0,05] [25].
Кроме того, тест может быть использован для поиска дополнительных молекулярных маркеров с целью определения показаний или выработки тактики адъювантной системной терапии при КРР II стадии. По данным J. Tie et al., в группе пациентов, не получавших адъювантную химиотерапию (АХТ) по поводу цДНК-позитивного КРР, частота рецидивов составила 78,6 % (у 11 из 14), в то время как в группе с цДНК-негативным КРР она не превысила 9,8 % (у 16 из 164). Всего АХТ получили 6 пациентов, у которых определялась цДНК после операции, из них у трех обнаружилось повышение цДНК после окончания АХТ. При сравнении этих пациентов с пациентами без цДНК в периоде после АХТ риск рецидива был выше в группе с наличием цДНК [ОР=11; 95 % ДИ 1,8–68; p=0,001] [26]. Необходимо отметить, что ввиду малого количества пациентов в исследовании не представлен сравнительный анализ отдаленных результатов лечения цДНК-позитивных после операции пациентов, которым проводилась или не проводилась АХТ. Соответственно, данных о целесообразности проведения АХТ при наличии цДНК после операции пока недостаточно.
Недавнее исследование F. Loupakis et al. показало прогностическую значимость наличия минимальной остаточной болезни (МОБ). Данный термин используется для описания очень небольшого количества опухолевых клеток, которые остаются в организме во время или после лечения. Определение МОБ производилось с помощью анализа циркулирующей опухолевой ДНК в плазме крови [27]. После операции МОБ наблюдалось у 52 % пациентов, из которых у 86,5 % (45/52) впоследствии зарегистрирован рецидив [ОР=4,6; 95 % ДИ 2,6–8,1; p<0,001]. Кроме того, наличие МОБ коррелировало с более низкой выживаемостью. На момент анализа в группе без МОБ 98 % пациентов были живы по сравнению с 57,7 % в группе с наличием МОБ. При многофакторном анализе наиболее значимым прогностическим фактором, связанным с ВБП, оказался статус цДНК [ОР=4,59, 95 % ДИ 2,51–8,4; p<0,001]. Однако в данном исследовании, как и в работе J. Tie et al., не представлен анализ отдаленных результатов лечения МОБ-позитивных пациентов в зависимости от проведения АХТ и, соответственно, не оценена предиктивная значимость МОБ.
Использование цДНК при лечении метастатического колоректального рака
Особое значение оценка цДНК приобретает при метастатическом КРР. По данным C. Bettegowda et al., вероятность обнаружения цДНК при диссеминированном процессе наиболее высока [28]. По данным метаанализа 21 исследования, определение цДНК обладает высокой специфичностью (96 %), но чувствительность остается достаточно низкой (67 %) [29]. Последние исследования (табл. 2) также сообщают о недостаточной чувствительности (70–96 %) и специфичности (83–98 %) определения цДНК [14, 30–33]. Несмотря на недостаточную чувствительность и специфичность, использование метода возможно в тех случаях, когда нельзя выполнить стандартную биопсию для оценки текущего статуса заболевания [34].
Необходимо учитывать, что вероятность выявления мутаций при мКРР неоднородна и коррелирует с объемом выделяемых цДНК, который максимален при метастазах в печени и большой опухолевой нагрузке и низкий при метастазах в лимфатических узлах, легких и брюшине [9]. В частности, по данным I. Van’t Erve et al., у пациентов с КРР с метастатическим поражением брю- таблица 2/table 2
Данные соответствия мутационного статуса RAS в опухолевой ткани и в цДнк плазмы крови пациентов с мкрр. Чувствительность и специфичность определения мутации RAS в цДнк плазмы крови у пациентов с мкрр data of the RAS mutational status accordance in tumor tissue and in ctdNa of blood plasma in patients with mcRc. sensitivity and specificity of the RAS mutation determining in ctdNa of blood plasma in patients with mcRc
Отмечено, что уровень цДНК увеличивается в процессе системного лекарственного лечения. J. Tie et al. зарегистрировали значимое повышение цДНК на 3-й день после химиотерапии у 4 пациентов с последующим быстрым снижением цДНК, причем у троих из них опухоль впоследствии уменьшилась на 20 % и более [36]. Вероятнее всего, первоначальное повышение концентрации цДНК связано с разрушением опухоли на фоне химиотерапии и выходом клеточных структур в общий кровоток.
Важным является поиск порогового числового значения цДНК для прогностической оценки эффекта системного противоопухолевого лекарственного лечения мКРР. J. Tie et al. показали, что 10-кратное снижение цДНК перед вторым циклом является достоверным критерием эффективности стандартной химиотерапии (ХТ) при лечении мКРР [36]. Схожие данные сообщают H.C. Hsu et al., отмечая, что медиана БРВ оказалась на 78 % выше у пациентов, чей уровень цДНК на фоне системного лечения уменьшился более чем на 80 % по сравнению с теми пациентами, у которых количество цДНК сохранилось на уровне 20 % и более относительно первоначальных значений [37]. В другом проспективном исследовании у 82 пациентов снижение концентрации цДНК на ≥80 % после ХТ 1-й или 2-й линии лечения коррелировало с улучшением частоты объективного ответа (47,1 % против 0 %; p=0,03) и более длительной медианой ВБП [8,5 против 2,4 мес; ОР=0,19, 95 % ДИ 0,09–0,40; р<0,0001] и ОВ [27,1 против 11,2 мес; ОР=0,25, 95 % ДИ 0,11–0,57; р<0,001] [38].
-
H. Osumi et al. определили прогностическую значимость уровня цДНК у пациентов на фоне химиотерапии 2-й линии лечения по поводу мКРР. Пациенты получали лечение по схеме FOLFIRI + бевацизумаб (n=15), FOLFIRI + рамуцирумаб (n=10) или FOLFOX + бевацизумаб (n=4). На 2-й и 8-й нед у пациентов выполнялась оценка уровня цДНК в крови. Установлено, что ВБП и ОВ были выше у пациентов с уровнем цДНК (на 8-й нед) 50 % и менее от первоначального уровня по сравнению с теми пациентами, чей уровень цДНК превышал 50 % (медиана ВБП 5,8 против 2,1 мес, р=0,0006; медиана ОВ не достигнута против 9,6 мес, р=0,006) [39].
Учитывая наличие прогностической значимости цДНК в 1-й и 2-й линиях лечения метастатического КРР, изучается возможность использования цДНК и при более поздних линиях. В 2021 г.
представлены результаты пилотного исследования прогностической значимости цДНК при терапии регорафенибом у пациентов с мКРР в четвертой и пятой линиях. Установлено, что у пациентов с уровнем опухолевой фракции цДНК до начала лечения, равным или более 5 % относительно общего уровня свободной ДНК в плазме, медиана общей выживаемости ниже по сравнению с пациентами с уровнем опухолевой фракции цДНК менее 5 % (37,4 против 52,6 мес; p=0,022) [40].
Другим важным направлением является изучение прогностической значимости числа циркулирующих опухолевых клеток. E. Aranda et al. на основании результатов многофакторного анализа показали, что у пациентов с мКРР в 1-й линии лечения при наличии более 20 циркулирующих опухолевых клеток на 7,5 мл крови риск прогрессирования был в 1,77 раза выше по сравнению с теми, у кого выявлено менее 20 опухолевых клеток на 7,5 мл крови (р=0,03) [41].
Оценивать прогностическую роль цДНК можно не только по количественным, но и по ее качественным изменениям, например по метилированию ДНК [42]. C.B. Thomsen et al. представили результаты исследования, в котором 107 пациентов с мКРР получали химиотерапию по схеме FOLFOX + бевацизумаб» в 1-й линии лечения. Пациенты были разделены на 2 группы в зависимости от изменений в уровне метилированной ДНК (мет-цДНК) до и после 1-го цикла. В первую группу вошли пациенты с нулевым или сниженным значением мет-цДНК, а во вторую – все остальные пациенты (уровень мет-цДНК был стабилен, увеличивался или слегка уменьшался). Медиана времени без прогрессирования и ОВ оказалась значимо выше в первой группе (9,5 против 7,4 мес, p=0,002 и 25,4 против 13,5 мес соответственно, p=0,0001) [43].
Таким образом, на основании данных об уровне цДНК, а также о динамике изменения маркера в процессе лечения можно судить об эффективности терапии мКРР и прогнозе заболевания.
Роль цДНК в оценке вторичной резистентности к ингибиторам EGFR Анализ цДНК может быть использован с целью поиска причин появления вторичной резистентности опухоли на фоне лечения анти-EGFR антителами. С помощью динамической оценки цДНК N. Jia et al. построили математическую модель, предсказывающую вероятность будущего прогрессирования после 1-го цикла 1-й линии лечения мКРР ингибиторами EGFR с точностью 95 % [44]. C. Misale et al.сообщили о возможности определения резистентности к таргетной терапии за 10 мес до рентгенологического прогрессирования с помощью поиска в крови опухолевых клеток с мутацией KRAS [45]. С другой стороны, по данным M.P. Morelli et al., динамическая оценка цДНК по-
|
сравнение результатов повторного использования комбинаци comparison of the results of egFR inhibitors combinations |
таблица 3/table 3 ингибиторов egFR rechallenge |
|||||||
|
Автор/ Author |
Количество пациентов/ Number of patients |
Тип исследования/ Type of trial |
Оценка цДНК/ ctDNA assessment |
Схема/ Regimen |
Объективный ответ/ Objective Response |
Контроль заболевания/ Disease control |
Медиана ВБП/ Median PFS |
Медиана ОВ/ Median OS |
|
Karani [48] |
17 (после прогрессирования)/ 17 (after progression) 51 (после других причин)/ 51 (for other reasons) |
Ретроспективное/ Retrospective |
Нет/ No |
«FOLFIRI» (40), Цетуксимаб (59), Панитумумаб (9)/ «FOLFIRI» (40), Cetuximab (59), Panitumumab (9) |
42,6 % |
Нет/ No |
3,3 мес./ months 8,4 мес./ months |
7,5 мес./ months 33,4 мес./ months |
|
Cremolini [49] |
28 |
Проспективное/ Prospective |
Да/ Yes |
Цетуксимаб + Иринотекан/ Cetuximab + Irinoteсan |
21 % |
54 % |
4 мес./ months (RASwt), 1,9 мес./ months (RASmut) |
Нет/ No |
|
Ciardiello [50] |
74 79 |
Проспективное, рандомизированное/ Prospective randomized |
Нет/ No |
«FOLFOX» + Цетуксимаб/ «FOLFOX» + Cetuximab «FOLFOX» |
21,6 % 12,7 % |
64,8 % 59 % |
6,4 мес./ months 4,5 мес./ months |
23,7 мес./ months 19,8 мес./ months |
|
Tsuji [51] |
36 |
Проспективное/ Prospective |
Нет/ No |
Цетуксимаб + Иринотекан/ Cetuximab + Irinoteсan |
2,9 % |
55,9 % |
2,4 мес./ months |
8,1 мес./ months |
|
Osawa [52] |
33 |
Проспективное/ Prospective |
Нет/ No |
Цетуксимаб + «CPT11»/ Cetuximab + «CPT11» |
15,6 % |
56,2 % |
2,9 мес./ months |
8,7 мес./ months |
|
Sunakawa [53] |
10 (RASwt) 6 (RASmut) |
Проспективное/ Prospective |
Да/ Yes |
Иринотекан + анти-EGFR/ Irinoteсan + анти-EGFR |
0 % 0 % |
80 % 33 % |
4,7 мес./ months 2,3 мес./ months |
16,0 мес./ months 3,8 мес./ months |
|
Rossini [54] |
56 (после прогрессирования) 30 (после других причин) |
Ретроспективное/ Retrospective |
Нет/ No |
Панитумумаб или Иринотекан + Цетуксимаб/ Panitumumab или Irinoteсan + Cetuximab |
20 % 20 % |
45 % 47 % |
3,5 мес./ months 5 мес./ months |
9,8 мес./ months 10,2 мес./ months |
Примечание: объективный ответ – частота полного регресса и частичного регресса; контроль заболевания – частота полного регресса, частичного регресса и стабилизации; wt – дикий тип; mut – наличие мутации.
Note: оbjective response – complete response and partial response rate; disease control – complete response, partial response and stabilization rate; wt – wild type; mut – mutant.
казала, что процент KRAS-мутированных аллелей увеличивается в процессе лечения ингибиторами EGFR и быстро снижается после их отмены [46]. C.M. Parseghian et al. отметили, что период «полужизни» мутированных RAS составляет приблизительно 4 мес [47]. В связи с этим появилась идея о возможности возвращения к терапии ингибиторами EGFR у пациентов с мКРР, у которых ранее (до прогрессирования и смены схемы терапии) уже была подтверждена эффективность такого варианта лечения.
Роль цДНК при повторной терапии ингибиторами EGFR
В нескольких исследованиях получены данные об эффективности повторного использования комбинации ингибиторов EGFR (цетуксимаба или панитумумаба) с химиотерапией [48–54] (табл. 3). В исследовании JACCRO CC-08 36 пациентов получили повторную терапию комбинацией цетуксимаба с иринотеканом. Медиана выживаемости без прогрессирования составила 2,4 мес, частота объективного ответа – 3 %, при этом контроль заболевания (частичный регресс и стабилизация заболевания) наблюдался у 56 % пациентов [51]. В исследовании E-rachallenge trial также показано наличие эффекта от повторного использования цетуксимаба в комбинации с CPT-11 у 33 пациентов с мКРР, у которых ранее наблюдался ответ до прогрессирования. Медиана выживаемости без прогрессирования была почти одинакова и составила 2,9 мес. Частота объективного ответа оказалась чуть выше – 16 %, уровень контроля заболевания оказался схожим – 56 % [52].
В исследовании CAPRI-GOIM 153 пациента с диким типом KRAS, ранее подвергавшихся по поводу мКРР терапии по схеме FOLFIRI + цетуксимаб, были рандомизированы в соотношении 1:1 в две группы. Первая группа получала комбинацию FOLFOX + цетуксимаб, а вторая – FOLFOX. Медиана безрецидивной выживаемости в первой группе оказалась достоверно лучше – 6,9 и 5,3 мес соответственно (р=0,025). При этом зарегистрирована лишь тенденция к улучшению показателей общей выживаемости в первой группе – 23,7 и 19,8 мес соответственно (р=0,056) [50]. C. Cremolini et al., используя оценку цДНК, изучили эффективность повторного назначения цетуксимаба (в комбинации с иринотеканом) в качестве 3-й линии лечения мКРР с диким типом RAS и BRAF. Зарегистрировано увеличение времени без прогрессирования с 1,9 мес в группе с мутацией RAS до 4 мес при диком типе RAS (р=0,03) [49]. В недавнем проспективном исследовании с помощью оценки цДНК удалось показать значимые различия в медиане ВБП – 2,3 и 4,7 мес (p=0,013) и медиане ОВ – 3,8 и 16,0 мес (p=0,0028) между группами пациентов без мутации по сравнению с пациентами, у которых появилась мутация RAS, соответственно [53].
Стоит отметить, что не все исследования сопоставимы для сравнения, так как некоторые оказались ретроспективными [48, 54] и в большинстве из них не выполнялся анализ цДНК [48, 50–52, 54]. В настоящий момент проводятся два проспективных рандомизированных исследования FIRE4 и COLOMATE, направленные на определение роли динамической оценки цДНК при повторной терапии ингибиторами EGFR [55, 56].
Заключение
Последние исследования показали значимый вклад анализа цДНК в поиске механизмов и факторов развития вторичной резистентности, оценке прогноза и выборе оптимального подхода к лечению пациентов с мКРР. Несмотря на некоторые ограничения метода, обусловленные его недостаточной чувствительностью, а также зависимостью точности молекулярного анализа от уровня опухолевой нагрузки, оценка цДНК имеет преимущества перед стандартной биопсией и может являться методом выбора при определенных ситуациях, в первую очередь касающихся получения материала из технически недоступных опухолевых очагов и динамической оценки статуса RAS у пациентов с тяжелой сопутствующей патологией, препятствующей проведению инвазивных процедур.
Перспективным направлением является возможность мониторинга уровня цДНК в процессе лечения при метастатическом КРР с целью оценки эффективности химиотерапии в 1-й и 2-й линиях лечения. Другая важная точка приложения цДНК связана с прогнозированием развития вторичной резистентности к ингибиторам EGFR (цетуксимаб и панитумумаб) в 1-й линии лечения, что позволяет своевременно переключиться на следующую линию лечения. Пилотные исследования подтвердили, что в случае развития резистентности последующий мониторинг статуса RAS при помощи цДНК определяет возможность возвращения к терапии ингибиторами EGFR в 3-й линии лечения при регистрации дикого типа RAS . Оценка цДНК приобретает важное значение и при ранних формах КРР. Маркер уже показал свою потенциальную эффективность при прогнозировании рецидива после радикальной операции, а также при определении показаний к адъювантной химиотерапии у пациентов со II стадией заболевания или химиотерапии после циторедуктивных операций. Таким образом, геномное профилирование при лечении мКРР позволяет не только оценить прогноз заболевания, но и предсказать чувствительность к системному лечению, в том числе в случае приобретенной устойчивости (с целью последующего возвращения к терапии ингибиторами EGFR).
Список литературы Значение циркулирующей опухолевой ДНК в оценке эффективности лечения метастатического колоректального рака
- Федянин М.Ю., Полянская Е.М., Тюляндин С.А. Роль циркулирующей в крови опухолевой ДНК при раке толстой кишки. Онкологическая колопроктология. 2016; 6(3): 43–52. [Fedyanin M.Yu., Polyanskaya E.M., Tyulyandin S.A. The blood circulating tumor DNA role in colon cancer. Onkologicheskaya Koloproktologiya. 2016; 6(3): 43–52. (in Russian)].
- Jahr S., Hentze H., Englisch S., Hardt D., Fackelmayer F.O., Hesch R.D., Knippers R. DNA fragments in the blood plasma of cancer patients: quantitations and evidence for their origin from apoptotic and necrotic cells. Cancer Res. 2001 Feb 15; 61(4): 1659–65.
- Bedin C., Enzo M.V., Del Bianco P., Pucciarelli S., Nitti D., Agostini M. Diagnostic and prognostic role of cell-free DNA testing for colorectal cancer patients. Int J Cancer. 2017 Apr; 140(8): 1888–98. doi: 10.1002/ijc.30565.
- Meddeb R., Dache Z.A.A., Thezenas S., Otandault A., Tanos R., Pastor B., Sanchez C., Azzi J., Tousch G., Azan S., Mollevi C., Adenis A., El Messaoudi S., Blache P., Thierry A.R. Quantifying circulating cellfree DNA in humans. Sci Rep. 2019 Mar 26; 9(1): 5220. doi: 10.1038/s41598-019-41593-4.
- Meng S., Tripathy D., Frenkel E.P., Shete S., Naftalis E.Z., Huth J.F., Beitsch P.D., Leitch M., Hoover S., Euhus D., Haley B., Morrison L., Fleming T.P., Herlyn D., Terstappen L.W., Fehm T., Tucker T.F., Lane N., Wang J., Uhr J.W. Circulating tumor cells in patients with breast cancer dormancy. Clin Cancer Res. 2004 Dec; 10(24): 8152–62. doi: 10.1158/1078-0432.CCR-04-1110.
- Lopresti A., Malergue F., Bertucci F., Liberatoscioli M.L., Garnier S., DaCosta Q., Finetti P., Gilabert M., Raoul J.L., Birnbaum D., Acquaviva C., Mamessier E. Sensitive and easy screening for circulating tumor cells by flow cytometry. JCI Insight. 2019; 5(14): e128180. doi: 10.1172/jci.insight.128180.
- Thierry A.R., El Messaoudi S., Mollevi C., Raoul J.L., Guimbaud R., Pezet D., Artru P., Assenat E., Borg C., Mathonnet M., De La Fouchardière C., Bouché O., Gavoille C., Fiess C., Auzemery B., Meddeb R., Lopez-Crapez E., Sanchez C., Pastor B., Ychou M. Clinical utility of circulating DNA analysis for rapid detection of actionable mutations to select metastatic colorectal patients for anti-EGFR treatment. Ann Oncol. 2017; 28(9): 2149–59. doi: 10.1093/annonc/mdx330.
- Xie W., Xie L., Song X. The diagnostic accuracy of circulating free DNA for the detection of KRAS mutation status in colorectal cancer: A meta-analysis. Cancer Med. 2019 Mar; 8(3): 1218–1231. doi: 10.1002/cam4.1989.
- Osumi H., Shinozaki E., Takeda Y., Wakatsuki T., Ichimura T., Saiura A., Yamaguchi K., Takahashi S., Noda T., Zembutsu H. Clinical relevance of circulating tumor DNA assessed through deep sequencing in patients with metastatic colorectal cancer. Cancer Med. 2019; 8(1): 408–17. doi: 10.1002/cam4.1913.
- Loree J.M., Pereira A.A.L., Lam M., Willauer A.N., Raghav K., Dasari A., Morris V.K., Advani S., Menter D.G., Eng C., Shaw K., Broaddus R., Routbort M.J., Liu Y., Morris J.S., Luthra R., Meric-Bernstam F., Overman M.J., Maru D., Kopetz S. Classifying Colorectal Cancer by Tumor Location Rather than Sidedness Highlights a Continuum in Mutation Profiles and Consensus Molecular Subtypes. Clin Cancer Res. 2018 Mar 1; 24(5): 1062–1072. doi: 10.1158/1078-0432.CCR-17-2484.
- Meddeb R., Pisareva E., Thierry A.R. Guidelines for the Preanalytical Conditions for Analyzing Circulating Cell-Free DNA. Clin Chem. 2019 May; 65(5): 623–633. doi: 10.1373/clinchem.2018.298323.
- Guha M., Castellanos-Rizaldos E., Makrigiorgos G.M. DISSECT Method Using PNA-LNA Clamp Improves Detection of EGFR T790m Mutation. PLoS One. 2013 Jun 21; 8(6): e67782. doi: 10.1371/journal.pone.0067782.
- Denis J.A., Patroni A., Guillerm E., Pépin D., Benali-Furet N., Wechsler J., Manceau G., Bernard M., Coulet F., Larsen A.K., Karoui M., Lacorte J.M. Droplet digital PCR of circulating tumor cells from colorectal cancer patients can predict KRAS mutations before surgery. Mol Oncol. 2016 Oct; 10(8): 1221–31. doi: 10.1016/j.molonc.2016.05.009.
- Grasselli J., Elez E., Caratù G., Matito J., Santos C., Macarulla T., Vidal J., Garcia M., Viéitez J.M., Paéz D., Falcó E., Lopez Lopez C., Aranda E., Jones F., Sikri V., Nuciforo P., Fasani R., Tabernero J., Montagut C., Azuara D., Dienstmann R., Salazar R., Vivancos A. Concordance of bloodand tumor-based detection of RAS mutations to guide anti-EGFR therapy in metastatic colorectal cancer. Ann Oncol. 2017; 28(6): 1294–301. doi: 10.1093/annonc/mdx112.
- Li X., Yang T., Li C.S., Song Y., Lou H., Guan D., Jin L. Surface Enhanced Raman Spectroscopy (SERS) for the Multiplex Detection of Braf, Kras, and Pik3ca Mutations in Plasma of Colorectal Cancer Patients. Theranostics. 2018 Feb 12; 8(6): 1678–1689. doi: 10.7150/thno.22502.
- Chen X., Zhang D.S., Wang L., Guo Q., Xu H., Lou J., Gu H. Multiplexed Detection of Mutant Circulating Tumor DNA Using Peptide Nucleic Acid Clamping Asymmetric Polymerase Chain Reaction and Liquidchip. J Biomed Nanotechnol. 2019 Jul 1; 15(7): 1578–1588. doi: 10.1166/jbn.2019.2794.
- Mosele F., Remon J., Mateo J., Westphalen C.B., Barlesi F., Lolkema M.P., Normanno N., Scarpa A., Robson M., Meric-Bernstam F., Wagle N., Stenzinger A., Bonastre J., Bayle A., Michiels S., Bièche I., Rouleau E., Jezdic S., Douillard J.Y., Reis-Filho J.S., Dienstmann R., André F. Recommendations for the use of next-generation sequencing (NGS) for patients with metastatic cancers: a report from the ESMO Precision Medicine Working Group. Ann Oncol. 2020 Nov; 31(11): 1491–1505. doi: 10.1016/j.annonc.2020.07.014.
- Vollbrecht C., Lehmann A., Lenze D., Hummel M. Validation and comparison of two NGS assays for the detection of EGFR T790M resistance mutation in liquid biopsies of NSCLC patients. Oncotarget. 2018 Apr 6; 9(26): 18529–18539. doi: 10.18632/oncotarget.24908.
- Li Y., Xu H., Su S., Ye J., Chen J., Jin X., Lin Q., Zhang D., Ye C., Chen C. Clinical validation of a highly sensitive assay to detect EGFR mutations in plasma cell-free DNA from patients with advanced lung adenocarcinoma. PLoS One. 2017 Aug 22; 12(8): e0183331. doi: 10.1371/journal.pone.0183331.
- Hu P., Zhang S., Wu T., Ni D., Fan W., Zhu Y., Qian R., Shi J. Fe-Au Nanoparticle-Coupling for Ultrasensitive Detections of Circulating Tumor DNA. Adv Mater. 2018; 30(31): e1801690. doi: 10.1002/adma.201801690.
- Povedano E., Vargas E., Montiel V.R., Torrente-Rodríguez R.M., Pedrero M., Barderas R., Segundo-Acosta P.S., Peláez-García A., Mendiola M., Hardisson D., Campuzano S., Pingarrón J.M. Electrochemical affinity biosensors for fast detection of gene-specific methylations with no need for bisulfite and amplification treatments. Sci Rep. 2018; 8(1): 6418. doi: 10.1038/s41598-018-24902-1.
- Ou C.Y., Vu T., Grunwald J.T., Toledano M., Zimak J., Toosky M., Shen B., Zell J.A., Gratton E., Abram T.J., Zhao W. An ultrasensitive test for profiling circulating tumor DNA using integrated comprehensive droplet digital detection. Lab Chip. 2019; 19(6): 993–1005. doi: 10.1039/c8lc01399c.
- Symonds E.L., Pedersen S.K., Murray D., Byrne S.E., Roy A., Karapetis C., Hollington P., Rabbitt P., Jones F.S., LaPointe L., Segelov E., Young G.P. Circulating epigenetic biomarkers for detection of recurrent colorectal cancer. Cancer. 2020 Apr 1; 126(7): 1460–1469. doi: 10.1002/cncr.32695.
- Tie J., Cohen J.D., Lo S.N., Wang Y., Li L., Christie M., Lee M., Wong R., Kosmider S., Skinner I., Wong H.L., Lee B., Burge M.E., Yip D., Karapetis C.S., Price T.J., Tebbutt N.C., Haydon A.M., Ptak J., Schaeffer M.J., Silliman N., Dobbyn L., Popoli M., Tomasetti C., Papadopoulos N., Kinzler K.W., Vogelstein B., Gibbs P. Prognostic significance of postsurgery circulating tumor DNA in nonmetastatic colorectal cancer: Individual patient pooled analysis of three cohort studies. Int J Cancer. 2021; 148(4): 1014–26. doi: 10.1002/ijc.33312.
- Wang R., Zhao A., Cao N., Li Z., Zhang G., Liu F. The value of circulation tumor DNA in predicting postoperative recurrence of colorectal cancer: a meta-analysis. Int J Colorectal Dis. 2020; 35(8): 1463–75. doi: 10.1007/s00384-020-03667-y.
- Tie J., Wang Y., Tomasetti C., Li L., Springer S., Kinde I., Silliman N., Tacey M., Wong H.L., Christie M., Kosmider S., Skinner I., Wong R., Steel M., Tran B., Desai J., Jones I., Haydon A., Hayes T., Price T.J., Strausberg R.L., Diaz L.A.Jr., Papadopoulos N., Kinzler K.W., Vogelstein B., Gibbs P. Circulating tumor DNA analysis detects minimal residual disease and predicts recurrence in patients with stage II colon cancer. Sci Transl Med. 2016 Jul 6; 8(346): 346ra92. doi: 10.1126/scitranslmed.aaf6219.
- Loupakis F., Derouazi M., Murgioni S., Rizzato M.D., Sharma S., Renner D., Shchegrova S., Sethi H., Zimmermann B., Aleshin A., Schirripa M., Munari G., Tos A.P.D., Lonardi S., Fassan M. 405MO Personalized circulating tumour DNA assay for the detection of minimal residual disease in CRC patients after resection of metastases. Ann Oncol. 2020; 31: S413. doi: 10.1016/j.annonc.2020.08.516.
- Bettegowda C., Sausen M., Leary R.J., Kinde I., Wang Y., Agrawal N., Bartlett B.R., Wang H., Luber B., Alani R.M., Antonarakis E.S., Azad N.S., Bardelli A., Brem H., Cameron J.L., Lee C.C., Fecher L.A., Gallia G.L., Gibbs P., Le D., Giuntoli R.L., Goggins M., Hogarty M.D., Holdhoff M., Hong S.M., Jiao Y., Juhl H.H., Kim J.J., Siravegna G., Laheru D.A., Lauricella C., Lim M., Lipson E.J., Marie S.K., Netto G.J., Oliner K.S., Olivi A., Olsson L., Riggins G.J., Sartore-Bianchi A., Schmidt K., Shih M., Oba-Shinjo S.M., Siena S., Theodorescu D., Tie J., Harkins T.T., Veronese S., Wang T.L., Weingart J.D., Wolfgang C.L., Wood L.D., Xing D., Hruban R.H., Wu J., Allen P.J., Schmidt C.M., Choti M.A., Velculescu V.E., Kinzler K.W., Vogelstein B., Papadopoulos N., Diaz L.A.Jr. Detection of circulating tumor DNA in early- and late-stage human malignancies. Sci Transl Med. 2014 Feb 19; 6(224): 224ra24. doi: 10.1126/scitranslmed.3007094.
- Hao Y.X., Fu Q., Guo Y.Y., Ye M., Zhao H.X., Wang Q., Peng X.M., Li Q.W., Wang R.L., Xiao W.H. Effectiveness of circulating tumor DNA for detection of KRAS gene mutations in colorectal cancer patients: a metaanalysis. Onco Targets Ther. 2017 Feb 16; 10: 945–953. doi: 10.2147/OTT.S123954.
- Vidal J., Muinelo L., Dalmases A., Jones F., Edelstein D., Iglesias M., Orrillo M., Abalo A., Rodríguez C., Brozos E., Vidal Y., Candamio S., Vázquez F., Ruiz J., Guix M., Visa L., Sikri V., Albanell J., Bellosillo B., López R., Montagut C. Plasma ctDNA RAS mutation analysis for the diagnosis and treatment monitoring of metastatic colorectal cancer patients. Ann Oncol. 2017 Jun 1; 28(6): 1325–1332. doi: 10.1093/annonc/mdx125.
- Bachet J.B., Bouché O., Taieb J., Dubreuil O., Garcia M.L., Meurisse A., Normand C., Gornet J.M., Artru P., Louafi S., Bonnetain F., Thirot-Bidault A., Baumgaertner I., Coriat R., Tougeron D., Lecomte T.,Mary F., Aparicio T., Marthey L., Taly V., Blons H., Vernerey D., Laurent-Puig P. RAS mutation analysis in circulating tumor DNA from patients with metastatic colorectal cancer: the AGEO RASANC prospective multicenter study. Ann Oncol. 2018 May 1; 29(5): 1211–1219. doi: 10.1093/annonc/mdy061.
- Schmiegel W., Scott R.J., Dooley S., Lewis W., Meldrum C.J., Pockney P., Draganic B., Smith S., Hewitt C., Philimore H., Lucas A., Shi E., Namdarian K., Chan T., Acosta D., Ping-Chang S., Tannapfel A., Reinacher-Schick A., Uhl W., Teschendorf C., Wolters H., Stern J., Viebahn R., Friess H., Janssen K.P., Nitsche U., Slotta-Huspenina J., Pohl M., Vangala D., Baraniskin A., Dockhorn-Dworniczak B., Hegewisch-Becker S., Ronga P., Edelstein D.L., Jones F.S., Hahn S., Fox S.B. Bloodbased detection of RAS mutations to guide anti-EGFR therapy in colorectal cancer patients: concordance of results from circulating tumor DNA and tissue-based RAS testing. Mol Oncol. 2017 Feb; 11(2): 208–219. doi: 10.1002/1878-0261.12023.
- Normanno N., Esposito Abate R., Lambiase M., Forgione L., Cardone C., Iannaccone A., Sacco A., Rachiglio A.M., Martinelli E., Rizzi D., Pisconti S., Biglietto M., Bordonaro R., Troiani T., Latiano T.P., Giuliani F., Leo S., Rinaldi A., Maiello E., Ciardiello F.; CAPRI-GOIM Investigators. RAS testing of liquid biopsy correlates with the outcome of metastatic colorectal cancer patients treated with first-line FOLFIRI plus cetuximab in the CAPRI-GOIM trial. Ann Oncol. 2018 Jan 1; 29(1): 112–118. doi: 10.1093/annonc/mdx417.
- Baraniskin A., Van Laethem J.L., Wyrwicz L., Guller U., Wasan H.S., Matysiak-Budnik T., Gruenberger T., Ducreux M., Carneiro F., Van Cutsem E., Seufferlein T., Schmiegel W. Clinical relevance of molecular diagnostics in gastrointestinal (GI) cancer: European Society of Digestive Oncology (ESDO) expert discussion and recommendations from the 17th European Society for Medical Oncology (ESMO)/World Congress on Gastrointestinal Cancer, Barcelona. Eur J Cancer. 2017 Nov; 86: 305–317. doi: 10.1016/j.ejca.2017.09.021.
- Van’t Erve I., Rovers K.P., Constantinides A., Bolhuis K., Wassenaar E.C., Lurvink R.J., Huysentruyt C.J., Snaebjornsson P., Boerma D., van den Broek D., Buffart T.E., Lahaye M.J., Aalbers A.G., Kok N.F., Meijer G.A., Punt C.J., Kranenburg O., de Hingh I.H., Fijneman R.J. Detection of tumor-derived cell-free DNA from colorectal cancer peritoneal metastases in plasma and peritoneal fluid. J Pathol Clin Res. 2021 May; 7(3): 203–208. doi: 10.1002/cjp2.207.
- Tie J., Kinde I., Wang Y., Wong H.L., Roebert J., Christie M., Tacey M., Wong R., Singh M., Karapetis C.S., Desai J., Tran B., Strausberg R.L., Diaz L.A.Jr., Papadopoulos N., Kinzler K.W., Vogelstein B., Gibbs P. Circulating tumor DNA as an early marker of therapeutic response in patients with metastatic colorectal cancer. Ann Oncol. 2015 Aug; 26(8): 1715–22. doi: 10.1093/annonc/mdv177.
- Hsu H.C., Lapke N., Wang C.W., Lin P.Y., You J.F., Yeh C.Y., Tsai W.S., Hung H.Y., Chiang S.F., Chen H.C., Chen S.J., Hsu A., Yang T.S. Targeted Sequencing of Circulating Tumor DNA to Monitor Genetic Variants and Therapeutic Response in Metastatic Colorectal Cancer. Mol Cancer Ther. 2018 Oct; 17(10): 2238–2247. doi: 10.1158/1535-7163. MCT-17-1306.
- Garlan F., Laurent-Puig P., Sefrioui D., Siauve N., Didelot A., Sarafan-Vasseur N., Michel P., Perkins G., Mulot C., Blons H., Taieb J., Di Fiore F., Taly V., Zaanan A. Early Evaluation of Circulating Tumor DNA as Marker of Therapeutic Efficacy in Metastatic Colorectal Cancer Patients (PLACOL Study). Clin Cancer Res. 2017; 23(18): 5416–25. doi: 10.1158/1078-0432.CCR-16-3155.
- Osumi H., Shinozaki E., Yamaguchi K., Zembutsu H. Early change in circulating tumor DNA as a potential predictor of response to chemotherapy in patients with metastatic colorectal cancer. Sci Rep. 2019 Nov 22; 9(1): 17358. doi: 10.1038/s41598-019-53711-3.
- Unseld M., Belic J., Pierer K., Zhou Q., Moser T., Bauer R., Piringer G., Gerger A., Siebenhüner A., Speicher M., Heitzer E., Prager G.W. A higher ctDNA fraction decreases survival in regorafenib-treated metastatic colorectal cancer patients. Results from the regorafenib’s liquid biopsy translational biomarker phase II pilot study. Int J Cancer. 2021; 148(6): 1452–61. doi: 10.1002/ijc.33303.
- Aranda E., Viéitez J.M., Gómez-España A., Gil Calle S., Salud- Salvia A., Graña B., Garcia-Alfonso P., Rivera F., Quintero-Aldana G.A., Reina-Zoilo J.J., González-Flores E., Salgado Fernández M., Guillén-Ponce C., Garcia-Carbonero R., Safont M.J., La Casta Munoa A., García- Paredes B., López López R., Sastre J., Díaz-Rubio E.; Spanish Cooperative Group for the Treatment of Digestive Tumors (TTD). FOLFOXIRI plus bevacizumab versus FOLFOX plus bevacizumab for patients with metastatic colorectal cancer and ≥3 circulating tumour cells: the randomized phase III VISNÚ-1 trial. ESMO Open. 2020 Nov; 5(6): e000944. doi: 10.1136/esmoopen-2020-000944.
- Luo H., Zhao Q., Wei W., Zheng L., Yi S., Li G., Wang W., Sheng H., Pu H., Mo H., Zuo Z., Liu Z., Li C., Xie C., Zeng Z., Li W., Hao X., Liu Y., Cao S., Liu W., Gibson S., Zhang K., Xu G., Xu R.H. Circulating tumor DNA methylation profiles enable early diagnosis, prognosis prediction, and screening for colorectal cancer. Sci Transl Med. 2020; 12(524): eaax7533. doi: 10.1126/scitranslmed.aax7533.
- Thomsen C.B., Hansen T.F., Andersen R.F., Lindebjerg J., Jensen L.H., Jakobsen A. Early identification of treatment benefit by methylated circulating tumor DNA in metastatic colorectal cancer. Ther Adv Med Oncol. 2020 May 26; 12: 1758835920918472. doi: 10.1177/1758835920918472.
- Jia N., Sun Z., Gao X., Cheng Y., Zhou Y., Shen C., Chen W., Wang X., Shi R., Li N., Zhou J., Bai C. Serial Monitoring of Circulating Tumor DNA in Patients With Metastatic Colorectal Cancer to Predict the Therapeutic Response. Front Genet. 2019 May 21; 10: 470. doi: 10.3389/fgene.2019.00470.
- Misale S., Yaeger R., Hobor S., Scala E., Janakiraman M., Liska D., Valtorta E., Schiavo R., Buscarino M., Siravegna G., Bencardino K., Cercek A., Chen C.T., Veronese S., Zanon C., Sartore-Bianchi A., Gambacorta M., Gallicchio M., Vakiani E., Boscaro V., Medico E., Weiser M., Siena S., Di Nicolantonio F., Solit D., Bardelli A. Emergence of KRAS mutations and acquired resistance to anti-EGFR therapy in colorectal cancer. Nature. 2012 Jun 28; 486(7404): 532–6. doi: 10.1038/nature11156.
- Morelli M.P., Overman M.J., Dasari A., Kazmi S.M.A., Mazard T., Vilar E., Morris V.K., Lee M.S., Herron D., Eng C., Morris J., Kee B.K., Janku F., Deaton F.L., Garrett C., Maru D., Diehl F., Angenendt P., Kopetz S. Characterizing the patterns of clonal selection in circulating tumor DNA from patients with colorectal cancer refractory to anti-EGFR treatment. Ann Oncol. 2015 Apr; 26(4): 731–736. doi: 10.1093/annonc/mdv005.
- Parseghian C.M., Loree J.M., Morris V.K., Liu X., Clifton K.K., Napolitano S., Henry J.T., Pereira A.A., Vilar E., Johnson B., Kee B., Raghav K., Dasari A., Wu J., Garg N., Raymond V.M., Banks K.C., Talasaz A.A., Lanman R.B., Strickler J.H., Hong D.S., Corcoran R.B., Overman M.J., Kopetz S. Anti-EGFR-resistant clones decay exponentially after progression: implications for anti-EGFR re-challenge. Ann Oncol. 2019; 30(2): 243–9. doi: 10.1093/annonc/mdy509.
- Karani A., Felismino T., Diniz L.A., Macedo M.P., Machado L., De Brito Sales D., Mello C.L. Trecc: Re-challenge therapy with anti-EGFR in metastatic colorectal adenocarcinoma (mCRC). JCO. 2019; 37(4_suppl): 683–683.
- Cremolini C., Rossini D., Dell’Aquila E., Lonardi S., Conca E., Del Re M., Busico A., Pietrantonio F., Danesi R., Aprile G., Tamburini E., Barone C., Masi G., Pantano F., Pucci F., Corsi D.C., Pella N., Bergamo F., Rofi E., Barbara C., Falcone A., Santini D. Rechallenge for Patients With RAS and BRAF Wild-Type Metastatic Colorectal Cancer With Acquired Resistance to First-line Cetuximab and Irinotecan: A Phase 2 Single-Arm Clinical Trial. JAMA Oncol. 2019 Mar 1; 5(3): 343–350. doi: 10.1001/jamaoncol.2018.5080.
- Ciardiello F., Normanno N., Martinelli E., Troiani T., Pisconti S., Cardone C., Nappi A., Bordonaro A.R., Rachiglio M., Lambiase M., Latiano T.P., Modoni G., Cordio S., Giuliani F., Biglietto M., Montesarchio V., Barone C., Tonini G., Cinieri S., Febbraro A., Rizzi D., De Vita F., Orditura M., Colucci G., Maiello E.; CAPRI-GOIM investigators. Cetuximab continuation after first progression in metastatic colorectal cancer (CAPRI-GOIM): a randomized phase II trial of FOLFOX plus cetuximab versus FOLFOX. Ann Oncol. 2016 Jun; 27(6): 1055–1061. doi: 10.1093/annonc/mdw136.
- Tsuji A., Eto T., Masuishi T., Satake H., Segawa Y., Tanioka H., Hara H., Kotaka M., Sagawa T., Watanabe T., Nakamura M., Takahashi T., Negoro Y., Manaka D., Fujita H., Suto T., Ichikawa W., Fujii M., Takeuchi M., Nakajima T. Phase II study of third-line cetuximab rechallenge in patients with metastatic wild-type K-RAS colorectal cancer who achieved a clinical benefit in response to first-line cetuximab plus chemotherapy (JACCRO CC-08). Ann Oncol. 2016 Oct; 27: vi168.
- Osawa H., Shinozaki E., Nakamura M., Ohhara Y., Shindo Y., Shiozawa M., Uetake H., Matsumoto H., Ureshino N., Satake H., Kobayashi T., Suto T., Kitano S., Ohashi Y., Uemura K., Yamaguchi K. Phase II study of cetuximab rechallenge in patients with ras wild-type metastatic colorectal cancer: E-rechallenge trial. Ann Oncol. 2018 Oct; 29: viii161.
- Kakizawa N., Suzuki K., Fukui T., Takayama Y., Ichida K., Muto Y., Hasegawa F., Watanabe F., Kikugawa R., Tsujinaka S., Futsuhara K., Miyakura Y., Noda H., Rikiyama T. Clinical and molecular assessment of regorafenib monotherapy. Oncol Rep. 2017 Apr; 37(4): 2506–2512. doi: 10.3892/or.2017.5456.
- Rossini D., Germani M.M., Pagani F., Pellino A., Dell’Aquila E., Bensi M., Liscia N., Moretto R., Boccaccino A., Prisciandaro M., Manglaviti S., Schirripa M., Vivolo R., Scartozzi M., Santini D., Salvatore L., Pietrantonio F., Loupakis F., Falcone A., Cremolini C. Retreatment With Anti-EGFR Antibodies in Metastatic Colorectal Cancer Patients: A Multiinstitutional Analysis. Clin Colorectal Cancer. 2020; 19(3): 191–199.e6. doi: 10.1016/j.clcc.2020.03.009.
- Metastatic Colorectal Cancer (RAS-wildtype) After Response to First-line Treatment With FOLFIR Plus Cetuximab – Full Text View – ClinicalTrials.gov [Internet]. URL: https://clinicaltrials.gov/ct2/show/NCT02934529 (cited 2020 Feb 2).
- Genetic Testing in Screening Patients With Metastatic or Unresectable Colon or Rectal Cancer For a COLOMATE Trial – Full Text View – ClinicalTrials.gov [Internet]. URL: https://clinicaltrials.gov/ct2/show/NCT03765736 (cited 2020 Feb 2).


